Naše první zkušenosti s novou formou transdermálního buprenorfinu
Souhrn
Procházka J. Naše první zkušenosti s novou formou transdermálního buprenorfinu. Remedia 2024; 34: 69–72.
Buprenorfin v transdermální formě se dlouhodobě používá v léčbě chronické středně silné až silné bolesti nádorového i nenádorového původu. Nyní je k dispozici v nové formě s prodlouženým sedmidenním uvolňováním v dávkování 5 µg/h, 20 µg/h, 30 µg/h a 40 µg/h. Tuto transdermální formu s pomalým uvolňováním jsme použili u 108 pacientů s chronickou bolestí pohybového aparátu, 76 žen a 32 mužů, ve věkovém rozmezí 28–87 let (průměrný věk 64 let). Výchozí dávka byla nejčastěji 5 µg/h nebo 20 µg/h. U 29 % pacientů zůstala výchozí dávka, u 42 % pacientů jsme dávku navýšili, u 6 % pacientů naopak dávku snížili, 17 % pacientů aplikaci buprenorfinu ukončilo, převážně z důvodu nežádoucích účinků. Spektrum nežádoucích účinků odpovídalo údajům v Souhrnu údajů o přípravku. Buprenorfin v nízkodávkové transdermální formě podle našich získaných zkušeností představuje přínosné rozšíření možností léčby chronické nenádorové bolesti pohybového aparátu a potvrzuje tak výsledky předchozích studií. Mezi jeho největší výhody patří dobrá tolerance, dobrý bezpečnostní profil a nízké riziko dechového útlumu i vzniku závislosti.
Klíčová slova: buprenorfin – transdermální systém – opioidní receptory – bolest pohybového systému.
Summary
Prochazka J. Our first experiences with a new form of transdermal buprenorphine. Remedia 2024; 34: 69–72.
Buprenorphine in transdermal form has long been used in the treatment of chronic moderate to severe pain of both tumor and non‑tumor origin. It is now available in a new extended 7‑day release formulation at doses of 5, 20, 30, and 40 µg/hr. We used this slow‑release transdermal formulation in 108 patients with chronic musculoskeletal pain, 76 women and 32 men, age range 28–87 years, mean age 64 years. The typical starting dose ranged between 5 µg/hr and 20 µg/hr. In 29% of patients, the starting dose was maintained while it was increased in 42% and decreased in 6% of patients; 17% of patients discontinued buprenorphine, mostly due to adverse effects. The spectrum of adverse events corresponded to the data in the SPC. In our experience, low‑dose transdermal buprenorphine represents a beneficial extension of treatment options for chronic non‑cancer musculoskeletal pain, confirming the results of previous studies. Its major advantages include good tolerability, safety profile, and low risk of respiratory depression and dependence.
Key words: buprenorphine – transdermal delivery system – opioid receptors – musculoskeletal pain.
Úvod
Buprenorfin v transdermální formě je molekula dlouhodobě známá a v praxi používaná pro léčbu chronické středně silné až silné bolesti nádorového i nenádorového původu. Nyní je k dispozici též nízkodávkový buprenorfin, který rozšiřuje terapeutické spektrum pro pacienty se středně silnou nenádorovou bolestí. U těchto pacientů bychom použili buď slabá neopioidní analgetika včetně nesteroidních antiflogistik, která však nemají dostatečnou analgetickou potenci, nebo analgetika na bázi tramadolu – nicméně je pro předchozí intoleranci nebo pro riziko interakcí použít nemůžeme, případně jsme se jejich účinkem dostali na samou hranu požadovaného analgetického působení. Velkým přínosem transdermálního buprenorfinu je i možnost použití ve vyšších věkových kategoriích nebo u pacientů s řadou interních komorbidit. Podle nejnovějších metodických pokynů se jedná o analgetikum první volby pro seniory, pro pacienty s renální insuficiencí a pro pacienty s rozsáhlou chronickou medikací, kde je výhodné, že se buprenorfin metabolizuje přes cytochrom P450 (CYP) pouze z 20 %, takže lékové interakce nejsou tak limitující. Jeho velkou výhodou je též pohodlné dávkování jednou týdně, čímž se mohou eliminovat výkyvy při nepravidelnosti v dávkování na straně pacienta. Jedním z jeho hlavních indikačních cílů jsou chronické bolesti pohybového aparátu [1–3].
Metodika
V tomto retrospektivním sledování jsme hodnotili analgetickou účinnost, toleranci a výskyt nežádoucích účinků nízkodávkového transdermálního buprenorfinu u pacientů s chronickou nenádorovou bolestí pohybového aparátu – bolestmi dolních zad (včetně syndromu neúspěšné operace dolních zad – failed back surgery syndrome, FBSS), bolestmi při osteoartróze, případně s kombinací obou. Transdermální buprenorfin jsme indikovali v případě, že dosavadní analgetická terapie nebyla dostačující nebo nebyla pacientem tolerována.
Výsledky
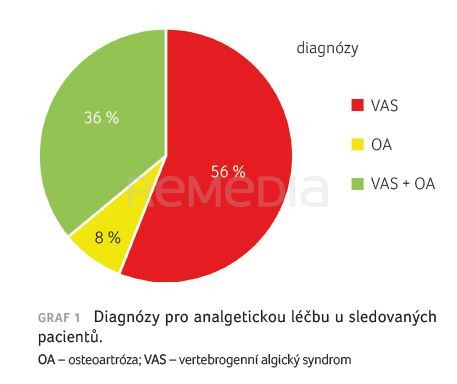 V období od dubna do června 2023 jsme v naší ambulanci bolesti použili transdermální nízkodávkový buprenorfin u 108 pacientů, 76 žen a 32 mužů, ve věkovém rozmezí 38–87 let (průměrný věk 64 let). Důvodem pro analgetickou terapii byly bolesti zad u 61 (tj. 56 %) pacientů, bolesti při osteoartróze u osmi (8 %) pacientů a kombinace obou u 39 (36 %) pacientů, graf 1.
V období od dubna do června 2023 jsme v naší ambulanci bolesti použili transdermální nízkodávkový buprenorfin u 108 pacientů, 76 žen a 32 mužů, ve věkovém rozmezí 38–87 let (průměrný věk 64 let). Důvodem pro analgetickou terapii byly bolesti zad u 61 (tj. 56 %) pacientů, bolesti při osteoartróze u osmi (8 %) pacientů a kombinace obou u 39 (36 %) pacientů, graf 1.
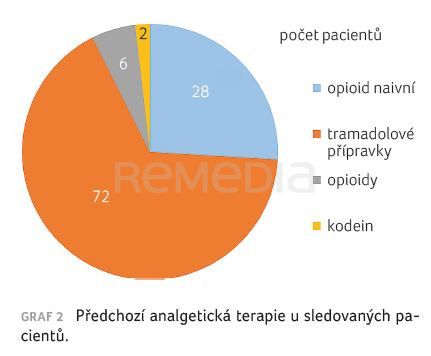 Předchozí analgetická terapie byla založena na neopioidních analgetikách u 28 (tj. 26 %) pacientů, tramadolové přípravky (včetně kombinace tramadolu s paracetamolem nebo dexketoprofenem) byly použity u 72 (66 %) pacientů, kodeinové přípravky u dvou (2 %) pacientů a jiné silné opioidy u šesti (6 %) pacientů, graf 2.
Předchozí analgetická terapie byla založena na neopioidních analgetikách u 28 (tj. 26 %) pacientů, tramadolové přípravky (včetně kombinace tramadolu s paracetamolem nebo dexketoprofenem) byly použity u 72 (66 %) pacientů, kodeinové přípravky u dvou (2 %) pacientů a jiné silné opioidy u šesti (6 %) pacientů, graf 2.
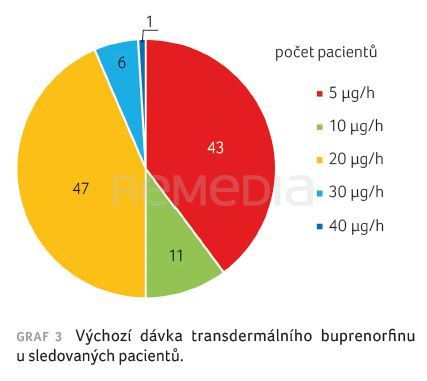 Výchozí dávka nízkodávkového buprenorfinu byla 5 µg/h u 43 (40 %) pacientů, 10 µg/h u 11 (10 %) pacientů, 20 µg/h u 47 (43 %) pacientů, 30 µg/h u šesti (6 %) pacientů a 40 µg/h u jednoho (1 %) pacienta, graf 3. Sledování pacientů probíhalo po dobu 4–6 měsíců. Nakonec bylo hodnoceno pouze 107 pacientů, jeden zemřel na neurologickou diagnózu.
Výchozí dávka nízkodávkového buprenorfinu byla 5 µg/h u 43 (40 %) pacientů, 10 µg/h u 11 (10 %) pacientů, 20 µg/h u 47 (43 %) pacientů, 30 µg/h u šesti (6 %) pacientů a 40 µg/h u jednoho (1 %) pacienta, graf 3. Sledování pacientů probíhalo po dobu 4–6 měsíců. Nakonec bylo hodnoceno pouze 107 pacientů, jeden zemřel na neurologickou diagnózu.
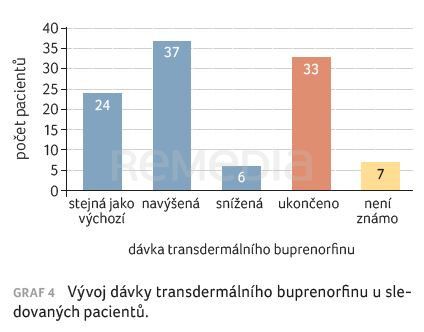 Zastoupení jednotlivých dávek při zahájení léčby a na konci sledovaného období (při osobní kontrole na ambulanci nebo při posledním objednávání elektronického receptu) je patrné z grafu 4. Celkem 33 (31 %) pacientů aplikaci transdermálního buprenorfinu ukončilo, důvody budou zmíněny dále, u sedmi (7 %) pacientů nejsou data k dispozici.
Zastoupení jednotlivých dávek při zahájení léčby a na konci sledovaného období (při osobní kontrole na ambulanci nebo při posledním objednávání elektronického receptu) je patrné z grafu 4. Celkem 33 (31 %) pacientů aplikaci transdermálního buprenorfinu ukončilo, důvody budou zmíněny dále, u sedmi (7 %) pacientů nejsou data k dispozici.
Výskyt nežádoucích účinků odpovídal údajům v Souhrnu údajů o přípravku [4].
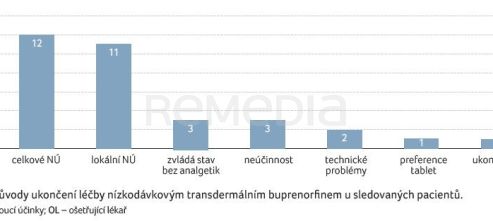 Celkem 33 (31 %) pacientů léčbu nízkodávkovým buprenorfinem ukončilo. Důvodem pro přerušení aplikace nízkodávkového transdermálního buprenorfinu byly reakce v místě aplikace (pálení, vyrážka) u 12 (11 %) pacientů, celkové nežádoucí účinky (obvykle závratě a somnolence) u 11 (10 %) pacientů, nedostatečný účinek u tří (3 %) pacientů – naopak tři (3 %) pacienti zvládali stav bez analgetik (po odstranění příčiny bolestí operací) –, u dvou (2 %) pacientů technické problémy (náplast nedrží, odchlipuje se), jedna (1 %) pacientka preferovala tabletovou formu analgetik a u jednoho (1 %) pacienta byla léčba ukončena jiným lékařem (za hospitalizace), graf 5.
Celkem 33 (31 %) pacientů léčbu nízkodávkovým buprenorfinem ukončilo. Důvodem pro přerušení aplikace nízkodávkového transdermálního buprenorfinu byly reakce v místě aplikace (pálení, vyrážka) u 12 (11 %) pacientů, celkové nežádoucí účinky (obvykle závratě a somnolence) u 11 (10 %) pacientů, nedostatečný účinek u tří (3 %) pacientů – naopak tři (3 %) pacienti zvládali stav bez analgetik (po odstranění příčiny bolestí operací) –, u dvou (2 %) pacientů technické problémy (náplast nedrží, odchlipuje se), jedna (1 %) pacientka preferovala tabletovou formu analgetik a u jednoho (1 %) pacienta byla léčba ukončena jiným lékařem (za hospitalizace), graf 5.
Jak je důležitá titrace dávky, chceme ilustrovat na případu 80leté pacientky s chronickými bolestmi dolních zad s propagací do levé dolní končetiny na podkladě degenerativních změn páteře a spondylolistézy L45 a L5S1. Analgetická léčba kombinací tramadolu s paracetamolem byla dostačující, ale prodělané onemocnění covid‑19 způsobilo zhoršení úrovně bolesti [5]. Vzhledem k užívané denní spotřebě šesti tablet (v dávce 37,5 mg tramadolu/325 mg paracetamolu) jsme zahájili léčbu transdermálním buprenorfinem rovnou v dávce 20 µg/h, po níž sice nastala úleva od bolesti, ale pacientka uváděla motání hlavy, nevolnost, světloplachost. Snížili jsme dávku na 5 µg/h, při které nežádoucí účinky vymizely, ale zhoršila se intenzita bolesti. Po navýšení dávky na 10 µg/h je pacientka již bez bolestí a bez uváděných či jiných nežádoucích účinků.
Diskuse
Buprenorfin – syntetický opioid odvozený od thebainu – byl vyvinut v roce 1966 jako analgetikum s nízkým potenciálem zneužití. V roce 1975 byl schválen jako alternativa k metadonu k léčbě závislostí na opioidech. V roce 1978 byl uveden na trh jako analgetikum pro pooperační bolest, nejdříve pouze v injekční formě, po roce 2002 též ve formě sublinguální a od roku 2010 i v transdermální formě [6–8]. Jako analgetikum se tedy používá téměř 40 let.
Jeho jedinečné farmakologické vlastnosti umožňují silnou analgezii při nižší intenzitě výskytu klasických nežádoucích účinků běžných u jiných „klasických“ opioidů. Z tohoto důvodu se buprenorfin zařazuje mezi tzv. atypické opioidy. Jeho účinek není dán pouze jeho aktivitou na receptoru µ, ale působí též na ostatních opioidních receptorech κ, δ a ORL1 (opioid receptor‑like 1). Na receptoru µ se chová jako parciální agonista, na receptorech κ a δ jako antagonista a na receptoru ORL1 jako agonista. Z toho vyplývají jeho unikátní vlastnosti: parciální agonismus na receptoru µ zajistí silnou analgezii se stropovým efektem na dechovou depresi, euforii i další nežádoucí účinky opioidů. Antagonismus na opioidních receptorech κ a δ snižuje výskyt některých obvyklých nežádoucích účinků opioidů, jako jsou zácpa, dechová deprese, úzkost a vznik závislosti. Agonismus na opioidním receptoru ORL1 přispívá ke spinální analgezii a dále omezuje potenciál pro vznik závislosti na opioidech. Buprenorfin neobsazuje všechny receptory µ, proto je v analgetických dávkách dostatek volných receptorů pro použití jiných opioidů, např. při řešení průlomové bolesti. Vazba na receptory je pomalá, proto účinky buprenorfinu nastupují pomalu a dlouho přetrvávají.
Buprenorfin je lipofilní, proto má dobrou biologickou dostupnost, metabolizuje se v játrech prostřednictvím CYP3A4, jeho metabolit norbuprenorfin má vysokou afinitu k receptoru µ, ale minimální analgetickou aktivitu, eliminuje se převážně žlučí, v menší míře i močí. Metabolismus buprenorfinu je při snížené renální clearance ovlivněn minimálně, proto je bezpečný i pro pacienty s renální insuficiencí. Vyznačuje se dobrou tolerancí u seniorů a nedochází k výraznému útlumu kognitivních funkcí oproti jiným opioidům. Jeho maximální dávka je 140 µg/h. Z tohoto pohledu se tedy jedná o velice účinné a přitom bezpečné opioidní analgetikum, podle Metodických pokynů pro léčbu chronické bolesti je vhodným opioidem první volby pro léčbu bolesti u seniorů [1,3,9,10]. Mnohými lékaři je doporučován jako dlouhodobě působící opioidní analgetikum první linie pro léčbu chronické bolesti [8,11].
Buprenorfin v porovnání s jinými µ agonisty vykazuje nejvyšší vazebnou afinitu k receptoru. Navíc svým účinkem na opioidním µ receptoru omezuje fosforylaci receptoru a snižuje tím tvorbu β‑arrestinu, který je odpovědný za nežádoucí účinky µ agonistů. Buprenorfin může mít větší vliv na spinální opioidní receptory než na receptory v mozku, což minimalizuje klasické opioidní nežádoucí účinky, jako jsou euforie, vznik závislosti nebo respirační deprese [12]. Tím, že buprenorfin neobsazuje všechny µ receptory, je volný dostatek receptorů, a je tedy možné jej kombinovat s dalšími opioidy jako tzv. záchrannou medikaci při náhlém zhoršení úrovně bolesti nenádorové, případně při průlomové bolesti. Vhodní jsou čistí µ agonisté (morfin, fentanyl) nebo atypické opioidy (tramadol či tapentadol), vždy v lékové formě s rychlým nástupem účinku [2,13,14].
Transdermální nízkodávkový buprenorfin 5 µg/h, 10 µg/h a 20 µg/h se sedmidenní výměnou je k dispozici ve světě již řadu let a využívá se k léčbě středně silné chronické bolesti při osteoartróze, bolestech zad a jiných perzistentních bolestivých syndromech, přičemž byla prokázána jeho dobrá účinnost i tolerance, a to rovněž u geriatrických pacientů [15].
Jak již bylo uvedeno výše, buprenorfin je vhodným analgetikem i pro seniorní populaci, podle metodických pokynů je doporučen jako analgetikum první volby [1]. Důvodem použití transdermálního buprenorfinu k léčbě bolesti u geriatrické populace je podle zahraničních studií skutečnost, že u této molekuly nedochází k ovlivnění kognitivních funkcí, k respirační depresi nebo k ovlivnění chování pacientů [16–18]. U pacientů s polypragmazií nelze opomenout ani možnost interakcí mezi různými léky při metabolismu prostřednictvím CYP (zejména CYP2D6 a CYP3A4) se zásahem do farmakokinetiky. Doporučuje se tedy při léčbě opioidy volit takové, které mají méně farmakokinetických interakcí, nemají aktivní metabolity, a vždy začínat jejich nejnižšími dávkami a podle potřeby je zvyšovat jen velmi pomalu [19]. Použití transdermálního buprenorfinu k léčbě bolesti u geriatrické populace bylo v zahraničních studiích popsáno jako účinná a bezpečná volba, při níž nedochází k ovlivnění kognitivních funkcí, k respirační depresi nebo ovlivnění chování pacientů [16–18].
Vzhledem k farmakologickému profilu a analgetickému účinku je buprenorfin vhodný též u nádorové bolesti somatického a viscerálního původu i bolesti neuropatické [6,20]. Má ale i další využití, díky velmi vysoké afinitě k µ receptoru se využívá v adiktologii k odvykací léčbě při abúzu jiných opioidů, zejména fentanylu, heroinu a oxykodonu, ale zmírní bažení (craving) také u metamfetaminu. V této indikaci se nicméně využívají dávky mnohonásobně vyšší, 16–24 mg/den, avšak použít je možné rovněž dávku 32 mg/den [3,6,7,21]. Toto dávkové rozpětí od nízkodávkového buprenorfinu (dávka 5 µg/h odpovídá 0,12 mg/den, 40 µg/h odpovídá 0,96 mg/den) až po adiktologické dávky 24 mg/den a více navíc svědčí o širokém terapeutickém okně této molekuly.
V našem souboru pacientů se projevila dobrá snášenlivost přípravku, odstupňované velikosti náplastí umožňují poměrně šetrnou titraci léku a úpravu dávky směrem nahoru i dolů. Výskyt nežádoucích účinků byl nízký, nejčastěji jsme se potýkali s reakcemi v místě aplikace. V té době také začalo velice horké počasí se zvýšeným pocením pacientů, nepřekvapilo nás tedy, že aplikované náplasti lokálně dráždily. Doporučujeme našim pacientům po sejmutí náplasti vždy ošetřit pokožku v místě aplikace mastným krémem, osvědčily se nám přípravky na dětské opruzeniny. U řady celkových nežádoucích účinků postačovalo snížit aplikovanou dávku. Prezentovaná kazuistika dokládá jednak účinnost přípravku u seniorní populace, jednak nezbytnost pečlivé titrace dávky, což nabízené dávky transdermálního buprenorfinu 5 µg/h, 20 µg/h, 30 µg/h a 40 µg/h umožňují.
Závěr
Buprenorfin v nízkodávkové transdermální formě podle našich získaných zkušeností představuje přínosné rozšíření možností léčby chronické nenádorové bolesti pohybového aparátu a potvrzuje tak výsledky předchozích studií. Mezi jeho největší výhody patří dobrá tolerance, dobrý bezpečnostní profil a nízké riziko dechového útlumu i vzniku závislosti.
MUDr. Jan Procházka, Ph.D.
Centrum léčby chronické bolesti při KAPIM
Krajská zdravotní, a.s. – Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 3316/12A, 401 13 Ústí nad Labem
e-mail: jan.prochazka@kzcr.cz
Literatura
[1] Kozák J, Lejčko J, Fricová J, et al. Metodické pokyny pro farmakoterapii chronické bolesti. Bolest 2022; 25(Suppl 1): 7–44.
[2] Vranová V. Buprenorfin – výjimečný opioid pro léčbu chronické bolesti. Farmakoter Revue 2023; 8: 1–4.
[3] Urits I, Pham C, Swanson D, et al. The utilization of buprenorphine in chronic pain. Best Pract Res Clin Anesthesiol 2020; 34: 355–368.
[4] SPC Buprenorfin. Dostupné na: https://prehledy.sukl.cz/prehled_leciv.html#/detail‑reg/0251682
[5] Procházka J. COVID‑19 a jeho vliv na bolest. Bolest 2021; 24: 59–63.
[6] Degnan M, Mousa SA. A narrative review of buprenorphine in adult cancer pain. Exp Rev Clin Pharmacol 2020; 13: 11591167.
[7] Shulman M, Wai JM, Nunes EV. Buprenorphine treatment for opioid use disorder: an overview. CNS Drugs 2019; 33: 567–580.
[8] Webster L, Gudin J, Raffa RB, et al. Understanding buprenorphine for use in chronic pain: expert opinion. Pain Med 2020; 21: 714–723.
[9] Kozák J, Lejčko J, Vrba I. Opioidy. 2. vydání. Praha: Maxdorf, 2021.
[10] Vranová V. Nová transdermální forma nízkodávkovaného buprenorfinu. Bolest 2023; 26: 6164.
[11] Fishman MA, Kim PS. Buprenorphine for chronic pain: a systemic review. Curr Pain Headache Rep 2018; 22: 83.
[12] Gudin J, Fudin J. A narrative pharmacological review of buprenorphine: a unique opioid for the treatment of chronic pain. Pain Ther 2020; 9: 41–54.
[13] Gregorová J, Holečková P. Úskalí farmakoterapie opioidy v klinické praxi. Prakt Lékáren 2016; 12: 47–49.
[14] Davis MP, Pasternak G, Behm B. Treating chronic pain: an overview of clinical studies centered on the buprenorphine option. Drugs 2018; 78: 1211–1228.
[15] Plosker GL. Buprenorphine 5, 10 and 20 µg/h transdermal patch. Drugs 2011; 71: 2491–2509.
[16] Vadivelu N, Hines RL. Management of chronic pain in the elderly: focus on transdermal buprenorphine. Clin Interv Aging 2008; 3: 421–430.
[17] Gianni W, Madaio AR, Ceci M, et al. Transdermal buprenorphine for treatment of chronic noncancer pain in the oldest old. J Pain Symptom Manage 2011; 41: 707–714.
[18] Schwan J, Sclafani J, Tawfik VL. Chronic pain management in the elderly. Anesthesiol Clin 2019; 37: 547–560.
[19] Virnes R‑E, Tiihonen M, Karttunen N, et al. Opioids and falls risk in older adults: a narrative review. Drugs Aging 2022; 39: 199–207.
[20] Sláma O. Buprenorfin v onkologické paliativní péči. Acta Medicinae 2023; 11: 1–3.
[21] Grande LA, Cun diff D, Greenwald MK, et al. Evidence on buprenorphine dose limits: a review. J Addict Med 2023; 17: 509516.