Psoriáza a spondyloartritida, nemoci mnoha tváří – jak se s nimi popasuje duální inhibice IL 17A a IL 17F?
Na Zimních revmatologických dnech, které se konaly v Clarion Grandhotelu Zlatý Lev v Liberci 17.–19. ledna 2024, se diskutovala aktuální mezioborová témata. Satelitní sympozium společnosti UCB, kterému předsedal prof. MUDr. Karel Pavelka, DrSc., zaměřilo svoji pozornost na psoriázu a spondyloartritidu a věnovalo se efektu duální inhibice interleukinu (IL) 17A a 17F.
Bimekizumab a psoriáza – rychlost a síla
S první přednáškou vystoupil před auditorium doc. MUDr. Filip Rob, Ph.D., přednosta Dermatovenerologické kliniky Fakultní nemocnice Bulovka a 2. LF UK. V úvodu připomněl, že inhibitory IL‑17 spolu s inhibitory IL‑23 představují v současnosti „top“ účinné terapie pro pacienty s psoriázou. Bimekizumabu, který obohatil léčebné možnosti psoriázy nedávno, se v rámci lékové skupiny podařilo nabídnout, i přes vysoko nastavenou laťku, ještě něco navíc. Bimekizumab je prvním schváleným biologikem, které bylo vyvinuto s cílem selektivně a přímo inhibovat jak IL‑17F, tak IL‑17A. Tyto interleukiny představují dva důležité členy rodiny cytokinů IL‑17, jejichž biologické role se překrývají a které jsou klíčovými prozánětlivými faktory v patogenezi psoriázy. Nadměrně se exprimují v psoriatických kožních lézích a mohou nezávisle na sobě vyvolávat zánětlivou reakci [1,2]. Bylo doloženo, že kombinovaná neutralizace IL‑17A a IL‑17F pomocí bimekizumabu inhibovala expresi genů souvisejících s psoriázou a produkci cytokinů ve větší míře, než tomu bylo při samostatné inhibici IL‑17A in vitro [1,2]. Amplifikační smyčka zánětu řídí aktivitu osy IL‑17/23. Produkce IL‑17A a IL‑17F buňkami vrozeného imunitního systému nezávislá na IL‑23 může u psoriatického onemocnění přispívat k zánětu zprostředkovanému IL‑17.
![GRAF 1A–D Superiorita bimekizumabu hodnocená jako odpověď PASI 75 ve 4. týdnu sledování; podle [3–6] – Reich, et al., 2021; Gordon, et al., 2021; Warren, et al., 2021; Reich, et al., 2021. BKZ – bimekizumab; PASI 75 – 75% zlepšení Psoriasis Area and Severity Index; Q4W – každé čtyři týdny GRAF 1A–D Superiorita bimekizumabu hodnocená jako odpověď PASI 75 ve 4. týdnu sledování; podle [3–6] – Reich, et al., 2021; Gordon, et al., 2021; Warren, et al., 2021; Reich, et al., 2021. BKZ – bimekizumab; PASI 75 – 75% zlepšení Psoriasis Area and Severity Index; Q4W – každé čtyři týdny](https://www.remedia.cz/photo-pg-1286---.jpg) Klinická hodnocení s bimekizumabem demonstrovala rychlejší nástup odpovědi oproti placebu i aktivním komparátorům (graf 1A–D) [3–6]. Superiorita účinku byla hodnocena odpovědí PASI 75 (75% zlepšení Psoriasis Area and Severity Index) ve čtvrtém týdnu léčby, tedy po jedné dávce bimekizumabu.
Klinická hodnocení s bimekizumabem demonstrovala rychlejší nástup odpovědi oproti placebu i aktivním komparátorům (graf 1A–D) [3–6]. Superiorita účinku byla hodnocena odpovědí PASI 75 (75% zlepšení Psoriasis Area and Severity Index) ve čtvrtém týdnu léčby, tedy po jedné dávce bimekizumabu.
![GRAF 2A–D Dosažení odpovědi PASI 90 v 16. týdnu při léčbě bimekizumabem; podle [3–6] – Reich, et al., 2021; Gordon, et al., 2021; Warren, et al., 2021; Reich, et al., 2021. BKZ – bimekizumab; PASI 90 – 90% zlepšení Psoriasis Area and Severity Index; Q4W – každé čtyři týdny GRAF 2A–D Dosažení odpovědi PASI 90 v 16. týdnu při léčbě bimekizumabem; podle [3–6] – Reich, et al., 2021; Gordon, et al., 2021; Warren, et al., 2021; Reich, et al., 2021. BKZ – bimekizumab; PASI 90 – 90% zlepšení Psoriasis Area and Severity Index; Q4W – každé čtyři týdny](https://www.remedia.cz/photo-pg-1287---.jpg) Za současný cíl terapeutické odpovědi v léčbě psoriázy je dnes považována odpověď PASI 90 (90% zlepšení PASI). Ve stejných klinických studiích dosáhlo při léčbě bimekizumabem této odpovědi 9 z 10 pacientů (graf 2A–D). Ideálem efektu léčby psoriázy je dosažení „čisté kůže“, tedy úplného zhojení (hodnoceno jako odpověď PASI 100). I v tomto parametru demonstroval bimekizumab v rámci všech klinických studií konzistentně vysokou účinnost. Odpověď PASI 100 byla v 16. týdnu zaznamenána u 6–7 z 10 pacientů.
Za současný cíl terapeutické odpovědi v léčbě psoriázy je dnes považována odpověď PASI 90 (90% zlepšení PASI). Ve stejných klinických studiích dosáhlo při léčbě bimekizumabem této odpovědi 9 z 10 pacientů (graf 2A–D). Ideálem efektu léčby psoriázy je dosažení „čisté kůže“, tedy úplného zhojení (hodnoceno jako odpověď PASI 100). I v tomto parametru demonstroval bimekizumab v rámci všech klinických studií konzistentně vysokou účinnost. Odpověď PASI 100 byla v 16. týdnu zaznamenána u 6–7 z 10 pacientů.
![GRAF 3 Setrvalá účinnost bimekizumabu po dobu tří let ve studiích BE SURE a BE BRIGHT dle randomizace k léčbě; podle [7] – Thaçi, et al., 2022. ADA – adalimumab; BZK – bimekizumab; PASI 100 – 100% zlepšení Psoriasis Area and Severity Index; Q2W/Q4W/Q8W – každé 2 týdny/4 týdny/ každých 8 týdnů GRAF 3 Setrvalá účinnost bimekizumabu po dobu tří let ve studiích BE SURE a BE BRIGHT dle randomizace k léčbě; podle [7] – Thaçi, et al., 2022. ADA – adalimumab; BZK – bimekizumab; PASI 100 – 100% zlepšení Psoriasis Area and Severity Index; Q2W/Q4W/Q8W – každé 2 týdny/4 týdny/ každých 8 týdnů](https://www.remedia.cz/photo-pg-1288---.jpg) V léčbě chronického onemocnění je důležitá také setrvalá odpověď na léčbu. Bimekizumab má dostupná již tříletá data účinnosti. Odpověď PASI 100 si udržel vysoký podíl pacientů až do 152. týdne sledování. Rychlé dosažení odpovědi PASI 100 a její udržení až do 152. týdne bylo zaznamenáno také u pacientů převedených na bimekizumab z adalimumabu ve 24. týdnu léčby (graf 3) [7].
V léčbě chronického onemocnění je důležitá také setrvalá odpověď na léčbu. Bimekizumab má dostupná již tříletá data účinnosti. Odpověď PASI 100 si udržel vysoký podíl pacientů až do 152. týdne sledování. Rychlé dosažení odpovědi PASI 100 a její udržení až do 152. týdne bylo zaznamenáno také u pacientů převedených na bimekizumab z adalimumabu ve 24. týdnu léčby (graf 3) [7].
Uvedené výsledky účinnosti zahrnují údaje od populace ITT (se záměrem léčit) na základě výchozí randomizované skupiny při zahájení studie BE SURE a zahrnují 152 týdnů léčby. Ve studii BE SURE byli pacienti randomizováni v poměru 1 : 1 : 1 k léčbě BKZ 320 mg Q4W po dobu 56 týdnů, k léčbě BKZ 320 mg Q4W po dobu 16 týdnů a poté Q8W od 16. do 56. týdne nebo k léčbě adalimumabem 40 mg Q2W po dobu 24 týdnů a k následnému převedení na léčbu BKZ 320 mg Q4W do 56. týdne. V 56. týdnu mohlo dojít u pacientů k úpravě dávky (BKZ 320 mg Q4W nebo Q8W) na základě dosažení odpovědi PASI 90. Ve 24. týdnu studie BE BRIGHT mohl zkoušející u pacientů, kterým byl podáván BKZ 320 mg Q4W a kteří dosáhli odpovědi PASI 90, změnit interval podání dávky 320 mg z Q4W na Q8W.
Z hlediska bezpečnosti léčby jsou při terapii bimekizumabem, jak už z mechanismu účinku blokády IL‑17 vyplývá, častěji hlášeny mykotické infekce. Docent Rob uvedl, že v praxi se nejčastěji jedná o soor, meziprstní infekce či u žen o kvasinkové genitální infekce. Dle výsledků poolované analýzy bezpečnostních dat z osmi studií s bimekizumabem byly nejčastějšími nežádoucími účinky nazofaryngitida, orální kandidóza a infekce horních cest dýchacích [8].
Přednášející v další části prezentace představil případ 46letého pacienta, který trpí psoriázou od 13 let. Zpočátku se jednalo o chronickou formu s postižením loktů, od 16 let se zhruba dvakrát ročně objevila erytrodermie postihující celé tělo. Pacient vystřídal různá pracoviště, ve 24 letech u něj byla nasazena celková terapie acitretinem, která vedla pouze ke snížení výskytu erytrodermií. Ve 26 letech byla léčba změněna na cyklosporin, rovněž vedla pouze ke snížení výskytu erytrodermií. Po dvou letech musela být terapie standardně ukončena a pacient byl dále pouze na lokální léčbě s minimálním efektem. Ve 30 letech (r. 2007) se objevily výrazné bolesti páteře, pacient byl vyšetřen v Revmatologickém ústavu a diagnostikován byl m. Bechtěrev. V témže roce byl pro výraznou erytrodermii poprvé hospitalizován na Dermatovenerologické klinice 2. LF UK a FN Bulovka. Zahájena byla kombinační terapie infliximab + metotrexát s velmi dobrým efektem, již po 16 týdnech měl pacient jen drobné projevy (lokty, bérce). V průběhu čtyř let ale docházelo k setrvalému zvyšování hodnot jaterních testů a v roce 2011 byl z tohoto důvodu metotrexát vysazen a ponechán byl pouze infliximab.
V roce 2021 po deseti letech a 84 aplikacích byla terapie infliximabem pro postupné zhoršování odpovědi ukončena (BSA [Body Surface Area] 15, PASI 13,1). Zahájena byla terapie secukinumabem, která byla ale v následujícím roce pro nedosažení odpovědi PASI 75 ukončena (BSA 14, PASI 9,4, DLQI [Dermatology Life Quality Index] 13). Následovala terapie ixekizumabem s dobrým efektem (až PASI 1,2). V roce 2023 nicméně pacient prodělal opakované těžké konjunktivitidy, došlo k poklesu účinnosti terapie (BSA 13, PASI 8,4, DLQI 14) a léčba byla ukončena. V březnu 2023 byla zahájena terapie bimekizumabem, na kterou pacient zareagoval velmi dobře, po čtyřech týdnech terapie bylo zaznamenáno BSA 4, PASI 0,6, po 16 týdnech terapie BSA 2, PASI 0,6, DLQI 0. Pacient je dosud bez výskytu nežádoucích účinků, bolestmi páteře také netrpí.
Je důležitá účinnost na klíčové domény PsA?
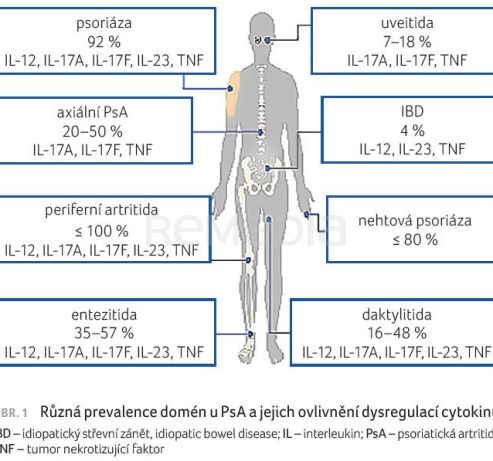 Na bimekizumab z pohledu klíčových domén psoriatické artritidy (PsA) se zaměřila ve své prezentaci MUDr. Leona Procházková, Ph.D., revmatoložka z II. interní kliniky Fakultní nemocnice u sv. Anny v Brně. Psoriatická artritida je systémové onemocnění s různými projevy. Ne všechny jsou ovlivnitelné léčbou stejným způsobem, a právě proto se bavíme o různých doménách onemocnění. Každá doména je ovlivňována dysregulací různých kombinací cytokinů. Mezi klíčové domény patří ty s nejvyšší frekvencí výskytu (obr. 1).
Na bimekizumab z pohledu klíčových domén psoriatické artritidy (PsA) se zaměřila ve své prezentaci MUDr. Leona Procházková, Ph.D., revmatoložka z II. interní kliniky Fakultní nemocnice u sv. Anny v Brně. Psoriatická artritida je systémové onemocnění s různými projevy. Ne všechny jsou ovlivnitelné léčbou stejným způsobem, a právě proto se bavíme o různých doménách onemocnění. Každá doména je ovlivňována dysregulací různých kombinací cytokinů. Mezi klíčové domény patří ty s nejvyšší frekvencí výskytu (obr. 1).
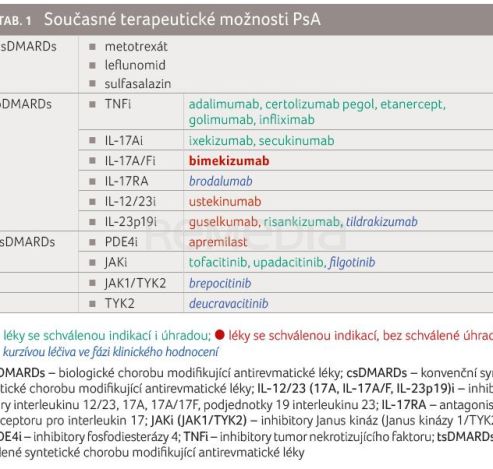 V posledních letech došlo k velkému rozvoji léčebných možností PsA (tab. 1). Cílem terapie je dosažení remise/alternativně nízké aktivity onemocnění prostřednictvím pravidelného hodnocení aktivity onemocnění a odpovídající úpravy léčby.
V posledních letech došlo k velkému rozvoji léčebných možností PsA (tab. 1). Cílem terapie je dosažení remise/alternativně nízké aktivity onemocnění prostřednictvím pravidelného hodnocení aktivity onemocnění a odpovídající úpravy léčby.
Portfolio přípravků se nedávno rozšířilo o bimekizumab, který sice patří do skupiny inhibitorů IL‑17, nicméně je svým mechanismem účinku unikátní. Tato monoklonální protilátka inhibuje vedle Il‑17A také IL‑17F a blokuje interakci s receptorovým komplexem IL‑17RA/IL‑17RC. Jak již bylo řečeno, tato duální inhibice blokuje expresi prozánětlivých cytokinů a chemotaxi neutrofilů účinněji než blokáda pouze IL‑17A či IL‑17F. Oba interleukiny představují relevantní cíle léčby kožního i kloubního postižení.
![GRAF 4A, B Dosažení minimální aktivity onemocnění při léčbě bimekizumabem ve studiích BE OPTIMAL (A) a BE COMPLETE (B); podle [9–11] – Ritchlin, et al., 2023; Coates, et al., 2023; Merola, et al., 2023. ADA – adalimumab; BKZ – bimekizumab; PBO – placebo; Q2W/Q4W – každé dva/čtyři týdny GRAF 4A, B Dosažení minimální aktivity onemocnění při léčbě bimekizumabem ve studiích BE OPTIMAL (A) a BE COMPLETE (B); podle [9–11] – Ritchlin, et al., 2023; Coates, et al., 2023; Merola, et al., 2023. ADA – adalimumab; BKZ – bimekizumab; PBO – placebo; Q2W/Q4W – každé dva/čtyři týdny](https://www.remedia.cz/photo-pg-1291---.jpg) Efekt léčby bimekizumabem u PsA zkoumala klinická hodnocení BE OPTIMAL s aktivním komparátorem (adalimumab) u pacientů dosud naivních k biologické terapii a BE COMPLETE u nemocných s nedostatečnou odpovědí na terapii inhibitory tumor nekrotizujícího faktoru (TNF). Jak dokládají výsledky klinického hodnocení (graf 4A, B), minimální aktivity onemocnění dosáhla v 16. týdnu téměř polovina pacientů [9–11]. Ve studii BE OPTIMAL byl dále sledován efekt léčby bimekizumabem na dosažení ACR 50 (50% zlepšení dle American College of Rheumatology) v souvislosti s konkomitantní léčbou metotrexátem a bez ní. Ukázalo se, že komedikace metotrexátem neměla vliv na účinnost léčby bimekizumabem.
Efekt léčby bimekizumabem u PsA zkoumala klinická hodnocení BE OPTIMAL s aktivním komparátorem (adalimumab) u pacientů dosud naivních k biologické terapii a BE COMPLETE u nemocných s nedostatečnou odpovědí na terapii inhibitory tumor nekrotizujícího faktoru (TNF). Jak dokládají výsledky klinického hodnocení (graf 4A, B), minimální aktivity onemocnění dosáhla v 16. týdnu téměř polovina pacientů [9–11]. Ve studii BE OPTIMAL byl dále sledován efekt léčby bimekizumabem na dosažení ACR 50 (50% zlepšení dle American College of Rheumatology) v souvislosti s konkomitantní léčbou metotrexátem a bez ní. Ukázalo se, že komedikace metotrexátem neměla vliv na účinnost léčby bimekizumabem.
Psoriáza ovlivňuje významně kvalitu života pacienta i po odeznění artritid. Pouze 47 % pacientů, kteří dosáhli nízké aktivity PsA, dosáhlo také skóre PASI ≤ 1. Z 53 % pacientů, kteří nízké aktivity PsA dosáhli a stále měli PASI > 1, mělo 31 % středně těžkou až těžkou psychosociální poruchu [12].
![GRAF 5A, B Efekt léčby bimekizumabem na kožní projevy u pacientů s PsA – dosažení odpovědi PASI 100 – ve studiích BE OPTIMAL (A) a BE COMPLETE (B); podle [9–11] – Ritchlin, et al., 2023; Coates, et al., 2023; Merola, et al., 2023. ADA – adalimumab; BKZ – bimekizumab; PASI 100 – 100% zlepšení Psoriasis Area and Severity Index; PBO – placebo; Q2W/Q4W – každé dva/čtyři týdny GRAF 5A, B Efekt léčby bimekizumabem na kožní projevy u pacientů s PsA – dosažení odpovědi PASI 100 – ve studiích BE OPTIMAL (A) a BE COMPLETE (B); podle [9–11] – Ritchlin, et al., 2023; Coates, et al., 2023; Merola, et al., 2023. ADA – adalimumab; BKZ – bimekizumab; PASI 100 – 100% zlepšení Psoriasis Area and Severity Index; PBO – placebo; Q2W/Q4W – každé dva/čtyři týdny](https://www.remedia.cz/photo-pg-1292---.jpg) Jak již bylo prezentováno výše, bimekizumab prokázal v léčbě psoriázy superioritu vůči ustekinumabu, adalimumabu a secukinumabu [3,5,6]. Registrační studie BE OPTIMAL a BE COMPLETE s bimekizumabem u pacientů s PsA potvrdily rovněž jeho účinnost na psoriázu. Do klinického hodnocení byli zařazeni pacienti s PsA, kteří měli alespoň 3 % povrchu těla postižena psoriázou. Bimekizumab prokázal v ovlivnění kožních projevů velmi dobrý efekt (graf 5A, B) [9–11] a zde, jak poukázala přednášející, je již možné vidět rozdíly v dosažených výsledcích oproti adalimumabu. Při jejich obdobné účinnosti na kloubní projevy je ale u kožních projevů možné pozorovat výrazně vyšší účinnost bimekizumabu.
Jak již bylo prezentováno výše, bimekizumab prokázal v léčbě psoriázy superioritu vůči ustekinumabu, adalimumabu a secukinumabu [3,5,6]. Registrační studie BE OPTIMAL a BE COMPLETE s bimekizumabem u pacientů s PsA potvrdily rovněž jeho účinnost na psoriázu. Do klinického hodnocení byli zařazeni pacienti s PsA, kteří měli alespoň 3 % povrchu těla postižena psoriázou. Bimekizumab prokázal v ovlivnění kožních projevů velmi dobrý efekt (graf 5A, B) [9–11] a zde, jak poukázala přednášející, je již možné vidět rozdíly v dosažených výsledcích oproti adalimumabu. Při jejich obdobné účinnosti na kloubní projevy je ale u kožních projevů možné pozorovat výrazně vyšší účinnost bimekizumabu.
Co se týče bezpečnosti, nebyly v klinických studiích BE OPTIMAL a BE COMPLETE pozorovány žádné nové bezpečnostní signály. Ve studii BE OPTIMAL byly nejčastějšími nežádoucími příhodami nazofaryngitida (12,0 %), infekty horních cest dýchacích (7,1 %) a uroinfekce (6,1 %). Studie BE COMPLETE probíhala v době covidové pandemie, nejčastější nežádoucí příhodou zde proto byla koronavirová infekce (7,2 %), dále orální kandidóza (6,2 %), nazofaryngitida (5,9 %) a uroinfekce (5,9 %). Se zvýšenou pozorností byly s ohledem na mechanismus účinku sledovány mykotické infekce, nicméně byly zaznamenány mírné až středně závažné, nejčastěji orofaryngeální, žádná z nich nebyla systémová [9,10].
Doktorka Procházková však upozornila, že mykotické infekce je třeba při anti‑IL‑17 léčbě s pacientem vždy probrat, upozornit ho na možný výskyt a v léčbě zohlednit. Před zahájením anti‑IL‑17 terapie je doporučen screening. Existují faktory, které mohou pravděpodobnost rozvoje kandidózy zvyšovat (kouření, špatná ústní hygiena, nekompenzovaný diabetes mellitus, hyposalivace, vyšší věk, terapie inhalačními kortikosteroidy, antibiotiky či chemoterapie). Pacienty je třeba o možných příznacích kandidózy informovat a pravidelně vyšetřovat ústní dutinu. Při rozvoji mírné kandidózy se doporučuje lokálně výplach chlorhexidinem (0,12–0,2 %, krátkodobě, maximálně dva týdny), aplikace magistraliter nystatinové suspenze (nystatin není k dispozici pro orální podání), klotrimazolu nebo mikonazolu (mukoadhezivní tbl., v ČR není dostupné), lze zvážit krátkodobé (3–5 dní) podávání flukonazolu perorálně (p.o.). V případě středně těžké infekce je doporučen flukonazol p.o.
Přednášející v závěru shrnula, že bimekizumab představuje novou možnost terapie PsA s unikátním mechanismem účinku, duální inhibicí IL‑17A a IL‑17F. Je účinný v ovlivnění kloubních i kožních projevů onemocnění. Jeho efekt je prokazatelný u pacientů dosud naivních k biologické léčbě i po selhání inhibitorů TNF, bez ohledu na souběžnou léčbu metotrexátem.
Přípravek byl pro terapii PsA recentně schválen Evropskou lékovou agenturou. Je indikován k podání samostatně nebo v kombinaci s metotrexátem u pacientů, kteří nedostatečně reagovali na jeden nebo více chorobu modifikujících antirevmatických léků (DMARDs) nebo kteří je netolerovali. Doporučená dávka pro dospělé pacienty s aktivní PsA je 160 mg subkutánně (s.c.) každé 4 týdny, u pacientů se současnou středně těžkou/těžkou formou ložiskové psoriázy je doporučena dávka 320 mg v týdnech 0, 4, 8, 12, 16 a poté každých osm týdnů. V České republice zatím nemá přípravek v této indikaci schválenu úhradu z prostředků veřejného zdravotního pojištění.
Přínos bimekizumabu napříč spektrem axiálních spondyloartritid
![OBR. 2 Uspořádání studií BE MOBILE 1 a 2; podle [14] – Baraliakos, et al., 2022. AS – ankylozující spondylitida; ASAS 40 – 40% zlepšení dle Assessment of SpondyloArthritis International Society; nr-axSpA – non-radiografická axiální spondyloartritida; Q4W – každé čtyři týdny OBR. 2 Uspořádání studií BE MOBILE 1 a 2; podle [14] – Baraliakos, et al., 2022. AS – ankylozující spondylitida; ASAS 40 – 40% zlepšení dle Assessment of SpondyloArthritis International Society; nr-axSpA – non-radiografická axiální spondyloartritida; Q4W – každé čtyři týdny](https://www.remedia.cz/photo-pg-1293---.jpg) Docent MUDr. Rudolf Horváth, Ph.D., (Oddělení revmatologie dětí a dospělých, FN Motol, Praha) se ve třetím sdělení zaměřil na bimekizumab v léčbě axiálních spondyloartritid (axSpA). V klinickém programu vývoje bimekizumabu pro léčbu axSpA jsou zásadní klinické studie fáze III BE MOBILE 1 a 2 (obr. 2).
Docent MUDr. Rudolf Horváth, Ph.D., (Oddělení revmatologie dětí a dospělých, FN Motol, Praha) se ve třetím sdělení zaměřil na bimekizumab v léčbě axiálních spondyloartritid (axSpA). V klinickém programu vývoje bimekizumabu pro léčbu axSpA jsou zásadní klinické studie fáze III BE MOBILE 1 a 2 (obr. 2).
Studie BE MOBILE 1 sledovala pacienty s aktivní non‑radiografickou axSpA (nr‑axSpA), studie BE MOBILE 2 pak pacienty se středně těžkou až těžkou aktivní ankylozující spondylitidou (AS). Zařazeni mohli být dospělí pacienti se skóre BASDAI ≥ 4 a bolestí páteře ≥ 4 na škále NRS (Numeric Rating Scale) 0–10 s nedostatečnou odpovědí na léčbu dvěma různými nesteroidními antiflogistiky (NSAIDs) nebo s anamnézou nesnášenlivosti či kontraindikace léčby NSAIDs. Do studie mohli být zařazeni i pacienti s předchozí zkušeností s léčbou maximálně jedním inhibitorem TNF, u nichž byla zaznamenána nedostatečná odpověď nebo nesnášenlivost.
![GRAF 6A, B Odpověď ASAS 40 do 24. týdne ve studiích BE MOBILE 1 (A) a BE MOBILE 2 (B); podle [13] – van der Heijde, et al., 2023. ASAS 40 – 40% zlepšení dle Assessment of SpondyloArthritis International Society; BKZ – bimekizumab; PBO – placebo; Q4W – každé čtyři týdny GRAF 6A, B Odpověď ASAS 40 do 24. týdne ve studiích BE MOBILE 1 (A) a BE MOBILE 2 (B); podle [13] – van der Heijde, et al., 2023. ASAS 40 – 40% zlepšení dle Assessment of SpondyloArthritis International Society; BKZ – bimekizumab; PBO – placebo; Q4W – každé čtyři týdny](https://www.remedia.cz/photo-pg-1294---.jpg) V dvojitě zaslepeném období v délce 16 týdnů dostávali pacienti bimekizumab v dávce 160 mg každé 4 týdny (Q4W) nebo placebo. Primárním cílovým ukazatelem byla odpověď ASAS 40 (40% zlepšení dle Assessment of SpondyloArthritis International Society) v 16. týdnu. Následovala fáze udržovací léčby, kdy byli pacienti z placebové skupiny převedeni na aktivní léčbu bimekizumabem a sledováni až do 52. týdne. Léčba bimekizumabem vedla v populaci pacientů s nr‑axSpA a AS k významnému zmírnění známek aktivity onemocnění ve srovnání s placebem. Graf 6A, B prezentuje vývoj odpovědi ASAS 40 až do týdne 24 [14]. Je zřetelné, že po převedení pacientů z placeba na aktivní léčbu došlo k vyrovnání efektu léčby i u této skupiny pacientů.
V dvojitě zaslepeném období v délce 16 týdnů dostávali pacienti bimekizumab v dávce 160 mg každé 4 týdny (Q4W) nebo placebo. Primárním cílovým ukazatelem byla odpověď ASAS 40 (40% zlepšení dle Assessment of SpondyloArthritis International Society) v 16. týdnu. Následovala fáze udržovací léčby, kdy byli pacienti z placebové skupiny převedeni na aktivní léčbu bimekizumabem a sledováni až do 52. týdne. Léčba bimekizumabem vedla v populaci pacientů s nr‑axSpA a AS k významnému zmírnění známek aktivity onemocnění ve srovnání s placebem. Graf 6A, B prezentuje vývoj odpovědi ASAS 40 až do týdne 24 [14]. Je zřetelné, že po převedení pacientů z placeba na aktivní léčbu došlo k vyrovnání efektu léčby i u této skupiny pacientů.
Účinnost léčby byla sledována i v dalším období, z pacientů, kteří dosáhli odpovědi ASAS 40 v 16. týdnu, si 82,1 % udrželo tuto odpověď i v 52. týdnu. Odpovědi ASDAS (Ankylosing Spondylitis Disease Activity Score) < 2,1 bylo v 52. týdnu dosaženo u více než 50 % pacientů s nr‑axSpA a AS randomizovaných k léčbě bimekizumabem [15].
Část pacientů zařazených ve studiích BE MOBILE 1 a 2 byla naivních k anti‑TNF léčbě, u části došlo k jejímu selhání (TNF‑IR). Souhrnná analýza prokázala obdobnou odpověď dle ASAS 40 u TNF naivních a TNF‑IR pacientů v 16. i 52. týdnu. Sledování objektivních známek zánětu (skóre SPARCC magnetickorezonančního zobrazení sakroiliakálních kloubů [MRI SIJ], vysoce senzitivní C‑reaktivní protein [CRP]) ukázalo pokles hodnot při aktivní léčbě i následně po převedení pacientů z placeba na bimekizumab v 16. týdnu. Při analýze podskupin dle probíhajícího zánětu byla nejvyšší míra odpovědi ASAS 40 zaznamenána právě u skupiny pacientů s aktivním zánětem prokázaným MRI a se zvýšenou hodnotou CRP (MR+/CRP+).
Vedle axiálního postižení byl ve studiích BE MOBILE 1 a 2 sledován i efekt léčby bimekizumabem na periferní artritidu. Podíl pacientů s nulovým počtem oteklých a bolestivých kloubů, kteří měli na začátku sledování periferní postižení, se během léčby postupně zvyšoval, v 52. týdnu činil ve studii BE MOBILE 1 téměr 38 %, ve studii BE MOBILE 2 dosáhl 50 % [14]. Víc než 50 % pacientů s entezitidou na počátku sledování (Maastricht AS Enthesitis score [MASES] > 0) dosáhlo kompletní rezoluce entezitid (MASES = 0) v týdnu 16 a udrželo tento stav do týdne 52. Jako další vyzdvihl docent Horváth nižší incidenci uveitid u pacientů léčených bimekizumabem v 16. týdnu oproti placebové větvi [16].
Co se týče bezpečnosti léčby, do 52. týdne byl při expozici bimekizumabu hlášen alespoň jeden nežádoucí účinek spojený s léčbou (treatment emergent adverse event, TEAE) u 75 % (183/244) pacientů s nr‑axSpA a u 75,5 % (249/330) pacientů s AS; včetně pacientů, kteří byli převedeni na bimekizumab z placeba v 16. týdnu. Nejčastěji hlášenými TEAE byly nazofaryngitida, infekce horních cest dýchacích a orální kandidóza. V případě mykotických infekcí šlo nejčastěji o kandidózy, případy byly mírné až středně závažné (žádný nebyl závažný ani systémový); dva pacienti s nr‑axSpA a dva s AS přerušili léčbu z důvodu kandidóz. Nebyly hlášeny závažné nežádoucí kardiovaskulární příhody, případy aktivní tuberkulózy ani úmrtí. Incidence zánětlivého střevního onemocnění a uveitidy byly nízké [15].
Závěrem docent Horváth shrnul, že bimekizumab byl spojen s velmi rychlým nástupem účinku (hodnoceno jako ASAS 40) jak u populace pacientů s nr‑axSpA, tak u AS, a to již v prvním týdnu. Léčba byla dobře tolerována a profil nežádoucích účinků byl podobný jako u placebové kohorty. Nejčastěji hlášenými nežádoucími účinky byly nezávažné infekce, zejména infekce horních cest dýchacích a orální kandidózy.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Literatura
[1] Glatt S, Baeten D, Baker T, et al. Dual IL‑17A and IL‑17F neutralisation by bimekizumab in psoriatic arthritis: evidence from preclinical experiments and a randomised placebo‑controlled clinical trial that IL‑17F contributes to human chronic tissue inflammation. Ann Rheum Dis 2018; 77: 523–532.
[2] Adams R, Maroof A, Baker T, et al. Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL‑17A and IL‑17F. Front Immunol 2020: 11: 1894.
[3] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487–498.
[4] Gordon KB, Foley P, Krueger JG, et al. Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double‑blind, placebo‑controlled, randomised withdrawal phase 3 trial. Lancet 2021; 397: 475–486.
[5] Warren RB, Blauvelt A, Bagel J, et al. imekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med 2021; 385: 130–141.
[6] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus secukinumab in plaque psoriasis. N Engl J Med 2021; 385: 142–152.
[7] Thaçi D, et al. Bimekizumab efficacy and safety through three years in patients with moderate to severe plaque psoriasis: Long‑term results from the BE SURE randomised controlled trial and the BE BRIGHT open‑label extension. EADV Congress 2022; Poster P1572.
[8] Gordon KB, Langley RG, Warren RB, et al. Bimekizumab Safety in Patients With Moderate to Severe Plaque Psoriasis: Pooled Results From Phase 2 and Phase 3 Randomized Clinical Trials. JAMA Dermatol 2022; 158: 735–744.
[9] Ritchlin CT, Coates LC, McInnes IB, et al. Bimekizumab treatment in biologic DMARD‑naïve patients with active psoriatic arthritis: 52‑week efficacy and safety results from the phase III, randomised, placebo‑controlled, active reference BE OPTIMAL study. Ann Rheum Dis 2023; 82: 1404–1414.
[10] Coates L, Landewé RBM, McInnes I. Sustained efficacy and safety of bimekizumab in patients with active psoriatic arthritis and prior inadequate response to tumour necrosis factor inhibitors: results from the phase 3 BE COMPLETE study and its open‑label extension up to 1 year. Ann Rheum Dis 2023; 82: 346–347.
[11] Merola JF, Landewé R, McInnes IB, et al. Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor‑α inhibitors: a randomised, double‑blind, placebo‑controlled, phase 3 trial (BE COMPLETE). Lancet 2023; 401: 38–48.
[12] Kasiem FR, Kok MR, LuimeJJ, et al. Impact of psoriasis remains important in psoriatic arthritis patients with low musculoskeletal disease activity. Clin Exp Rheumatol 2023; 41: 88–93.
[13] van der Heijde D, Deodhar A, Baraliakos X, et al. Efficacy and safety of bimekizumab in axial spondyloarthritis: results of two parallel phase 3 randomised controlled trials. Ann Rheum Dis 2023; 82: 515–526.
[14] Baraliakos X, Deodhar A, van der Heijde D, et al. Bimekizumab Maintains Improvements in Efficacy Endpoints and Has a Consistent Safety Profile Through 52 Weeks in Patients with Non‑Radiographic Axial Spondyloarthritis and Ankylosing Spondylitis: Results from Two Parallel Phase 3 Studies. ACR Convergence 2022; Abstr. Nr. L14.