Tofacitinib v léčbě axiálních spondyloartritid – co nového?
Sympozium společnosti Pfizer na Zimních revmatologických dnech, které se konaly 17.–19. ledna 2024 v Liberci, se věnovalo tofacitinibu a jeho postavení v terapii spondyloartritid – psoriatické artritidy (PsA) a ankylozující spondylitidy (AS). Poslední přednáška pak přinesla důležité poznatky o vlivu kouření na prognózu pacientů i léčbu jejich revmatologických onemocnění a aktuální možnosti léčby závislosti na tabáku.
Co přináší tofacitinib v léčbě psoriatické artritidy?
Na tofacitinib v terapii PsA se v prvním sdělení zaměřila MUDr. Leona Procházková, Ph.D., (II. interní klinika revmatologie, FN u sv. Anny a LF MU Brno). K terapii dospělých pacientů s aktivní PsA v kombinaci s metotrexátem byl tofacitinib schválen americkým Úřadem pro kontrolu potravin a léčiv (FDA) již v roce 2017 a o rok později Evropskou lékovou agenturou (EMA). Úhradu z prostředků veřejného zdravotního pojištění v České republice a dostupnost pro pacienty ale získal až od ledna tohoto roku.
Tofacitinib je inhibitorem Janus kináz (JAK), zejména JAK1 a JAK3, méně i JAK2. V terapii aktivní PsA byl hodnocen v programu klinického hodnocení fáze III OPAL (Oral Psoriatic Arthritis Trial). Klinická studie OPAL BROADEN sledovala pacienty, kteří dosud nebyli léčeni biologickou terapií (tzv. bDMARDs naivní) a měli nedostatečnou odpověď na léčbu konvenčními syntetickými chorobu modifikujícími antirevmatickými léky (conventional synthetic disease‑modifying antirheumatic drugs, csDMARDs) [1]. Aktivním komparátorem byl adalimumab, všichni pacienti souběžně užívali csDMARDs. Studie OPAL BEYOND hodnotila tofacitinib u pacientů po selhání terapie inhibitory tumor nekrotizujícího faktoru (TNFi) [2]. V obou hodnoceních tofacitinib prokázal efekt na snížení aktivity nemoci. Bezpečností a snášenlivostí léčby se dále zabývala otevřená extenze obou předchozích studií OPAL BALANCE [3].
U PsA je v rámci posuzování účinnosti léčby sledován efekt na jednotlivé domény onemocnění u konkrétního pacienta (ovlivnění periferní artritidy, axiálních projevů, entezitidy, daktylitidy, kožní a nehtové psoriázy). Hodnotí se také ovlivnění extraartikulárních manifestací (uveitida, idiopatické střevní záněty [IBD]) a doprovodných komorbidit. Z pohledu pacienta mohou být terapeutické cíle odlišné, většina pacientů považuje za zásadní ovlivnění bolesti, únavy a fyzických funkcí, velký důraz je rovněž kladen na ovlivnění kožních projevů psoriatické nemoci. Pro pacienta může mít zásadní význam i rychlost působení léčby, frekvence dávkování či způsob podání (např. perorální).
![GRAF 1A, B Efekt léčby tofacitinibem na periferní artritidu – dosažení ACR 20 – ve studii OPAL BROADEN (A) a OPAL BEYOND (B); podle [1,2] – Mease, et al., 2017; Gladman, et al., 2017. ACR 20 – 20% zlepšení dle American College of Rheumatology; BID – dvakrát denně; csDMARD – konvenční syntetický chorobu modifikující antirevmatický lék; Q2W – každé dva týdny GRAF 1A, B Efekt léčby tofacitinibem na periferní artritidu – dosažení ACR 20 – ve studii OPAL BROADEN (A) a OPAL BEYOND (B); podle [1,2] – Mease, et al., 2017; Gladman, et al., 2017. ACR 20 – 20% zlepšení dle American College of Rheumatology; BID – dvakrát denně; csDMARD – konvenční syntetický chorobu modifikující antirevmatický lék; Q2W – každé dva týdny](https://www.remedia.cz/photo-pg-1278---.jpg) Tofacitinib nabízí rychlou a setrvalou účinnost u kloubních projevů. Klinické studie OPAL BROADEN a OPAL BEYOND doložily jeho účinnost v dosažení odpovědi ACR 20 (20% zlepšení dle American College of Rheumatology) oproti placebu u populace TNFi naivních pacientů s PsA i nemocných po selhání anti‑TNF terapie (graf 1A, B) a rychlý nástup efektu terapie (již ve 2. týdnu). Studie OPAL BROADEN sledovala u pacientů i radiografickou progresi; u 96 % pacientů léčených tofacitinibem (5 mg 2× denně) nedošlo po 12 měsících k radiografické progresi (hodnoceno jako změna modifikovaného Total Sharp Score [ΔmTSS]).
Tofacitinib nabízí rychlou a setrvalou účinnost u kloubních projevů. Klinické studie OPAL BROADEN a OPAL BEYOND doložily jeho účinnost v dosažení odpovědi ACR 20 (20% zlepšení dle American College of Rheumatology) oproti placebu u populace TNFi naivních pacientů s PsA i nemocných po selhání anti‑TNF terapie (graf 1A, B) a rychlý nástup efektu terapie (již ve 2. týdnu). Studie OPAL BROADEN sledovala u pacientů i radiografickou progresi; u 96 % pacientů léčených tofacitinibem (5 mg 2× denně) nedošlo po 12 měsících k radiografické progresi (hodnoceno jako změna modifikovaného Total Sharp Score [ΔmTSS]).
U pacientů dosud neléčených biologickou terapií byl prokázán významný efekt léčby na kožní projevy. Odpovědi PASI 75 (75% zlepšení dle Psoriasis Area and Severity Index) dosáhlo významně více pacientů léčených tofacitinibem v porovnání s placebem (35 % vs. 12 %; aktivní komparátor adalimumab 30 %) [1]. U pacientů ze studie OPAL BEYOND již léčených TNFi statisticky významného rozdílu dosaženo nebylo (21 % vs. 14 %) [2].
Při terapii tofacitinibem bylo dosaženo minimální aktivity onemocnění (minimal disease activity, MDA) přibližně ve stejné míře jako při léčbě adalimumabem (37,4 % vs. 39,6 % pacientů ve 12. měsíci) [1]. Přednášející upozornila na nejčastější příčiny nedosažení MDA. Patří mezi ně zejména pacientem reportované faktory – bolest a celkové hodnocení pacientem (Patient Global Assessment, PtGA) [4].
![GRAF 2A–C Redukce bolesti při léčbě tofacitinibem ve studiích OPAL BROADEN (A), OPAL BEYOND (B) a OPAL BALANCE (C); podle [1–3] – Mease, et al., 2017; Gladman, et al., 2017; Nash, et al. 2017. GRAF 2A–C Redukce bolesti při léčbě tofacitinibem ve studiích OPAL BROADEN (A), OPAL BEYOND (B) a OPAL BALANCE (C); podle [1–3] – Mease, et al., 2017; Gladman, et al., 2017; Nash, et al. 2017.](https://www.remedia.cz/photo-pg-1279---.jpg) Z klinických hodnocení i praxe u pacientů s revmatoidní artritidou (RA) již víme, že inhibice JAK má velmi dobrý efekt na bolest. Doktorka Procházková na výsledcích klinického programu OPAL doložila významnou redukci bolesti při terapii tofacitinibem (graf 2A, B) již od druhého týdne a její dlouhodobé udržení (graf 2C).
Z klinických hodnocení i praxe u pacientů s revmatoidní artritidou (RA) již víme, že inhibice JAK má velmi dobrý efekt na bolest. Doktorka Procházková na výsledcích klinického programu OPAL doložila významnou redukci bolesti při terapii tofacitinibem (graf 2A, B) již od druhého týdne a její dlouhodobé udržení (graf 2C).
Pozitivní vliv má terapie tofacitinibem rovněž na únavu. Významná redukce únavy oproti placebu byla zaznamenána ve třetím měsíci léčby. Zlepšení přetrvávalo v 6. a 12. měsíci i v otevřené extenzi po dobu tří let.
Přednášející se dále zaměřila na extraartikulární manifestace PsA (uveitida, IBD). Tofacitinib je schválen pro léčbu pacientů s ulcerózní kolitidou (UC), v tomto případě (při konkomitantním výskytu) ho lze tedy s výhodou využít. Data pro uveitidu z klinických hodnocení nejsou k dispozici.
Bezpečnostní data tofacitinibu u PsA nejsou dosud tak robustní jako u RA. Celková doba expozice tofacitinibu je zhruba 776 pacientoroků ve dvou studiích fáze III a jedné dlouhodobé extenzi [5]. Nebyly detekovány nové bezpečnostní signály, hlášena nebyla žádná příhoda tromboembolismu [3]. Výskyt sledovaných nežádoucích příhod speciálního zájmu byl nízký a obecně podobný výskytu pozorovanému u biologických chorobu modifikujících antirevmatických léků (biologic antirheumatic disease‑modifying drugs, bDMARDs), s výjimkou zvýšeného výskytu herpes zoster (HZ) [6]. Zvýšený výskyt HZ je považován za „class“ efekt terapie inhibitory JAK, nicméně nedávno publikované systematické review poukázalo na nižší výskyt HZ u pacientů s PsA ve srovnání s frekvencí výskytu HZ u pacientů s RA či UC léčených tofacitinibem (incidence 2,2–7,1/100 pacientoroků při léčbě RA, 1,3–7,6/100 pacientoroků při terapii UC ve srovnání s 1,7/100 pacientoroků u PsA) [7]. Před zahájením terapie inhibitory JAK je doporučeno preventivní očkování proti HZ. K dispozici je rekombinantní (neživá) očkovací látka, která bohužel nemá úhradu ze zdravotního pojištění. Očkovat může i revmatolog, klasické očkovací schéma úvodní dávkou následovanou po dvou měsících druhou dávkou, interval je možno zkrátit na jeden měsíc, ev. posunout podání druhé dávky na dobu mezi dvěma a šesti měsíci po první dávce. Jak uvádějí nejnovější doporučení American College of Rheumatology, terapii inhibitory JAK není třeba z důvodu tohoto očkování přerušovat [8], lze tedy očkovat i v průběhu léčby.
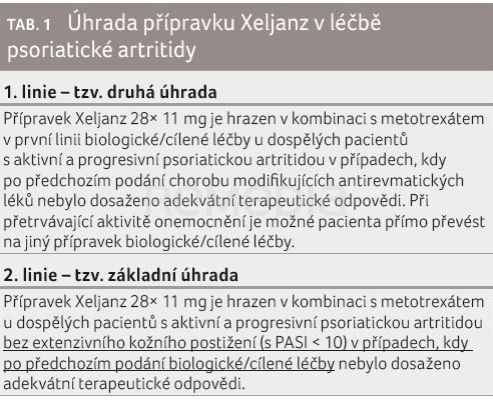 Doktorka Procházková shrnula, že tofacitinib je účinný v ovlivnění kloubních projevů PsA u pacientů naivních k biologické léčbě i po předchozím selhání terapie TNFi. Vyznačuje se rychlým nástupem účinku a poskytuje zlepšení i v ostatních relevantních klinických doménách PsA, jako jsou entezitida, daktylitida a kožní postižení. Má prokazatelný efekt na kvalitu života zmírněním bolesti, únavy a ovlivněním funkčních schopností. Jeho výhodou je dále perorální podání a rychlá clearance. Podmínky úhrady přípravku v léčbě PsA shrnuje tabulka 1.
Doktorka Procházková shrnula, že tofacitinib je účinný v ovlivnění kloubních projevů PsA u pacientů naivních k biologické léčbě i po předchozím selhání terapie TNFi. Vyznačuje se rychlým nástupem účinku a poskytuje zlepšení i v ostatních relevantních klinických doménách PsA, jako jsou entezitida, daktylitida a kožní postižení. Má prokazatelný efekt na kvalitu života zmírněním bolesti, únavy a ovlivněním funkčních schopností. Jeho výhodou je dále perorální podání a rychlá clearance. Podmínky úhrady přípravku v léčbě PsA shrnuje tabulka 1.
Tofacitinib v léčbě ankylozující spondylitidy
Profesor MUDr. Ladislav Šenolt, Ph.D., (Revmatologický ústav, 1. LF UK, Praha) se zaměřil na účinnost tofacitinibu v terapii AS. Klinické hodnocení fáze II porovnávalo různé dávky tofacitinibu oproti placebu a potvrdilo jeho efekt na zmírnění známek a symptomů i objektivních ukazatelů nemoci [9]. Primárního cílového ukazatele, odpovědi ASAS 20 (20% zlepšení dle Assessment in Ankylosing Spondylitis Response Criteria), dosáhlo při dávce 5 mg podávané 2× denně 80,8 % pacientů oproti 41,2 % z placebové větve (p < 0,001). Zlepšení bylo doloženo rovněž ve výsledcích hlášených pacienty a ve skóre zánětu na magnetické rezonanci (MR).
![GRAF 3 Dosažení primárního cílového ukazatele – odpovědi ASAS 20 – při léčbě tofacitinibem; podle [10] – Deodhar, et al., 2021. ASAS 20 – 20% zlepšení dle Assessment in Ankylosing Spondylitis Response Criteria; BID – dvakrát denně GRAF 3 Dosažení primárního cílového ukazatele – odpovědi ASAS 20 – při léčbě tofacitinibem; podle [10] – Deodhar, et al., 2021. ASAS 20 – 20% zlepšení dle Assessment in Ankylosing Spondylitis Response Criteria; BID – dvakrát denně](https://www.remedia.cz/photo-pg-1281---.jpg) Účinnost léčby tofacitinibem ve studii fáze III [10] demonstruje graf 3. Zlepšení při terapii tofacitinibem bylo pozorováno jak v primárním cílovém ukazateli, tak i v dalších sledovaných parametrech – ASAS 40 (40% zlepšení ASAS), ASDAS (Ankylosing Spondylitis Disease Activity Score), CRP (C‑reaktivní protein), BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), v ukazatelích kvality života (AS‑QoL, SF‑36), únavy (FACIT‑F), noční bolesti, pracovní produktivity aj.
Účinnost léčby tofacitinibem ve studii fáze III [10] demonstruje graf 3. Zlepšení při terapii tofacitinibem bylo pozorováno jak v primárním cílovém ukazateli, tak i v dalších sledovaných parametrech – ASAS 40 (40% zlepšení ASAS), ASDAS (Ankylosing Spondylitis Disease Activity Score), CRP (C‑reaktivní protein), BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), v ukazatelích kvality života (AS‑QoL, SF‑36), únavy (FACIT‑F), noční bolesti, pracovní produktivity aj.
Post hoc analýza klinického hodnocení fáze II [11] ukázala, že přibližně u třetiny pacientů s AS léčených tofacitinibem došlo ve 12. týdnu ke klinicky významné redukci zánětu na MR páteře a sakroiliakálního (SI) skloubení (hodnoceno jako minimally important change [MIC] SPondyloArthritis Research Consortium of Canada [SPARCC] MRI score), které bylo rovněž spjato s lepší klinickou odpovědí.
Další post hoc analýza studií fáze II a III hodnotila dopad počátečních hodnot CRP na účinnost a bezpečnost léčby tofacitinibem [12]. Bez ohledu na výchozí hodnoty CRP byl efekt léčby tofacitinibem větší než u placeba. Rozdíl v účinnosti byl numericky větší u jedinců se zvýšeným vs. normálním CRP (ΔASAS 20: 45 % vs. 16 %). Z hlediska bezpečnosti bylo numericky více infekcí při léčbě tofacitinibem oproti placebu zaznamenáno ve skupině s normálním CRP.
![GRAF 4 Efekt léčby tofacitinibem podle předléčenosti; podle [13] – Deodhar, et al., 2022. ASDAS-CRP – Ankylosing Spondylitis Disease Activity Score with C-reactive protein; bDMARDs – biologické chorobu modifikující antirevmatické léky; BID – dvakrát denně; CI – konfidenční interval; TNFi-IR – neadekvátní odpověď na léčbu inhibitory tumor nekrotizujícího faktoru GRAF 4 Efekt léčby tofacitinibem podle předléčenosti; podle [13] – Deodhar, et al., 2022. ASDAS-CRP – Ankylosing Spondylitis Disease Activity Score with C-reactive protein; bDMARDs – biologické chorobu modifikující antirevmatické léky; BID – dvakrát denně; CI – konfidenční interval; TNFi-IR – neadekvátní odpověď na léčbu inhibitory tumor nekrotizujícího faktoru](https://www.remedia.cz/photo-pg-1282---.jpg) Vliv předchozí léčby AS na účinnost a bezpečnost tofacitinibu sledovala další analýza klinického hodnocení fáze III [13]. Jak demonstruje graf 4, tofacitinib byl účinný u skupiny pacientů naivních k biologické terapii i ve skupině nemocných, u nichž selhala předchozí léčba TNFi. Výskyt nežádoucích účinků byl v obou skupinách podobný.
Vliv předchozí léčby AS na účinnost a bezpečnost tofacitinibu sledovala další analýza klinického hodnocení fáze III [13]. Jak demonstruje graf 4, tofacitinib byl účinný u skupiny pacientů naivních k biologické terapii i ve skupině nemocných, u nichž selhala předchozí léčba TNFi. Výskyt nežádoucích účinků byl v obou skupinách podobný.
Že lze tofacitinib podávat bez omezení dle indexu tělesné hmotnosti (BMI), doložila post hoc analýza Nortonové a kol. [14]. Jeho účinnost byla ve všech skupinách pacientů srovnatelná. Výskyt nežádoucích příhod byl paradoxně vyšší ve skupině pacientů s BMI < 25 kg/m2, ale tyto výsledky připisuje přednášející spíše skutečnosti, že v této skupině bylo vyšší zastoupení kuřáků. Na tento fakt poukázala post hoc analýza klinických studií s tofacitinibem u pacientů s PsA a AS [15]. Z hlediska účinnosti rozdíl mezi kuřáky a nekuřáky zaznamenán nebyl, odpověď na léčbu tofacitinibem se nelišila, nicméně nežádoucí příhody byly častěji pozorovány u kuřáků.
 Profesor Šenolt v závěru shrnul, že tofacitinib je možné použít pro léčbu AS při selhání konvenční léčby, a to jak u pacientů naivních, tak i u pacientů po předchozím selhání léčby TNFi. Přednost je v první linii léčby zatím dávána biologickým lékům. Tofacitinib významně snižuje objektivní parametry aktivity, vč. MR skóre zánětu, a příznivě ovlivňuje i ukazatele zdravotního stavu a kvality života hodnocené pacienty. Pacienti odpovídají na tofacitinib bez většího vlivu CRP, BMI nebo kouření, ale nízká tělesná hmotnost a kouření mohou být spjaty s četnějším výskytem nežádoucích příhod. V léčbě je nutno zohledňovat individuální přístup, přání pacienta a preskripční omezení. Aktuální úhradu tofacitinibu pro léčbu AS uvádí tabulka 2.
Profesor Šenolt v závěru shrnul, že tofacitinib je možné použít pro léčbu AS při selhání konvenční léčby, a to jak u pacientů naivních, tak i u pacientů po předchozím selhání léčby TNFi. Přednost je v první linii léčby zatím dávána biologickým lékům. Tofacitinib významně snižuje objektivní parametry aktivity, vč. MR skóre zánětu, a příznivě ovlivňuje i ukazatele zdravotního stavu a kvality života hodnocené pacienty. Pacienti odpovídají na tofacitinib bez většího vlivu CRP, BMI nebo kouření, ale nízká tělesná hmotnost a kouření mohou být spjaty s četnějším výskytem nežádoucích příhod. V léčbě je nutno zohledňovat individuální přístup, přání pacienta a preskripční omezení. Aktuální úhradu tofacitinibu pro léčbu AS uvádí tabulka 2.
Užívání tabáku a nikotinu v praxi
Třetí přednáška, se kterou vystoupila před auditorium prof. MUDr. Eva Králíková, CSc., (Ústav hygieny a epidemiologie 1. LF UK a VFN, Centrum pro závislé na tabáku 3. interní kliniky 1. LF UK a VFN, Praha, Společnost pro léčbu závislosti na tabáku), byla zaměřena na kouření, které významně ovlivňuje pacientův zdravotní stav i léčbu.
Kouření zvyšuje riziko revmatických onemocnění, snižuje účinnost léčby a zhoršuje prognózu [16]. Vedle specifických revmatologických negativních vlivů kouření (jako jsou například zvýšená citrulinace proteinů v plicích a gingivě či zvýšená nabídka peptidů, proti nimž jsou namířeny protilátky spjaté s RA), zmínila přednášející i obecné negativní vlivy kouření (prozánětlivý vliv, zhoršené hojení ran, zvýšené riziko kardiovaskulární, onkologické i riziko depresí a úzkosti) [17–19].
Kouření je významné z hlediska ovlivnění zdravotního stavu pacienta, ale také pro významné farmakologické interakce (zejména polyhalogenované uhlovodíky obsažené v kouři), a to vždy ve smyslu urychlení clearance, metabolismu, a tedy snížení účinku řady léků [20]. Kuřácký status a léčba kouření by měly být součástí všech klinických studií [21].
Závislost na tabáku je definována jako nemoc. Její účinná léčba existuje, je dostupná a má být nabízena. Terapie má dvě základní části, jednak psychobehaviorální intervenci, která se zabývá zejména psychosociální závislostí (měla by vést ke změně denních stereotypů – nekuřácká řešení pro nejčastější situace s cigaretou), a dále farmakologickou léčbu k potlačení abstinenčních příznaků.
Jedním z hlavních cílů Společnosti pro léčbu závislosti na tabáku (SLZT) je motivace všech pracovníků ve zdravotnictví, aby se zajímali o kouření svých pacientů/klientů a aby léčba závislosti na tabáku byla standardní součástí běžné denní praxe všech klinických oborů alespoň formou krátké intervence. Profesorka Králíková upozornila na dostupné doporučené postupy [22–24]. V běžné klinické praxi lze uplatnit krátkou intervenci dle schématu DIK (Dotaz, Intervence, Kontakty): Dotaz na užívání tabáku/expozici tabákovému kouři, v pacientově dokumentaci uvést vhodnou diagnózu (F17.2 Závislost na tabáku; Z72.0 Užívání tabáku; Z58.7 Pasivní kouření; P04.2 Postižení plodu a novorozence užíváním tabáku matkou). Dále Intervence – jasně doporučit přestat kouřit či užívat tabák, pacienta informovat o účinné léčbě a předat mu Kontakty na pracoviště intenzivní léčby a informace o dalších možnostech podpory odvykání. Přednášející upozornila na význam empatie, způsobu položení otázky a uvedla, že velký podíl kuřáků by rád kouřit přestal. V rozhovoru uvedla jako důležité konkrétní zmínění vlivu kouření na pacientovu diagnózu a prognózu a projevení pochopení, jak obtížné je přestat kouřit, a návrh konkrétních postupů řešení a pomoci. Kontakty lze nalézt na stránkách Společnosti pro léčbu závislosti na tabáku (centra pro závislé na tabáku, adiktologické ambulance, poradny v lékárnách či bezplatné mobilní aplikace). Uvedeny jsou zde i další praktické informace (například co pacienta při návštěvě centra čeká či aktuální příspěvky zdravotních pojišťoven na léky závislosti na tabáku).
Pro farmakoterapii máme k dispozici substituci nikotinu ve formě náplastí, žvýkaček, ústního spreje či pastilek, které jsou v lékárně volně prodejné. Dále antidepresivum bupropion snižující potřebu kouřit, vázaný na lékařský předpis. V léčbě se především používají parciální agonisté α4β2 acetylcholin‑nikotinových receptorů vareniklin a cytisin. Vareniklin v současné době na našem trhu dostupný není, cytisin ano a je volně prodejný. Jedná se o přírodní látku, která byla vzorem pro vareniklin. Cytisin má kratší biologický poločas než vareniklin (4,8 h vs. 17 h). O jeho účinnosti nebyla dosud k dispozici dostatečná data, vloni byly publikovány výsledky rozsáhlejší randomizované kontrolované studie, která prokázala účinnost šestitýdenní i 12týdenní léčby cytisinem a vynikající snášenlivost [25].
U všech výše uvedených léků je optimální doba užívání 3–6 měsíců, ovšem i dle individuálního stavu. Na souboru více než 7 000 pacientů svého centra přednášející ukázala, že celková průměrná (a mezinárodně vysoce hodnocená) abstinence po roce je zhruba 35 % a ukazuje se, že s délkou léčby se úspěšnost pacientů zvyšuje až na více než 80 %.
Profesorka Králíková v závěru porovnala dostupné formy „nikotinu bez kouře“, které se liší tím, zda obsahují jen nikotin, nebo tabák a zda se zahřívají, nebo ne, tak lze logicky odstupňovat zdravotní riziko. Mezi nezahřívané formy na bázi čistého nikotinu patří náhradní léčba nikotinem dostupná v lékárnách (viz výše) a nikotinové sáčky; na bázi čistého nikotinu, ale zahřívané, jsou elektronické cigarety, tedy vapování. Dále jsou k dispozici přípravky na bázi tabáku: nezahřívaný orální porcovaný tabák (snus) nebo zahřívaný/tlející tabák (heated tobacco products jako IQOS, GLO apod.), jejichž zdravotní riziko se blíží riziku kouření. Jinou otázkou je riziko závislosti, to existuje vždy, když se nikotin vstřebá dostatečně rychle a v dostatečném množství.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Literatura
[1] Mease P, Hall S, FitzHGerald O, et al. Tofacitinib or Adalimumab versus Placebo for Psoriatic Arthritis. N Engl J Med 2017; 377:1537–1550.
[2] Gladman D, Rigby W, Zevedo VF, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors. N Engl J Med 2017; 377: 1525–536.
[3] Nash P, Coates LC, Kivitz AJ, et al. Safety and Efficacy of Tofacitinib, an Oral Janus Kinase Inhibitor, up to 36 Months in Patients with Active Psoriatic Arthritis: Data from the Second Interim Analysis of OPAL Balance, an Open‑Label, Long‑Term Extension Study. 2017 ACR/ARHP Annual Meeting, Abstr. Nr. 620.
[4] Scriffignano S, Perrotta FM, Conigliaro P, et al. Identification of the Minimal Disease Activity Domains Achieved Based on Different Treatments in Psoriatic Arthritis. Rheumaol Ther 2023; 10: 1785–1794.
[5] Burmester G, Curtis JR, Fitzgerald O. An Integrated Analysis of the Safety of Tofacitinib in Psoriatic Arthritis across Phase III and Long‑Term Extension Studies with Comparison to Real‑World Observational Data. EULAR 2017, Poster Nr. SAT0439.
[6] Cohen SB, Tanaka Y, Mariette X, et al. Long‑term safety of tofacitinib for the treatment of rheumatoid arthritis up to 8.5 years: integrated analysis of data from the global clinical trials. Ann Rheum Dis 2017; 76: 1253–1262.
[7] Gialouri CG, Moustafa S, Thomas K, et al. Herpes zoster in patients with inflammatory arthritides or ulcerative colitis treated with tofacitinib, baricitinib or upadacitinib: a systematic review of clinical trials and real‑world studies. Rheumatol Int 2023; 43: 421–435.
[8] Bass AR, Chakravarty E, Akl EA, et al. 2022 American College of Rheumatology Guideline for Vaccinations in Patients With Rheumatic and Musculoskeletal Diseases. Arthritis Rheumatol 2023; 75: 333–348.
[9] van der Heijde D, Deodhar A, Wei JC, et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16‑week, randomised, placebo‑controlled, dose‑ranging study. Ann Rheum Dis 2017; 76: 1340–1347.
[10] Deodhar A, Sliwinska‑Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double‑blind, placebo‑controlled study. Ann Rheum Dis 2021; 80: 1004–1013.
[11] Maksymowych WP, van der Heijde D, Baraliakos X, et al. Tofacitinib is associated with attainment of the minimally important reduction in axial magnetic resonance imaging inflammation in ankylosing spondylitis patients. Rheumatology (Oxford) 2018; 57: 1390–1399.
[12] Deodhar A, Baraliakos X, Magrey MN, et al. Tofacitinib Efficacy and Safety in Patients with Ankylosing Spondylitis by Baseline C‑Reactive Protein Levels: A Post Hoc Analysis. Arthritis Rheumatol 2023; 75 (Suppl 9). ACR 2023, Abstr. Nr. 0518.
[13] Deodhar A, Marzo‑Ortega H, Wu J, et al. Efficacy and Safety of Tofacitinib in Patients with Ankylosing Spondylitis by Prior bDMARD Treatment: Analysis of a Phase 3 Trial. Rheumatol 2022; 74(Suppl 9). ACR 2022, Abstr. Nr. 0421.
[14] Norton H, Sliwinska‑Stanczyk P, Hala T, et al. Efficacy and Safety of Tofacitinib in Patients with Ankylosing Spondylitis by Baseline BMI: A Post Hoc Analysis of Phase 2 and Phase 3 Trials. Rheumatol 2022; 74(suppl 9). ACR 2022, Abstr. Nr. 0405.
[15] Ogdie A, Kristensen LE, Soriano ER, et al. Efficacy and Safety of Tofacitinib in Patients with Psoriatic Arthritis or Ankylosing Spondylitis by History of Cigarette Smoking. Rheumatol 2022; 74(Suppl 9). ACR 2022, Abstr. Nr. 1036.
[16] Vencovský J. Kouření a revmatoidní artritida, in: Králíková E, et al. Závislost na tabáku – epidemiologie, prevence a léčba. Adamira, 1. vydání, 2013.
[17] Flensborg‑Madsen T, von Scholten MB, Flachs EM, et al. Tobacco smoking as a risk factor for depression. A 26‑year population‑based follow‑up study. J Psychiatr Res 2011; 45: 143–149.
[18] Kean J. The effects of smoking on the wound healing process. J Wound Care 2010; 19: 5–8.
[19] Michalski P, Palazzo‑Michalska V, Buda P, et al. A crossroads between dietary habits, alcohol consumption, and smoking in the clinical course of psoriasis: a narrative review. Postepy Dermatol Alergol 2023; 40: 599–605.
[20] Lucas C, Martin J. Smoking and drug interactions. Aust Prescr 2013; 36: 102–104.
[21] Gritz ER, Dresler C, Sarna L. Smoking, the missing drug interaction in clinical trials: ignoring the obvious. Cancer Epidemiol Biomarkers Prev 2005; 14: 2287–2293.
[22] Králíková E, Zvolská K, Štěpánková L, Pánková A. Doporučení pro léčbu závislosti na tabáku. Čas Lék čes 2022; 161: 33–43. Dostupné na: https://www.slzt.cz/media/document/79bee9694f97b9bdf14eafaf8f20b392.pdf
[23] Šťastný B, Králíková E, Seifert B, Býma S. Léčba závislosti na tabáku v ordinaci všeobecného praktického lékaře. Doporučené diagnostické a léčebné postupy pro všeobecné praktické lékaře, 2022. Dostupné na: https://www.svl.cz/files/files/Doporucene‑postupy/2020/DP‑Tabak.pdf
[24] Králíková E, Aschermann M, Dvořák V, et al. Léčba závislosti na tabáku. Národní portál klinických doporučených postupů, 2022. Dostupné na: https://kdp.uzis.cz/index.php?pg=kdp&id=56
[25] Rigotti NA, Benowitz NL, Prochaska J, et al. Cytisinicline for Smoking Cessation: A Randomized Clinical Trial. JAMA 2023; 330: 152–160.