Dlouhodobé setrvání na léčbě certolizumab pegolem u pacientů s revmatoidní artritidou
V časopise Rheumatology and Therapy byly v letošním roce publikovány výsledky analýzy, která na základě dat z několika desítek klinických studií zkoumala dlouhodobé setrvání na léčbě certolizumab pegolem – pět let a více – u pacientů trpících revmatoidní artritidou [1]. Autoři se zaměřili na charakteristiku zařazených pacientů a na důvody ukončení léčby certolizumab pegolem v různých skupinách nemocných.
V současnosti není k dispozici dostatek dat o podílu pacientů s revmatoidní artritidou (RA) dlouhodobě léčených certolizumab pegolem (CZP) ani o jejich charakteristikách, které mohou ovlivnit pravděpodobnost setrvání na léčbě. Publikace tedy přináší užitečné informace, jež mohou revmatologové využít při rozhodování o terapii pacientů s RA.
Analýza shromáždila data 27 klinických studií s pacienty s RA. Setrvání na léčbě bylo definováno jako podíl pacientů randomizovaných k léčbě CZP při vstupu do studie, kteří byli touto terapií nadále léčeni také ve stanoveném termínu daného sledování. Zahrnuty byly podskupiny pacientů podle věku (18 až < 45; 45 až < 65; ≥ 65 let), pohlaví (muž/žena), předchozí léčby inhibitorem tumor nekrotizujícího faktoru – TNFi (ano/ne) a trvání onemocnění (< 1/1 až < 5; 5 až < 10; ≥ 10 let).
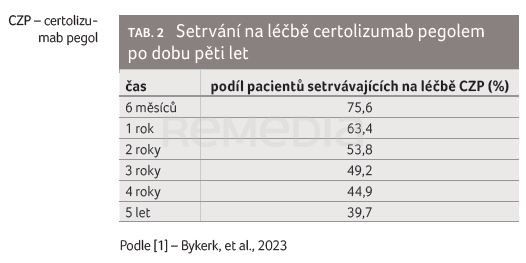
Setrvání na léčbě CZP po pěti letech bylo zjištěno u 39,7 % z celkového počtu 6 927 pacientů. Pacienti ve věku ≥ 65 let měli o 33 % vyšší riziko přerušení léčby CZP než pacienti ve věkové skupině 18 až < 45 let. Také nemocní s předchozím užíváním TNFi měli o 24 % vyšší riziko přerušení léčby CZP oproti nemocným bez něj. Naopak delší setrvání na léčbě bylo pozorováno u pacientů, kteří měli výchozí dobu trvání onemocnění ≥ 1 rok, výsledky nebyly závislé na pohlaví. Nejčastějším důvodem přerušení léčby byla nedostatečná účinnost (13,5 %), dále nežádoucí účinky (11,9 %), odvolání souhlasu (6,7 %), ztráta při sledování (1,8 %), porušení protokolu (1,7 %) a jiné důvody (9,3 %). Zjištěné setrvání na léčbě CZP bylo srovnatelné s údaji o setrvání na léčbě jinými biologickými chorobu modifikujícími antirevmatickými léky (biologic disease‑modifying antirheumatic drugs, bDMARDs) u pacientů s RA. Charakteristiky pacientů spojené s delším setrváním na léčbě zahrnovaly nižší věk, naivitu k léčbě TNFi a trvání onemocnění ≥ 1 rok.
Revmatoidní artritida a setrvání na léčbě
Revmatoidní artritida je chronické autoimunitní zánětlivé onemocnění kloubů [2,3]. Neléčený zánět může vést k postižení chrupavky a kosti a následně k poškození fyzické funkce a ke špatné kvalitě života [2–5]. Vzhledem k chronické povaze onemocnění vyžadují pacienti s RA efektivní dlouhodobou terapii. Současné pokyny pro léčbu RA doporučují přidání bDMARD (včetně TNFi) k metotrexátu (MTX) v případě nedostatečné odpovědi na léčbu konvenčním DMARD [6,7]. Nedostatečná efektivita a výskyt nežádoucích příhod jsou v některých publikacích uváděny jako běžné důvody pro ukončení léčby bDMARDs [8,9]. V retrospektivní tzv. real‑world studii porovnávající míru setrvání na léčbě sedmi bDMARDs (včetně CZP) u pacientů s RA se tříleté setrvání pohybovalo v rozmezí 31,1–60,7 % [8]. V real‑world studiích s TNFi se míra setrvání na léčbě liší v jednotlivých podskupinách – ženské pohlaví, vyšší věk, souběžná léčba prednisolonem a absence nebo nízká dávka MTX jsou spojeny s větší pravděpodobností ukončení léčby TNFi [10–14]. Důvody pro přerušení léčby bDMARD se liší také v rámci konkrétních podskupin pacientů – např. u nemocných rozdělených podle věku byla nedostatečná efektivita častěji uváděna u osob ve věku < 60 let oproti osobám ve věku ≥ 60 let [15].
Certolizumab pegol je rekombinantní humanizovaný Fab fragment protilátky proti TNF produkovaný bakterií Escherichia coli a konjugovaný s polyetylenglykolem (PEG), který je indikovaný pro léčbu časné aktivní RA [16–21]. Míra setrvání na léčbě CZP u RA byla dříve uváděna v rozmezí 42,5–59,9 % po dobu 3–5 let, a to v klinických studiích i real‑world studiích [8,9,22,23]. Také v případě CZP mohou rozdíly v charakteristikách pacientů přispět ke konkrétním důvodům přerušení léčby v rámci dané podskupiny [9,24].
Metody
Analýza shromáždila data o léčbě CZP u RA z 27 klinických studií po celém světě, včetně jedné otevřené farmakokinetické studie s jednorázovou dávkou CZP, 18 randomizovaných klinických studií, sedmi otevřených extenzí a jedné přímé srovnávací studie. Analýza zahrnuje období léčby od 16 týdnů do 7,7 roku (uzávěrka dat – srpen 2017); úplný seznam studií byl již dříve publikován [25]. Do výzkumu byli zařazeni pacienti léčení CZP v monoterapii nebo v kombinaci (např. s MTX), dále nemocní, kteří přešli z placeba na terapii CZP.
Post hoc analýzy údajů z klinických studií o setrvání na léčbě a důvodech pro přerušení léčby v různých podskupinách pacientů byly provedeny pomocí Kaplanovy–Meierovy křivky a Coxova modelu proporcionálních rizik. Zahrnuté podskupiny pacientů a definice setrvání na léčbě jsou uvedeny výše v textu. Zohledněny byly pouze doby skutečné léčby CZP a jakékoliv vystoupení ze studie bylo definováno jako přerušení terapie. Pokud byl CZP podáván po více období, byla využita kumulativní doba léčby. Expozice CZP v pacientorocích zahrnovala počet let expozice CZP od první dávky léku do konce expozičního období léčby nebo do data poslední dávky před prvním přerušením terapie. Přestože byla do analýzy shromážděna všechna dostupná data až do maximálního léčebného období 7,7 roku, prostřednictvím Kaplanových–Meierových křivek byly znázorněny pouze pětileté údaje vzhledem k malému počtu pacientů za uvedeným časovým bodem. Důvody pro přerušení léčby CZP byly rozděleny do následujících kategorií: nedostatečná účinnost, nežádoucí účinky, odvolání souhlasu, ztráta při sledování, porušení protokolu nebo jiné důvody s uvedením doplňujícího popisu [25]. Riziko přerušení léčby CZP pro různé podskupiny pacientů je vyjádřeno jako poměr rizik (hazard ratio, HR) s 95% intervalem spolehlivosti (confidence interval, CI). Coxovy modely ilustrovaly všechna dostupná data až do maximální doby léčby 7,7 roku.
Výsledky
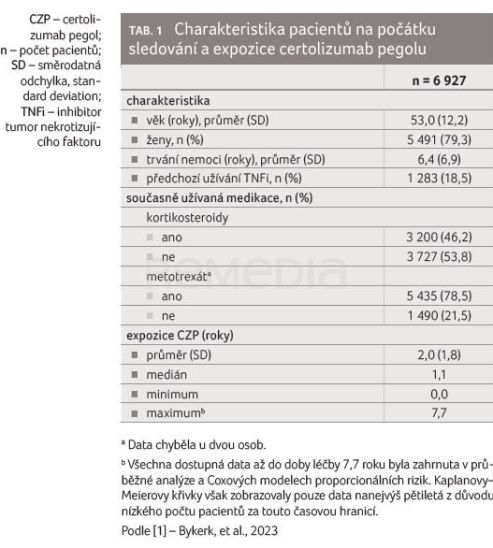 Analýza zahrnovala celkem 6 927 pacientů ve 27 studiích. Většina pacientů byly ženy (79,3 %), průměrná doba trvání onemocnění 6,4 roku (směrodatná odchylka [SD] 6,9 roku), průměrná expozice CZP 2,0 roky (rozmezí 0,0–7,7 roku). Přibližně u poloviny osob bylo hlášeno současné užívání kortikosteroidů (46,2 %) a většina osob hlásila souběžné užívání MTX (78,5 %), tabulka 1. Celkové setrvání na léčbě CZP činilo 39,7 % v pětiletém období (tab. 2).
Analýza zahrnovala celkem 6 927 pacientů ve 27 studiích. Většina pacientů byly ženy (79,3 %), průměrná doba trvání onemocnění 6,4 roku (směrodatná odchylka [SD] 6,9 roku), průměrná expozice CZP 2,0 roky (rozmezí 0,0–7,7 roku). Přibližně u poloviny osob bylo hlášeno současné užívání kortikosteroidů (46,2 %) a většina osob hlásila souběžné užívání MTX (78,5 %), tabulka 1. Celkové setrvání na léčbě CZP činilo 39,7 % v pětiletém období (tab. 2).
 Nejčastějším důvodem pro přerušení léčby byla nedostatečná efektivita (13,5 % pacientů), druhým nejčastějším pak nežádoucí účinky (11,9 %). Celkem 9,3 % pacientů přerušilo terapii z jiných důvodů; z toho v některých případech vyšetřovatelé zaznamenali uvedení nedostatečné efektivity a nežádoucích účinků v kategorii jiné důvody. Na léčbě CZP setrval po pěti letech vyšší podíl pacientů ve věku méně než 65 let nebo s dobou trvání onemocnění delší než jeden rok. Předchozí užívání TNFi a pohlaví neměly zjevný dopad na setrvání na léčbě CZP. Podíl pacientů, kteří přerušili léčbu CZP v důsledku nežádoucích účinků, se zvyšoval s věkem – 16,6 % osob ve věku ≥ 65 let ukončilo léčbu CZP ve srovnání s 8,5 % osob ve věku 18 až < 45 let. Podíl pacientů, kteří přerušili léčbu CZP z jiného důvodu, byl srovnatelný napříč všemi věkovými skupinami. Větší podíl pacientů s délkou trvání onemocnění < 1 rok přerušil léčbu CZP z jiných důvodů (17,3 %) ve srovnání s ostatními podskupinami tohoto parametru (5,7–8,8 %). Podobně větší podíl pacientů bez předchozí expozice TNFi přerušil léčbu CZP z jiných důvodů ve srovnání s podskupinou s předchozí expozicí TNFi. Naopak více pacientů z podskupiny s předchozím užíváním TNFi (17,1 %) ukončilo léčbu CZP kvůli nedostatečné účinnosti oproti podskupině bez předchozí expozice TNFi (12,7 %). Všechny důvody přerušení léčby CZP byly hlášeny v podobném poměru bez ohledu na pohlaví (graf 1A–D).
Nejčastějším důvodem pro přerušení léčby byla nedostatečná efektivita (13,5 % pacientů), druhým nejčastějším pak nežádoucí účinky (11,9 %). Celkem 9,3 % pacientů přerušilo terapii z jiných důvodů; z toho v některých případech vyšetřovatelé zaznamenali uvedení nedostatečné efektivity a nežádoucích účinků v kategorii jiné důvody. Na léčbě CZP setrval po pěti letech vyšší podíl pacientů ve věku méně než 65 let nebo s dobou trvání onemocnění delší než jeden rok. Předchozí užívání TNFi a pohlaví neměly zjevný dopad na setrvání na léčbě CZP. Podíl pacientů, kteří přerušili léčbu CZP v důsledku nežádoucích účinků, se zvyšoval s věkem – 16,6 % osob ve věku ≥ 65 let ukončilo léčbu CZP ve srovnání s 8,5 % osob ve věku 18 až < 45 let. Podíl pacientů, kteří přerušili léčbu CZP z jiného důvodu, byl srovnatelný napříč všemi věkovými skupinami. Větší podíl pacientů s délkou trvání onemocnění < 1 rok přerušil léčbu CZP z jiných důvodů (17,3 %) ve srovnání s ostatními podskupinami tohoto parametru (5,7–8,8 %). Podobně větší podíl pacientů bez předchozí expozice TNFi přerušil léčbu CZP z jiných důvodů ve srovnání s podskupinou s předchozí expozicí TNFi. Naopak více pacientů z podskupiny s předchozím užíváním TNFi (17,1 %) ukončilo léčbu CZP kvůli nedostatečné účinnosti oproti podskupině bez předchozí expozice TNFi (12,7 %). Všechny důvody přerušení léčby CZP byly hlášeny v podobném poměru bez ohledu na pohlaví (graf 1A–D).
![GRAF 1A–D Důvody pro přerušení léčby certolizumab pegolem podle podskupin pacientů; podle [1] – Bykerk, et al., 2023. n – počet pacientů; TNFi – inhibitor tumor nekrotizujícího faktoru GRAF 1A–D Důvody pro přerušení léčby certolizumab pegolem podle podskupin pacientů; podle [1] – Bykerk, et al., 2023. n – počet pacientů; TNFi – inhibitor tumor nekrotizujícího faktoru](https://www.remedia.cz/photo-pg-1139---.jpg) Coxovy modely proporcionálních rizik byly použity k posouzení rizika ukončení léčby CZP asociovaného s různými charakteristikami pacientů. V porovnání s věkovou kategorií 18 až < 45 let měli pacienti ve věku ≥ 65 let výrazně vyšší riziko přerušení léčby CZP (HR 1,33; 95% CI 1,19–1,49; p < 0,0001). Pacienti s počáteční dobou trvání onemocnění < 1 rok měli signifikantně vyšší riziko přerušení léčby CZP než nemocní v jiných podskupinách tohoto parametru – HR s 95% CI ve srovnání s trváním onemocnění < 1 rok byly pro podskupinu a) 1 až < 5 let: 0,79; 0,71–0,87; p < 0,0001; b) 5 až < 10 let: 0,80; 0,72–0,89; p < 0,0001; c) ≥ 10 let: 0,84; 0,75–0,93; p = 0,0012. Pacienti s předchozím užíváním TNFi měli rovněž výrazně vyšší riziko ukončení léčby CZP ve srovnání s pacienty bez předchozí expozice (HR 1,24; 95% CI 1,12–1,37; p < 0,0001).
Coxovy modely proporcionálních rizik byly použity k posouzení rizika ukončení léčby CZP asociovaného s různými charakteristikami pacientů. V porovnání s věkovou kategorií 18 až < 45 let měli pacienti ve věku ≥ 65 let výrazně vyšší riziko přerušení léčby CZP (HR 1,33; 95% CI 1,19–1,49; p < 0,0001). Pacienti s počáteční dobou trvání onemocnění < 1 rok měli signifikantně vyšší riziko přerušení léčby CZP než nemocní v jiných podskupinách tohoto parametru – HR s 95% CI ve srovnání s trváním onemocnění < 1 rok byly pro podskupinu a) 1 až < 5 let: 0,79; 0,71–0,87; p < 0,0001; b) 5 až < 10 let: 0,80; 0,72–0,89; p < 0,0001; c) ≥ 10 let: 0,84; 0,75–0,93; p = 0,0012. Pacienti s předchozím užíváním TNFi měli rovněž výrazně vyšší riziko ukončení léčby CZP ve srovnání s pacienty bez předchozí expozice (HR 1,24; 95% CI 1,12–1,37; p < 0,0001).
Diskuse
Autoři analyzovali data shromážděná napříč 27 klinickými studiemi s léčbou CZP u 6 927 pacientů trpících RA, aby prozkoumali dlouhodobé setrvání na terapii CZP a důvody jejího přerušení celkově a v různých podskupinách nemocných. Pětileté setrvání na léčbě CZP činilo 39,7 %. Tato zjištění jsou srovnatelná s mírou setrvání na léčbě jinými bDMARDs u pacientů s RA, jež byla hlášena v jiných klinických studiích podobné délky sledování (3 až > 10 let). Zde se míra setrvání pohybovala v rozmezí 30–56 % [11,26–30]. Dle analýzy bylo zjištěno, že kratší setrvání na léčbě CZP je častější u pacientů ve věku ≥ 65 let, s předchozím užíváním TNFi a s výchozí délkou trvání onemocnění < 1 rok. Nejčastějším důvodem přerušení léčby u všech podskupin pacientů byly nedostatečná efektivita a nežádoucí účinky. Nižší míra setrvání na léčbě CZP byla pozorována u pacientů ve věku ≥ 65 let ve srovnání s věkovou kategorií < 65 let. Tento trend je doložen také při léčbě jinými bDMARDs u pacientů s RA [13]. U pacientů ve věku ≥ 65 let je vyšší pravděpodobnost přerušení léčby CZP z důvodu nežádoucích účinků [15,31–33]. Zvýšené riziko výskytu nežádoucích účinků ve vyšším věku je zřejmě spojeno rovněž s obezitou, větším počtem komorbidit, systémovým užíváním kortikosteroidů, se sníženou imunitou podmíněnou věkem a celkovou křehkostí [31,34–36].
Uvedené výsledky naznačují, že včasná intervence, optimalizace léčby TNFi a zmírnění rizika výskytu nežádoucích účinků u starších pacientů s RA může být nástrojem pro zlepšení míry setrvání na léčbě CZP v této skupině [37]. Předchozí užívání TNFi bylo též spojeno s vyšším rizikem přerušení léčby v porovnání s TNFi naivními pacienty. To je v souladu s další literaturou, která popisuje ztrátu odpovědi během léčby TNFi (sekundární selhání léku) v důsledku tvorby protilátek, čímž se zvyšuje pravděpodobnost následného ukončení terapie [37,38].
Analýza zahrnula dlouhodobé údaje o léčbě CZP z klinických studií. Její výsledky lze zobecnit vůči populaci pacientů s RA, neboť byla použita data od velkého počtu pacientů. Studie navíc zachytila pacienty z různých populací ve vztahu k výchozím charakteristikám, včetně trvání onemocnění či předchozí expozice TNFi. Údaje z analýzy mohou přispět k optimalizaci léčebných strategií při dlouhodobé terapii CZP. Limitací této analýzy je variabilita v uspořádání zahrnutých klinických studií a specifikace jiných důvodů přerušení léčby, které se v některých sledováních překrývaly s nedostatečnou účinností či nežádoucími účinky nebo nebyly vůbec popsány. Určitá nedůslednost se projevila rovněž ve sběru základních údajů o pacientovi (anamnéza, souběžná medikace atp.). Do analýzy byly zahrnuty randomizované klinické studie a otevřené extenze, výsledky tedy nemusejí odrážet léčbu onemocnění v reálné klinické praxi. Nicméně dosavadní real‑world studie s léčbou CZP vykázaly míru setrvání na terapii 42,5–43,3 % v průběhu 3–5 let, což je srovnatelné s výsledky analýzy i s výsledky real‑world sledování s jinými TNFi [8,9,39].
Závěr
Publikovaná analýza zachycuje míru setrvání na léčbě certolizumab pegolem po delší časové období u dosud největší populace pacientů s revmatoidní artritidou. Vzhledem k chronicitě a závažnosti tohoto onemocnění je důležité zkoumat léčebné strategie u postižených pacientů z dlouhodobého hlediska. Celkově lze konstatovat, že údaje o setrvání na léčbě certolizumab pegolem ze zahrnutých klinických studií byly srovnatelné s údaji z jiných sledování s biologickými chorobu modifikujícími léky. Konkrétní výsledky naznačují, že starší pacienti s revmatoidní artritidou by mohli mít prospěch ze včasné implementace strategií zmírňujících riziko výskytu nežádoucích účinků, které umožní dlouhodobé setrvání na léčbě certolizumab pegolem. Také charakteristiky pacientů mohou lékaře včas upozornit na pravděpodobnost přerušení léčby certolizumab pegolem v budoucnu.
Literatura
[1] Bykerk VP, Nash P, Nicholls D, et al. Long‑Term Durability of Certolizumab Pegol in Patients with Rheumatoid Arthritis Over 5 Years: An Analysis of Pooled Clinical Trial Data. Rheumatol Ther 2023; 10: 693–706.
[2] Guo Q, Wang Y, Xu D, et al. Rheumatoid arthritis: pathological mechanisms and modern pharmacologic therapies. Bone Res 2018; 6: 15.
[3] Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet 2016; 388: 2023–2038.
[4] Bai B, Chen M, Fu L, et al. Quality of life and influencing factors of patients with rheumatoid arthritis in Northeast China. Health Qual Life Outcomes 2020; 18: 119.
[5] Matcham F, Scott IC, Rayner L, et al. The impact of rheumatoid arthritis on quality‑of‑life assessed using the SF‑36: a systematic review and metaanalysis. Semin Arthritis Rheum 2014; 44: 123–130.
[6] Fraenkel L, Bathon JM, England BR, et al. 2021 American college of rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Rheumatol 2021; 73: 1108–1123.
[7] Smolen JS, Landewé RBM, Bijlsma JWJ, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs: 2019 update. Ann Rheum Dis 2020; 79: 685–699.
[8] Ebina K, Hashimoto M, Yamamoto W, et al. Drug retention and discontinuation reasons between seven biologics in patients with rheumatoid arthritis – the ANSWER cohort study. PLoS One 2018; 13: e0194130.
[9] Favalli EG, Becciolini A, Sarzi Puttini P, et al. FRI0114 Efficacy and retention rate of certolizumab pegol in rheumatoid arthritis: data from a large reallife multicentre retrospective cohort. Ann Rheum Dis 2018; 77(Suppl 2): 601.
[10] Alvarez‑Madrazo S, Kavanagh K, Siebert S, et al. Discontinuation, persistence and adherence to subcutaneous biologics delivered via a homecare route to Scottish adults with rheumatic diseases: a retrospective study. BMJ Open 2019; 9: e027059.
[11] Gabay C, Riek M, Scherer A, Finckh A. Effectiveness of biologic DMARDs in monotherapy versus in combination with synthetic DMARDs in rheumatoid arthritis: data from the Swiss Clinical Quality Management Registry. Rheumatology (Oxford) 2015; 54: 1664–1672.
[12] Hetland ML, Christensen IJ, Tarp U, et al. Direct comparison of treatment responses, remission rates, and drug adherence in patients with rheumatoid arthritis treated with adalimumab, etanercept, or infliximab: results from eight years of surveillance of clinical practice in the nationwide Danish DANBIO registry. Arthritis Rheum 2010; 62: 22–32.
[13] Kawabe A, Nakano K, Kubo S, et al. Differential long‑term retention of biological disease‑modifying antirheumatic drugs in patients with rheumatoid arthritis by age group from the FIRST registry. Arthritis Res Ther 2020; 22: 136.
[14] Souto A, Maneiro JR, Gómez‑Reino JJ. Rate of discontinuation and drug survival of biologic therapies in rheumatoid arthritis: a systematic review and meta‑analysis of drug registries and health care databases. Rheumatology (Oxford) 2016; 55: 523–534.
[15] Cho SK, Sung YK, Kim D, et al. Drug retention and safety of TNF inhibitors in elderly patients with rheumatoid arthritis. BMC Musculoskelet Disord 2016; 17: 333.
[16] Atsumi T, Yamamoto K, Takeuchi T, et al. The first double‑blind, randomised, parallel‑group certolizumab pegol study in methotrexate‑naive early rheumatoid arthritis patients with poor prognostic factors, C‑OPERA, shows inhibition of radiographic progression. Ann Rheum Dis 2016; 75: 75–83.
[17] Bi L, Li Y, He L, et al. Efficacy and safety of certolizumab pegol in combination with methotrexate in methotrexate‑inadequate responder Chinese patients with active rheumatoid arthritis: 24‑week results from a randomised, double‑blind, placebo‑controlled phase 3 study. Clin Exp Rheumatol 2019; 37: 227–234.
[18] Keystone E, Heijde DVD, Mason D Jr, et al. Certolizumab pegol plus methotrexate is significantly more effective than placebo plus methotrexate in active rheumatoid arthritis: findings of a fiftytwo–week, phase III, multicenter, randomized, double‑blind, placebo‑controlled, parallel‑group study. Arthritis Rheum 2008; 58: 3319–3329.
[19] Smolen J, Landewé RB, Mease P, et al. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: the RAPID 2 study. A randomised controlled trial. Ann Rheum Dis 2009; 68: 797–804.
[20] Yamamoto K, Takeuchi T, Yamanaka H, et al. Efficacy and safety of certolizumab pegol plus methotrexate in Japanese rheumatoid arthritis patients with an inadequate response to methotrexate: the J‑RAPID randomized, placebo‑controlled trial. Mod Rheumatol 2014; 24: 715–724.
[21] European Medicines Agency. Cimzia European product assessment report. February 11, 2019. Dostupné na: https://www.ema.europa.eu/en/medicines/human/EPAR/cimzia [navštíveno 9/2021].
[22] Keystone E, Landewé R, van Vollenhoven R, et al. Long‑term safety and efficacy of certolizumab pegol in combination with methotrexate in the treatment of rheumatoid arthritis: 5‑year results from the RAPID 1 trial and open‑label extension. Ann Rheum Dis 2014; 73: 2094–2100.
[23] Smolen JS, van Vollenhoven R, Kavanaugh A, et al. Certolizumab pegol plus methotrexate 5‑year results from the rheumatoid arthritis prevention of structural damage (RAPID) 2 randomized controlled trial and long‑term extension in rheumatoid arthritis patients. Arthritis Res Ther 2015; 17: 245.
[24] Bykerk V, Gottlieb AB, Reich K, et al. FRI0087 Durability of certolizumab pegol in patients with rheumatoid arthritis or psoriasis over three years: an analysis of pooled clinical trial data. Ann Rheum Dis 2020; 79(Suppl 1): 621.
[25] Curtis JR, Mariette X, Gaujoux‑Viala C, et al. Longterm safety of certolizumab pegol in rheumatoid arthritis, axial spondyloarthritis, psoriatic arthritis, psoriasis and Crohn’s disease: a pooled analysis of 11,317 patients across clinical trials. RMD Open 2019; 5: e000942.
[26] Burmester GR, Matucci‑Cerinic M, Mariette X, et al. Safety and effectiveness of adalimumab in patients with rheumatoid arthritis over 5 years of therapy in a phase 3b and subsequent postmarketing observational study. Arthritis Res Ther 2014; 16: R24.
[27] Genovese MC, Schiff M, Luggen M, et al. Long‑term safety and efficacy of abatacept through 5 years of treatment in patients with rheumatoid arthritis and an inadequate response to tumor necrosis factor inhibitor therapy. J Rheumatol 2012; 39: 1546–1554.
[28] Klareskog L, Gaubitz M, Rodríguez‑Valverde V, et al. Assessment of long‑term safety and efficacy of etanercept in a 5‑year extension study in patients with rheumatoid arthritis. Clin Exp Rheumatol 2011; 29: 238–247.
[29] Smolen JS, Kay J, Landewé RB, et al. Golimumab in patients with active rheumatoid arthritis who have previous experience with tumour necrosis factor inhibitors: results of a long‑term extension of the randomised, double‑blind, placebo‑controlled GOAFTER study through week 160. Ann Rheum Dis 2012; 71: 1671–1679.
[30] Weinblatt ME, Bathon JM, Kremer JM, et al. Safety and efficacy of etanercept beyond 10 years of therapy in North American patients with early and longstanding rheumatoid arthritis. Arthritis Care Res (Hoboken) 2011; 63: 373–382.
[31] Bykerk VP, Blauvelt A, Curtis JR, et al. Associations between safety of certolizumab pegol, disease activity, and patient characteristics, including corticosteroid use and body mass index. ACR Open Rheumatol 2021; 3: 501–511.
[32] Curtis JR, Winthrop K, O’Brien C, et al. Use of a baseline risk score to identify the risk of serious infectious events in patients with rheumatoid arthritis during certolizumab pegol treatment. Arthritis Res Ther 2017; 19: 276.
[33] Ishchenko A, Lories RJ. Safety and efficacy of biological disease‑modifying antirheumatic drugs in Rheumatol Ther (2023) 10:693–706 705 older rheumatoid arthritis patients: staying the distance. Drugs Aging 2016; 33: 387–398.
[34] Lindstrom TM, Robinson WH. Rheumatoid arthritis: a role for immunosenescence? J Am Geriatr Soc 2010; 58: 1565–1575.
[35] van Onna M, Boonen A. The challenging interplay between rheumatoid arthritis, ageing and comorbidities. BMC Musculoskelet Disord 2016; 17: 184.
[36] Xue QL. The frailty syndrome: definition and natural history. Clin Geriatr Med 2011; 27: 1–15.
[37] Roda G, Jharap B, Neeraj N, Colombel JF. Loss of response to anti‑TNFs: definition, epidemiology, and management. Clin Transl Gastroenterol 2016; 7: e135.
[38] Owczarczyk‑Saczonek A, Owczarek W, Osmola‑Mańkowska A, et al. Secondary failure of TNF‑a inhibitors in clinical practice. Dermatol Ther 2019; 32: e12760.
[39] Neovius M, Arkema EV, Olsson H, et al. Drug survival on TNF inhibitors in patients with rheumatoid arthritis comparison of adalimumab, etanercept and infliximab. Ann Rheum Dis 2015; 74: 354–360.