Durvalumab v léčbě lokálně pokročilého nemalobuněčného karcinomu plic
Souhrn:
Koubková L. Durvalumab v léčbě lokálně pokročilého nemalobuněčného karcinomu plic. Remedia 2022; 32: 387–391.
Lokálně pokročilý nemalobuněčný bronchogenní karcinom (non‑small cell lung cancer, NSCLC) představuje nehomogenní skupinu onemocnění, u nichž se léčebné možnosti liší podle rozsahu postižení. Jednou z možností je imunoterapie, pokud po předchozí chemoradioterapii nedojde k progresi onemocnění. Tímto způsobem se rozšiřují možnosti léčby pacientů s inoperabilním NSCLC stadia III. V uvedené indikaci je u nás schválena léčba durvalumabem.
Summary:
Koubkova L. Durvalumab in the treatment of locally advanced non‑small cell lung carcinoma. Remedia 2022; 32: 387–391.
Locally advanced non‑small cell bronchogenic carcinoma (NSCLC) is a non‑homogeneous group of diseases in which treatment options vary according to the extent of the disease. One option is immunotherapy if the disease does not progress after previous chemoradiotherapy. It shifts the treatment options for patients with inoperable stage III NSCLC. Durvalumab treatment is approved for this indication.
Key words: non‑small cell lung cancer, locally advanced disease, durvalumab.
Úvod
Lokálně pokročilý bronchogenní karcinom (non small cell lung cancer, NSCLC) představuje nehomogenní skupinu onemocnění, u nichž se volba optimálního léčebného postupu může lišit zvláště podle rozsahu metastatického postižení mediastinálních uzlin. Nezastupitelné je zde proto místo multidisciplinárního týmu (MDT) k posouzení operability, radioterapie a chemoterapie. S přibývajícími zkušenostmi s imunoterapií metastatického NSCLC jsme postupně svědky jejího posouvání i do nižších stadií onemocnění. Jako první byla schválena k léčbě lokálně pokročilého NSCLC stadia III na základě výsledků studie PACIFIC monoklonální protilátka IgG1 durvalumab, která blokuje interakci ligandu programované buněčné smrti 1 (PD L1) s PD 1.
Studie PACIFIC
V placebem kontrolované studii
fáze III PACIFIC u pacientů s neresekovatelným NSCLC
stadia III, jejichž onemocnění neprogredovalo po souběžné
chemoradioterapii na bázi platiny (cCRT), zlepšil durvalumab
celkové přežití (overall survival, OS) – poměr rizik (HR)
0,68; 95% interval spolehlivosti (CI) 0,53–0,87; p = 0,0025;
mezní hodnota dat (data cut off, DCO) 22. března 2018 –
a přežití bez progrese (progression free survival, PFS) –
HR 0,52; 95% CI 0,42–0,65; p < 0,0001; DCO
13. února 2017 [1,2]. Na základě DCO použitých pro
primární analýzy zůstala míra prospěchu konzistentní
i v dalších aktualizacích. Ve srovnání
s placebem byl durvalumab spojen se zvládnutelným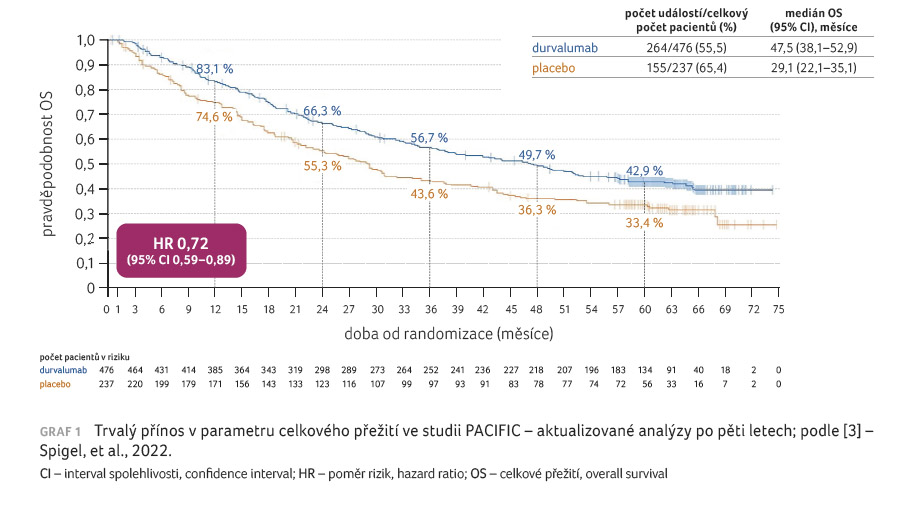 bezpečnostním profilem a neměl nepříznivý vliv na výsledky
hlášené pacienty. Tato zjištění vedla k tomu, že
konsolidační léčba durvalumabem po CRT (tzv. PACIFIC režim)
je léčebným standardem u těchto pacientů. Byly již
publikovány aktualizované průzkumné analýzy OS a PFS
hodnocené přibližně pět let po randomizaci posledního
pacienta [2]. Pacienti s performance status (PS) 0/1 podle WHO
(World Health Organization) a s jakýmkoliv nádorovým
stavem PD L1, jejichž onemocnění po cCRT neprogredovalo
(≥ dva překrývající se cykly), byli randomizováni
v poměru 2 : 1 v době 1–42 dní po cCRT
(typická celková dávka rad
bezpečnostním profilem a neměl nepříznivý vliv na výsledky
hlášené pacienty. Tato zjištění vedla k tomu, že
konsolidační léčba durvalumabem po CRT (tzv. PACIFIC režim)
je léčebným standardem u těchto pacientů. Byly již
publikovány aktualizované průzkumné analýzy OS a PFS
hodnocené přibližně pět let po randomizaci posledního
pacienta [2]. Pacienti s performance status (PS) 0/1 podle WHO
(World Health Organization) a s jakýmkoliv nádorovým
stavem PD L1, jejichž onemocnění po cCRT neprogredovalo
(≥ dva překrývající se cykly), byli randomizováni
v poměru 2 : 1 v době 1–42 dní po cCRT
(typická celková dávka rad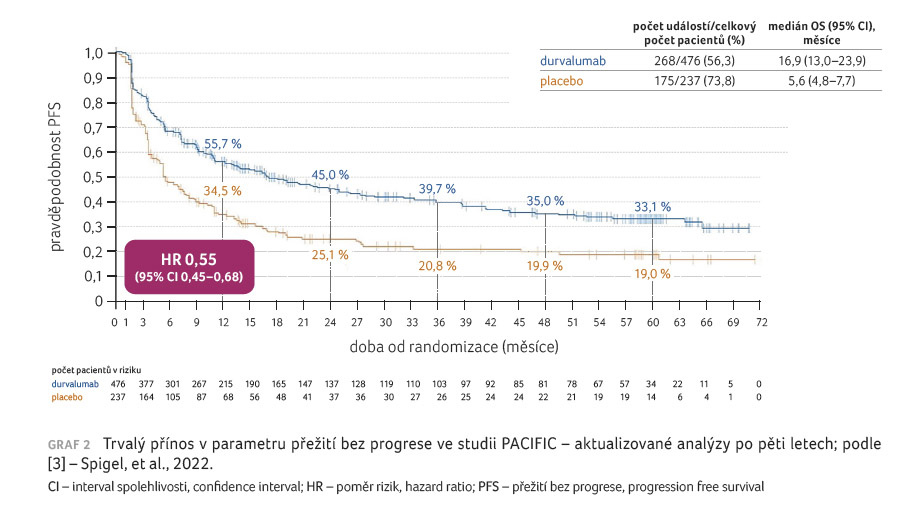 ioterapie 60–66 Gy ve 30–33
frakcích) k 12měsíčnímu podávání durvalumabu (10 mg/kg
intravenózně každé dva týdny) nebo placeba, diferencovaně podle
věku (< 65 let versus ≥ 65 let),
pohlaví a historie kouření (současný/dřívější kuřák
vs. nikdy nekouřil). Primárními cílovými parametry byly OS a PFS
(zaslepený nezávislý centrální přehled; kritéria RECIST v1.1)
v ITT (intention to treat) populaci. Poměr rizik
a 95% CI byly odhadnuty pomocí stratifikovaných log rank
testů v ITT populaci. Mediány a míry OS/PFS po
60 měsících byly odhadnuty Kaplanovou–Meierovou metodou.
Celkově bylo 709/713 randomizovaných pacientů léčeno buď
v rameni s durvalumabem (n/N = 473/476), nebo
v rameni s placebem (n/N = 236/237). Poslední
pacient absolvoval studijní léčbu v květnu 2017. K 11. lednu
2021 (medián doby sledování 34,2 měsíce u všech
pacientů; rozmezí 0,2–74,7 měsíce), aktualizovaný OS (HR
0,72; 95% CI 0,59–0,89; medián 47,5 měsíce vs. 29,1 měsíce;
graf 1) a PFS (stratifikovaný HR 0,55; 95% CI
0,45–0,68; medián 16,9 měsíce vs. 5,6 měsíce; graf 2)
zůstaly v souladu s výsledky primárních analýz. Míra
šedesátiměsíční OS byla pro durvalumab, resp. placebo 42,9 %,
resp. 33,4 %, šedesátiměsíční četnost PFS činila 33,1 %,
resp. 19,0 %. Budou předloženy aktualizované odhady účinku
léčby pro podskupiny pacientů. Tyto aktualizované analýzy
přežití založené na pětiletých datech ze studie
PACIFIC demonstrují robustní a trvalý přínos OS a PFS.
Odhaduje se, že 42,9 % pacientů randomizovaných k podávání
durvalumabu zůstává naživu po pěti letech a přibližně
třetina zůstává naživu i bez progrese onemocnění [3].
ioterapie 60–66 Gy ve 30–33
frakcích) k 12měsíčnímu podávání durvalumabu (10 mg/kg
intravenózně každé dva týdny) nebo placeba, diferencovaně podle
věku (< 65 let versus ≥ 65 let),
pohlaví a historie kouření (současný/dřívější kuřák
vs. nikdy nekouřil). Primárními cílovými parametry byly OS a PFS
(zaslepený nezávislý centrální přehled; kritéria RECIST v1.1)
v ITT (intention to treat) populaci. Poměr rizik
a 95% CI byly odhadnuty pomocí stratifikovaných log rank
testů v ITT populaci. Mediány a míry OS/PFS po
60 měsících byly odhadnuty Kaplanovou–Meierovou metodou.
Celkově bylo 709/713 randomizovaných pacientů léčeno buď
v rameni s durvalumabem (n/N = 473/476), nebo
v rameni s placebem (n/N = 236/237). Poslední
pacient absolvoval studijní léčbu v květnu 2017. K 11. lednu
2021 (medián doby sledování 34,2 měsíce u všech
pacientů; rozmezí 0,2–74,7 měsíce), aktualizovaný OS (HR
0,72; 95% CI 0,59–0,89; medián 47,5 měsíce vs. 29,1 měsíce;
graf 1) a PFS (stratifikovaný HR 0,55; 95% CI
0,45–0,68; medián 16,9 měsíce vs. 5,6 měsíce; graf 2)
zůstaly v souladu s výsledky primárních analýz. Míra
šedesátiměsíční OS byla pro durvalumab, resp. placebo 42,9 %,
resp. 33,4 %, šedesátiměsíční četnost PFS činila 33,1 %,
resp. 19,0 %. Budou předloženy aktualizované odhady účinku
léčby pro podskupiny pacientů. Tyto aktualizované analýzy
přežití založené na pětiletých datech ze studie
PACIFIC demonstrují robustní a trvalý přínos OS a PFS.
Odhaduje se, že 42,9 % pacientů randomizovaných k podávání
durvalumabu zůstává naživu po pěti letech a přibližně
třetina zůstává naživu i bez progrese onemocnění [3].
Kazuistika
Z pacientů, kteří byli na našem pracovišti indikováni k léčbě durvalumabem po předchozí CRT, zatím jeden dokončil plnou dávku, tedy 12 cyklů.
V době diagnózy se jednalo
o 74letého pacienta, exkuřáka. V anamnéze měl
hypotyreózu se substituční léčbou levotyroxinem, hyperurikemii
s léčbou alopurinolem, hypakuzi. Od října 2020 začal
pacient pozorovat chrapot, nejprve byl přeléčen kyselinou
pantotenovou a erdosteinem. V Ústřední vojenské
nemocnici Praha bylo provedeno RTG vyšetření plic, kde byl popsán
ložiskový stín v levé plíci a suspektní rozšíření
mediastina a bylo doporučeno vyšetření hrudníku výpočetní
tomografií (CT). Na pracovišti ORL v místě bydliště
byla v listopadu 2020 zjištěna paréza levé hlasivky.
V prosinci 2020 bylo na CT vyšetření popsáno ložisko
v levém horním laloku a levém hilu, lymfadenopatie
v zadním mediastinu místy splývající až do paketů.
Pacient byl odeslán na naše pracoviště k dovyšetření.
Vzhledem k intimní návaznosti na plicnici byla
k histologické verifikaci doporučena biopsie pod CT kontrolou,
která byla provedena v lednu 2021. Histologicky byl potvrzen
středně diferencovaný acinárně rostoucí adenokarcinom, který
byl PD L1 pozitivní (méně než 25 % nádorových buněk),
ALK negativní, ROS1 (pomocí fluorescenční in situ
hybridizace) negativní, EGFR mutace negativní. Následně bylo
tentýž měsíc doplněno vyšetření pozitronovou emisní
tomografií/výpočetní tomografií (PET/CT), kde bylo popsáno
ložisko hypermetabolismu glukózy na periferii levého horního
plicního laloku velmi suspektní z přítomnosti viabilní
neoplazie. Velmi suspektní z viabilní neoplazie bylo i další
ložisko či lymfatická uzlina v levém horním plicním laloku
při dorzokraniálním okraji levého plicního hilu a ve vícečetných
zvětšených a nezvětšených uzlinách v horním
mediastinu paratracheálně vlevo, v levém plicním hilu
a v dolním mediastinu. Další zřetelná ložiska
hypermetabolismu glukózy suspektní z přítomnosti viabilní
neoplazie v rozsahu vyšetření nebyla nalezena (obr. 1).
Jednalo se tedy o lokálně pokročilý NSCLC stupně IIIB
(T3N2M0 podle TNM klasifikace zhoubných nádorů). V únoru
2021 byla u pacienta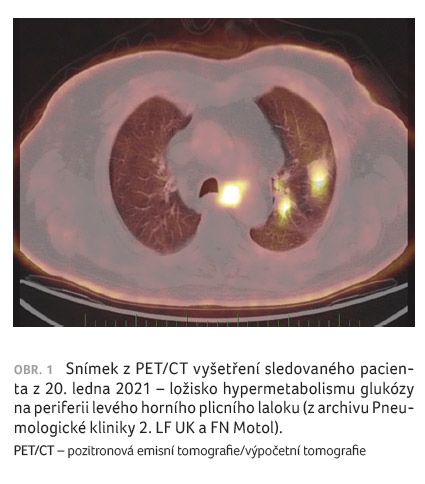 zahájena chemoterapie navelbinem
a karboplatinou a do závěru května 2021 bylo podáno
pět cyklů. V dubnu 2021 byla u pacienta zahájena
radikální konkomitantní radioterapie (celková dávka 60 Gy/30
fr), která byla ukončena na začátku červ
zahájena chemoterapie navelbinem
a karboplatinou a do závěru května 2021 bylo podáno
pět cyklů. V dubnu 2021 byla u pacienta zahájena
radikální konkomitantní radioterapie (celková dávka 60 Gy/30
fr), která byla ukončena na začátku červ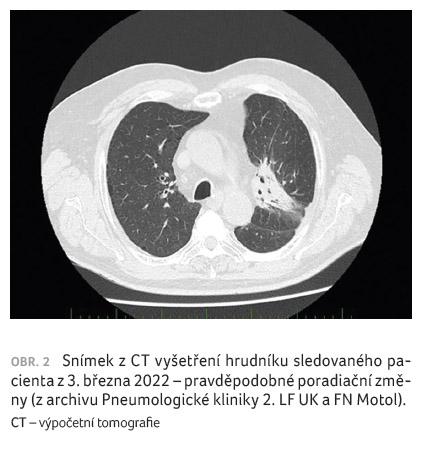 na 2021. Na CT
hrudníku 10. června 2021 byla patrná mírná regrese ložiska
v horním laloku vlevo, menší byla rovněž ložiska v levém
hilu, paket zvětšených lymfatických uzlin s defigurací
stěny jícnu a mediastinální lymfadenopatie byly též méně
zřetelné. Prostřednictvím MDT byl nález po CRT hodnocen
jako stabilizace nemoci a byla indikována imunoterapie
durvalumabem, která byla zahájena 22. června 2021.
Na kontrolním CT hrudníku v polovině září 2021 byly
popsány vlevo parahilárně rozsáhlé nehomogenní konsolidační
změny s bronchiektaziemi, pravděpodobně poradiační,
primární tumorózní ložisko v tomto terénu nelze hodnotit,
stacionární lymfadenopatie mediastina. Pacient pokračoval v léčbě
durvalumabem, na CT hrudníku v prosinci 2021 byly popsány
opět pravděpodobné poradiační změny s nemožností
hodnotit primární tumorózní ložisko. Rovněž CT hrudníku
z března 2022 bylo bez podstatných změn (obr. 2).
Dne 26. dubna 2022 byl podán 12. cyklus durvalumabu,
imunoterapie byla podle úhradové vyhlášky ukončena. Na PET/CT
vyšetření ze dne 17. června 2022 bylo popsáno
hypermetabolické ložisko v nevzdušné tkáni mediálně
v horním laloku levé plíce (v okolí s difuzní
mírnou aktivitou), hypermetabolický nodul/lymfatická uzlina
v levém plicním hilu před levým hlavním bronchem, nálezy
suspektní z FDG (fluorodeoxyglukóza) avidní viabilní
neoplazie (obr. 3A, B). Ná
na 2021. Na CT
hrudníku 10. června 2021 byla patrná mírná regrese ložiska
v horním laloku vlevo, menší byla rovněž ložiska v levém
hilu, paket zvětšených lymfatických uzlin s defigurací
stěny jícnu a mediastinální lymfadenopatie byly též méně
zřetelné. Prostřednictvím MDT byl nález po CRT hodnocen
jako stabilizace nemoci a byla indikována imunoterapie
durvalumabem, která byla zahájena 22. června 2021.
Na kontrolním CT hrudníku v polovině září 2021 byly
popsány vlevo parahilárně rozsáhlé nehomogenní konsolidační
změny s bronchiektaziemi, pravděpodobně poradiační,
primární tumorózní ložisko v tomto terénu nelze hodnotit,
stacionární lymfadenopatie mediastina. Pacient pokračoval v léčbě
durvalumabem, na CT hrudníku v prosinci 2021 byly popsány
opět pravděpodobné poradiační změny s nemožností
hodnotit primární tumorózní ložisko. Rovněž CT hrudníku
z března 2022 bylo bez podstatných změn (obr. 2).
Dne 26. dubna 2022 byl podán 12. cyklus durvalumabu,
imunoterapie byla podle úhradové vyhlášky ukončena. Na PET/CT
vyšetření ze dne 17. června 2022 bylo popsáno
hypermetabolické ložisko v nevzdušné tkáni mediálně
v horním laloku levé plíce (v okolí s difuzní
mírnou aktivitou), hypermetabolický nodul/lymfatická uzlina
v levém plicním hilu před levým hlavním bronchem, nálezy
suspektní z FDG (fluorodeoxyglukóza) avidní viabilní
neoplazie (obr. 3A, B). Ná
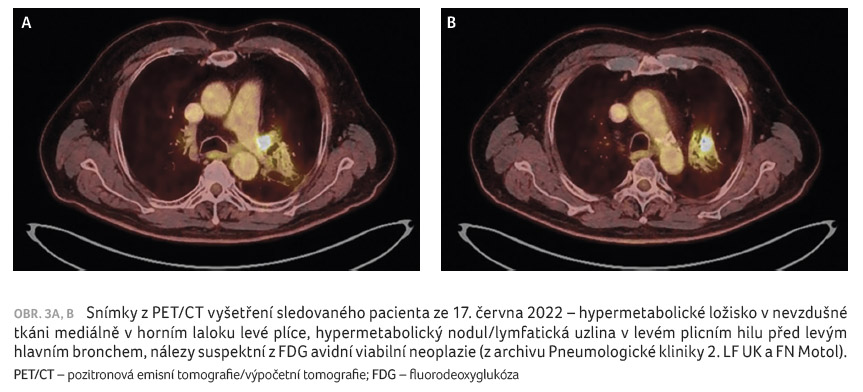
lez byl prezentován v rámci MDT kliniky, kde byl porovnán s předchozí obrazovou dokumentací a byl hodnocen jako progrese onemocnění, rovněž bylo indikováno doplnění vyšetření NGS (sekvenování nové generace). Pacient léčbu durvalumabem trvající 10 měsíců toleroval velmi dobře, bez nežádoucích účinků, při velmi dobré kvalitě života.
Závěr
Durvalumab je od září 2018 schválen Evropskou lékovou agenturou (EMA) a v České republice je od 1. ledna 2021 hrazen v monoterapii k léčbě dospělých pacientů, kteří trpí neresekovatelným lokálně pokročilým NSCLC exprimujícím PD L1 na ≥ 1 % nádorových buněk a u kterých nedošlo k progresi onemocnění po konkomitantní chemoradiační léčbě na bázi platiny. Léčba je hrazena do potvrzení progrese onemocnění verifikované opakovaným radiologickým vyšetřením v odstupu 4–8 týdnů z důvodu odlišného mechanismu účinku imunoonkologické terapie nebo do nepřijatelné toxicity, maximálně po dobu 12 měsíců. Rozšiřuje se tak indikace imunoterapie do stadia III s potenciálně kurativním efektem léčby.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN Motol