Fixní kombinace degludek/liraglutid v klinické praxi
Souhrn:
Karásek D. Fixní kombinace degludek/liraglutid v klinické praxi. Remedia 2018; 28: 238–243.
Fixní kombinace degludek/liraglutid (IDegLira) je injekční přípravek, který obsahuje dlouhodobě působící inzulinový analog degludek a agonistu receptoru pro glukagonu podobný peptid 1 liraglutid. Kombinace těchto léčivých látek se vzájemně doplňuje v ovlivnění glykemie nalačno i postprandiálně, a navíc existují důkazy o příznivém působení liraglutidu na kardiovaskulární systém. Jejich společná aplikace a jednoduchá titrace dávky spojená s nízkou frekvencí selfmonitoringu glykemií zjednodušuje léčbu i její monitoraci, čímž významně zlepšuje adherenci nemocných. Sdělení se věnuje výsledkům randomizovaných kontrolovaných studií i hodnocení z reálné klinické praxe, jež dokumentují účinnost a bezpečnost podávání fixní kombinace IDegLira při léčbě nemocných s diabetem 2. typu.
Summary:
Karasek D. Fixed dose combination degludec/liraglutide in clinical practice. Remedia 2018; 28: 238–243.
Diabetes mellitus (DM) 2. typu je závažné multiorgánové onemocnění, jehož prevalence neustále roste. V současné době se stává hlavní příčinou morbidity i mortality v rozvinutých zemích a jeho narůstající výskyt se podílí významnou měrou na zhoršení zdravotního stavu obyvatelstva také v zemích rozvojových. Podle některých dat představují výdaje na léčbu diabetu celosvětově více než 10 % všech prostředků veřejného zdravotního pojištění [1]. V České republice zdravotní pojišťovny vynaloží na léčbu diabetu zhruba 10–15 % svých rozpočtů, přičemž hlavní část prostředků se spotřebuje na terapii chronických komplikací, které vznikají v souvislosti s jeho dlouhodobě neuspokojivou kompenzací. Přesto je snaha o optimální kompenzaci diabetu mnohdy neúspěšná. Například ve Velké Británii dosahuje cílových hodnot glykovaného hemoglobinu (HbA1c) jen asi třetina diabetiků 2. typu [2]. Podle epidemiologické studie provedené v České republice v roce 2006 mělo HbA1c < 53 mmol/mol (dle IFCC) asi 44 % diabetiků 2. typu, přičemž u nemocných léčených inzulinem to bylo jen 22 % [3]. Proto je věnována velká pozornost novým možnostem antidiabetické léčby, včetně využití kombinací léků, které mohou postihnout více patogenetických mechanismů, jež se na vývoji diabetu a jeho komplikací podílejí.
Kromě nefarmakologických opatření zůstává nadále lékem první volby diabetu 2. typu metformin. Pokud není dosaženo adekvátní glykemické kontroly, jsou namístě různé kombinace antidiabetik s tím, že u nemocných s vysokým kardiovaskulárním rizikem se preferují ty léky, u nichž existují důkazy, že jsou schopny jej pozitivně ovlivnit [4]. Zejména u jedinců s progresivním úbytkem beta buněk a s alterací sekrece inzulinu se neobejdeme bez časného zahájení substituční léčby inzulinem. Díky dlouhodobě působícím inzulinovým analogům, která mají mnohem delší biologický poločas a jejichž sérové koncentrace jsou velmi stabilní (prakticky bez vrcholu na ploché křivce), je léčba mnohem predikovatelnější, bezpečnější (s nízkým rizikem hypoglykemie) a také jednodušší (aplikace jen jednou denně, titrace na základě ranní glykemie nalačno).
Pokud tato léčba není účinná či pokud selhává, bývá dalším krokem intenzifikace pomocí několika prandiálních dávek krátkodobého inzulinu či jeho analoga. To však bývá spojeno s rizikem vyššího výskytu hypoglykemií, a tím pádem s nutností častějšího selfmonitoringu a titrace dávek inzulinu [1,2]. S narůstajícím množstvím podávaného inzulinu se navíc zvyšuje riziko hmotnostního přírůstku. Jako stejně účinná, bezpečnější, jednodušší a z dlouhodobého hlediska pro pacienta výhodnější se jeví kombinace dlouhodobě působícího inzulinového analoga s agonistou receptorů pro glukagonu podobný peptid 1 (glucagon like peptide 1, GLP 1). Je prokazatelně spojena s nižším výskytem hypoglykemií, menší potřebou selfmonitoringu a titrace dávek inzulinu, nižšími hmotnostními přírůstky, či dokonce s poklesem hmotnosti a v některých případech existují i důkazy o významném snížení kardiovaskulární rizika [1,5]. Fixní kombinace těchto léčiv v jednom roztoku navíc umožní simultánní aplikaci pomocí jednoho pera, což dále léčbu zjednoduší a zvyšuje adherenci nemocných k léčbě. Aktuálně máme k dispozici dvě takové kombinace – inzulin degludek s liraglutidem (IDegLira) a inzulin glargin s lixisenatidem (IGlarLixi). V tomto přehledu se budeme věnovat první z nich.
IDegLira
Přípravek IDegLira obsahuje v 1 ml roztoku 100 jednotek (IU) inzulinu degludek a 3,6 mg liraglutidu. Směs je podávána v předplněném peru, ve kterém jsou 3 ml roztoku (celkem 300 IU inzulinu degludek a 10,8 mg liraglutidu). Jedna dávkovací jednotka pera představuje 1 IU degludeku a 0,036 mg liraglutidu [6]. Inzulin degludek má biologický poločas delší než 24 hodin, nízkou farmakodynamickou variabilitu, a tak může být aplikován kdykoliv během dne. Prostřednictvím vazby na inzulinový receptor působí stejně jako humánní inzulin. Ve srovnání s inzulinem glargin (podávaným v koncentraci 100 IU v 1 ml roztoku – IGlar U100) vedl ve studii DEVOTE k signifikantně nižšímu výskytu hypoglykemií při doložené stejné kardiovaskulární bezpečnosti [7].
Liraglutid jeví 97% homologii se zastoupením aminokyselin humánního GLP 1 a snižuje glykemii nalačno i postprandiálně. V závislosti na plazmatické koncentraci glukózy stimuluje endogenní sekreci inzulinu a inhibuje produkci glukagonu. Zpomaluje evakuaci žaludku a v souvislosti se snížením pocitu hladu vede k redukci tělesné hmotnosti. Má biologický poločas 13 hodin, takže jeho 24hodinový účinek je zajištěn podáváním 1krát denně. Navíc v denní dávce 1,8 mg signifikantně snížil u nemocných s DM 2. typu ve studii LEADER kardiovaskulární i celkovou mortalitu a vedl k poklesu výskytu hlavních kardiovaskulárních příhod [8].
Program randomizovaných klinických hodnocení DUAL
Přípravek IDegLira prošel (resp. nadále prochází) rozsáhlým
programem klinického hodnocení DUAL (Dual Action of Liraglutide and
Insulin Degludec in Type 2 Diabetes), ve kterém bylo provedeno
už několik randomizovaných kontrolovaných studií (randomized
controlled trials, RCT). Byli do nich zařazeni diabetici
2. typu s různou vstupní medikací. Uspořádání
a výsledky některých provedených RCT byly již publikovány
v časopise Remedia v loňském roce, a to v čísle
2/2017 v článku „Fixní kombinace degludek/liraglutid“,
kde jsou podrobně po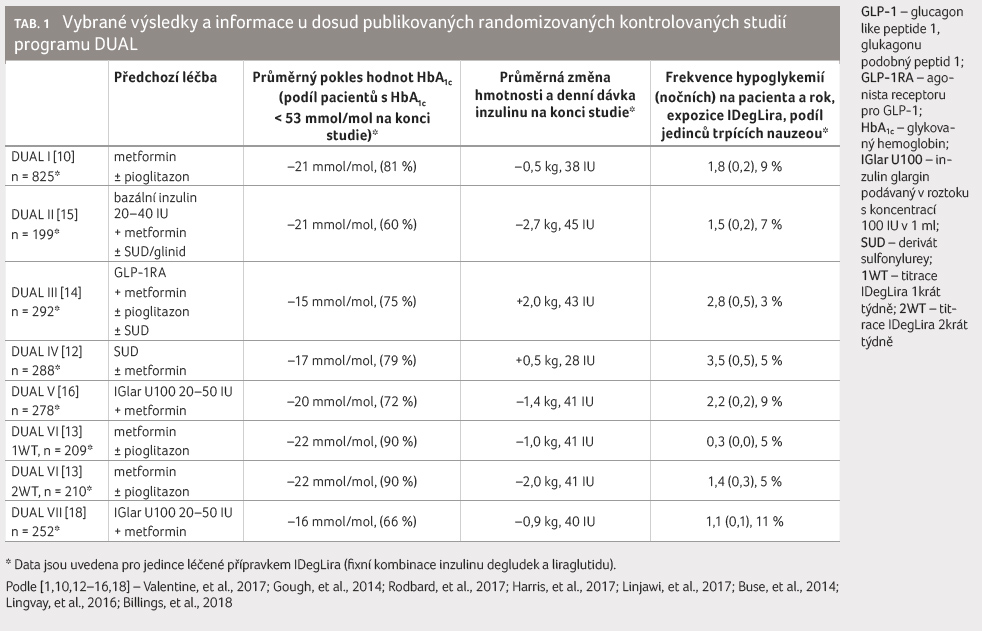 psány také farmakodynamické
a farmakokinetické vlastnosti přípravku [9]. Vybraná data
a výsledky studií DUAL I–VII shrnuje níže uvedená
tabulka 1.
psány také farmakodynamické
a farmakokinetické vlastnosti přípravku [9]. Vybraná data
a výsledky studií DUAL I–VII shrnuje níže uvedená
tabulka 1.
Dosud provedené klinické studie programu DUAL můžeme rozdělit podle toho, k jaké původní léčbě DM 2. typu byl přípravek IDegLira přidán. Ve studiích, kde předcházela léčba perorálními antidiabetiky (PAD), tzn. u inzulin naivních pacientů (DUAL I, IV, VI), bylo dosaženo cílových hodnot HbA1c u nejvyššího počtu léčených nemocných (79–90 %). Ve studii DUAL I snížila fixní kombinace IDegLira hodnotu HbA1c signifikantně více než samotný liraglutid [10]. Vůči inzulinu degludek, který však musel být podáván ve vyšší dávce než při podávání v kombinaci (na konci studie 53 IU vs. 38 IU), byla zaznamenána non inferiorita. Ve srovnání s monoterapií inzulinem byla fixní kombinace provázena snížením výskytu hypoglykemií a redukcí tělesné hmotnosti. Extenze této studie ukázala, že tyto rozdíly platí i po roce léčby [11].
Studie DUAL IV prokázala vyšší účinnost IDegLira na redukci hodnot HbA1c ve srovnání s placebem, a to i u nemocných léčených deriváty sulfonylurey (SUD). Dokumentovala také dobrou toleranci a relativní bezpečnost kombinace IDegLira + SUD [12]. Klinicky významné jsou i výsledky studie DUAL VI, kde pacienti původně léčení metforminem (popř. v kombinaci s pioglitazonem) byli randomizováni do dvou skupin, kterým oběma byla podávána fixní kombinace IDegLira. V první skupině byla podle ranní glykemie nalačno titrována dávka jednou týdně, ve druhé skupině dvakrát týdně. Při častější titraci se sice dávky zvyšovaly rychleji, avšak na konci studie nebyl v dávkování žádný rozdíl. Nebyly také nalezeny významné rozdíly v dosažené úrovni kompenzace, jen při častější titraci byl registrován větší počet hypoglykemických epizod. Studie doložila non inferioritu pro jednodušší, dle autorů pragmatičtější, algoritmus titrace léčby [13].
Do studie DUAL III byli zahrnuti nemocní, kteří byli kromě PAD léčeni také agonisty receptoru pro GLP 1 (liraglutidem nebo exenatidem) v maximální, resp. maximálně tolerované dávce [14]. Náhodně byli zařazeni do skupiny, kde byla zahájena terapie přípravkem IDegLira, nebo pokračovali v původní léčbě. Podání fixní kombinace vedlo k signifikantně vyššímu poklesu HbA1c a ke zvýšení počtu nemocných, kteří dosáhli jeho cílových hodnot (75 % vs. 36 %). Ve srovnání s nemocnými léčenými pouze agonisty receptoru pro GLP 1 v maximálně tolerované dávce bylo podávání IDegLira provázeno zvýšením tělesné hmotnosti, což souviselo se zahájením podávání inzulinu a také s tím, že podstatná část účastníků, kterým byl podáván přípravek IDegLira, nebyla léčena maximální dávkou liraglutidu (průměrná dávka na konci byla 1,5 mg za den).
Klinicky největší přínos mají studie, které zařadily pacienty již léčené bazálním inzulinem (DUAL II, V a VII). Ve studii DUAL II byli účastníci rozděleni do dvou skupin – do skupiny s IDegLira a do skupiny léčené pouze inzulinem degludek [15]. Titrace dávky byla prováděna podle ranní lačné glykemie, přesto na konci studie byly obě skupiny léčeny průměrně stejnou dávkou degludeku. Ti jedinci, kteří navíc dostávali liraglutid, dosáhli signifikantně vyššího poklesu hodnot HbA1c (došlo ke snížení o dalších 11 mmol/mol) i redukce hmotnosti (–2,7 kg), a to bez rozdílu ve výskytu hypoglykemických epizod.
Cílem studie DUAL V bylo zhodnotit účinnost IDegLira vůči intenzifikaci léčby bazálním inzulinem IGlar U100 [16], a to včetně jednotlivých podskupin pacientů s DM 2. typu [17]. Ty byly definovány podle hodnot HbA1c, indexu tělesné hmotnosti (BMI) a glykemie nalačno. Ve srovnání s glarginem vedla léčba IDegLira k signifikantně většímu poklesu HbA1c, ke snížení hmotnosti i k nižšímu výskytu hypoglykemií, a to ve všech hodnocených podskupinách [16,17]. Pokles hodnot HbA1c byl nejvýraznější u nemocných, kteří měli iniciálně nejvyšší hodnotu HbA1c. Podávání IDegLira bylo spojeno i s vyšším počtem nemocných, kteří dosáhli cílové hodnoty HbA1c, a to opět ve všech sledovaných podskupinách [17]. Byla tedy potvrzena vyšší efektivita fixní kombinace IDegLira na dosažení glykemické kontroly ve srovnání s navýšením dávky bazálního inzulinu [16]. Léčba byla navíc provázena poklesem hmotnosti a nižším výskytem hypoglykemií.
Zatím poslední publikovaná studie DUAL VII porovnávala účinnost a bezpečnost přípravku IDegLira ve srovnání s intenzifikovanou inzulinovou léčbou pomocí kombinace bazálního inzulinu IGlar U100 a krátce působícího inzulinového analoga aspartu (IAsp) podávaného nejvýše 4krát denně u diabetiků 2. typu nedostatečně kompenzovaných léčbou bazálním inzulinem a metforminem [18]. Porovnávaná léčba byla v obou skupinách prakticky stejně účinná. Došlo ke stejné redukci hodnot HbA1c a k dosažení obdobného počtu nemocných s jeho cílovou hodnotou. Ale zatímco nemocní ve skupině s přípravkem IDegLira byli na konci studie léčeni průměrnou dávkou inzulinu 40 IU za den, ve skupině s režimem bazál–bolus činila průměrná denní dávka inzulinu 84 IU (52 IU IGlar a 32 IU IAsp). A tak u jedinců s intenzifikovanou inzulinoterapií se tělesná hmotnost zvyšovala, kdežto podávání IDegLira bylo spojeno s hmotnostním úbytkem (rozdíl činil 3,6 kg). I když jedinci léčení intenzifikovanou inzulinoterapií museli provádět mnohem častěji selfmonitoring glykemií a titrovat léčbu, byl u nich dokumentován signifikantně vyšší výskyt hypoglykemií (rozdíl činil téměř 90 %).
Na základě výsledků výše uvedených studií u nemocných léčených inzulinem a PAD lze shrnout, že fixní kombinace IDegLira je v glykemické kontrole účinnější než léčba samotným bazálním inzulinem a v podstatě stejně účinná jako intenzifikovaná inzulinoterapie. Vede však k nižšímu výskytu hypoglykemií a k nižšímu přírůstku hmotnosti. Pokud tedy selhává léčba bazálním inzulinem, měla by být terapie přípravkem IDegLira bezpečnější a zároveň jednodušší alternativou intenzifikované inzulinoterapie.
Data z reálné klinické praxe
Pozitivní výsledky RCT programu DUAL byly potvrzeny také některými daty z reálné klinické praxe. V malé otevřené studii (n = 61) jednoho švýcarského centra bylo převedení nedostatečně kompenzovaných nemocných s DM 2. typu na léčbu fixní kombinací IDegLira provázeno snížením hodnot HbA1c, poklesem dávky inzulinu i redukcí hmotnosti [19]. Během půlroku léčba nevedla k žádné epizodě těžké hypoglykemie. Pouze u asi 10 % pacientů byla terapie přerušena kvůli zažívacím potížím.
Výsledky mnohem rozsáhlejší multicentrické retrospektivní
studie EXTRA (European Xultophy Treatment Retrospective Audit), která
hodnotila terapii přípravkem IDegLira v podmínkách reálné
klinické praxe na základě informací získaných z 61
center pěti evropských zemí v období od dubna do října
2016, byly publikovány v loňském roce [20]. Studie zahrnula
611 diabetiků 2. typu (analyzováno bylo 566 nemocných), kteří
byli touto fixní kombinací léčeni déle než šest měsíců před
zahájením sběru dat. Klinické charakteristiky s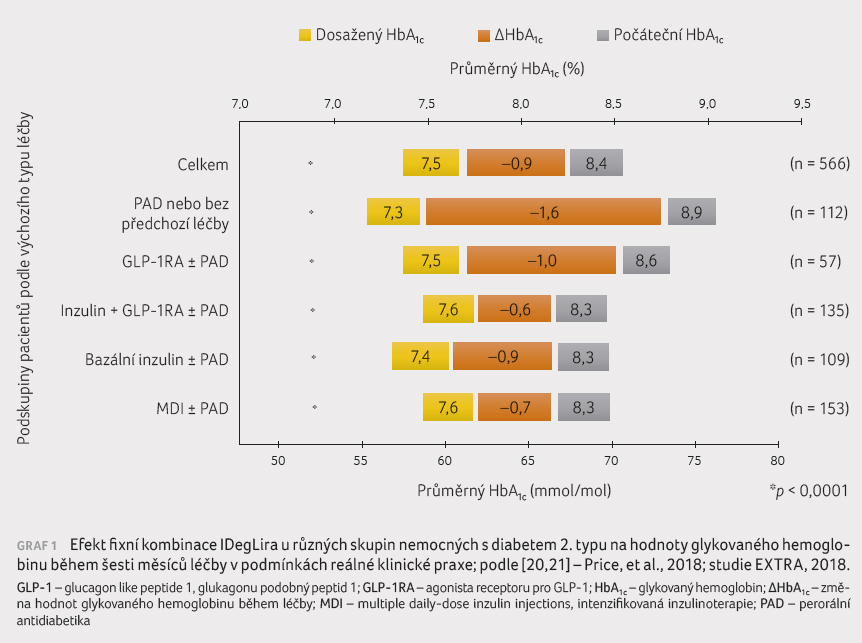 e registrovaly
v období před léčbou a dále v tříměsíčních
intervalech během jednoho roku léčby. Zařazeni byli pacienti
s různou předchozí medikací: 19 % užívalo pouze PAD,
19 % jen bazální inzulin a 10 % jen agonistu receptoru pro
GLP 1, 24 % dostávalo kombinaci bazálního inzulinu
s agonistou GLP 1 a 28 % bylo léčeno několika
dávkami inzulinu za den – režim MDI (multiple
daily dose insulin injections). U všech byla po půlroce
léčby dokumentována významná redukce hodnot HbA1c
(v průměru –10 mmol/mol, viz graf 1 [20,21]) a pokles hmotnosti (v průměru
o 0,7 kg). U pacientů, kteří byli původně léčeni
režimem MDI, byl zaznamenán pokles hmotnosti nejvyšší (–2,4 kg).
Výskyt hypoglykemií byl ve srovnání s předchozím
obdobím snížen o 82 %. Na konci sledování činila
průměrná denní dávka IDegLira 32 jednotek, maximální dávkou
(50 jednotek za den) se léčilo necelých 11 % nemocných.
Studie ukázala, že i v podmínkách běžné klinické
praxe je podávání střední dávky fixní kombinace IDegLira
spojeno s významným poklesem hodnoty HbA1c, se
snížením hmotnosti a zároveň vede i k významné
redukci výskytu hypoglykemie.
e registrovaly
v období před léčbou a dále v tříměsíčních
intervalech během jednoho roku léčby. Zařazeni byli pacienti
s různou předchozí medikací: 19 % užívalo pouze PAD,
19 % jen bazální inzulin a 10 % jen agonistu receptoru pro
GLP 1, 24 % dostávalo kombinaci bazálního inzulinu
s agonistou GLP 1 a 28 % bylo léčeno několika
dávkami inzulinu za den – režim MDI (multiple
daily dose insulin injections). U všech byla po půlroce
léčby dokumentována významná redukce hodnot HbA1c
(v průměru –10 mmol/mol, viz graf 1 [20,21]) a pokles hmotnosti (v průměru
o 0,7 kg). U pacientů, kteří byli původně léčeni
režimem MDI, byl zaznamenán pokles hmotnosti nejvyšší (–2,4 kg).
Výskyt hypoglykemií byl ve srovnání s předchozím
obdobím snížen o 82 %. Na konci sledování činila
průměrná denní dávka IDegLira 32 jednotek, maximální dávkou
(50 jednotek za den) se léčilo necelých 11 % nemocných.
Studie ukázala, že i v podmínkách běžné klinické
praxe je podávání střední dávky fixní kombinace IDegLira
spojeno s významným poklesem hodnoty HbA1c, se
snížením hmotnosti a zároveň vede i k významné
redukci výskytu hypoglykemie.
Zajímavé zjištění přinesla také analýza prof. Kvapila a jeho spolupracovníků, která ukázala, že i když IDegLira nepatří mezi levné přípravky, jeho podávání je z hlediska nákladové efektivity výhodné. U nemocných, kteří nedosahovali optimální glykemické kontroly při léčbě bazálním inzulinem, byla z dlouhodobého hlediska (při dosažení stejné míry kvality života) terapie fixní kombinací IDegLira ve srovnání s léčbou samotným inzulinem v režimu bazál–bolus nebo ve srovnání s režimem, kdy k bazálnímu inzulinu byl navíc přidán liraglutid, ekonomicky výhodnější [22].
Praktické poznámky k léčbě IDegLira
Dle Souhrnu údajů o přípravku (SPC) Xultophy je přípravek určen k léčbě dospělých pacientů s DM 2. typu v kombinaci s PAD, pokud tato léčba samotná nebo v kombinaci s agonistou receptoru pro GLP 1 či v kombinaci s bazálním inzulinem nevede k dostatečné kompenzaci glykemie [6]. Pro úhradu léčby IDegLira z prostředků veřejného zdravotního pojištění je nutné, aby byl diabetik 2. typu léčen nejméně jedním PAD v kombinaci s bazálním inzulinem, a to v denní dávce alespoň 20 IU po dobu minimálně tří měsíců společně s režimovými opatřeními a aby tato léčba nebyla spojena s uspokojivou kompenzací diabetu definovanou hodnotou HbA1c < 60 mmol/mol. Přípravek se podává jednou denně subkutánně a lze jej podat kdykoliv v průběhu dne, nejlépe ve stejnou dobu. Pokud pacient dávku vynechá, má přípravek aplikovat ihned, jak to zjistí, a pak pokračovat v podávání jednou denně ve stejnou dobu. Doporučená počáteční dávka je při převodu z léčby bazálním inzulinem nebo agonistou receptoru pro GLP 1 16 jednotek denně, při převodu z PAD 10 jednotek denně [6]. Pokud se přidává k léčbě SUD, je vhodné jejich dávku snížit. Dávku IDegLira je nutné titrovat podle individuálních potřeb pacienta a dle stanovených cílových hodnot. Titraci je doporučeno provádět dvakrát týdně podle ranní glykemie nalačno (při hodnotě < 4,0 mmol/l snížit dávku o 2 jednotky, při glykemii 4,0–5,0 mmol/l ponechat stávající dávku, při glykemii > 5,0 mmol/l zvýšit dávku o 2 jednotky [13]).
Mezi nejčastější nežádoucí účinky patří gastrointestinální potíže, zejména nauzea, průjem a zvracení, dále bolesti hlavy a nazofaryngitida. Většinou se objevují na začátku léčby a obvykle vymizejí do několika dnů nebo týdnů léčby. Méně často byly hlášeny zácpa, dyspepsie, gastritida, bolest břicha, gastroezofageální refluxní choroba, břišní distenze, říhání, flatulence a snížená chuť k jídlu. Bylo pozorováno také několik případů akutní pankreatitidy. U pacientů s pankreatitidou v anamnéze je třeba dbát zvláštní opatrnosti, a pokud se objeví během léčby, je další podávání IDegLira kontraindikované. Lék se také nedoporučuje u pacientů trpících zánětlivým onemocněním střev a diabetickou gastroparézou. V souvislosti s gastrointestinálními nežádoucími účinky existuje také potenciální riziko dehydratace a zhoršení funkce ledvin. IDegLira není doporučen u pacientů se závažnou poruchou funkce ledvin, včetně pacientů v konečném stadiu renálního onemocnění. Nedoporučuje se podávat ani u jedinců se závažnou poruchou funkce jater. Dostatečné zkušenosti s jeho podáváním nejsou ani u nemocných se závažným srdečním selháním, zejména v kombinaci s pioglitazonem může dojít ke zhoršení příznaků onemocnění. Po podání IDegLira byly také hlášeny alergické reakce a reakce v místě vpichu. Nadměrný efekt léčby může vést k hypoglykemii, nedostatečný naopak k hyperglykemii. Příliš rychlá kompenzace diabetu může být provázena většinou přechodným zhoršením diabetické retinopatie [6,8].
Závěr
Fixní kombinace IDegLira obsahuje dvě navzájem se doplňující látky, které v současné době představují jedinečné produkty ve svých kategoriích. Mají optimální farmakodymické i farmakokinetické vlastnosti a pro liraglutid navíc existují důkazy, že jako jedno z mála antidiabetik snižuje také výskyt kardiovaskulárních příhod a kardiovaskulární i celkovou mortalitu. Jejich společná aplikace a jednoduchá titrace dávky spojená s nízkou frekvencí selfmonitoringu glykemií zjednodušuje léčbu i její monitoraci, čímž významně zlepšuje adherenci nemocných. Nízký výskyt hypoglykemií a hmotnostních přírůstků spolu s prokázanou účinností na glykemickou kompenzaci, což dokládají nejen randomizované kontrolované studie, ale též data z reálné klinické praxe, činí přípravek IDegLira velmi atraktivním lékem, zejména v případech selhávání kombinace bazálního inzulinu s perorálními antidiabetiky.
Podpořeno MZ ČR – RVO (FNOL, 00098892)
Seznam použité literatury
- [1] Valentine V, Goldman J, Shubrook JH. Rationale for, Initiation and Titration of the Basal Insulin/GLP‑1RA Fixed‑Ratio Combination Products, IDegLira and IGlarLixi, for the Management of Type 2 Diabetes. Diabetes Ther 2017; 8: 739–752.
- [2] Hughes E. IDegLira: Redefining insulin optimisation using a single injection in patients with type 2 diabetes. Prim Care Diabetes 2016; 10: 202–209.
- [3] Škrha J. Epidemiologická studie o diabetu mellitu v České republice, porovnání výsledků z roku 2002 a 2006. Diabet Metab Endokrin Výž 2010; 13: 55–62.
- [4] Doporučený postup péče o diabetes mellitus 2. typu České diabetologické společnosti 2017. Dostupné na: http://www.diab.cz/dokumenty/standard_lecba_dm_typ_II.pdf
- [5] Harris K, Nealy KL. The Clinical Use of a Fixed‑Dose Combination of Insulin Degludec and Liraglutide (Xultophy 100/3.6) for the Treatment of Type 2 Diabetes. Ann Pharmacother 2018; 52: 69–77.
- [6] Údaje o přípravku Xultophy. Dostupné na: http://www.ema.euro-
- [7] Marso SP, McGuire DK, Zinman B, et al; DEVOTE Study Group. Efficacy and Safety of Degludec versus Glargine in Type 2 Diabetes. N Engl J Med 2017; 377: 723–732.
- [8] Marso SP, Daniels GH, Brown‑Frandsen K, et al.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375: 311–322.
- [9] Ondřichová L. Fixní kombinace degludek/liraglutid. Remedia 2017; 27: 187–190.
- [10] Gough SC, Bode B, Woo V, et al.; NN9068‑3697 (DUAL‑I) trial investigators. Efficacy and safety of a fixed‑ratio combination of insulin degludec and liraglutide (IDegLira) compared with its components given alone: results of a phase 3, open‑label, randomised, 26‑week, treat‑to‑target trial in insulin‑naive patients with type 2 diabetes. Lancet Diabetes Endocrinol 2014; 2: 885–893.
- [11] Gough SC, Bode BW, Woo VC, et al. One‑year efficacy and safety of a fixed combination of insulin degludec and liraglutide in patients with type 2 diabetes: results of a 26‑week extension to a 26‑week main trial. Diabetes Obes Metab 2015; 17: 965–973.
- [12] Rodbard HW, Bode BW, Harris SB, et al.; Dual Action of Liraglutide and insulin degludec (DUAL) IV trial investigators. Safety and efficacy of insulin degludec/liraglutide (IDegLira) added to sulphonylurea alone or to sulphonylurea and metformin in insulin‑naïve people with Type 2 diabetes: the DUAL IV trial. Diabet Med 2017; 34: 189–196.
- [13] Harris SB, Kocsis G, Prager R, et al. Safety and efficacy of IDegLira titrated once weekly versus twice weekly in patients with type 2 diabetes uncontrolled on oral antidiabetic drugs: DUAL VI randomized clinical trial. Diabetes Obes Metab 2017; 19: 858–865.
- [14] Linjawi S, Bode BW, Chaykin LB, et al. The Efficacy of IDegLira (Insulin Degludec/Liraglutide Combination) in Adults with Type 2 Diabetes Inadequately Controlled with a GLP‑1 Receptor Agonist and Oral Therapy: DUAL III Randomized Clinical Trial. Diabetes Ther 2017; 8: 101–114.
- [15] Buse JB, Vilsbøll T, Thurman J, et al.; NN9068‑3912 (DUAL‑II) Trial Investigators. Contribution of liraglutide in the fixed‑ratio combination of insulin degludec and liraglutide (IDegLira). Diabetes Care 2014; 37: 2926–2933.
- [16] Lingvay I, Pérez Manghi F, García‑Hernández P, et al.; DUAL V Investigators. Effect of Insulin Glargine Up‑titration vs Insulin Degludec/Liraglutide on Glycated Hemoglobin Levels in Patients With Uncontrolled Type 2 Diabetes: The DUAL V Randomized Clinical Trial. JAMA 2016; 315: 898–907.
- [17] Lingvay I, Harris S, Jaeckel E, et al. Insulin degludec/liraglutide (IDegLira) was effective across a range of dysglycaemia and body mass index categories in the DUAL V randomized trial. Diabetes Obes Metab 2018; 20: 200–205.