Imatinib mesylát v paliativní léčbě pacientů s pokročilým gastrointestinálním stromálním tumorem
Imatinib, malá molekula, která blokuje tyrozinkinázy (c-kit, bcr-abl), prokázal svoji výraznou účinnost v léčbě pokročilého gastrointestinálního stromálního tumoru (GIST) v celé řadě klinických studií. Pacienti mají významný přínos z paliativní terapie, jejich doba přežití je několikanásobně delší oproti éře před zařazením tohoto preparátu. V terapii pokročilých GIST lze zcela oprávněně používat pro časová období označení „léta před zavedením imatinibu“ a „léta po zavedení imatinibu“
Úvod
Ve studii fáze II Demetriho a kol. [1, 2] (klinická studie B2222) byly poprvé použity záměrně různé dávky imatinibu u metastatického gastrointestinálního stromálního tumoru (GIST). Celkem 147 pacientů bylo randomizováno do dvou ramen – v prvním rameni byli pacienti léčeni iniciální dávkou 400 mg imatinibu denně a v případě progrese byla následně možná eskalace na 600 mg/den, ve druhém rameni byli pacienti léčeni od počátku dávkou
600 mg/den. Parciální odpovědi bylo dosaženo u 53,7 % pacientů, stabilizace nemoci u 27,9 % pacientů (léčebný benefit 81 %) a iniciální progrese jen u 13,6 % pacientů. V rámci studie CSTI571B2222 [3] byl představen také celkový léčebný benefit – a to až u 84 % pacientů (kompletní remise, CR, 1 %; parciální remise, PR, 67 %; stabilizace nemoci, SD, 16 %)! Medián do dosažení léčebných odpovědí (CR, PR) byl 13 týdnů, mediánu celkového přežití nebylo v době follow-up periody 34 měsíců dosaženo. Velice zajímavá data poskytla tato studie po pětiletém sledování. Medián celkového přežití se prakticky nelišil u pacientů, kteří dosáhli parciální léčebné odpovědi, a u pacientů s „pouhou“ stabilizací metastatické choroby (medián přežití 248 týdnů), zatímco přežití u pacientů s primární progresí bylo výrazně horší (medián 36 týdnů). Pravděpodobnost pětiletého přežití u pacientů s léčebnou odpovědí či stabilizací onemocnění při podávání iniciální dávky imatinibu byla 55 %, kdežto u pacientů s primární progresí při podávání iniciální dávky jen 9 %!
Další otázkou bylo, zda pacienty léčit i nadále – po dosažení výrazné léčebné odpovědi, případně kompletní remise, nebo raději terapii přerušit a znovu ji zahájit až při další progresi choroby. Blayova studie fáze III [6] se na tuto otázku snažila odpovědět – zařadila 182 pacientů s pokročilým c-kit pozitivním GIST. Po dosažení léčebné odpovědi u 98 z nich (42 % parciálních a 10 % kompletních odpovědí, tj. RR 52 %) bylo nakonec z etických důvodů a se souhlasem léčených randomizováno 58 pacientů do ramene s kontinuálním pokračováním aplikace imatinibu nebo do ramene s přerušením léčby a s jejím opětným zahájením při případné progresi. Po ročním vyhodnocení došlo k progresi u 8 pacientů ve skupině s pokračující léčbou (26 pacientů) a u 26 pacientů ve skupině s přerušením léčby (32 pacientů), což je signifikantní rozdíl (p < 0,0001). Je ale pravda, že u většiny z nich – u 22 z 26 pacientů progredujících po přerušení léčby – došlo po obnovení léčby imatinibem k opětné rychlé regresi. U těchto dvou skupin dosáhlo dvouleté celkové přežití 92 % ve skupině s pokračováním léčby a 87 % ve skupině s přerušením léčby (p = 0,87). Z této studie tedy jednoznačně vyplývá, že dojde-li k výrazné léčebné odpovědi (výrazná parciální nebo kompletní léčebná odpověď) u pacienta s pokročilou metastatickou chorobou a imatinib je snášen prakticky bez potíží, pak pacient nemá žádný prospěch z přerušení léčby a doporučuje se s léčbou pokračovat do progrese pokročilé choroby nebo do doby, než se objeví limitující nežádoucí účinky.
V roce 2006 však byla opětně nastolena otázka optimální iniciální dávky imatinibu. Dosud uváděná a doporučovaná iniciální dávka byla 400 mg imatinibu denně, ale při subanalýzách studií se objevoval fakt, že kromě nejobvyklejší mutace exonu 11 kit receptoru je u ostatních mutací exonů 9, 4 i ostatních raritních mutací včetně kit receptoru bez mutace („wild“ typ) patrný trend přínosu z hlediska PFS při podávání dávek iniciálně vyšších. Proto se v současné době hovoří o možnosti prediktivního faktoru – mutace exonu 9 – s ohledem na vyšší účinnost imatinibu v primárně eskalovaných dávkách. Toto zjištění podporuje práce Cioffiho [7], který prezentuje skupinu dlouhodobě přežívajících pacientů s pokročilými metastatickými GIST. Ze 200 pacientů trvala významná remise u 31 z nich, a to po dobu delší než pět let. Tyto případy byly podrobněji zkoumány a jako potenciální příznivé prognostické faktory se jeví mužské pohlaví (61 %), původ GIST v tenkém střevě (60 % – toto zjištění oponuje dřívějšímu předpokladu o lepší prognóze GIST žaludku), izolované jaterní metastatické postižení (80 %), iniciálně normální koncentrace hemoglobinu, tj. více než 10 g/dl (92 %), a prakticky u všech případů byla prokázána mutace exonu 11 (většinou v oblasti kodonu 557–558).Pro pacienty s progresí pokročilého GIST při léčbě imatinibem je dnes k dispozici terapie druhé linie – sunitinib [8, 9], případně terapie třetí linie – regorafenib [10].
Kazuistika
Pacientka, rok narození 1977, trpěla několikaměsíční bolestivostí v epigastriu, v březnu 1993 u ní byly nalezeny mnohočetné jaterní metastázy. Z toho důvodu byla indikována další terapie na Klinice dětské onkologie FN v Motole. V dubnu 1993 byla provedena probatorní laparotomie (první operace) a byl potvrzen primární tumor v oblasti pyloru. Proto byla časně, 5. května 1993, provedena druhá operace – resekce žaludku, ale současně plánovaný resekční výkon pravého jaterního laloku pro pokročilost tumoru proveden nebyl. Histologicky byl primární resekát žaludku hodnocen jako maligní leiomyosarkom. Následně byla aplikována chemoterapie dle SIOP (International Society for Pediatric Oncology) pro IV. klinické stadium – celkem 4 cykly (vinkristin + etoposid, ifosfamid). Ale již během této chemoterapie byla v září 1993 potvrzena lokální recidiva. Proto za plánované další operace pokračovala identická terapie až do ledna 1994. Dne 16. listopadu 1993 byla uskutečněna třetí operace (Klinika dětské chirurgie FN v Motole), při níž byla provedena ligatura arteriae hepaticae, probatorní excize z levého jaterního laloku, cholecystektomie a exstirpace lymfatické uzliny z porty hepatis; ovšem pokus o resekce metastáz jater z obou laloků byl peroperačně odmítnut pro masivní jaterní postih. Histologická klasifikace tumoru byla identická s původní histologií, přesto byla nově s využitím imunohistochemie přehodnocena na tehdy GIST typu GIANT (gastrointestinal autonomous nerve tumors – podobný low grade sarkomu). Po skončení chemoterapie v lednu 1994 a po třetí operaci byl v únoru 1994 proveden restaging – tehdy byla potvrzena výrazná regrese metastáz jater. Proto pacientka podstoupila ve FN Královské Vinohrady (březen–duben 1994) konsolidační radioterapii jater do celkové dávky 25,5 Gy. Poté byla dále dlouhodobě dispenzarizována bez jasné progrese. Ještě v lednu 1999 byla potvrzena jen drobná rezidua jaterní – velmi pravděpodobně jen fibrotické jizvy po původním metastatickém postihu jater. Poté ale v září 1999 vzniklo podezření na lokální recidivu – v oblasti velké kurvatury žaludku byl nalezen polypózní tumor o velikosti 10 x 10 mm, endoskopické vyšetření bylo negativní. Přesto byla doporučena operační revize.
Dne 2. listopadu 1999 byla provedena čtvrtá operace – pacientka podstoupila revizi břišní dutiny a resekci tumoru s další parciální resekcí žaludku. Histologicky se jednalo o nádorový uzel neostře ohraničený do okolí, který mikroskopicky odpovídal opět GIST typu GIANT. Po operaci byla pacientka opět dispenzarizována na Klinice dětské onkologie FN v Motole.
Pro nejasný nález na vyšetření CT (počítačová tomografie) plic, respektive suspektní z metastatického postižení v oblasti plic, byla v lednu 2000 na Klinice dětské chirurgie FN v Motole provedena resekce středního laloku pravé plíce. Histologicky byla zachycena chrupavčitá tkáň, místy zvápenatělá, hodnocení nálezu bylo uzavřeno jako chondrohamartom plíce. Pro opětnou suspektní chorobu ve stěně žaludku byla dne 20. června 2000 provedena pátá operace – revize břišní dutiny s resekcí části žaludku pro lokální recidivu; histologicky se jednalo o opětnou lokální recidivu tumoru o velikosti 2 cm, mikroskopicky byla svalovina opakovaně prostoupena tumorem – opět charakteru GIST-GIANT. Pooperačně byl staging negativní a remise trvala do listopadu 2002.
Pro další suspekci na lokální progresi byla uskutečněna dne 3. prosince 2002 šestá operace – opět byla provedena další revize břišní dutiny a resekce části fundu žaludku s lokální recidivou. Histologicky se jednalo o nádor vřetenobuněčný, zčásti tvořený nepravidelně polygonálními buňkami, místy vyplněný kolagenní stromou. Nádor odpovídal nádoru typu GIST-GIANT, byl jen částečně opouzdřen, místy se nacházel přímo v okraji resekátu. Tehdy byl poprvé s rozvojem imunohistochemie vyšetřen target pro imatinib – receptor c-kit. Receptor c-kit byl pozitivní, aktin mírně pozitivní, S100 negativní, chromogranin A negativní, marker proliferační aktivity (Ki-67) středně pozitivní. Nádor byl patologem hodnocen opět jako GIST podtypu GIANT. Souběžně proběhlo genetické vyšetření s ohledem na souběžný nález plicního chondrohamartomu. Hodnocení nálezu bylo u této pacientky uzavřeno jako Carneyův syndrom. Následně byla pacientka převedena do dispenzarizace Radioterapeuticko-onkologického oddělení FN v Motole. Pro opětnou suspekci na lokální progresi byla v květnu 2003 provedena sedmá operace – resekce lokální recidivy tumoru žaludku, ale peroperačně byla potvrzena inoperabilní jaterní metastatická choroba. Kvůli jasné progresi do té doby prakticky nedetekovatelných jaterních metastáz začal být od 8. dubna 2004 podáván imatinib mesylát v iniciální paliativní dávce 400 mg/den. Při této terapii byl stav pacientky bez komplikací, ale pro jasnou progresi metastáz jaterních a další lokální recidivu v říjnu 2004 byla zvýšena dávka imatinibu na 600 mg/den.
Operace recidivy tumoru na žaludku byla oddálena pro systémovou progresi. První eskalace dávky imatinibu – na 600 mg/den – umožnila stabilizovat chorobu déle než 2,5 roku. V listopadu 2007 však byla potvrzena další progrese velikosti i počtu jaterních metastáz. Proto byla provedena druhá eskalace imatinibu, a to na dávku 800 mg/den; při léčbě touto dávkou došlo k další progresi velikosti i počtu jaterních metastáz v lednu 2008.
Od ledna 2008 byla proto zahájena druhá paliativní linie léčby sunitinibem; při této terapii byla na CT potvrzena stabilizace. Další progrese byla potvrzena až v prosinci 2009, kdy došlo k opětné progresi jaterních metastáz a k výrazné lokální progresi tumorózní infiltrace žaludku!
P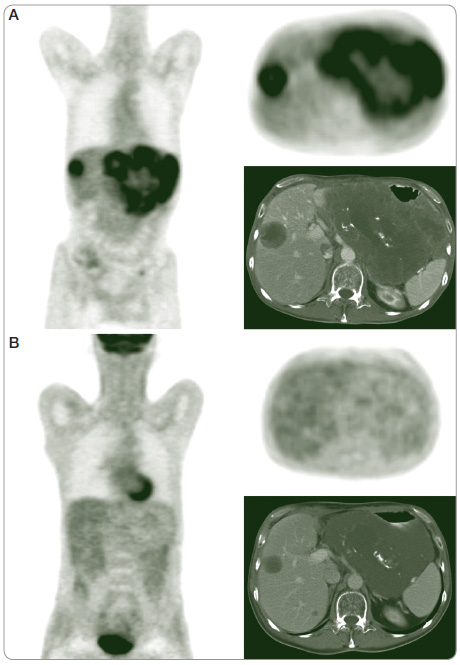 roto byla tehdy při vyčerpané standardní terapii zahájena salvage aplikace imatinibu v dávce 800 mg/den od prosince 2009 a při této terapii došlo k další stabilizaci metastatické choroby dle CT a k regresi PET (pozitronová emisní tomografie) nálezu (obr. 1) – tento stabilizovaný stav trval až do PET/CT vyšetření 30. července 2012. Tehdy byl proveden metabolický PET/CT trupu, kde bylo nalezeno nové ložisko zvýšené akumulace radiofarmaka ve stěně žaludku. Jaterní ložiska jsou patrná jako minimální zvýšení akumulace radiofarmaka pod pouzdrem pravého laloku jater, nález se v porovnání s předchozím vyšetřením nezměnil. Navíc na dně malé pánve jsou dvě nové cystické fotopenické formace o průměru 6,8 cm a 2,2 cm. Vyšetření bylo doplněno 18. září 2012 o gastroskopii s negativním nálezem a endosonografii s průkazem cca 5cm submukózního tumoru ve fornixu žaludku. Protože salvage aplikace imatinibu byla účinná z hlediska jaterních metastáz, byla indikována paliativní resekce tumoru žaludku a případná resekce duplicitního tumoru v malé pánvi.
roto byla tehdy při vyčerpané standardní terapii zahájena salvage aplikace imatinibu v dávce 800 mg/den od prosince 2009 a při této terapii došlo k další stabilizaci metastatické choroby dle CT a k regresi PET (pozitronová emisní tomografie) nálezu (obr. 1) – tento stabilizovaný stav trval až do PET/CT vyšetření 30. července 2012. Tehdy byl proveden metabolický PET/CT trupu, kde bylo nalezeno nové ložisko zvýšené akumulace radiofarmaka ve stěně žaludku. Jaterní ložiska jsou patrná jako minimální zvýšení akumulace radiofarmaka pod pouzdrem pravého laloku jater, nález se v porovnání s předchozím vyšetřením nezměnil. Navíc na dně malé pánve jsou dvě nové cystické fotopenické formace o průměru 6,8 cm a 2,2 cm. Vyšetření bylo doplněno 18. září 2012 o gastroskopii s negativním nálezem a endosonografii s průkazem cca 5cm submukózního tumoru ve fornixu žaludku. Protože salvage aplikace imatinibu byla účinná z hlediska jaterních metastáz, byla indikována paliativní resekce tumoru žaludku a případná resekce duplicitního tumoru v malé pánvi.
Z toho důvodu byla 11. října 2012 provedena zatím poslední operační revize břicha, resekce malé kurvatury s progredující lokální recidivou ve stěně žaludku, a současně byl při revizi v břišní dutině resekován benigní cystadenom levého ovaria. Histologicky byla v oblasti žaludku potvrzena lokální recidiva – tumor o velikosti 40 × 28 × 24 mm, jenž vychází ze svaloviny stěny žaludku, je ohraničený, neprorůstá do sliznice a zasahuje těsně pod korporální žaludeční sliznici, kterou neinfiltruje. Tumor je tvořen zčásti vřetenitými eozinofilními buňkami, místy převažují partie s buňkami polygonálními střední velikosti. Jádra s mírnými atypiemi, mitózy max. 6/50 HPF. Imunohistochemicky byla opět prokázána pozitivita receptoru c-kit (CD117). Cystický útvar s hladkým povrchem o průměru 70 mm v pánvi byl potvrzen jako benigní serózní cystadenom. Mutační analýza prokázala tzv. wild (nemutovanou) formu c-kit receptoru.
Pooperačně pacientka pokračuje od 20. října 2012 s paliativní aplikací imatinibu 800 mg/den, protože jaterní metastatická choroba byla při dosavadní terapii stabilizována. Kontrolní PET/CT je plánováno na leden 2013.
Pro případ systémové progrese lze u této pacientky uvažovat o podávání nového léčiva pro GIST rezistentní vůči léčbě imatinibem a sunitinibem – regorafenibu, případně o zařazení do některých možných klinických studií.
Shrnutí
Léčba této pacientky je typickým příkladem, kdy paliativní terapie výrazně prodlužuje období přežití bez známek progrese a tím prodlužuje celkovou dobu přežití. Navíc ukazuje na to, že biologickou terapii nelze chápat jako dosavadní nejčastější léčbu – chemoterapii. U biologické léčby je možný i racionální návrat k předchozí terapii a opět může být dosaženo dobrého účinku této terapie. Uvedený případ pacientky je důležitý i z hlediska demonstrace nutné úzké spolupráce onkologa s chirurgem. Průběh terapie byl navíc jistě modifikován terapeuticky velmi nepříznivým mutačním statusem c-kit receptoru – tzv. wild typem. I přes tento terapeuticky nepříznivý typ c-kit receptoru je jasně dokumentován dobrý paliativní efekt terapie.
Seznam použité literatury
- [1] Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and Safety of Imatinib Mesylate in Advanced Gastrointestinal Stromal Tumors. N Engl J Med 2002; 347: 472–480.
- [2] Rios M, Lecesne A, Bui B, et al. Interruption of imatinib in GIST patients with advanced disease after one year of treatment: Updated results of the prospective French Sarcoma Group randomized phase III trial on long term survival. J Clin Oncol 2007; 25: No. 18S (June 20 Supplement), abstract 10016.
- [3] Data on file, Novartis UK Ltd. Study No STI571B2222. Open, randomized, phase II study of Glivec in patients with unresectable or metastatic malignant gastrointestinal stromal tumors expressing c-kit. Report 15th December 2003.
- [4] Van Glabbeke M, Verweij J, Casali PG, et al. Initial and late resistance to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for Research and Treatment of er-Italian Sarcoma Group-Australasian Gastrointestinal Trials Group study. J Clin Oncol 2005; 23: 5795–5804.
- [5] Rankin C, Von Mehren M, Blanke C, et al. Dose effect of imatinib in patients with metastatic GIST: Phase III Sarcoma Group Study S0033 (abstract 9005), Proc ASCO 2004; 23: 815.
- [6] Blay JY, Le Cesne A, Ray-Coquard I, et al. Prospective multicentric randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: the French Sarcoma Group. J Clin Oncol 2007; 25: 1107–1113.
- [7] Cioffi A, Emile JF, Domont J, et al. Long term progression-free-survival correlates with KIT/PDGFR mutational status in advanced GIST patients treated with imatinib (IM). J Clin Oncol 2007; 25: No. 18S (June 20 Supplement), abstract 10053.
- [8] Heindrich MC, Maki RG, Corless CL, et al. Sunitinib response in imatinib – resistant GIST correlates with KIT and PDGFR mutation status. J Clin Oncol 2006; 24: No. 18S (June 20 Supplement), abstract 9502.
- [9] Demetri GD, van Oosterom AT, Garrett CR, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006; 368: 1329–1338.
- [10] Demetri GD, Reichardt P, Kang YK, et al. Randomized phase III trial of regorafenib in patients (pts) with metastatic and/or unresectable gastrointestinal stromal tumor (GIST) progressing despite prior treatment with at least imatinib (IM) and sunitinib (SU): GRID trial. J Clin Oncol 2012; 30: No. 15S (May 30 Supplement), abstract LBA10008.