Kazuistika pacientky s časným karcinomem prsu s vysokým rizikem relapsu onemocnění
Souhrn:
Palácová M. Kazuistika pacientky s časným karcinomem prsu s vysokým rizikem relapsu onemocnění. Remedia 2022; 32: 236–238.
Karcinom prsu je vyléčitelné onemocnění, nicméně u vyšších klinických stadií je spojeno s rizikem relapsu. Snahou terapie je snížení uvedeného rizika. V případě luminálních nádorů prsu, které mají pozitivní hormonální receptory a negativní HER2 status, představuje nyní nadějnou možnost kombinovaná hormonální léčba inhibitorem cyklin‑dependentní kinázy 4/6 (CDK 4/6) abemaciklibem, která prokazuje při mediánu sledování 15,5 měsíce prodloužení přežití bez invazivního onemocnění. Tento přínos byl potvrzen také při sledování v délce 27,1 měsíce. Data pro celkové přežití nejsou zralá. Z nežádoucích účinků léčby se nejčastěji vyskytují průjem, neutropenie a únava v rameni s kombinovanou léčbou abemaciklibem s hormonální terapií.
Summary:
Palacova M. Case report of a patient with early‑stage breast cancer with a high risk of disease relapse. Remedia 2022; 32: 236–238.
Breast cancer is a curable disease with a risk of relapse in higher clinical stages. The therapy aims to lower the risk of relapse. In the case of HR+/HER2− luminal breast carcinomas, combined hormonal therapy with abemaciclib, a cyclin‑dependent kinase inhibitor 4/6 (CDK 4/6), is a promising treatment option exhibiting higher survival without invasive disease in a median evaluation period of 15.5 months. This benefit was also confirmed in an evaluation of 27.1 months. Overall survival data are not mature yet. The most common side effects include diarrhea, neutropenia and fatigue in the arm with combined abemaciclib and hormonal therapy.
Key words: early‑stage breast carcinoma HR positive/HER2 negative, luminal phenotype, gh risk of disease relapse, abemaciclib.
Úvod
Karcinom prsu představuje nejčastější malignitu u žen. I navzdory screeningu, který v České republice probíhá od roku 2004, zůstává určitý podíl žen, u nichž je diagnóza stanovena v klinickém stadiu III, kdy je riziko relapsu onemocnění vysoké. Časný karcinom prsu (I.–III. klinického stadia) je stále vyléčitelným onemocněním při využití multimodálního léčebného přístupu. Lokálně se využívá operační řešení a radioterapie. Ze systémové léčby je dlouhodobě standardem adjuvantní chemoterapie (CHT), hormonální léčba (HT), cílená terapie u nádorů s pozitivitou HER2 (receptor pro epidermální růstový faktor 2).
Adjuvantní onkologická léčba je zaměřena na možnou mikroskopickou reziduální chorobu. Rozsah použití adjuvantní léčby závisí na fenotypu nádoru a na klinickém stadiu nemoci. Standardně se ke zjištění fenotypu nádoru využívá stanovení statusu estrogenového (ER) a progesteronového (PR) receptoru a HER2. Dalšími parametry, které hrají roli v použití léčebných modalit u konkrétní pacientky, jsou histologický typ nádoru, grade (stupeň závažnosti) a hodnota proliferace – stanovení hodnoty proteinu Ki 67. I přes pokroky v onkologii především v poslední dekádě dochází u minimálně 20 % pacientek k recidivě onemocnění, které je i nadále nevyléčitelné. Snahou je tedy efektivní přípravky pro terapii metastatické fáze onemocnění použít i v úvodu léčby nemoci.
Kazuistika
Naše pacientka absolvovala pravidelně od 45 let mamární screening, poslední vyšetření proběhlo v září 2020 s negativním nálezem. Sama si náhodně v květnu 2021 ve věku 52 let nahmatala bulku v levém prsu. Při trvání nálezu po druhém samovyšetření za týden se objednala prostřednictvím praktického lékaře znovu na vyšetření prsů. Při opakovaně provedené mamografii byla popsána asymetrie obou prsů, ale bez evidentní ložiskové patologie. Vzhledem k palpačnímu nálezu byla mamografie doplněna o ultrazvukové vyšetření – s již patrnou tumorózní lézí velikosti 3,5 cm, v podpažní jamce byla popsána jedna zvětšená uzlina. Standardně byla provedena biopsie z prsu i z patologické uzliny z axily, v obou lokalitách byl nalezen invazivní lobulární karcinom stupně 2 s vysokou expresí hormonálních receptorů (HR), HER2 negativní.
S diagnózou karcinomu prsu byla pacientka odeslána na naše pracoviště, kde jsme doplnili stagingové vyšetření k vyloučení vzdálených metastáz. U pacientky bylo i přes pozitivní axilární nález indikováno primárně operační řešení v rozsahu radikální modifikované mastektomie. Nebyla indikována neoadjuvantní CHT, protože s ohledem na histologii a fenotyp nádoru se nedal očekávat tak výrazný downstaging nádoru, který by umožnil prs zachovávající operaci s redukcí rozsahu chirurgického výkonu i v axile. Pacientka tedy podstoupila operaci s nálezem invazivního lobulárního karcinomu velikosti 47 mm s 15 pozitivními metastatickými axilárními uzlinami z celkového počtu 20 odstraněných – cpT2N3aM0. Jednalo se o klinické stadium III, které je řazeno do skupiny vysokého rizika relapsu onemocnění. Indikována byla na základě luminálního fenotypu a klinického stadia III adjuvantní CHT na bázi antracyklinů a taxanů, dále adjuvantní HT a adjuvantní radioterapie. Z adjuvantní HT byl zvolen inhibitor aromatázy – anastrozol, s ohledem na míru rizika a histologický typ nádoru. Plánovaná délka podávání HT činí deset let. Radioterapie byla indikována na oblast hrudní stěny a regionální lymfatické drenáže. Dále jsme pacientce nabídli aplikaci kyseliny zoledronové s cílem dalšího snížení rizika relapsu onemocnění a s cílem minimalizovat pokles kostní denzity, jenž je jedním z možných nežádoucích účinků léčby anastrozolem. Pacientka absolvovala adjuvantní CHT v období od července 2021 do ledna 2022. Následně byla od února 2022 zahájena adjuvantní HT s anastrozolem.
S ohledem na vysoké riziko relapsu onemocnění a na výsledky klinické studie monarchE jsme nově indikovali také podávání abemaciklibu v dávce 150 mg dvakrát denně po dobu dvou let. Na základě klinických výsledků monarchE byl abemaciklib schválen Evropskou lékovou agenturou (EMA) v březnu 2022 s platností od 1. dubna 2022 pro podání u pacientů (žen i mužů) s časným HR+/HER2– karcinomem prsu s vysokým rizikem relapsu onemocnění. U naší pacientky jsme zahájili léčbu abemaciklibem hned v úvodu dubna 2022. Lék podáváme v dávce 150 mg dvakrát denně dosud. V prvních dvou měsících léčby jsou doporučeny kontroly laboratorních parametrů ve dvoutýdenních intervalech s cílem zajistit bezpečnost pacientek. Od třetího měsíce jsou možné kontroly jednou měsíčně. U naší pacientky jsme zaznamenali po dvoutýdenním užívání abemaciklibu v krevním obraze neutropenii stupně 1, průjem ani další nežádoucí účinky se nevyskytly. Ani při následujících kontrolách ve dvoutýdenních intervalech prvního a druhého cyklu podávání abemaciklibu nebyly zaznamenány jiné nežádoucí účinky, přetrvává pouze neutropenie prvního stupně. Pacientka toleruje terapii velmi dobře a v současné době pokračuje v léčbě kombinací HT (anastrozolu) s abemaciklibem bez redukce dávky.
Diskuse – výsledky klinických
hodnocení
Abemaciklib je řazen k cíleným
lékům do skupiny inhibitorů cyklin dependentní kinázy
4/6 (CDK 4/6). Jedná se o perorálně podávaný
přípravek, který je schválen v kombinaci s HT –
s inhibitory aromatáz nebo s fulvestrantem pro léčbu
metastatického HR+/HER2– karcinomu prsu. Na základě
předchozích výsledků sledování byl abemaciklib testován také
u pacientek s časným karcinomem prsu. Cílem
randomizované multicentrické otevřené klinické studie fáze III
monarchE bylo zhodnotit účinnost a bezpečnost přidání
abemaciklibu ke standardní adjuvantní HT u pacientek
s časným vysoce rizikovým hormonálně dependentním HER2
negativním karcinomem prsu [1]. Do studie byli zařazeni
pacienti (ženy i muži) s vysoce rizikovým karcinomem
prsu, kteří podstoupili operační výkon s radioterapií
a systémovou neoadjuvantní/adjuvantní CHT nebo bez ní.
Podání CHT nebylo podmínkou. Vysoké riziko bylo definováno
pozitivitou čtyř a více axilárních uzlin nebo postižením
1–3 axilárních uzlin při nádoru grade 3 nebo při
velikosti tumoru pět a více centimetrů. Pacienti léčení
adjuvantní HT byli randomizováni do ramene s léčbou
abemaciklibem (150 mg dvakrát denně) nebo bez ní. Léčba byla
podávána po dobu dvou let, následně pacienti pokračovali
v adjuvantní HT celkově po dobu 5–10 let.
Primárním cílovým ukazatelem bylo přežití bez invazivního
onemocnění (invasive disease free survival, iDFS), mezi sekundární
cílové ukazatele patřily přežití bez vzdáleného relapsu
(distant relaps free survival, DRFS), celkové přežití (overall
survival, OS) a výskyt nežádoucích účinků.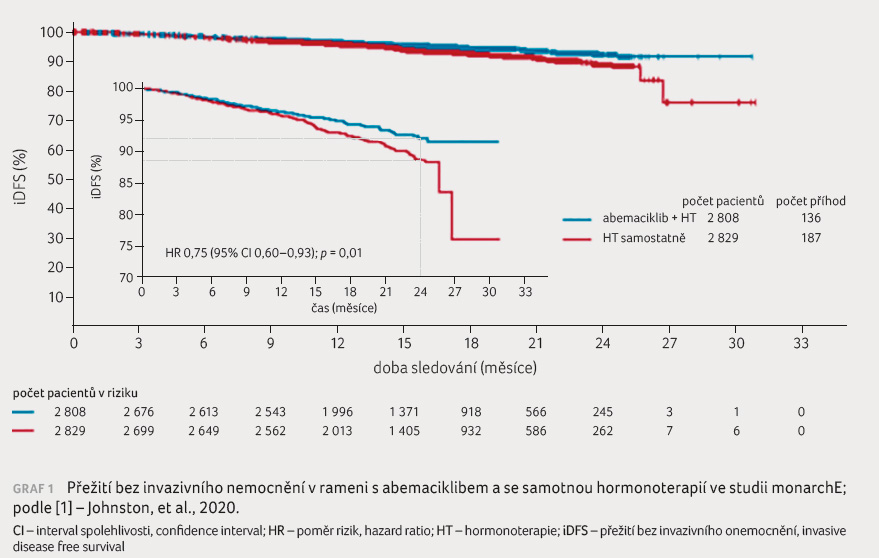
Zařazeno bylo 5 637 pacientů,
z toho 5 601 žen a 36 mužů. Medián věku byl 51
let; téměř 60 % pacientů patřilo do skupiny vysokého
rizika na základě pozitivity čtyř a více axilárních
uzlin. Adjuvantní CHT absolvovalo 95,4 % pacientů
a radioterapii 95,4 % pacientů. V rámci HT byl
u 68,3 % nemocných podáván inhibitor aromatázy
a u 31,4 % nemocných tamoxifen. Analýza byla provedena
při mediánu sledování 15,5 měsíce. V době analýzy bylo
zaznamenáno 323 událostí iDFS, z toho 136 (4,8 %)
ve skupině léčených abemaciklibem a 187 (6,6 %)
ve skupině se samotnou HT. Četnost dvouletého iDFS byla
92,2 % vs. 88,7 %. Přidání abemaciklibu ke standardní
adjuvantní HT vedlo ke statisticky signifikantnímu prodloužení
iDFS v porovnání se samotnou HT u pacientek s vysokým
rizikem recidivy onemocnění (graf 1). U většiny
relapsů onemocnění se jednalo o vzdálené metastázy.
Přidání abemaciklibu vedlo i k prodloužení DRFS
v porovnání se samotnou HT (poměr rizik [HR] 0,72; 95%
interval spolehlivosti [CI] 0,56–0,92; p = 0,01).
Výskyt dvouletého DRFS byl 93,6 % v rameni s abemaciklibem
oproti 90,3 % v rameni pouze s HT (graf 2).
Bezpečnost byla hodnocena u 5 591 pacientů. Úprava dávky
abemaciklibu byla nutná u 68,1 % osob. V důsledku
nežádoucích účinků byla terapie s abemaciklibem ukončena
u 16,6 % pacientů, HT u 0,8 % nemocných a u 6,2 %
pacientů došlo k ukončení léčby abemaciklibem i HT.
Nejméně jeden nežádoucí účinek byl zaznamenán u 97,9 %
nemocných. Nejčastěji se vyskytujícími nežádoucími účinky
v rameni s abemaciklibem byly průjem, neutropenie a únava,
v rameni se samotnou HT artralgie, návaly horka a únava.
Nežádoucí účinky stupně 3 a vyššího byly zaznamenány
u 45,9 % pacientů léčených kombinací abemaciklibu
a HT a u 12,9 % nemocných léčených HT [1].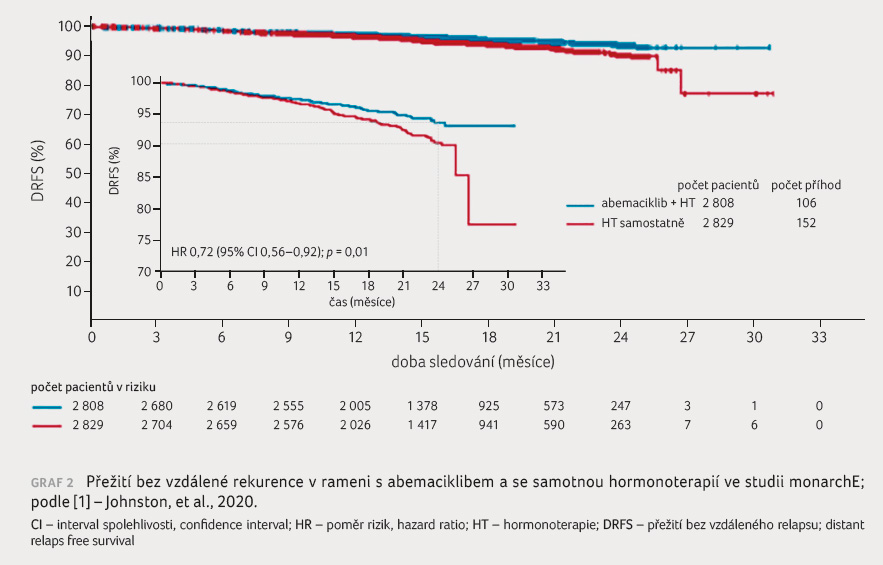
V říjnu loňského roku byla publikována druhá průběžná analýza při mediánu sledování 27,1 měsíce, kdy terapii s abemaciklibem dokončilo již 90 % pacientek. I v této analýze byl prokázán trvalý prospěch v parametru iDFS (HR 0,70; 95% CI 0,59–0,82; nominální p < 0,0001) a DRFS (HR 0,69; 95% CI 0,57–0,83; nominální p < 0,0001) [2]. Absolutní zlepšení ve tříletém iDFS a DRFS činí 5,4 % (abemaciklib + HT 88,8 % vs. HT 83,4 %) a 4,2 % (abemaciklib + HT 90,3 % vs. HT 86,1 %). Léčebný prospěch byl pozorován napříč definovanými podskupinami. Nejčastěji dochází k relapsu onemocnění v oblasti jater a skeletu. I nadále zůstávají nezralá data pro hodnocení celkového přežití.
Kombinace abemaciklibu s HT signifikantně redukuje v parametru iDFS riziko vzniku události o 36 % i u pacientek s vysokou hodnotou Ki 67 v kohortě 1. Dvouleté iDFS činilo 91,3 % u abemaciklibu + HT a 86,1 % u samotné HT, s absolutním zlepšením o 5,2 %. Podobný prospěch byl pozorován u abemaciklibu + HT v kohortě 1 s nízkou hodnotou Ki 67 – s 31% redukcí rizika v parametru iDFS a absolutním rozdílem ve dvouletém iDFS 2,8 % (94,8 % u abemaciklibu + HT a 92,0 % u HT samotné). V kontrolním rameni při tříletém iDFS měli pacienti s vysokou hodnotou Ki 67 vyšší riziko vzniku události v parametru iDFS ve srovnání s tumory s nízkou hodnotou Ki 67, což značí spíše prognostickou hodnotu Ki 67 [2].
Závěr
Na základě uvedených výsledků byl abemaciklib v kombinaci s HT (tamoxifenem nebo inhibitorem aromatázy) schválen EMA k použití v adjuvantním podání u pacientů s časným karcinomem prsu s vysokým rizikem relapsu onemocnění (≥ 4 pozitivní axilární uzliny nebo 1–3 pozitivní axilární uzliny s nádorem grade 3 nebo s velikostí tumoru pět a více centimetrů). Doufejme, že tato slibná data budou potvrzena i v dalších plánovaných průběžných analýzách. Nový lék do adjuvance časného HR+/HER2– karcinomu prsu byl schválen po více než 15 letech! Přidání abemaciklibu ke standardní adjuvantní HT zvyšuje pacientkám s časným HR+/HER2– karcinomem prsu šanci na vyléčení i ve skupině žen s vysokým rizikem relapsu onemocnění.
Seznam použité literatury
- [1] Johnston S, Harbeck N, Hegg R, et al. Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+ HER2– node‑positive, high risk, early breast cancer (monarchE). J Clin Oncol 2020; 38: 3987–3998.
- [2] Harbeck N, Rastogi P, Martin M, et al. Adjuvant abemaciclib combined with endocrine therapy for high‑risk early breast cancer: updated efficacy and ki‑67 analysis from the monarchE study. Ann Oncol 2021; 32: 1571–1581.