Kdy v praxi indikovat sarilumab?
Souhrn
Pavelka K. Kdy v praxi indikovat sarilumab? Remedia 2023; 33: 29–35.
Vysoký podíl pacientů s revmatoidní artritidou má systémové projevy onemocnění. Velmi často se u nemocných objevují únava, anémie, deprese, osteoporóza, plicní projevy a pacienti jsou ohroženi zvýšeným kardiovaskulárním rizikem. Za řadu z projevů je patogeneticky zodpovědný interleukin 6 (IL‑6), který se stal logicky předmětem cílené léčby RA. V první části sdělení autor podává přehled výsledků tzv. pivotálních studií s inhibitorem receptoru pro IL‑6 sarilumabem. Tento přípravek se osvědčil u celého spektra pacientů s RA tzv. metotrexát (MTX) naivních, MTX selhávajících a anti‑TNF selhávajících. Ve studii MONARCH prokázal sarilumab v monoterapii vyšší účinnost oproti adalimumabu. Ve druhé části článku autor uvádí výsledky hodnocení léčby sarilumabem v běžné klinické praxi v ČR v českém národním registru ATTRA, které doložily rychlý, robustní a přetrvávající klinický účinek. Ze subanalýzy pacientů vyplynulo, že prediktivním faktorem odpovědi je linie léčby, ve které byl sarilumab nasazen. Výsledky biologické léčby jsou ve třetí a vyšší linii horší než v linii první a druhé. Další analyzované prediktivní faktory odpovědi neměly na výsledky léčby signifikantní vliv. V závěrečné části je uvedena kazuistika pacienta úspěšně léčeného sarilumabem. Šlo o nemocného s dlouhotrvající aktivní RA a výraznými systémovými projevy. Léčba konvenčními syntetickými antirevmatickými léky u pacienta selhala, a navíc došlo k rozvoji hepatopatie. Efektu nebylo dosaženo při vynucené monoterapii biologiky (bDMARDs) ani při aplikaci tocilizumabu a cíle bylo dosaženo až při aplikaci sarilumabu. Vhodným pacientem pro léčbu sarilumabem může být nemocný s vysoce aktivní RA, s vysokými hodnotami reaktantů akutní fáze a se systémovými projevy onemocnění. Vhodné je časnější nasazení sarilumabu.
Klíčová slova: revmatoidní artritida – inhibitory IL‑6 – sarilumab.
Summary
Pavelka K. When should sarilumab be used in clinical practice? Remedia 2023; 33: 29–35.
High proportion of patients with rheumatoid arthritis (RA) suffers from systemic symptoms of this disease. These are very common and include fatigue, anemia, depression, osteoporosis, pulmonary symptoms, and elevated cardiovascular risk. Many of these traits are caused by interleukin 6 (IL‑6), which became – quite logically – the target of specific RA treatment. In the first part of his article, the author summarizes the results of pivotal trials with a IL‑6 receptor inhibitor sarilumab. This drug has proved to be effective in a wide range of RA patients – so called methotrexate (MTX)‑naïve, MTX‑failure, and anti‑TNF‑failure. In the MONARCH trial, sarilumab in monotherapy was found to be more effective than adalimumab. In the second part, the author comments on the results of sarilumab treatment in everyday clinical practice in the Czech Republic; the Czech National Registry ATTRA has proved its fast, lasting, and robust clinical effect. As shown by a sub‑analysis, the line of treatment in which sarilumab is initiated represents a predictive factor. The results of the third‑ or higher‑line biological therapy are worse than those of the first or second‑line treatment. Other analyzed predictive factors did not have any significant impact on the therapeutic effect. The final part is dedicated to a case study of a patient successfully treated with sarilumab. His RA was long‑standing and with marked systemic symptoms. Not only has the therapy with conventional synthetic antirheumatic drugs failed; he also developed hepatopathy. Forced monotherapy with biologics (bDMARDs) was ineffective, and so was tocilizumab application. Only sarilumab made the achievement of the therapeutic goal possible. Sarilumab treatment may be suitable for patients with highly‑active RA, pronounced elevation of acute phase reactants, and systemic disease symptoms. It is prudent not to postpone the sarilumab therapy more than necessary.
Key words: rheumatoid arthritis – IL‑6 inhibitors – sarilumab.
Revmatoidní artritida (RA) je chronické, progresivní, autoimunitní revmatické onemocnění, které postihuje až 1 % populace. RA způsobuje chronickou bolest, zhoršení funkce, vznik deformit a destrukcí kloubů, zhoršení řady aspektů kvality života a zkracuje život nemocných o 5–9 let.
Revmatoidní artritida je systémové onemocnění, nepostihuje pouze klouby, výskyt mimokloubních projevů je relativně častý. Mezi nejčastější systémové mimokloubní projevy patří únavnost (80 %), plicní projevy (60 %), anémie (33–60 %), osteoporóza (30 %), oční projevy (27 %), deprese (15 %) a kardiovaskulární projevy [1–7]. Přítomnost těchto mimokloubních příznaků je častou příčinou nedosažení cíle léčby, tzn. remise či stavu nízké aktivity nemoci. Příkladem může být přítomnost závažné únavy, která se vyskytuje až u 40 % pacientů s RA. U pacientů s RA únava výrazně ovlivňuje duševní i tělesné zdraví, kvalitu spánku, práceschopnost a je spojena se sníženou kvalitou života. Častým a dominantním příznakem RA, který významně zhoršuje kvalitu života a koreluje s výskytem deprese u nemocných s RA, je bolest. Několik experimentálních studií na potkanech ukazuje, že interleukin 6 (IL‑6) zaujímá v neuroendokrinní signalizaci centrální roli spojenou s bolestí a zánětem [8].
Pokud se jako revmatolog podívám zpětně na vývoj léčby RA v posledních 20 letech, musím vyjádřit určité uspokojení. Do konce 20. století byly dostupné pouze tzv. konvenční syntetické antirevmatické léky modifikující onemocnění (csDMARDs, conventional synthetic disease‑modifying antirheumatic drugs), z nichž nejčastěji používaným byl metotrexát (MTX). Dosažení remise či stavu nízké aktivity nemoci bylo nedostatečné, a to včetně léčby kombinací více csDMARDs. Navíc tolerance této léčby nebyla vždy optimální a řada pacientů terapii přerušovala. Pochopení patogeneze RA umožnilo identifikaci potenciálních cytokinů, receptorů či buněk účastnících se patogeneze zánětu a pokroky genetického inženýrství vedly ke vzniku biologických antirevmatických léků modifikujících onemocnění (bDMARDs) a později cílených syntetických léků (tsDMARDs, targeted synthetic disease‑modifying antirheumatic drugs). Tyto léky představují doslova revoluci v léčbě RA. Splňují podmínky dnes kladené na definici chorobu modifikujících léků: výrazně potlačují symptomy RA (bolest, ztuhlost, únavnost), zlepšují nebo udržují funkci, zlepšují kvalitu života a zpomalují až zastavují strukturální progresi RA [9]. Dnes, po 20 letech, máme poměrně široké armamentarium těchto léků: pět anti‑TNF přípravků, dva inhibitory receptoru pro IL‑6, jeden inhibitor kostimulace aktivace T lymfocytů, jeden inhibitor receptoru pro IL‑1 a jedno léčivo cílící na antigen CD20 na lymfocytech. Nově k těmto lékům přibyly čtyři blokátory signální transdukce působící intracelulárně, tzv. inhibitory Janus kináz (JAK) [10].
Kromě těchto nových léků však bylo důležité i zavedení nových strategií léčby. Velmi důležitá je časná, agresivní léčba. Časná léčba, tj. zavedení DMARD do tří měsíců od začátku symptomů, má výrazně vyšší šanci na dosažení remise než opožděné zahájení terapie. Velmi důležitou strategií je i koncept léčby k cíli (treat to target, T2T) [11].
I přes zavedení nových molekul a uplatnění nových strategií není u 10–30 % pacientů dosaženo cíle léčby a hovoří se o tzv. obtížně léčitelné RA (difficult to treat RA) [12]. I pro tyto pacienty navrhuje Evropská aliance revmatologických asociací (European Alliance of Associations for Rheumatology, EULAR) strategii léčby. Zároveň existence této podskupiny pacientů iniciuje další výzkum a hledání zcela nových DMARDs – účinnějších nebo ultimátně vedoucích k úplnému vyléčení RA. Takové přípravky ze skupiny DMARDs však zatím nejsou k dispozici. Pokračují ale snahy definovat pacienty, kteří by měli větší pravděpodobnost odpovědi na léčbu jednotlivými DMARDs, tedy postup ve smyslu individualizované medicíny. Dosavadní zkušenosti však ukazují, že určení optimálního léku ze skupiny bDMARDs pro každého pacienta bude složité a nebude zcela kopírovat situaci např. v některých onkologických indikacích.
Jednu skupinu bDMARDs zavedených do klinické praxe reprezentují inhibitory receptoru pro IL‑6, konkrétně tocilizumab, sarilumab a satralizumab. Kteří pacienti by mohli být vhodní pro léčbu těmito přípravky, je předmětem další části textu se zaměřením především na sarilumab.
Interleukin 6 v organismu
Interleukin 6 má u RA velký význam, což vyplývá z vysokých koncentrací IL‑6 zjištěných v séru nemocných s RA a ze zásadní role IL‑6 při indukci tvorby reaktantů akutní fáze [13]. Interleukin 6 je cytokin s mnohočetnými funkcemi a je produkován celou řadou buněk. Díky své pleomorfní charakteristice je IL‑6 zahrnut v mnoha základních procesech růstu a aktivace buněk, jako jsou embryonální vývoj, hematopoeza, kostní metabolismus, imunitní odpověď a zánět [14]. Imunologicky je IL‑6 důležitým faktorem regulace B buněk a je rovněž zapojen do aktivace T buněk. IL‑6 má pivotální roli při vzniku a přetrvávání zánětlivé reakce, včetně destrukce kloubů, aktivuje metaloproteinázy a osteoklasty a stimuluje sekreci reaktantů akutní fáze (obr. 1) [15–19]. Injekční podání IL‑6 na experimentálním modelu indukuje artritidu, zatímco organismy, většinou myši, s knockoutovaným genem jsou ke vzniku choroby rezistentní [14].![OBR. 1 Vliv interleukinu 6 na jednotlivé buněčné typy; podle [15–19] – Chomarat, et al., 2000; Choy, 2012; Castell, et al., 1988; Imai, et al., 1991; Scheller, et al., 2014. OBR. 1 Vliv interleukinu 6 na jednotlivé buněčné typy; podle [15–19] – Chomarat, et al., 2000; Choy, 2012; Castell, et al., 1988; Imai, et al., 1991; Scheller, et al., 2014.](https://www.remedia.cz/1-23-30-photo-pg-983-367-283-.png)
Léčiva blokující IL‑6
Při zvažování důležité úlohy IL‑6 v patogenezi RA se stal koncept blokování IL‑6 nebo receptoru pro IL‑6 atraktivním cílem nových biologických léků. V současné době jsou v České republice schváleny k běžnému klinickému užití tocilizumab, což je humanizovaná monoklonální protilátka proti receptoru IL‑6, a dále sarilumab – plně humánní IgG1 monoklonální protilátka, která se váže na solubilní i membránově vázaný receptor pro IL‑6α s vysokou afinitou. V různém stupni vývoje se pak nacházejí další látky blokující IL‑6 nebo jeho receptor, jako jsou sirukumab, olokizumab a clazakizumab [20]. Velký zájem o tento terapeutický princip vyvolal především úspěch prvního léku této skupiny – tocilizumabu, který je v současné době indikován pro léčbu pacientů s RA, u nichž selhala terapie MTX i anti‑TNF [21]. Výsledky klinických studií a data z registrů dokumentovaly významnou klinickou účinnost tocilizumabu a signifikantní zpomalení rentgenové progrese RA. Ve studii AMBITION byla monoterapie tocilizumabem účinnější než monoterapie MTX [22] a v přímém (head‑to‑head) srovnání oproti adalimumabu ve studii ADACTA rovněž [23]. Tocilizumab dále doložil účinnost na systémové projevy RA, jako jsou únava, anémie a amyloidóza [20]. Tento výrazný úspěch tocilizumabu inspiroval výzkumné týmy k syntéze nových monoklonálních protilátek cílících na IL‑6 a jeho receptor s vyšší afinitou.
Sarilumab
Sarilumab je plně humánní monoklonální protilátka IgG1, která se váže na solubilní i membránově vázaný receptor pro IL‑6 s vysokou (20× vyšší než u tocilizumabu) afinitou. Sarilumab interferuje s cis‑ i transsignální aktivační cestou IL‑6 [20]. Preklinická data ukázala výraznou na dávce závislou inhibici IL‑6 po aplikaci sarilumabu a garantovala oprávněnost provádění klinického zkoušení v plném rozsahu. Po potvrzení účinnosti ve fázi II klinického zkoušení pak následovala fáze III, která již obsahovala tzv. pivotální studie u širokého spektra nemocných s RA a posléze byla předložena k úspěšné registraci sarilumabu v celém světě (tab. 1).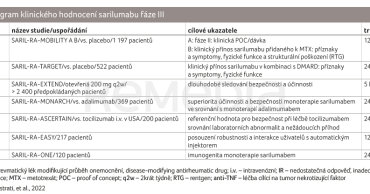
Studie MOBILITY sestávala z části A, která byla vedena jako fáze II a řešila mimo jiné vhodné dávkování, zatímco MOBILITY B byla zařazena do fáze III a řešila klinický přínos sarilumabu v kombinaci s MTX oproti MTX samotnému [24]. Studie měla tři větve: sarilumab podávaný v dávce 150 mg subkutánně (s.c.) každé dva týdny, sarilumab 200 mg s.c. každé dva týdny a kontrolní placebovou skupinu (monoterapie MTX). Ve studii byly zvoleny celkem tři primární cílové ukazatele a sarilumab v obou dávkách byl ve všech těchto třech cílových parametrech účinnější než placebo. Konkrétně se jednalo o odpověď ACR 20 (20% zlepšení dle American College of Rheumatology) v týdnu 24 (66,4 % vs. 58,0 % vs. 33,4 %), graf 1,![GRAF 1 Odpověď ACR 20 v týdnu 24 ve studii MOBILITY; podle [24] – Genovese, et al., 2015. GRAF 1 Odpověď ACR 20 v týdnu 24 ve studii MOBILITY; podle [24] – Genovese, et al., 2015.](https://www.remedia.cz/1-23-32b-photo-pg-968-367-412-.png) změnu skóre HAQ‑DI (Health Assessment Questionnaire‑Disability Index) v týdnu 16 (–0,55 vs. –0,53 vs. –0,29), graf 2, a změnu modifikovaného celkového Sharpova skóre rentgenové progrese s modifikací podle van der Heijde v týdnu 52 (mTSS 0,25 vs. 0,90 vs. 2,78), vše na hladině významnosti p < 0,0001. Sarilumab byl v obou dávkách oproti placebu také účinnější ve všech sekundárních ukazatelích účinnosti včetně např. navození remise nebo všech aspektů kvality života. Po skončení klinického hodnocení MOBILITY B byli pacienti zařazeni do studie EXTEND, což byla otevřená studie, ve které všichni pacienti dostávali sarilumab v kombinaci s MTX v dávce 200 mg denně do celkové doby tří let sledování [25].
změnu skóre HAQ‑DI (Health Assessment Questionnaire‑Disability Index) v týdnu 16 (–0,55 vs. –0,53 vs. –0,29), graf 2, a změnu modifikovaného celkového Sharpova skóre rentgenové progrese s modifikací podle van der Heijde v týdnu 52 (mTSS 0,25 vs. 0,90 vs. 2,78), vše na hladině významnosti p < 0,0001. Sarilumab byl v obou dávkách oproti placebu také účinnější ve všech sekundárních ukazatelích účinnosti včetně např. navození remise nebo všech aspektů kvality života. Po skončení klinického hodnocení MOBILITY B byli pacienti zařazeni do studie EXTEND, což byla otevřená studie, ve které všichni pacienti dostávali sarilumab v kombinaci s MTX v dávce 200 mg denně do celkové doby tří let sledování [25].![GRAF 2 Změna skóre HAQ-DI v týdnu 16 ve studii MOBILITY; podle [24] – Genovese, et al., 2015. GRAF 2 Změna skóre HAQ-DI v týdnu 16 ve studii MOBILITY; podle [24] – Genovese, et al., 2015.](https://www.remedia.cz/1-23-33-photo-pg-969-367-449-.png)
TARGET byla randomizovaná, placem kontrolovaná studie u pacientů s nedostatečným efektem léčby csDMARD, kteří již byli v minulosti léčeni minimálně jedním bDMARD [26]. Ve studii byly zvoleny dva primární cílové ukazatele: odpověď ACR 20 v týdnu 24 a změna skóre HAQ‑DI v týdnu 12. Pacienti byli randomizováni do skupin sarilumab 200 mg + csDMARD, sarilumab 150 mg + csDMARD a placebo + csDMARD. Sarilumab byl v obou dávkách účinnější než placebo, konkrétně v ukazateli ACR 20 v týdnu 24 (60,9 % vs. 55,8 % vs. 33,7 %) a v ukazateli změna HAQ‑DI v týdnu 12 (–0,47 vs. –0,46 vs. –0,26). Sarilumab prokázal v obou dávkách vyšší účinnost než placebo i ve všech sekundárních cílových ukazatelích (odpovědi ACR 50 [50% zlepšení dle ACR] v týdnu 24, ACR 70 [70% zlepšení] v týdnu 24, remise DAS 28 CRP [Disease Activity Score pro 28 kloubů s hodnotou C‑reaktivního proteinu] a DAS 28 FW [Disease Activity Score pro 28 kloubů se sedimentací], CDAI [Clinical Disease Activity Index]).
MONARCH byla randomizovaná, kontrolovaná studie hodnotící sarilumab v monoterapii oproti adalimumabu [27]. Do studie byli zařazeni pacienti s nedostatečnou odpovědí na MTX nebo s nesnášenlivostí této léčby. Pacienti byli randomizováni do větve se sarilumabem podávaným v dávce 200 mg s.c. každé dva týdny a do větve s adalimumabem 40 mg aplikovaným každé dva týdny. První dvojitě zaslepená fáze studie trvala 24 týdnů a následovala otevřená fáze. Primárním cílovým ukazatelem byla změna skóre aktivity nemoci využívající rychlosti sedimentace erytrocytů (DAS 28‑ESR) do týdne 24. Primárního cíle bylo dosaženo, změna DAS 28‑ESR byla signifikantně vyšší při podávání sarilumabu než adalimumabu (–3,28 vs. –2,20, p < 0,0001), graf 3. Sarilumab byl také ve srovnání s adalimumabem signifikantně účinnější ve všech sekundárních cílových ukazatelích (DAS 28‑ESR Remission, ACR 20/50/70, průměrná změna HAQ‑DI, obě komponenty [fyzická i mentální] SF‑36 [Short Form 36 Health Survey] a skóre FACIT‑F [Functional Assessment of Chronic Illness Therapy‑Fatigue]).![GRAF 3 Vývoj skóre DAS 28-ESR ve studii MONARCH; podle [27] – Burmester, et al., 2017. GRAF 3 Vývoj skóre DAS 28-ESR ve studii MONARCH; podle [27] – Burmester, et al., 2017.](https://www.remedia.cz/1-23-33b-photo-pg-970-367-255-.png)
Zkušenosti s aplikací sarilumabu v běžné klinické praxi
V ČR jsou bDMARDs podávány v centrech biologické léčby a všichni pacienti jsou zavedeni do českého národního registru ATTRA. Ten byl založen v roce 2001 a v současné době soustřeďuje údaje o léčbě RA u 7 000 pacientů. Vyhodnocení účinnosti, bezpečnosti a setrvání na léčbě sarilumabem mohlo být provedeno na konci roku 2021 u 243 pacientů. Průměrná hodnota DAS 28 před léčbou sarilumabem byla 5,3 ± 1,6 a během 24 měsíců léčby poklesla na 2,5 ± 1,5. Stavu remise bylo dosaženo po dvou letech u 57,1 % pacientů a stavu nízké aktivity nemoci u 71,4 % pacientů. Setrvání na léčbě po dvou letech terapie dosahovalo 67,2 %, došlo k výraznému zlepšení všech komponent kvality života při hodnocení dotazníkem SF‑36. Velmi cenné výsledky přinesla subanalýza, která se zabývala faktory na začátku léčby, jež ovlivňují její výsledek. Bylo prokázáno, že sarilumab je účinnější, pokud je podán v první nebo druhé linii biologické léčby než v linii třetí a vyšší (p < 0,002). Naopak se neprokázal vliv pohlaví, pozitivity revmatoidního faktoru (RF), protilátek proti cyklickým citrulinovaným peptidům (anti‑CCP) ani komedikace s MTX.
Bezpečnost sarilumabu
Ve studii MOBILITY byly jako nejčastější nežádoucí účinky uváděny infekce, neutropenie a jaterní toxicita. Všechny nežádoucí účinky byly mírné intenzity a závislé na dávce. Incidence závažných infekcí byla obdobná jako ve studiích s tocilizumabem. Nebyly zjištěny žádné případy tuberkulózy, lymfomů nebo perforací gastrointestinálního traktu. Ve studii TARGET byl sarilumab všeobecně dobře tolerován. Nejčastějšími nežádoucími účinky zde byly infekce, ale žádné případy oportunních infekcí nebo tuberkulózy. Ve studii MONARCH byla tolerance sarilumabu a adalimumabu obdobná (nežádoucí účinky: sarilumab – 64,1 %, adalimumab – 63,1 %; závažné nežádoucí účinky: sarilumab – 4,9 %, adalimumab – 6,5 %). Změny profilu sérových lipidů byly ve větvi léčené adalimumabem častější než ve skupině léčené sarilumabem (4,3 % vs. 1,6 %). Ve spojené analýze bezpečnosti studií MOBILITY a TARGET se závažné nežádoucí účinky vyskytovaly především ve věkové skupině nad 65 let [28]. U většiny pacientů s laboratorními abnormalitami ve smyslu neutropenií při absenci infekce, při trombocytopenii při absenci krvácení a zvýšení aktivity transamináz (3,5–5×) bylo možno po snížení dávky z 200 mg na 150 mg sarilumabu pokračovat v léčbě. Dále byly bezpečnost a snášenlivost sarilumabu srovnávány oproti tocilizumabu ve studiii ASCERTAIN [29]. Snášenlivost sarilumabu byla obdobná jako u tocilizumabu s laboratorními změnami podobnými pro léky blokující IL‑6.
Shrnutí bezpečnosti inhibitorů IL‑6 publikovala skupina akademiků v roce 2022 [28]. Většina získaných dat pochází ze studií s tocilizumabem, ale protože bylo prokázáno, že bezpečnostní profil inhibitorů IL‑6 je identický, lze získané údaje extrapolovat i na sarilumab. Výskyt závažných bakteriálních infekcí je při léčbě inhibitory IL‑6 zvýšen asi dvakrát oproti placebu, ale frekvence výskytu je stejná jako u jiných bDMARDs. Pozor na riziko zpoždění v diagnóze, protože inhibitory IL‑6 snižují hodnoty CRP. Při léčbě se zvyšuje riziko gastrointestinální perforace, přičemž rizikovými faktory jsou anamnéza divertikulitidy, vyšší věk a současné používání glukokortikoidů a nesteroidních antirevmatik. Z laboratorních ukazatelů je nutno upozornit na neutropenie, trombocytopenie, elevace hodnot transamináz. U části pacientů dochází ke zvýšení sérových koncentrací lipidů. Studie ENTRACTE však nepotvrdila vyšší kardiovaskulární riziko při aplikaci tocilizumabu oproti etanerceptu [29]. Obdobná studie se sarilumabem probíhá. Dostupná data zvýšené kardiovaskulární riziko při podávání sarilumabu nesignalizují.
Doporučený screening před léčbou inhibitory IL‑6 zahrnuje: anamnézu a fyzikální vyšetření, rutinní laboratorní testování včetně hodnot lipidů, testování na hepatitidu B a C, screening na tuberkulózu a vyhodnocení potřeby očkování podle lokálních doporučení.
Jaký pacient je vhodný pro léčbu sarilumabem?
Kritéria pro zahájení léčby
Kritéria pro indikaci a úhradu bDMARDs se mohou v jednotlivých zemích lišit. Kritéria pro zahájení léčby v ČR představují selhání léčby alespoň jedním csDMARD (většinou MTX) a aktivita RA vyšší než 3,2 DAS 28. Toto platí pro bDMARD v první linii. Sarilumab je v ČR hrazen ve druhé linii, kdy už by u pacienta mělo dojít k prokazatelnému selhání léčby alespoň jedním bDMARD. Pokud je léčba anti‑TNF nevhodná, je možné aplikovat sarilumab již v první linii, ale je nutné požádat o úhradu podle paragrafu 16. Sarilumab byl účinný jak u pacientů anti‑TNF naivních [24], tak u pacientů, u nichž anti‑TNF léčba selhala [26].
Pacient na monoterapii
Léčba DMARD je účinnější v kombinaci s MTX než v monoterapii. Nicméně data z registrů ukazují, že až 30 % pacientů je podávána monoterapie bDMARD, protože csDMARDs tito nemocní netolerují nebo si je nepřejí užívat. Sarilumab a tocilizumab prokázaly větší účinnost v monoterapii než adalimumab [15]. Při aplikaci vynucené monoterapie bDMARD doporučuje EULAR inhibitory IL‑6 nebo inhibitory JAK [30].
Pacient s vysokou aktivitou nemoci, vysokým CRP a systémovými projevy
Sarilumab velmi účinně potlačuje zánětlivou aktivitu a zejména snižuje hodnotu CRP. Kromě toho velmi silně potlačuje systémové projevy RA, jako jsou únavnost, bolest, zhoršení funkce. Údaje z registru svědčí o tom, že větší šance na dosažení odpovědi má časnější aplikace sarilumabu v první či druhé linii biologické léčby než v liniích vyšších, tzn. po selhání dvou a více anti‑TNF léčiv.
Která aplikační forma inhibitoru IL‑6 je vhodná?
V klinické praxi v ČR jsou dostupné pro léčbu dva inhibitory IL‑6, a to konkrétně tocilizumab a sarilumab. Při subkutánní formě podání je frekvence aplikace u sarilumabu v důsledku vyšší afinity a delšího biologického poločasu dva týdny a u tocilizumabu jeden týden. Nižší frekvence s.c. aplikace může být komparativní výhodou sarilumabu. Lokální snášenlivost obou inhibitorů IL‑6 se jeví jako obdobná.
Kazuistika
Pacientka, ročník 1967, v osobní anamnéze výrazná polymorbidita: ischemická choroba srdeční (ICHS; STEMI), od té doby léčena duální antikoagulační terapií; arteriální hypertenze, dyslipidemie, organická depresivní porucha, polyneuropatie, sideropenická anémie.
Revmatoidní artritida od roku 2007, RF a anti‑CCP pozitivní. Aktuálně rentgenologicky II. st., funkčně střední postižení (HAQ 1,2), léčena v Revmatologickém ústavu Praze, opakovaně hospitalizována (v letech 2007–2021 celkem 10×).
Přehled terapie:
- 2006 – sulfasalazin – bez efektu;
- 2006–2009 – MTX – pouze nízké dávky, vyšší dávky pacientka netolerovala (padání vlasů);
- 2015–2016 – leflunomid – bez efektu, hepatopatie;
- 2004 až dodnes – glukokortikoidy.
Biologická léčba:
- květen až říjen 2016 – adalimumab – bez efektu;
- říjen 2016 až květen 2017 – tofacitinib – bez efektu;
- 2017 etanercept – nedostatečný efekt;
- 2018/2019 abatacept – nedostatetčný efekt, špatná tolerance;
- od března 2019 do současnosti – terapie sarilumabem.
Vyšetření před zahájením léčby sarilumabem: výrazná polyartritida (10 oteklých kloubů), FW [sedimentace erytrocytů] – 80 mm/h, CRP 94 mg/l, hemoglobin (Hb) – 113 g/l, DAS 28 – 6,8.
Podávání sarilumabu v dávce 200 mg s.c. zahájeno v monoterapii 28. března 2019.
Při poslední kontrole – v říjnu 2022 – aktivita nemoci nízká, DAS 28 0,91 (remise), CRP 0,46 mg/l, Hb 155 g/l, žádné oteklé klouby.
Jednalo se tedy o pacientku s dlouhotrvající a postupně progredující RA s výraznými komorbiditami (anémie, ICHS, deprese). Léčba csDMARD u nemocné selhala, navíc došlo k rozvoji hepatopatie. Doloženo bylo vícečetné selhání léčby bDMARDs, při léčbě sarilumabem doposud v remisi.
Vhodným pacientem pro léčbu sarilumabem tedy může být nemocný s vysoce aktivní RA, s vysokými hodnotami reaktantů akutní fáze a systémovými projevy onemocnění. Žádoucí je časnější zahájení léčby sarilumabem.
Literatura
[1] Pollard LC, Choy EH, Gonzalez J, et al. Fatigue in rheumatoid arthritis reflects pain, not disease activity. Rheumatology (Oxford) 2006; 45: 885–889.
[2] Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis‑associated lung disease. Eur Respir Rev 2015; 24: 1–16.
[3] Wilson A, Yu HT, Goodnough LT, Nissenson AR. Prevalence and outcomes of anemia in rheumatoid arthritis: a systematic review of the literature. Am J Med 2004; 116(Suppl 7A): 50S–57S.
[4] Prete M, Racanelli V, Digiglio L, et al. Extra‑articular manifestations of rheumatoid arthritis: An update. Autoimmun Rev 2011; 11: 123–131.
[5] Hauser B, Riches PL, Wilson JF, et al. Prevalence and clinical prediction of osteoporosis in a contemporary cohort of patients with rheumatoid arthritis. Rheumatology (Oxford) 2014; 53: 1759–1766.
[6] Dougados M, Soubrier M, Antunez A, et al. Prevalence of comorbidities in rheumatoid arthritis and evaluation of their monitoring: results of an international, cross‑sectional study (COMORA). Ann Rheum Dis 2014; 73: 62–68.
[7] Van Halm VP, Peters MJL, Voskuyl AE, et al. Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross‑sectional study, the CARRE Investigation. Ann Rheum Dis 2009; 68: 1395–1400.
[8] Mc Innes IB, Buckley CD, Isaacs JD. Cytokines in rheumatoid arthritis – shapping the immunological landscape. Nat Rev Rheumatol 2016; 12: 63–68.
[9] Smolen J, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet 2016; 388: 2023–2038.
[10] Kastrati K, Aletaha D, Burmester GR, et al. A systematic literature review informing the consensus statement on efficacy and safety of pharmacological treatment with interleukin‑6 pathway inhibition with biological DMARD in immune‑mediated inflammatory diseases. RMD Open 2022; 8: e002359.
[11] Smolen J, Breedveld FC, Burmester GR, et al. Treating rheumatoid arthritis to target. 2014 update of the reccommendations of international task force. Ann Rheum Dis 2016; 75: 3–15.
[12] Nagy G, Roodenrijs NMT, Welsing PMJ, et al. EULAR points to consider for the management of difficult‑to‑treat rheumatoid arthritis. Ann Rheum Dis 2022; 81: 20–33.
[13] Hunter CA, Jones SA. IL‑6 as a key cytokine in health and disease. Nat Immunol 2015; 16: 448–457.
[14] Fonseca JE, Santos MJ, Canhao H, Choy E. Interleukin 6 as a key player in systemic inflammation and joint destruction. Autoimune Rev 2009; 8: 538–542.
[15] Chomarat P, Banechereau J, Davoust J, Palucka AK. IL‑6 switches the differentiation of monocytes from dendritic cells to macrophages. Nat Immunol 2000; 1: 510–514.
[16] Choy E. Understanding the dynamics: pathways involved in the pathogenesis of rheumatoid arthritis. Rheumatology (Oxford) 2012; 51(Suppl 5): v3–11.
[17] Castell JV, Gómez‑Lechón MJ, David M, et al. Recombinant human interleukin‑6 (IL‑6/BSF‑2/HSF) regulates the synthesis of acute phase proteins in human hepatocytes. FEBS Lett 1988; 232: 347–350.
[18] Imai T, Koike K, Kubo T, et al. Interleukin‑6 supports human megakaryocytic proliferation and differentiation in vitro. Blood 1991; 78: 1969–1974.
[19] Scheller J, Garbers C, Rose‑John S, et al. Interleukin‑6: from basic biology to selective blockade of pro‑inflammatory activities. Semin Immunol 2014; 26: 2–12.
[20] Raimondo MG, Biggioggero M, Crotti C, et al. Profile of sarfilumab and its potential in the treatment of rheumatoid arthritis. Drug Des Devel Ther 2017; 11: 1593–1603.
[21] Smolen J, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological DMARD: 2013 update. Ann Rheum Dis 2014; 73: 492–509.
[22] Jones G, Sebba A, Gu J, et al. Comparison of tocilizumab monotherapy verus MTX monotharapy in patients with moderate to severe RA in AMBITION study. Ann Rheum Dis 2009; 69: 88–96.
[23] Gabay C, Emery P, vanVollenhofen R, et al.; ADACTA study investigators. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of RA: a randomised, double blind, controlled phase 4 trial. Lancet 2013; 381: 1541–1550.
[24] Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to MTX: results from phase III study. Arthritis Rheumatol 2015; 67: 1424–1437.
[25] Emery P, Rondon J, Parrino J, et al. Safety and tolerability of subcutaneous sarilumab and intravenous tocilizumab in patients with rheumatoid arthritis. Rheumatology 2019: 58: 849–858.
[26] Fleischmann RM, van Adelsberg J, Lin Y, et al. Sarilumab and nonbiologic disease‑modifying antirheumatic drugs in patients with active DMARD in patients with active rheumatoid arthritis and inadequate response or intolerance to tumor necrosis factor inhibitors. Arthritis Rheumatol 2017; 69: 277–290.
[27] Burmester GR, Lin Y, Patel R, et al. Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double‑blind, parallel‑group phase III trial. Ann Rheum Dis 2017; 76: 840–847.
[28] Aletaha D, Kerschbaumer A, Kastrati K, et al. Consensus statement on blocking interleukin‑6 receptor and interleukin 6 in inflammatory conditions: an update. Ann Rheum Dis 2022; doi: 10.1136/ard‑2022‑222784.
[29] Giles JT, Sattar N, Gabriel S, et al. Cardiovascular safety of tocilizumab verus etanercept in rheumatoid arthritis patients: A randomised controlled trial. Arthritis Rheumatol 2020; 72: 31–40.
[30] Smolen JS, Landewé RBM, Bijlsma JWJ, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease – modifying antirheumatic drugs: 2019 update. Ann Rheum Dis 2020; 79: 685–699.