Klinické zkušenosti s léčbou pacientů v sekundárně progresivní fázi roztroušené sklerózy
Souhrn
Stolaříková K. Klinické zkušenosti s léčbou pacientů v sekundárně progresivní fázi roztroušené sklerózy. Remedia 2023; 33: 376–380.
Siponimod (Mayzent) je v současné době jediným schváleným léčivým přípravkem pro farmakoterapii sekundárně progresivní fáze roztroušené sklerózy. Mechanismus účinku spočívá v modulaci sfingosin‑1‑fosfátových (S1P) receptorů a díky S1PR1 a S1PR5 specificitě má minimální účinky na kardiovaskulární systém. Pro optimální terapeutický efekt je nutné léčbu siponimodem zahájit co nejdříve, nejlépe již ve fázi vyhasínání zánětlivé aktivity a přechodu z relabující‑remitující formy do sekundární progrese. Před jeho nasazením není nutné projít eskalační terapií, tato léčba je vhodná i pro pacienty užívající přípravky první linie, jako jsou interferony, glatiramer acetát, teriflunomid a ponesimod.
Klíčová slova: siponimod – roztroušená skleróza – sekundární progrese.
Summary
Stolarikova K. Clinical experience concerning the treatment of patients in the secondary progressive phase of multiple sclerosis. Remedia 2023; 33: 376–380.
Siponimod (Mayzent) is currently that only drug approved for the treatment of the secondary progressive phase of multiple sclerosis. Its mechanism of action is related to the modulation of sphingosine‑1‑phosphate (S1P) receptors and, thanks to the S1PR1 a S1PR5 specificity, its cardiovascular side‑effects are minimal. In order to achieve its optimal therapeutic effect, the treatment with siponimod has to be initiated as early as possible, ideally when the inflammatory activity subsides and the relapsing‑remitting phase transforms into the secondary progression. There is no need to undergo an escalation therapy before starting siponimod. This drug can be offered to patients treated with first‑line therapies like interferons, glatiramer acetate, teriflunomide or ponesimod.
Key words: siponimod – multiple sclerosis – secondary progression.
Úvod
Roztroušená skleróza (RS) je poměrně časté chronické autoimunitní onemocnění centrálního nervového systému s heterogenním klinickým obrazem charakterizované vícečetnými zánětlivými ložisky demyelinizace (a remyelinizace), axonální ztrátou a mozkovou atrofií [1,2]. Onemocnění je nejčastěji diagnostikováno ve věku mezi 20. a 30. rokem a významně se podílí na invaliditě mladých dospělých. Prevalence v České republice je v současnosti okolo 200/100 000 [3]. Celosvětově RS postihuje téměř tři miliony osob a negativně ovlivňuje kvalitu jejich života [3,4].
Průběh onemocnění a jeho tíže jsou značně individuální a pokrývají celou škálu od celoživotně asymptomatických pacientů až po fulminantní varianty. Nejčastěji (až v 85 %) se setkáváme s relabující‑remitující formou roztroušené sklerózy (RR‑RS), která je typická rekurentními relapsy a remisemi neurologických příznaků. V průběhu 10-20 let zhruba dvě třetiny neléčených pacientů přecházejí do tzv. sekundárně progresivní roztroušené sklerózy (SP‑RS), která se projevuje postupným zhoršováním neurologických obtíží, progresí disability, poklesem mnestických funkcí a vymizením relapsů [1-5]. Pouze asi u 30 % pacientů zaznamenáme relaps po diagnostikování sekundárně progresivní formy [2].
Roztroušená skleróza je onemocnění zatím nevyléčitelné, nicméně pomocí moderních přípravků se nám daří progresi výrazně zpomalit. V České republice se začalo léčit v roce 1996 interferonem beta‑1b a od té doby přicházejí na trh stále účinnější léčivé přípravky. Přesto stále existuje významné množství pacientů, kteří jsou dlouhodobě stabilní na prvoliniové léčbě, a i přes výrazný diskomfort spojený s injekční aplikací léčiv na této terapii setrvávají. V naší praxi pozorujeme, že se tak ve většině případů děje kvůli jejich vlastním obavám ze změny zavedené léčby, a i patřičnou edukací je těžké tyto pochybnosti rozptýlit.
Cílená, chorobu modifikující léčba (disease‑modifying therapy, DMT) byla ovšem dlouhou dobu vyhrazena pouze pro pacienty s diagnózou RR‑RS. Situace se změnila až v roce 2021, kdy byla schválena úhrada siponimodu (Mayzent®) pro pacienty se SP‑RS. Do té doby byli pacienti v sekundární progresi dlouhodobě léčeni nízkými dávkami perorálních kortikosteroidů nebo cytostatiky (azatioprinem či pulzy cyklofosfamidu). Tato terapie, ač u některých pacientů dostatečně účinná, s sebou nesla výrazná rizika výskytu nežádoucích účinků. Definice SP‑RS nebyla dlouho jasně daná, a pacienti proto nezřídka zůstávali i přes pozvolné horšení stavu na terapii první linie. Někteří navíc sami příznaky sekundární progrese popírali z obavy z odnětí léčby. Kromě toho, že byli pacienti exponováni neúčinné terapii a jejím nežádoucím účinkům, měl tento postup dopady i v jiných oblastech, např. neudělení invalidního důchodu kvůli nepřiznané nesoběstačnosti či neproplácení potřebných ortopedických pomůcek zdravotní pojišťovnou (hole, invalidní vozíky). Jak neurologové, tak pacienti z těchto důvodů velmi uvítali schválení siponimodu v terapii SP‑RS.
Siponimod – mechanismus účinku
Sfingosin‑1‑fosfát (S1P) je lipidová signální molekula hrající důležitou roli zejména v imunitní odpovědi, kardiovaskulárním systému a také v CNS. S1P účinkuje prostřednictvím pěti receptorů spřažených s G proteiny, které označujeme jako S1PR1-5. Tyto receptory jsou v různých tkáních rozdílně zastoupeny. S1P se uplatňuje např. v migraci lymfocytů, vaskulární homeostáze, aktivaci mikroglií, neuronálních interakcích, axonálním růstu, přežívání oligodendrocytů, myelinizaci axonů a celistvosti hematoencefalické bariéry [6,7]. Role S1P v etiopatogenezi RS se dostala do širšího povědomí s příchodem prvního modulátoru S1PR fingolimodu. Fingolimod (na trh uveden pod obchodním názvem Gilenya) je nicméně neselektivním funkčním antagonistou S1PR1,3,4,5, je spojen s vyšším rizikem vzniku nežádoucích účinků, zejména bradykardie, blokády síňokomorového převodu a makulárního edému. Za působení na kardiovaskulární systém je zodpovědný zejména receptor S1PR3 [6,8]. Naproti tomu siponimod je S1PR3 šetřící S1PR modulátor, efekt na kardiovaskulární systém tedy není tak výrazný [9]. Naopak moduluje zejména receptory S1PR1 a S1PR5, které jsou exprimovány na astrocytech a oligodendrocytech, a ovlivňuje tak obnovu myelinu. Omezuje také migraci lymfocytů z lymfatických uzlin [10-12].
U zdravých dobrovolníků došlo po podání siponimodu k redukci počtu CD4+ T lymfocytů, naivních T lymfocytů i B lymfocytů v periferní krvi díky jejich reverzibilní sekvestraci v lymfatických tkáních. Maximální redukce počtu lymfocytů bylo dosaženo za 28 dní léčby, hodnoty se normalizovaly během deseti dnů od přerušení užívání siponimodu. Reziduální efekt však může přetrvávat ještě 3-4 týdny [13].
Siponimod lehce přechází přes hematoencefalickou bariéru a může být detekován v mozkomíšním moku. Z větší části je metabolizován cytochromem P450 2C9 (CYP2C9), který vykazuje genový polymorfismus a jeho genotyp ovlivňuje metabolismus a eliminaci siponimodu [13]. Takzvaní pomalí metabolizátoři, tj. zdraví dobrovolníci s genotypem CYP2C9*2*3 a CYP2C9*3*3, jsou vystaveni při stejném dávkování dvou‑ až čtyřnásobně vyšším plazmatickým koncentracím siponimodu než tzv. rychlí metabolizátoři s genotypem CYP2C9*1*1. Proto je nutné před nasazením siponimodu u každého pacienta vyšetřit genotyp CYP2C9 [13]. Pacienti s genotypem CYP2C9*3*3 nesmějí siponimod užívat, u genotypů CYP2C9*2*3 nebo *1*3 je doporučována udržovací dávka 1 mg (na rozdíl od standardní dávky 2 mg denně) [13]. Užívání siponimodu je zahajováno pětidenním pozvolným navyšováním dávky od 0,25 mg až do 2 mg. K tomuto účelu slouží tzv. titrační balení, které pacienty začátkem léčby bezpečně provede. Následně se přechází na terapeutickou dávku.
Siponimod je kontraindikován u pacientů s imunodeficitem či anamnézou kryptokokové meningitidy nebo progresivní multifokální leukoencefalopatie. U pacientů s anamnézou sinusové bradykardie, AV blokády, myokarditidy či srdečního selhání musí být po prvním podání siponimodu šest hodin monitorován srdeční rytmus. U pacientů bez kardiologické anamnézy není monitorace nutná. Léčba siponimodem není provázena rizikem prodloužení QT intervalu a nebyl zaznamenán arytmogenní potenciál [13].
Z nežádoucích účinků byly ve studii EXPAND zaznamenány nejčastěji mírné obtíže – cefalea, hypertenze, vertiginozita, nauzea, průjem či elevace hodnot alaninaminotransferázy. Oproti kontrolní skupině užívající placebo byl u dobrovolníků na siponimodu signifikantně vyšší výskyt hypertenze a elevace hodnot jaterních enzymů, naopak výskyt bradykardií či makulárního edému byl zaznamenán vzácně. Nebylo prokázáno zvýšené riziko rozvoje malignit [13].
Klinické zkušenosti
Ve zlínském RS centru léčíme siponimodem 13 pacientů, z toho pouze jedna pacientka užívá sníženou dávku 1 mg denně. Pro čtyři pacienty je siponimod první nasazenou DMT, pět pacientů přešlo na siponimod z přípravků první linie léčby (interferony, glatiramer acetát, teriflunomid), čtyři pacienti byli převedeni z eskalační terapie (fingolimod, dimetylfumarát, natalizumab). Následující kazuistiky popisují případy pacientek, které přešly na siponimod přímo z první linie léčby.
Kazuistika 1
Nejmladší pacientce je aktuálně 48 let. Na naše pracoviště přešla z RS centra Brno, kde byla sledována od roku 1995. Léčena byla glatiramer acetátem od roku 2005, se vstupní hodnotou na škále EDSS (Expanded Disability Status Scale) 2,5. V průběhu let prodělala dvě lehké senzitivní ataky. Do naší péče se dostala v roce 2014, s glatiramer acetátem byla spokojena. V objektivním nálezu dominoval motorický deficit – triparéza s převahou postižení pravostranných končetin, lehká cerebelární symptomatika, depresivní porucha. V průběhu let stav mírně progredoval, přidávaly se sfinkterové obtíže, poruchy čití, kmenové příznaky (nystagmus). V dubnu 2021 a únoru 2022 proběhly dva lehké relapsy, které jsme přeléčili kortikosteroidy. Pacientka referovala zhoršení paměti a chůze, ujde okolo 500 metrů. Obtěžuje ji výrazná únava. Sama udává, že se obtíže zvolna horší. Vyšetření mozku magnetickou rezonancí (MR) prokázalo stacionární nález. V květnu 2022 byla u pacientky zahájena léčba siponimodem. Hodnota na EDSS je v současné době 4,5, nemocná je s léčbou spokojena, její stav se stabilizoval.
Kazuistika 2
Druhé pacientce je 50 let. Roztroušená skleróza jí byla diagnostikována ve 20 letech a projevila se monoparézou pravé dolní končetiny. Ve 34 letech byla zahájena terapie glatiramer acetátem, lehké relapsy prodělala v letech 2016 a 2021. To už choroba postoupila do obrazu spastické paraparézy dolních končetin, stav je navíc komplikován posttraumatickou parézou n. peroneus se svalovou hypotrofií m. tibialis anterior. Pacientka potřebuje francouzské hole a dlouhodobý vadný chůzový stereotyp jí způsobil bolesti páteře. Na MR mozku a krční míchy v roce 2022 byla popsána progrese počtu i velikosti demyelinizačních ložisek supratentoriálně, v zadní jámě i prodloužené míše. Vícečetná ložiska byla popsána v krční a horní hrudní míše, bez postkontrastního enhancementu. Pacientka tedy splnila kritéria pro úhradu léčby siponimodem, která u ní byla zahájena v květnu 2022, její stav se však bohužel stále zhoršuje.
Kazuistika 3
Třetí pacientka ve věku 55 let neměla příznivý osud. Kromě RS, kterou trpí od roku 1995, má také Recklinghausenovu chorobu a prodělala nefrektomii pro maligní tumor. Léčena byla interferonem beta‑1a od roku 2011, kdy už stav zvolna progredoval. Pro vysokou aktivitu choroby svědčil vstupní vysoký počet oligoklonálních pásů v likvoru [13], kontrolní MR mozku v letech 2013, 2015 a 2017 vykazovaly známky aktivity a progresi počtu a velikosti ložisek, která se nacházela i infratentoriálně a v krční míše. Pacientka byla opakovaně přeléčována kortikosteroidy. Podle tehdy platných úhradových kritérií nemohla být nasazena účinnější terapie. V klinickém obraze zpočátku dominovaly paraparéza dolních končetin a sfinkterové obtíže, postupně se přidávala cerebelární symptomatika, klesala schopnost chůze a narůstala disabilita. Sekundárně progresivní forma byla definitivně diagnostikována až koncem roku 2022 a léčba byla změněna na siponimod. Novou terapii si pacientka pochvaluje a oceňuje zejména pohodlné perorální užívání.
Kazuistika 4
Případ poslední pacientky je nejkomplikovanější. Roztroušená skleróza jí byla diagnostikována v roce 1998 v jejích 30 letech. Glatiramer acetát byl nasazen v roce 2000, při této terapii měla v průběhu devíti let dva relapsy. Léčba jí byla tedy pro neúčinnost změněna na interferon beta‑1a, záhy však byla nemocná po dalším relapsu převedena na interferon beta‑1b. Pro intoleranci léčby s výraznými lokálními reakcemi se musela vrátit k interferonu beta‑1a. Na této terapii prodělala v průběhu šesti let pět lehkých relapsů a hodnota EDSS vzrostla o dva body, na 5,0. V roce 2018 proběhla změna léčby na teriflunomid pro vyčerpanost podkoží, nicméně pacientku trápily trvalé průjmy. Po dalších dvou relapsech v září 2021 a květnu 2022 jí byla navržena terapie siponimodem. Pacientka má genotyp CYP2C9*1*3, užívá tedy poloviční dávku 1 mg denně. Gastrointestinální obtíže ustoupily a léčbu pacientka velmi dobře toleruje.
Diskuse
Siponimod znamená naději pro pacienty v pokročilejších stadiích RS, jeho nástup má také potenciál kompletně změnit terapeutický postup jak u nových pacientů, tak u pacientů na dlouhodobě zavedené léčbě. Bylo prokázáno, že siponimod významně zpomaluje progresi disability a oddaluje zhoršování kognitivních funkcí. Rovněž snižuje ukazatele zánětlivé aktivity onemocnění, včetně relapsů a lézí na MR [13-16]. Hlavním úkolem lékařů je nyní přestat si „šetřit“ účinnější léčbu na pozdější a terapeuticky hůře ovlivnitelná stadia choroby. Pacienti uvítají informaci, že jejich léčba má kam pokračovat a nebude jim odebrána. Siponimod je v současné době nejen jedinou možností, ale také moderní a bezpečnou terapeutickou variantou pro pacienty přecházející z RR‑RS do sekundární progrese. Pro dosažení optimálního účinku je nutné včasné nasazení siponimodu, jak jsme mohli vypozorovat i na uvedených kazuistikách. Pacientky, jejichž disabilita již před nasazením siponimodu delší dobu progredovala, měly horší výsledky a jejich stav se nepodařilo dostatečně stabilizovat. Zejména pacienti z první léčebné linie mají prospěch z dostatečné účinnosti a bezpečnostního profilu siponimodu.
K zahájení léčby siponimodem je kromě vyloučení genotypu CYP2C9*3*3 potřeba také splnit úhradová kritéria, která jsou shrnuta v tabulce 1. Vstupní hodnota EDSS musí být v rozmezí 4–6,5, tedy pacient je schopen s oboustrannou oporou ujít aspoň 20 metrů. Léčba není dále hrazena při ztrátě schopnosti chůze, tedy dosažení hodnoty EDSS 7,0 a více. Musí být prokázána progrese disability nezávislá na relapsech, která trvá minimálně šest měsíců. U pacientů se vstupní hodnotou EDSS do 5,5 včetně je požadován vzestup o 1 stupeň mimo relaps, u pacientů s EDSS vyšším než 5,5 o 0,5 stupně Kurtzkeho škály. Požadován je též průkaz aktivity onemocnění, který zajistí, že bude siponimod nasazen pacientům na začátku sekundárně progresivní fáze. Je potřeba zaznamenat klinické relapsy v průběhu předchozích dvou let před zahájením léčby siponimodem nebo prokázat zánětlivou aktivitu na MR mozku (tj. gadolinium enhancující T1 léze nebo nová či zvětšující se T2 léze) [14].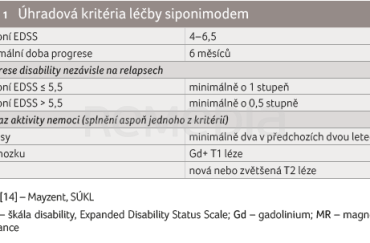
V případě přetrvávající klinické aktivity choroby (manifestující se více než jedním relapsem) je možno diagnózu sekundární progrese přehodnotit a pacienta převést na léčbu jinou léčivou látkou eskalační linie, která nebyla použita v předchozí léčbě. Tento přístup nám poskytuje jistou flexibilitu v případě, že by pacient léčbu netoleroval nebo pro něj nebyla dostatečně účinná.
Závěr
Modulátor S1PR siponimod je v současné době jediným specifickým léčivým přípravkem schváleným pro terapii sekundárně progresivní formy RS. Jako selektivní modulátor S1PR1 a S1PR3 má nízké riziko výskytu závažných nežádoucích účinků a je pacienty velmi dobře snášen. Před jeho nasazením musí být vyšetřen genotyp CYP2C9 a splněna úhradová kritéria, není ale nutné vyčerpat veškeré terapeutické možnosti RR‑RS. Léčba siponimodem může být s výhodou zahájena i u pacientů dlouhodobě užívajících přípravky první léčebné linie, tedy interferony, teriflunomid či glatiramer acetát.
Literatura
[1] Montalban X, Gold R, Thompson AJ, et al. ECTRIMS/EAN guideline on the pharmacological treatment of people with multiple sclerosis. Mult Scler J 2018; 24: 96−120.
[2] Oh J, Alikhani K, Bruno T, et al. Diagnosis and management of secondary‑progressive multiple sclerosis: time for change. Neurodegener Dis Manag 2019; 9: 201−217.
[3] Atlas of MS. 2022. Dostupné na: https://www.atlasofms.org/map/czech‑republic/epidemiology/number‑of‑people‑with‑ms
[4] Wallin MT, Culpepper WJ, Nichols E, et al. Global, regional, and national burden of multiple sclerosis 1990−2016: a systematic analysis for the Global Burden of Disease study 2016. Lancet Neurol 2019; 18: 269−285.
[5] Inojosa H, Proschmann U, Akgün K, Ziemssen T. A focus on secondary progressive multiple sclerosis (SPMS): challenges in diagnosis and definition. J Neurol 2019; 268: 1210−1221.
[6] Chaudhry BZ, Cohen JA, Conway DS. Sphingosine 1‑phosphate receptor modulators for the treatment of multiple scerosis. Neurotherapeutics 2017; 14: 859−873.
[7] Dumitrescu L, Constantinescu CS, Tanasescu R. Siponimod for the treatment of secondary progressive multiple sclerosis. Expert Opin Pharmacother 2019; 20: 143−150.
[8] Cugati S, Chen CS, Lake S, et al. Fingolimod and macular edema. Pathophysiology, diagnosis, and management. Neurol Clin Pract 2014; 5: 402−407.
[9] Scott LJ. Siponimod: A Review in Secondary Progressive Multiple Sclerosis. CNS Drugs 2020; 34: 1191−1200.
[10] Pan S, Gray NS, Gao W, et al. Discovery of BAF312 (siponimod), a potent and selective S1P receptor modulator. ACS Med Chem Lett 2013; 4: 333−337.
[11] Gergely P, Nuesslein‑Hildesheim B, Guerini D, et al. The selective sphingosine 1‑phosphate receptor modulator BAF213 redirects lymphocyte distribution and has species‑specific effects on hearth rate. Br J Pharmacol 2012; 167: 1035−1047.
[12] O’Sullivan C, Schubart A, Mir AK, et al. The dual S1PR1/S1PR5 drug BAF313 (siponimod) attenuates demyelination in organotypic slice cultures. J Neuroinflammation 2016; 13: 31.
[13] SPC Mayzent®. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/mayzent‑epar‑product‑information_cs.pdf
[14] Státní ústav pro kontrolu léčiv: Mayzent – detail léčivého přípravku [online]. Dostupné na: https://www.sukl.cz/modules/medication/detail.php?code=0238786&tab=prices.
[15] Benedict RHB, Cree B, Tomic D, et al. Impact of siponimod on cognition in patients with secondary progressive multiple sclerosis: phase 3 EXPAND study results. Presented at: AAN Meeting; April 26, 2018; Los Angeles, USA. Poster S44.004.
[16] Arnold DL, Fox R, Bar‑Or A, et al. Effect of siponimod on cortical grey matter and thalamic volume in patients with secondary progressive multiple sclerosis: results of the EXPAND study. Presented at: 35th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; September 11−13, 2019; Stockholm, Sweden. Poster P382.