Komentář k italským doporučením pro monitoraci a léčbu psoriatické artritidy v kontextu českých doporučených postupů
Souhrn:
Štolfa J. Komentář k italským doporučením pro monitoraci a léčbu psoriatické artritidy v kontextu českých doporučených postupů. Remedia 2018; 28: 419–428.
Doporučení České revmatologické společnosti pro psoriatickou artritidu (PsA) vycházející z guidelines Evropské ligy proti revmatismu (EULAR) byla vytvořena v roce 2016 a publikována na začátku roku 2017. Vývoj poznatků o etiopatogenezi PsA, o jejích jednotlivých manifestacích a léčebné strategii je však velmi rychlý, stejně jako zkoušení a postupné zavádění nových biologických a cílených syntetických léků do praxe. Jednotlivé národní revmatologické společnosti na to reagují aktualizací, resp. extenzí svých doporučení. V poslední době byla publikována taková doporučení italskou, francouzskou a španělskou revmatologickou společností. Je jistě namístě porovnání přístupu jednotlivých guidelines podle jednotlivých klinických manifestací s ohledem na jejich diagnostiku, volbu farmaka, hodnocení léčebné odpovědi, postup v případě selhání léčby, další postup u pacienta v remisi. Vzhledem k tomu, že francouzská doporučení se nevěnují specificky PsA a španělská doporučení nebyla donedávna k dispozici v angličtině, zaměřujeme se v tomto komentáři na široce koncipovaná italská doporučení v kontextu českých doporučených postupů.
Summary:
Stolfa J. A commentary to Italian psoriatic arthritis monitoring and treatment guidelines within the context of Czech guidelines. Remedia 2018; 28: 419–428.
Psoriatic arthritis (PsA) guidelines of the Czech Rheumatological Society based on guidelines of the Europen League Against Rheumatism (EULAR) were drafted in 2016 and published in 2017. However, the progress in the development of the knowledge base about PsA etiopathogenesis, its individual manifestations and treatment strategy as well as the evaluation and gradual introduction of new biologics and targeted synthetic drugs into clinical practice is very fast. Individual national rheumatological societies react to it with an update or extension of their existing guidelines. Recently, this has been done by the Italian, French and Spanish rheumatological societies. Certainly, it is appropriate to compare the approach of the individual guidelines according to their diagnostics, drug choices, treatment response evaluation, treatment failure response process, and further remission care. Since French guidelines do not specifically cover PsA and Spanish guidelines were not available in English until recently, we focus on broadly outlined Italian guidelines within the context of Czech guidelines in this commentary.
Key words: psoriatic arthritis, biologic therapy, targeted synthetic disease‑modifying antirheumatic drugs, disease activity assessment, therapeutic response
Úvod
Doporučení České revmatologické společnosti pro psoriatickou artritidu (PsA) byla vytvořena v roce 2016 a publikována na začátku roku 2017 [1]. Vycházejí z doporučení Evropské ligy proti revmatismu (EULAR) z roku 2015 [2] a z doporučení GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis), rovněž z roku 2015 [3]. Nicméně vývoj poznatků o etiopatogenezi PsA, o jejích jednotlivých manifestacích (zejména extraartikulárních) a léčebné strategii je velmi rychlý, stejně jako zkoušení a postupné zavádění nových biologických chorobu modifikujících antirevmatických léků (bDMARDs) a tzv. cílených syntetických chorobu modifikujících antirevmatických léků (tsDMARDs) do praxe. Jednotlivé národní revmatologické společnosti na to reaguji aktualizací, resp. extenzí svých guidelines. V poslední době byla publikována taková doporučení italskou [4], francouzskou [5] a španělskou [6] revmatologickou společností. Francouzská doporučení jsou zaměřena na celou skupinu spondyloartritid a PsA je pojednána jako jejich součást.
Tvorba doporučeného postupu je v případě PsA komplikována značnou heterogenitou klinického obrazu, kde vedle psoriázy a artritidy mohou být přítomny extraartikulární manifestace jako entezitida, daktylitida nebo axiální postižení (spondylitida), takže je namístě hovořit spíše o psoriatické nemoci (PN) než pouze o PsA. Uvedené manifestace mohou být u jednoho pacienta přítomny v různých kombinacích, které se v průběhu onemocnění mohou měnit, co se týče fenotypu i tíže postižení. Přitom každá z těchto manifestací by měla být pro potřebu tvorby doporučení pokud možno jednoznačně definována. Pro potřebu hodnocení odpovědi na léčbu by pak měla být pro každou klinickou manifestaci stanovena kritéria aktivity. Toto je vcelku dobře definováno pro psoriázu a artritidu, méně již pro ostatní manifestace. Je to důležité i proto, že různé klinické manifestace odpovídají různě na stejnou léčbu. Relativně novou součástí některých guidelines je rovněž přístup k extraskeletálním manifestacím (komorbiditám).
Z tohoto důvodu je jistě vhodné porovnání přístupu jednotlivých doporučení podle jednotlivých klinických manifestací s ohledem na jejich diagnostiku, volbu farmaka, hodnocení léčebné odpovědi, postup v případě selhání léčby, další postup u pacienta v remisi. Vzhledem k tomu, že francouzská doporučení se nevěnují specificky PsA a španělská doporučení nebyla donedávna k dispozici v angličtině, zaměřujeme se v této publikaci na široce koncipovaná italská doporučení v kontextu českých doporučených postupů.
Farmaka pro léčbu PsA (disease modifying antirheumatic drugs, DMARDs) se nově dělí do tří kategorií: konvenční syntetické chorobu modifikující antirevmatické léky (conventional synthetic disease modifying antirheumatic drugs, csDMARDs), biologické chorobu modifikující antirevmatické léky (biologic disease modifying antirheumatic drugs, bDMARDs) a tzv. cílené syntetické chorobu modifikující antirevmatické léky (targeted synthetic disease modifying antirheumatic drugs, tsDMARDs) neboli tzv. malé molekuly pro perorální použití. Do kategorie csDMARDs se ve všech doporučeních řadí metotrexát (MTX), leflunomid (LEF), sulfasalazin (SSZ) a cyklosporin A (CsA). Mezi bDMARDs patří pět originálních přípravků (boDMARDs) ‒ infliximab (IFX), etanercept (ETA), adalimumab (ADA), certolizumab pegol (CZP) a golimumab (GOL). Mimo to jsou k dispozici i dva biosimilární přípravky (bsDMARDs), a to pro infliximab a pro etanercept. V krátké době lze očekávat příchod biosimilárních přípravků také pro další molekuly.
Z inhibitorů osy IL 12/IL 23‒Th17 jsou to ustekinumab (UST), sekukinumab (SEC) a ixekizumab (IXE). Vývoj brodalumabu byl pozastaven kvůli neočekávanému nárůstu suicidiálních tendencí, guselkumab a tildrakizumab (monoklonální protilátky proti podjednotce p19 interleukinu 23 [IL 23]) jsou vysoce účinné při léčbě psoriázy, výsledky studií u PsA nebyly dosud publikovány. Do kategorie tsDMARDs jsou řazeny dva přípravky ‒ apremilast (APRE) a nově tofacitinib (TOFA).
Italská doporučení vycházejí z rozsáhlé literární rešerše (Systematic Literature Review, SLR) prací publikovaných v období let 2014–2016 zaměřených na hlavní klinické manifestace PN, tj. periferní artritidu, entezitidu, daktylitidu a axiální postižení (spondylitidu). Doporučené postupy jsou cíleny na léčbu biologickými farmaky a na tsDMARDs.
Biologická léčba a tsDMARDs
Z inhibitorů tumor nekrotizujícího faktoru alfa (TNFα) používají italské doporučené postupy všech pět biologik v obvyklém dávkování stejně jako v České republice (ETA, IFX, ADA, GOL, CZP). Pro léčbu samotné psoriázy není v Itálii schválen GOL a CZP, podobně jako v ČR.
Z inhibitorů osy IL 12/IL 23‒Th17 jsou indikovány UST a SEC pro léčbu aktivní rezistentní PsA.
Z kategorie tzv. malých molekul byl nedávno schválen APRE. Z ostatních bDMARDs jsou uvedeny dobré výsledky hodnocení fáze III abataceptu (ABA) včetně příznivého ovlivnění rentgenové progrese. Klinické studie s rituximabem (RTX), tocilizumabem (TOC) a clazakizumabem (CLA; inhibitor IL 6) přinášejí rozporné výsledky, i když určitá účinnost oproti placebu byla u PsA prokázána.
Pokud jde o bezpečnost léčby, SLR nenalezla žádná nová bezpečnostní rizika pro inhibitory TNFα. Zvláštní pozornost je věnována výskytu malignit, resp. progresi malignity po zavedení bDMARDs. Výskyt malignity v uplynulých pěti letech je obecně považován za kontraindikaci pro zavedení léčby inhibitory TNFα. Po 15 letech používání inhibitorů TNFα se zdá, že tato farmaka jsou bezpečná i u pacientů s prodělaným karcinomem. V případě psoriázy odkazují autoři na literární přehled Patela a kol., z něhož vyplývá, že riziko malignity, resp. progrese předchozí malignity při léčbě bDMARDs není signifikantně vyšší než u takto neléčených pacientů [8]. Konstatují tedy, že u aktivních forem PsA rezistentních na jinou léčbu „prospěch z léčby inhibitory TNFα převažuje nad rizikem malignity“ [4]. Rozhodnutí o této terapii musí být nicméně sdíleno s pacientem a schváleno onkologem, který zajistí sledování nemocného po onkologické stránce.
V případě biologik s jiným mechanismem účinku italská doporučení konstatují, že výskyt těžkých infekcí při léčbě UST je velmi neobvyklý, výskyt aktivní tuberkulózy žádný – podobně jako výskyt demyelinizačních onemocnění. Rovněž velmi nízký je výskyt malignit a velkých kardiovaskulárních příhod (major adverse cardiovascular events, MACEs), které zahrnují srdeční infarkt, cévní mozkovou příhodu a náhlou srdeční smrt. Guidelines se odvolávají též na výsledky registru PSOLAR (Psoriasis Longitudinal Assessment and Registry), který mj. konstatuje nižší výskyt těžkých infekcí a malignit u pacientů léčených UST ve srovnání s léčbou inhibitory TNFα (ADA, IFX, ETA) a MTX [9]. Uvádějí tedy, že pacienti s předchozí malignitou mohou být „s opatrností léčeni ustekinumabem“ [4].
Podobně při léčbě SEC nebyly zaznamenány případy aktivní tuberkulózy či demyelinizačního onemocnění. Je známý častější výskyt mykotických infekcí. Diskutuje se výskyt Crohnovy choroby de novo, v klinických studiích byl potvrzen v jednom případě, obavy z exacerbace preexistující Crohnovy nemoci se nepotvrdily. Výskyt MACEs a malignit je nízký. Autoři uzavírají, že výskyt nežádoucích účinků je přinejmenším srovnatelný s výskytem při léčbě inhibitory TNFα, s lepším bezpečnostním profilem pro aktivní tuberkulózu a demyelinizační onemocnění. APRE má velmi příznivý bezpečnostní profil, srovnatelný s placebem. Nevyskytly se žádné případy aktivní tuberkulózy, výskyt závažných infekcí, malignit a MACEs je nízký. Doporučení nicméně konstatují, že pokud jde o preexistující malignity, není dostatek dat pro posouzení rizika exacerbace. Dosud nevysvětlený zůstává pokles tělesné hmotnosti, který nesouvisí s dyspeptickými obtížemi (nauzea, průjem), jež někdy zahájení léčby APRE doprovázejí.
Která onemocnění jsou považována za kontraindikaci zavedení léčby bDMARDs/tsDMARDs?
Za kontraindikaci zahájení léčby inhibitory TNFα je považována sepse a vysoké riziko jejího vývoje, aktivní infekce včetně aktivní tuberkulózy, latentní tuberkulózy, pokud není adekvátně léčena, infekce virem hepatitidy B (VHB), infekce HIV, dále srdeční selhání stupně III/IV a demyelinizační onemocnění. Malignita v posledních pěti letech je dále považována za kontraindikaci, ale výjimky z tohoto pravidla jsou možné (viz výše).
Srdeční selhání stupně III/IV a demyelinizační onemocnění nejsou považovány za kontraindikaci pro léčbu UST, SEC a APRE. Za kontraindikaci pro podávání APRE není považována ani latentní tuberkulóza a infekce VHB. Přes signifikantně nižší riziko rozvoje infekcí při podávání UST, SEC a APRE jsou i tato farmaka kontraindikována u sepse, při jejím zvýšeném riziku a u aktivních infekcí.
Používání bDMARDs/tsDMARDs by se mělo řídit doporučeními v souhrnu údajů o přípravku (SPC) pro jednotlivé léky. V této souvislosti stojí za zmínku, že britská revmatologická společnost konstatuje, že na rozdíl od ostatních bDMARDs je CZP kompatibilní s celým průběhem těhotenství, což potvrzují i recentní experimentální data [10]. Vždy by však léčba měla být diskutována s pacientem.
Periferní artritida
Diagnóza periferní artritidy je
založena na kritériích CASPAR (Classification Criteria for
Psoriatic Arthritis) ve všech doporučeních [7], tabulka 1.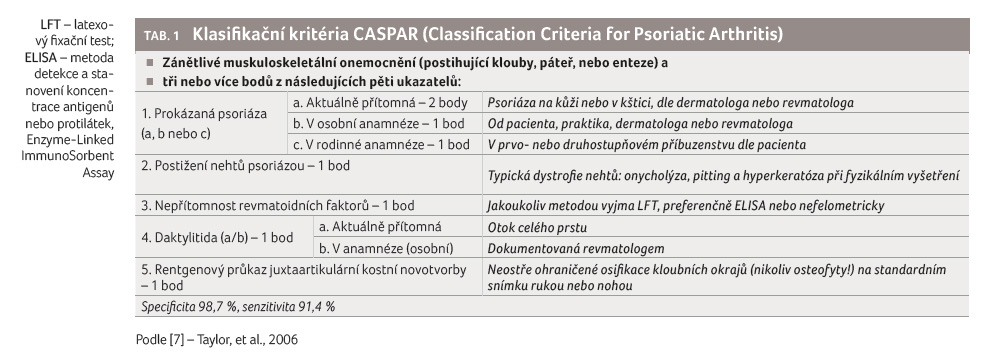
Indikace pro zahájení biologické léčby, resp. léčby tsDMARDs
Indikace DMARDs/tsDMARDs dle italských doporučení
- ≥ 1 aktivní kloub (artritida)
- Chybějící odpověď na nesteroidní antirevmatika (NSA), na lokální injekci glukokortikoidu nebo na csDMARDs
- Příznivý názor experta na základě subjektivních a objektivních parametrů
Indikace DMARDs/tsDMARDs dle českých doporučení
- Při nedosažení léčebného cíle na úrovni 2, tj. při léčbě csDMARDs, případně při jejich toxicitě
- Při významném axiálním postižení (s výjimkou APRE), pokud nedošlo k odpovědi na léčbu NSA
- Při těžké entezitidě, pokud nedošlo k odpovědi na léčbu NSA či lokálně aplikovanými glukokortikoidy
- Léčebného cíle by mělo být dosaženo do 3–6 měsíců
Komentář

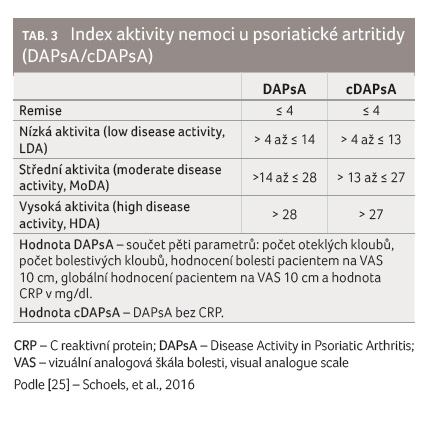
Aktivní kloub je zde definován jako kloub, který je palpačně bolestivý a oteklý. V českých doporučeních se nespecifikuje při indikaci bDMARDs/tsDMARDs počet aktivních kloubů, indikací je „nedosažení léčebného cíle“, tj. stavu minimální aktivity nemoci (minimal disease activity, MDA) ‒ tabulka 2, remise dle skóre DAPsA (Disease Activity in Psoriatic Arthritis) nebo alespoň nízké aktivity dle DAPsA po 3‒6 měsících léčby ‒ tabulka 3. V českých doporučeních je specifikován počet neúčinných csDMARDs tak, že v případě nepřítomnosti negativních prognostických markerů je možno zkusit druhý csDMARD, v případě jejich přítomnosti pak stačí selhání jednoho csDMARD ‒ tabulka 4. V této souvislosti je třeba zmínit radikálnější přístup italských doporučení, v nichž je navrženo zvážit zavedení biologické léčby v případě nově vzniklých erozí či deformit nebo v případě progrese stávajících erozí a deformit, ačkoliv je klinická odpověď přijatelná. Lze rovněž souhlasit s názorem, že pacienti s přítomností nepříznivých prognostických markerů by měli být léčeni biologickou léčbou co nejdříve.
Sekvence jednotlivých csDMARDs je v ČR obdobná (MTX, LEF, SSZ, CsA) jako v Itálii (MTX, SSZ, LEF, CsA). Příznivý názor experta není v českých guidelines zahrnut, nicméně i v italských doporučeních se vychází z parametrů obsažených v indexu DAPsA, který používají oba dokumenty.
Volba farmaka
Volba farmaka dle italských doporučení

- Inhibitory TNFα, SEC, UST, APRE ‒ s výjimkou erozivních forem
- Volba farmaka dle českých doporučení
- Obvykle inhibitory TNFα, při nevhodnosti či kontraindikaci inhibitor IL 12/IL 23 (UST) nebo inhibitor IL 17 (SEC) csDMARD
- U pacientů, u nichž léčba bDMARDs není vhodná, může být zvážena terapie tsDMARDs (např. inhibitorem PDE4 ‒ APRE)
Komentář
Italská doporučení neuvádějí žádnou hierarchii biologik jako léčbu první volby. V českých doporučeních jsou inhibitory TNFα uváděny obvykle jako první volba, není to však nepřekročitelné pravidlo. Jistě zde hraje roli i zkušenost lékaře s jednotlivými biologiky, preference pacienta (to se týká spíše způsobu a častosti aplikace než farmakodynamiky jednotlivých farmak). Nezanedbatelnou úlohu má v tomto případě také ekonomická stránka, tedy cena léku. Tady vstupují do hry i biosimilární biologika (bsDMARDs), která jsou zpravidla (ale ne vždy) levnější než originální biologikum (boDMARD). Shodný je přístup ke kombinaci biologik s csDMARDs. Data z některých registrů ukazují, že kombinace bDMARDs s csDMARDs (zejména s MTX) prodlužují setrvání v léčbě monoklonálními protilátkami [11,12]. Ze zkušenosti je známo, že v některých případech může přidání MTX zvýšit účinnost biologika jak na kloubní, tak na kožní symptomy. Pro toto tvrzení však nemáme oporu v klinických studiích [13]. Rozhodnutí o komedikaci biologika s csDMARD je tedy individuální a odvíjí se od zkušenosti ošetřujícího revmatologa.
Hodnocení léčebné odpovědi
Hodnocení léčebné odpovědi dle italských doporučení
- Skóre DAPsA ≤ 4
- ACR 50 (dosažení alespoň 50% zlepšení podle kritérií American College of Rheumatology) nebo DAPsA ≤ 14
- Příznivý názor experta
Hodnocení léčebné odpovědi dle českých doporučení
- Primárním cílem léčby je dosažení remise nebo stavu MDA. Tento cíl zahrnuje rovněž velkou část extraartikulárních manifestací choroby.
- Alternativně lze v případě, že dominantní (nebo jedinou) manifestací je periferní artritida, použít hodnocení aktivity dle DAPsA (resp. cDAPsA – DAPsA bez hodnoty C reaktivního proteinu). V tomto případě je cílem opět dosažení remise (DAPsA ≤ 4) nebo stavu nízké aktivity nemoci (DAPsA ≤ 14).
Komentář
V obou doporučeních je cílem léčby dosažení remise. Tato ovšem není jednoznačně definována a zpravidla se jí rozumí absence jakýchkoliv subjektivních a objektivních příznaků onemocnění, včetně laboratorních parametrů. Při hodnocení aktivity onemocnění dle indexu DAPsA je remise definována jako hodnota tohoto indexu ≤ 4 (tab. 3). Recentně byl navržen jako ekvivalent remise stav velmi nízké aktivity nemoci (very low disease activity, VLDA) definovaný jako splnění všech sedmi kritérií dle MDA [14], tabulka 2. V obou případech je podmínkou hodnocení remise chybějící progrese klinického či rentgenového kloubního postižení.
V českých doporučeních je primárním cílem léčby dosažení tzv. minimální aktivity onemocnění, což je komplexnější ukazatel, který zahrnuje i velkou část extraartikulárních manifestací onemocnění (tab. 2). Dosažení remise nebo alespoň stavu nízké aktivity choroby dle DAPsA je alternativním cílem v případech, kde kloubní poškození představuje jediné nebo dominantní postižení.
Další otázkou je požadovaný časový interval dosažení cíle léčby. V českých doporučeních je stanoven volně jako období 3–6 měsíců. Italské guidelines navrhují první kontrolu po třech měsících ‒ pokud pacient nedosáhne cíle, mělo by to být hodnoceno jako selhání léčby. Autoři nicméně ponechávají možnost posouzení expertem, zda pacient dosáhl alespoň částečné významné odpovědi, a zhodnocení odpovědi za další tři měsíce. Dle našeho názoru je interval tří měsíců příliš krátký pro rozhodnutí o ukončení léčby daným přípravkem z důvodu jeho neúčinnosti. Další kontroly (a zhodnocení odpovědi) by měly následovat po 4–6 měsících.
Postup v případě selhání léčby
Postup v případě selhání léčby dle italských doporučení
- Při primárním selhání inhibitorů TNFα změna (switch) na jiný inhibitor TNFα nebo na bDMARD s jiným mechanismem účinku
- Při sekundárním selhání inhibitoru TNFα změna na jiný inhibitor TNFα
- Při výskytu nežádoucích účinků biologického léku:
- Pokud se vztahuje k celé třídě biologik (tzv. class effect), pak bDMARD s jiným mechanismem účinku
- Jinak výměna za přípravek stejné třídy
- V případě selhání biologika s jiným mechanismem účinku než inhibitor TNFα a APRE ‒ přechod na biologikum s jiným mechanismem účinku
Postup v případě selhání léčby dle českých doporučení
- Změna biologika (switch) na jiný inhibitor TNFα při nedosažení léčebného cíle prvním bDMARD nebo biologikum s jiným mechanismem účinku nebo tsDMARD
Komentář
Údaje o změně biologika pocházejí převážně z registrů. Z nich vyplývá, že druhý inhibitor TNFα je zpravidla méně účinný než první a třetí méně účinný než druhý [15‒17]. Postup při změně biologika tak, jak je uveden v italských doporučeních, se zdá být racionální a může být aplikován i v podmínkách ČR. S postupem při změně biologika v případě, že prvním byl přípravek s jiným mechanismem účinku (tj. inhibitory cesty IL 12/IL 23‒Th17 a APRE), nejsou dosud žádné zkušenosti.
Postup u pacienta po dosažení remise
Postup u pacienta po dosažení remise dle italských doporučení
Pokud trvá remise ≥ 6 měsíců:- Redukce dávky o třetinu
- Po dalších třech měsících redukce o polovinu iniciální dávky
Postup u pacienta po dosažení remise dle českých doporučení
- V českých doporučeních není postup po dosažení remise specifikován
Komentář
V italských doporučeních je specifikován postup snižování dávek biologik po dosažení remise. V českém dokumentu sice není postup detrakce dávek přesně definován, nicméně soustavně probíhá, ať už snižováním dávek, nebo prodlužováním intervalů. Tento postup je součástí projektu v registru ATTRA a bude následně vyhodnocen.
Podmínkou zahájení redukce léčby je vždy přítomnost remise (jak definováno výše) a chybějící progrese kloubního poškození trvající minimálně šest měsíců. Klinická hodnocení s tímto zadáním nebyla dosud provedena a observační studie přinášejí nejednoznačné a obtížně srovnatelné výsledky. V jedné ze studií udrželo remisi po prodloužení intervalu podávání ADA v dávce 40 mg na čtyři týdny 88,6 % pacientů v průměru 28,9 8,4 měsíce [18]. V jiné studii udrželo remisi 60 % pacientů průměrně 1,0 0,8 roku po redukci dávky inhibitoru TNFα o jednu třetinu [19]. V recentní studii došlo u pacientů v remisi k relapsu choroby u 76,9 % osob v průměru po 74,5 51,7 dne [20]. Z uvedeného mimo jiné vyplývá, že úplné ukončení léčby nelze doporučit a v případě redukce dávky či prodloužení intervalu podávání je třeba se vrátit k původní dávce při prvních projevech relapsu.
Entezitida
Aktivní entezitida je definována jako přítomnost bolesti a palpační bolestivosti v místě enteze, pokud jsou jiné příčiny vyloučeny. Vyšetřovaná místa jsou předdefinována a jejich kombinace se liší dle použitých indexů ‒ klasicky Maastrichtský index MASES (vyvinutý pro ankylozující spondylitidu) nebo v současné době nejčastěji LEI (Leeds Enthesitis Index), který je jediným indexem speciálně vyvinutým a validizovaným pro PsA [21]. Vzhledem k poněkud vágní definici entezitidy je vhodné verifikovat diagnózu aktivní entezitidy ultrasonografickým vyšetřením k odlišení od nezánětlivé entezopatie.
Indikace biologické léčby u entezitidy
Indikace DMARDs/tsDMARDs dle italských doporučení
- ≥ 1 aktivní entezitida
- Chybějící odpověď na NSA, lokální injekci glukokortikoidu nebo csDMARDs
- Příznivý názor experta na základě subjektivních a objektivních parametrů
Indikace DMARDs/tsDMARDs dle českých doporučení
- Entezitida je přítomna minimálně ve třech různých lokalitách
- Hodnocené lokality: úpon Achillovy šlachy do patní kosti, úpon patelárního ligamenta do tibie nebo do dolního pólu pately, úpon šlachy kvadricepsu do horního pólu pately
- Entezitidy jsou přítomny v některé z uvedených lokalit opakovaně (minimálně při dvou následných kontrolách v odstupu tří měsíců) navzdory léčbě na úrovni 1 (NSA + lokální instilace glukokortikoidu)
- Entezitidy ovlivňují negativně funkci (HAQ 0,5)
- Verifikace aktivní entezitidy ultrazvukovým vyšetřením (tzv. power Doppler)
Komentář
Česká doporučení jsou v tomto směru přísnější a požadují nejméně tři lokality, vždy ultrasonografickou verifikaci a dopad na funkci dle dotazníku HAQ (Health Assessment Questionnaire). Při takto definované indikaci jsme vycházeli z toho, že izolovaná entezitida bude zřídka indikací k biologické léčbě sama o sobě a že její klasická definice je velmi vágní.
V italských doporučeních je vyžadována pro indikaci bDMARD pouze jedna aktivní entezitida. Nicméně příznivý názor experta vychází z podobných požadavků (HAQ), navíc i z hodnocení na vizuální škále bolesti (VAS) a z globálního hodnocení VAS.
Volba farmaka
Volba farmaka dle italských doporučení
- Všechna biologika (inhibitory TNFα, UST, SEC a APRE) mohou být použita v první linii léčby
Volba farmaka dle českých doporučení
- bDMARDs s doklady o účinnosti u entezitid: inhibitory TNFα, inhibitor IL 12/IL 23 (UST), inhibitor IL 17 (SEC), inhibitor PDE4 (APRE)
Komentář
O účinnosti jednotlivých biologik, resp. APRE u entezitidy existuje málo dat, tím méně o komparativní účinnosti. Česká doporučení vycházejí z guidelines GRAPPA z roku 2016 [22].
Hodnocení léčebné odpovědi
Hodnocení léčebné odpovědi dle italských doporučení
- Chybění entezitidy. Pokud nelze jednoznačně hodnotit, pak alternativní ukazatele aktivity: VAS bolesti 15 mm a/nebo globální hodnocení pacientem na VAS 20 mm a/nebo HAQ 0,5 nebo splnění kritérií MDA. Ultrasonografické hodnocení, je li dosažitelné.
- Názor experta, že bylo dosaženo odpovědi a že léčba by měla pokračovat. Intervaly hodnocení stejně jako u periferní artritidy.
Hodnocení léčebné odpovědi dle českých doporučení
- Odpověď na léčbu není definována
Komentář
Jak již bylo řečeno, izolovaná entezitida bude jen zcela výjimečně sama o sobě indikací pro biologickou léčbu. Pokud ano, pak bude záležet na hodnocení indikujícího lékaře. Pro pozitivní hodnocení odpovědi by mělo dojít k významnému zlepšení ve všech pěti požadovaných položkách vyžadovaných pro indikaci biologické léčby (viz výše). Většinou však budeme posuzovat efekt léčby v kontextu s postižením ostatních oblastí (především u artritidy).
Postup v případě selhání léčby
Postup v případě selhání léčby dle italských doporučení
- Je shodný s doporučením při selhání léčby u periferních artritid
Postup v případě selhání léčby dle českých doporučení
- Není definován
Komentář
Pro léčebný postup v této situaci není opora v klinických ani observačních studiích. Rozhodnutí bude vždy záležet na úvaze a zkušenosti odborníka pro terapii PN.
Postup u pacienta po dosažení remise
Postup u pacienta po dosažení remise dle italských doporučení
- Pokud trvá remise ≥ 6 měsíců:
- Redukce dávky o polovinu iniciální dávky
- Po dalších třech měsících možno ukončit léčbu, pokud trvá odpověď (remise)
Postup u pacienta po dosažení remise dle českých doporučení
- V českých doporučeních není postup po dosažení remise specifikován
Komentář
Pokud bude výjimečně entezitida indikací k biologické léčbě, bude tato vždy dočasná (na rozdíl od terapie artritidy), interval léčby šest měsíců je pravděpodobně dostatečný. Vždy je nezbytné pečlivě zhodnotit aktivitu entezitidy, tedy zda obtíže pacienta jsou skutečně způsobeny entezitidou (a nikoliv např. fibromyalgií). Ultrasonografické vyšetření zde bude vždy nezbytné. Zda ukončit léčbu náhle, nebo postupně, bude záležet na úvaze ošetřujícího revmatologa (experta).
Daktylitida
Daktylitida je definována jako difuzní otok celého prstu, tedy od metakarpofalangeálního, resp. metatarzofalangeálního kloubu po vrchol prstu do té míry, že otok jednotlivých kloubů není diferencovatelný. Obvod prstu na úrovni první falangy by měl být alespoň o 10 % větší než na druhé straně. Pro diagnózu akutní daktylitidy je nezbytná současně přítomnost bolesti a palpační bolestivosti prstu. K ověření daktylitidy může být použito ultrasonografické vyšetření. Jiné příčiny daktylitidy musejí být vždy vyloučeny.
Indikace biologické léčby u daktylitidy
Indikace DMARDs/tsDMARDs dle italských doporučení
- ≥ 1 akutní daktylitida
- Chybějící odpověď na NSA, na lokální injekci glukokortikoidu nebo na csDMARDs
- Příznivý názor experta na základě hodnocení pacientem a na základě přítomnosti kloubního poškození
Indikace DMARDs/tsDMARDs dle českých doporučení
- Daktylitida je přítomna minimálně na třech prstech horních/dolních končetin
- Daktylitidy jsou přítomny opakovaně (minimálně při dvou následných kontrolách v odstupu tří měsíců) navzdory léčbě na úrovni 1 (NSA + lokální instilace glukokortikoidu), resp. 2 (csDMARDs)
- Daktylitidy ovlivňují negativně funkci (HAQ 0,5)
- Verifikace aktivní daktylitidy ultrazvukovým vyšetřením (tzv. power Doppler)
- bDMARDs s doklady o účinnosti u daktylitid: inhibitory TNFα, inhibitor IL 12/IL 23 (UST), inhibitor IL 17 (SEC), inhibitor PDE4 (APRE) [16]
Komentář
Česká doporučení vyžadují pro indikaci biologické léčby tři prsty s daktylitidou na rozdíl od guidelines italských. Je to dáno tím, že tato kritéria jsou navržena pro situace, kdy je daktylitida jediným projevem onemocnění. Pokud je však daktylitida součástí artritidy přítomné na ostatních kloubech (artritida na prstu s daktylitidou se v tomto případě nepočítá), pak se tato považuje za prediktor závažného průběhu onemocnění a posouvá úvahu o terapii směrem k indikaci biologické léčby. Vždy je třeba mít na paměti, že máme na mysli akutní (aktivní) daktylitidu (která bolí a je palpačně bolestivá), nikoliv chronickou daktylitidu (u které otok může přetrvávat, ale nebolí a je palpačně nebolestivý). V případě nejistoty je vhodné doplnit ultrasonografické vyšetření.
Volba farmaka
Volba farmaka dle italských doporučení
- Všechna biologika (inhibitory TNFα, UST, SEC a APRE) mohou být použita v první linii léčby
Volba farmaka dle českých doporučení
- bDMARDs s doklady o účinnosti u daktylitid: inhibitory TNFα, inhibitor IL 12/IL 23 (UST), inhibitor IL 17 (SEC), inhibitor PDE4 (APRE)
Komentář
Pro účinnost jednotlivých biologik, resp. APRE u daktylitid je málo dat, tím méně o komparativní účinnosti. Česká doporučení vycházejí z guidelines GRAPPA z roku 2016 [22].
Hodnocení léčebné odpovědi
Hodnocení léčebné odpovědi dle italských doporučení
- Chybění daktylitidy. Pokud nelze jednoznačně hodnotit, pak alternativní ukazatele aktivity: VAS bolesti 15 mm a/nebo globální hodnocení pacientem na VAS 20 mm a/nebo HAQ 0,5 nebo splnění kritérií MDA. Ultrasonografické hodnocení, je li dosažitelné.
- Názor experta, že bylo dosaženo odpovědi a že léčba by měla pokračovat. Intervaly hodnocení stejné jako u periferní artritidy.
Hodnocení léčebné odpovědi dle českých doporučení
- Odpověď na léčbu není definována
Komentář
Odpověď na léčbu hodnotíme podobně jako v případě entezitidy. Na rozdíl od ní ovšem nutno považovat daktylitidu za závažnější známku PN, protože představuje negativní prognostický faktor. Uvedené se však týká pouze aktivní (akutní) daktylitidy. Často totiž otok celého prstu přetrvává, i když nejeví známky aktivity (bolest, bolestivost, ev. proteplení, ultrasonografické známky aktivity). Pak se jedná o chronickou daktylitidu, jejíž přítomnost nelze hodnotit jako selhání léčby.
Postup v případě selhání léčby
Postup v případě selhání léčby dle italských doporučení
- Je shodný s doporučením při selhání léčby u periferních artritid
Postup v případě selhání léčby dle českých doporučení
- V českých doporučeních není specifikován
Komentář
Pro léčebný postup v této situaci není opora v klinických ani observačních studiích. Rozhodnutí bude vždy záležet na úvaze a zkušenosti odborníka pro léčbu PN.
Postup u pacienta po dosažení remise
Postup u pacienta po dosažení remise dle italských doporučení
- Pokud trvá remise ≥ 6 měsíců:
- Redukce dávky o polovinu iniciální dávky
- Po dalších třech měsících možno ukončit léčbu, pokud trvá odpověď (remise)
Postup u pacienta po dosažení remise dle českých doporučení
- V českých doporučeních není postup po dosažení remise specifikován
Komentář
Při dosažení remise lze akceptovat postup navržený v italských doporučeních. Vzhledem k tomu, že daktylitida je zpravidla součástí celkového klinického obrazu, je léčebný postup nezbytné vždy posuzovat v kontextu s ostatními manifestacemi choroby.
Axiální postižení (spondylitida)
Diagnostická, resp. klasifikační kritéria pro axiální formu PsA (axPsA) chybějí, alternativně je v literatuře označována jako psoriatická spondyloartritida (PsSpA). Zahrnuje postižení sakroiliakálních kloubů (sakroiliitida) a/nebo postižení obratlových těl (spondylitida) obdobně jako u ankylozující spondylitidy (AS). Přes tyto společné rysy odlišuje obě chorobné jednotky řada rysů: u axPsA chybí převaha mužů, je častěji asymetrická a méně závažná, mírnější spondylitida, která tzv. přeskakuje segmenty páteře, syndesmofyty, resp. parasyndesmofyty jsou disperzně rozloženy, je lépe zachována páteřní mobilita, nemoc zpravidla vynechává apofyzeální klouby, často se vyskytuje postižení krční páteře a asociace s antigenem HLA B27 je méně výrazná [23].
Indikace biologické léčby u axiálního postižení (spondylitidy)
Indikace DMARDs/tsDMARDs dle italských doporučení
- Aktivní spondylitida (BASDAI [Bath Ankylosing Spondylitis Disease Activity Index] 4)
- Chybějící odpověď na alespoň dvě NSA podávaná po dobu čtyř týdnů
- Příznivý názor experta založený na subjektivních a objektivních parametrech
Indikace DMARDs/tsDMARDs dle českých doporučení
- Indikace biologické léčby se řídí dle doporučení České revmatologické společnosti pro léčbu AS [24]
Komentář
V obou doporučeních se konstatuje známá skutečnost, že axiální postižení u PsA podobně jako u AS neodpovídá na léčbu csDMARDs, a tudíž by se tato léčba neměla v této indikaci používat. Dalším krokem po selhání léčby NSA je biologická léčba dle výše uvedených kritérií. Vzhledem k tomu, že v projektu PALACE nebyla prokázána účinnost APRE u AS, neměl by se APRE používat ani v léčbě axPsA.
Volba farmaka
Volba farmaka dle italských doporučení
- Inhibitory TNFα, SEC, UST pouze, jsou li ostatní biologika kontraindikována
Volba farmaka dle českých doporučení
- Podle doporučení České revmatologické společnosti pro léčbu AS
Komentář
Postup při léčbě axiálních forem PsA se řídí doporučeními pro léčbu AS (inhibitory TNFα a SEC). Tato léčba současně pokryje i aktivitu eventuálního periferního postižení u kombinovaných forem nemoci.
Hodnocení léčebné odpovědi
Hodnocení léčebné odpovědi dle italských doporučení
- Remise dle klinického posouzení nebo pokles BASDAI o 50 % nebo o 2 jednotky
- Příznivý názor experta
Hodnocení léčebné odpovědi dle českých doporučení
- Odkazují na hodnocení u AS, tj. pokles BASDAI o 50 % nebo o 2 jednotky
Komentář
Primárním cílem léčby by vždy měla být remise. Tím se rozumí absence subjektivních i objektivních známek onemocnění spolu s normalizací parametrů zánětu (sedimentace erytrocytů, C reaktivní protein ‒ pokud je příčinou jejich elevace axPsA), měla by se zastavit rovněž rentgenová progrese. Současně by mělo dojít k normalizaci funkčního postižení (dle HAQ) a kvality života i mobility páteře, pokud není podmíněna strukturálními změnami na páteři (v tom případě by omezení hybnosti nemělo pokračovat). Pokud není plná remise dosažitelná, lze akceptovat určitou reziduální nízkou aktivitu nemoci. Vzhledem k tomu, že MDA není pro axPsA definována, lze použít kritéria MDA pro periferní artritidu (tab. 2). Lze převzít také nástroje z hodnocení AS – BASDAI pro subjektivní hodnocení, BASMI (Bath Ankylosing Spondylitis Metric Index) pro hodnocení mobility páteře a BASRI (Bath Ankylosing Spondylitis Radiology Index) pro hodnocení rentgenové progrese. Rentgenologické hodnocení specificky pro PsA (Psoriatic Arthritis Spondylitis Radiologic Index, PASRI) se dosud používá jen v omezené míře.
Postup v případě selhání léčby
Postup v případě selhání léčby dle italských doporučení
- Při primárním selhání inhibitorů TNFα změna na jiný inhibitor TNFα nebo na bDMARD s jiným mechanismem účinku
- Při sekundárním selhání inhibitoru TNFα změna na jiný inhibitor TNFα
- Při nežádoucím účinku biologického léku:
- Pokud se vztahuje k celé třídě biologik (tzv. class effect), pak bDMARD s jiným mechanismem účinku
- Jinak výměna za přípravek stejné třídy
- V případě selhání biologika s jiným mechanismem účinku než inhibitor TNFα (SEC) změna na inhibitor TNFα
Postup v případě selhání léčby dle českých doporučení
- V českých doporučeních není specifikován
Komentář
Nejsou k dispozici žádná data z klinických ani observačních studií, která by specificky sledovala tuto otázku u axPsA. Proto se jeví jako racionální převzít doporučení z postupu u periferní artritidy, resp. AS.
Postup u pacienta po dosažení remise
Postup u pacienta po dosažení remise dle italských doporučení
- Při trvání remise 6 měsíců: opatrný pokus o snížení dávky
Postup u pacienta po dosažení remise dle českých doporučení
- V českých doporučeních není specifikován
Komentář
Vzhledem k úplnému chybění dat o postupu u pacientů s axPsA, kteří dosáhli remise, se musíme odvolat na zkušenosti s touto situací u AS. Ta ukazuje, že většina pacientů, kteří ukončili léčbu inhibitorem TNFα, relabovala, zatímco redukce dávky či prodloužení intervalu podávání ve většině případů remisi udrželo. Proto je oprávněné postupovat obdobně i v případě axPsA. Vždy je nezbytné zohlednit také ostatní manifestace PsA.
Postup u pacienta s extraartikulárními manifestacemi
V českých doporučeních se tato otázka řeší na různých místech v souvislosti s jednotlivými přípravky, aniž by tomuto tématu byla věnována samostatná kapitola. Nicméně se vzrůstajícím zájmem o tuto problematiku a s přibývajícími zkušenostmi bude nezbytné se v příští aktualizaci guidelines uvedené tematice věnovat.
V italských doporučeních se konstatuje to, co je známo o psoriáze, akutní přední uveitidě, Crohnově chorobě a ulcerózní kolitidě. Pokud jde o psoriázu, je ETA méně účinný než ostatní inhibitory TNFα, UST a SEC pak vykazují větší účinnost. Pacienti s uveitidou, pokud je u nich indikována biologická terapie, by měli být léčeni inhibitory TNFα, preferenčně monoklonálními protilátkami. Pacienti s Crohnovou chorobou, kteří vyžadují biologickou léčbu z revmatologické indikace, by měli být léčeni inhibitory TNFα (monoklonálními protilátkami) nebo UST. Obavy z nové manifestace Crohnovy nemoci při léčbě SEC se nepotvrdily, ale při preexistující Crohnově chorobě by SEC neměl být zaváděn, pokud se objeví revmatologická indikace.
Závěr
Diagnostice, monitoraci a léčbě PsA je v posledních letech věnována zvýšená pozornost a všechny národní společnosti prezentují aktualizace svých doporučených postupů. Česká doporučení navazují na guidelines EULAR a GRAPPA, recentně aktualizovaná doporučení italské revmatologické společnosti vycházejí ze SLR zahrnující publikace na toto téma z let 2014‒2016. Věnují se selektivně biologické léčbě a léčbě tsDMARDs (apre). O rychlosti vývoje nových léků svědčí i to, že mezitím přichází na trh nový lék z této skupiny ‒ tofacitinib. Při srovnání s českými doporučeními lze konstatovat, že strategie léčby je obdobná, stejně jako monitoring pacientů. Italský dokument podrobně zpracovává problematiku axiální formy PsA v samostatné kapitole. S aktualizací svých doporučení přichází i francouzská a španělská revmatologická společnost. Tento bouřlivý vývoj si vynutí v krátké době rovněž další aktualizaci českých doporučených postupů.
Seznam použité literatury
- [1] Štolfa J, Vencovský, J, Pavelka K. Doporučené léčebné postupy pro psoriatickou artritidu. Česká revmatologie 2016; 24: 142‒152.
- [2] Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016; 75: 499‒510.
- [3] Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheum 2016; 5: 1060–1071.
- [4] Marchesoni A, Olivieri I, Salvarani C, et al. Recommendations for the use of biologics and other novel drugs in the treatment of psoriatic arthritis: 2017 update from the Italian Society of Rheumatology. Clin Exp Rheumatol 2017; 35: 991‒1010.
- [5] Wendling D, Lukas C, Paccou J, et al. Recommendations of the French Society for Rheumatology (SFR) on the everyday management of patients with spondyloarthritis. Joint Bone Spine 2014; 81: 6‒14.
- [6] Torre Alonso JC, Díaz Del Campo Fontecha P, Almodóvar R, et al. Recommendations of the Spanish Society of Rheumatology on treatment and use of systemic biological and non‑biological therapies in psoriatic arthritis. Rheumatol Clin 2017; Epub ahead of print.
- [7] Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54: 2665‒2673.
- [8] Patel S, Patel T, Kerdel FA. The risk of malignancy or progression of existing malignancy in patients with psoriasis treated with biologics: case report and review of the literature. Int J Dermatol 2016; 55: 487‒493.
- [9] Papp K, Gottlieb AB, Naldi L, et al. Safety surveillance for ustekinumab and other psoriasis treatments from the psoriasis longitudinal assessment and registry (PSOLAR). J Drugs Dermatol 2015; 14: 706‒714.
- [10] Porter C, Armstrong‑Fisher S, Kopotsha S, et al. Certolizumab pegol does not bind the neonatal Fc receptor (FcRn): Consequences for FcRn‑mediated in vitro transcytosis and ex vivo human placental transfer. J Rep Immunol 2016; 116: 7‒12.
- [11] Fagerli KM, Lie E, van der Heijde D, et al. The role of methotrexate co‑medication in TNF‑inhibitor treatment in patients with psoriatic arthritis: results from 440 patients included in the NOR‑DMARD study. Ann Rheum Dis 2014; 73: 132‒137.
- [12] Behrens F, Cañete JD, Olivieri I, et al. Tumour necrosis factor inhibitor monotherapy vs. combination with MTX in the treatment of PsA: a systematic review of the literature. Rheumatology 2015; 54: 915‒926.
- [13] Coates LC, Moverley AR, McParland L, et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open‑label, randomised controlled trial. Lancet 2015; 386: 2489‒2498.
- [14] Coates LC, Helliwell PS. Defining low disease activity states in psoriatic arthritis using novel composite disease instruments. J Rheumatol 2016; 43: 371‒375.
- [15] Glintborg B, Østergaard M, Krogh NS, et al. Clinical response, drug survival and predictors thereof among 548 patients with psoriatic arthritis who switched Tumor Necrosis Factorinhibitor therapy. Results from the Danish nationwide DANBIO registry. Arthritis Rheum 2013; 65: 1213‒1223.
- [16] Fagerli KM, Lie E, van der Heijde D, et al. Switching between TNF inhibitors in psoriatic arthritis: data from the NORDMARD study. Ann Rheum Dis 2013; 72: 1840‒1844.
- [17] Kristensen LE, Lie E, Jacobsson LTH, et al. Effectiveness and feasibility associated with switching to a second or third TNF inhibitor in patients with psoriatic arthritis: A cohort study from Southern Sweden. J Rheumatol 2016; 43: 81‒87.
- [18] Cantini F, Niccoli L, Cassara E, et al. Sustained maintenance of clinical remission after adalimumab dose reduction in patients with early psoriatic arthritis: a long‑term follow‑up study. Biologics 2012; 6: 201‒206.
- [19] Fong W, Holroyd C, Davidson B, et al. The effectiveness of a real life dose reduction strategy for tumour necrosis factor inhibitors in ankylosing spondylitis and psoriatic arthritis. Rheumatology 2016; 55: 1837‒1842
- [20] Araujo EG, Finzel S, Englbrecht M, et al. High incidence of disease recurrence after discontinuation of disease‑modifying anti‑rheumatic drug treatment in patients with psoriatic arthritis in remission. Ann Rheum Dis 2015; 74: 655‒660.
- [21] Healy PJ, Helliwell PS. Measuring clinical enthesitis in psoriatic arthritis: Assessment of existing measures and development of an instrument specific to psoriatic arthritis. Arthritis Rheum 2008; 59: 686‒689.
- [22] Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015. Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol 2016; 68: 1060‒1071.
- [23] Nash P, Lubrano E, Cauli, A, et al. Updated Guidelines for the Management of Axial Disease in Psoriatic Arthritis. J Rheumatol 2014; 41: 11.
- [24] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Čes Revmatol 2012; 20: 4‒11; 12: 30‒35.
- [25] Schoels M, Aletaha D, Alasti F, et al. Disease activity in psoriatic arthritis (PsA): defining remission and treatment success using the DAPSA score. Ann Rheum Dis 2016; 75: 811‒818.
- [26] Bergman M, Lundholm A. Mitigation of disease‑ and treatment‑related risks in patients with psoriatic arthritis. Arthritis Res Ther 2017; 19: 63.