Léčba nemocné s aktivní revmatoidní artritidou a četnými komorbiditami: účinné a bezpečné využití sarilumabu
Souhrn
Hušáková M. Léčba nemocné s aktivní revmatoidní artritidou a četnými komorbiditami: účinné a bezpečné využití sarilumabu. Remedia 2023; 33: 292–297.
Cílem léčby revmatoidní artritidy (RA) je dosažení remise, nebo alespoň nízké aktivity onemocnění. Recentní doporučení EULAR představují strategii, jak tohoto cíle dosáhnout a jak dále postupovat v léčbě při dosažení remise onemocnění. Komorbidity mohou ovlivňovat průběh RA, ale i omezovat léčebné možnosti. Léčba pomocí inhibitoru interleukinu 6 je účinná pro nemocné s RA i v monoterapii. Na příkladu předkládané kazuistiky představujeme rovněž bezpečnost této léčby u nemocné s řadou komorbidit.
Klíčová slova: revmatoidní artritida – komorbidity – aktivita onemocnění – sarilumab – infekční komplikace.
Summary
Husakova M. The treatment of a female patient with rheumatoid arthritis and many comorbidities: effective and safe sarilumab use. Remedia 2023; 33: 292–297.
The aim of rheumatoid arthritis (RA) treatment is the achievement of remission or, at least, low disease activity. Recent EULAR guidelines offer a strategy enabling clinicians to reach this target and to further head towards full disease remission. Comorbidities may influence not only the course of RA; they may also limit the treatment possibilities. Therapy with interleukin‑6 inhibitor is effective for RA even in monotherapy. Within this case study, we demonstrate the safety of this treatment in a female patient with many comorbidities.
Key words: rheumatoid arthritis – comorbidities – disease activity – sarilumab – infectious complications.
Úvod
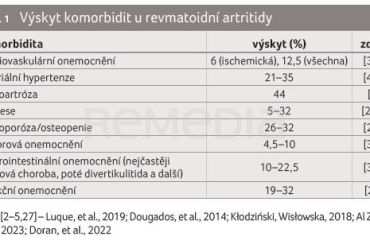 Revmatoidní artritida (RA) je chronické zánětlivé onemocnění, které doprovází nemocného po celý jeho život. V současné době je RA nemocí velmi dobře léčitelnou: k dispozici je řada farmakologických přípravků s prokázaným účinkem i bezpečností – nejen na úrovni registračních studií, ale i dle dlouhodobých dat z klinických registrů. Expandující vědomosti o patogenezi, průběhu onemocnění a odpovědi na léčbu jsou reflektovány i v terapeutické strategii, kterou v updatu 2022 představila EULAR (European Alliance of Associations for Rheumatology): cílem je dosažení trvalé remise, nebo alespoň nízké aktivity onemocnění, předcházení radiografické progresi a funkčnímu postižení [1]. RA bývá spojována s řadou komorbidit (tab. 1), které mohou ovlivňovat průběh a léčbu onemocnění, snižovat kvalitu života, anebo i zvyšovat morbiditu a mortalitu pacientů [1–5]. Léčba RA proto musí vždy reflektovat i současné komorbidity nemocných a být upravována tak, aby byla pro nemocného optimální [1].
Revmatoidní artritida (RA) je chronické zánětlivé onemocnění, které doprovází nemocného po celý jeho život. V současné době je RA nemocí velmi dobře léčitelnou: k dispozici je řada farmakologických přípravků s prokázaným účinkem i bezpečností – nejen na úrovni registračních studií, ale i dle dlouhodobých dat z klinických registrů. Expandující vědomosti o patogenezi, průběhu onemocnění a odpovědi na léčbu jsou reflektovány i v terapeutické strategii, kterou v updatu 2022 představila EULAR (European Alliance of Associations for Rheumatology): cílem je dosažení trvalé remise, nebo alespoň nízké aktivity onemocnění, předcházení radiografické progresi a funkčnímu postižení [1]. RA bývá spojována s řadou komorbidit (tab. 1), které mohou ovlivňovat průběh a léčbu onemocnění, snižovat kvalitu života, anebo i zvyšovat morbiditu a mortalitu pacientů [1–5]. Léčba RA proto musí vždy reflektovat i současné komorbidity nemocných a být upravována tak, aby byla pro nemocného optimální [1].
Kazuistika
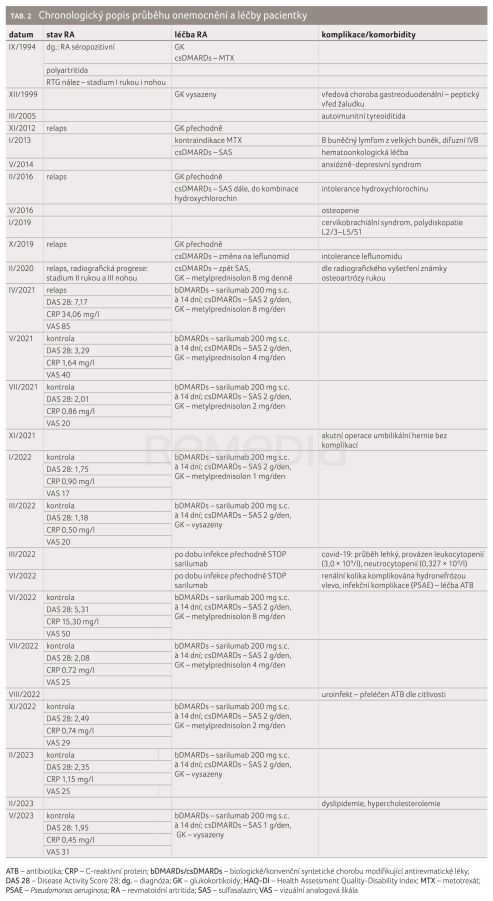 V tomto kazuistickém sdělení představujeme nemocnou s letitou anamnézou RA (tab. 2). Onemocnění se u pacientky objevilo ve věku 42 let jako aktivní polyartritida, která byla séropozitivní. Stav byl zhodnocen jako séropozitivní RA, nemocná byla vcelku zavčas předána do péče revmatologie a byla u ní zahájena léčba glukokortikoidy a metotrexátem (MTX). Tato léčba byla úspěšná, co se aktivity onemocnění týče. Po pěti letech léčby, kdy pacientka stále užívala glukokortikoidy, byť v nízkých dávkách, došlo k rozvoji vředové choroby gastroduodenální. Po zaléčení byly glukokortikoidy vysazeny a nemocná zůstala na dlouhodobé terapii MTX. Relapsy onemocnění byly zvládány přechodně glukokortikoidy – ať intraartikulární aplikací, nebo i systémově.
V tomto kazuistickém sdělení představujeme nemocnou s letitou anamnézou RA (tab. 2). Onemocnění se u pacientky objevilo ve věku 42 let jako aktivní polyartritida, která byla séropozitivní. Stav byl zhodnocen jako séropozitivní RA, nemocná byla vcelku zavčas předána do péče revmatologie a byla u ní zahájena léčba glukokortikoidy a metotrexátem (MTX). Tato léčba byla úspěšná, co se aktivity onemocnění týče. Po pěti letech léčby, kdy pacientka stále užívala glukokortikoidy, byť v nízkých dávkách, došlo k rozvoji vředové choroby gastroduodenální. Po zaléčení byly glukokortikoidy vysazeny a nemocná zůstala na dlouhodobé terapii MTX. Relapsy onemocnění byly zvládány přechodně glukokortikoidy – ať intraartikulární aplikací, nebo i systémově.
Za 19 let od stanovení diagnózy RA se u pacientky objevil velkobuněčný B lymfom, který si vyžádal komplexní hematoonkologickou léčbu. Bohužel byl v tu dobu z hematologického pohledu kontraindikován MTX. Nemocná byla tedy převedena na léčbu sulfasalazinem. Objevily se u ní další komorbidity – a sice rozvoj depresivních stavů, rozvoj degenerativního postižení páteře a osteopenie. Během dalších let pak pacientka prodělala několik relapsů, které byly řešeny přechodným navýšením dávky glukokortikoidů, proběhly pokusy o změnu konvenčních syntetických chorobu modifikujících léků (conventional synthetic disease‑modifying antirheumatic drugs, csDMARDs) – kombinace sulfasalazinu s plaquenilem anebo změna na leflunomid. Všechny tyto postupy však byly spojeny s neefektivitou a/nebo s intolerancí.
Postupně došlo k progresi RA – a to jak radiografické, tak relapsu aktivity onemocnění – a nemocná byla předána do péče centra s biologickou léčbou. Pro vysokou aktivitu onemocnění (DAS [Disease Activity Score] 28: 7,17) byla zahájena léčba sarilumabem. Léčba byla velmi dobře tolerována, pouze s minimálními lokálními projevy po subkutánní (s.c.) aplikaci, které pacientka hodnotila jen jako přechodné a nebyly důvodem k vysazení terapie. Po šesti měsících bylo dosaženo remise onemocnění a byla zahájena detrakce glukokortikoidů. Mezi šestým a devátým měsícem léčby sarilumabem nemocná podstoupila akutní chirurgický zákrok pro uskřinutí umbilikální hernie. Výkon proběhl bez komplikací a léčba sarilumabem byla přerušena na nezbytně dlouhou dobu.
Po 12 měsících léčby sarilumabem byly vysazeny glukokortikoidy a nemocná byla v setrvalé remisi. Následovala však další komplikace – u nemocné propukl covid‑19. Vzhledem k vysokému riziku byla zaléčena molnupiravirem a průběh onemocnění byl lehký. V tu dobu se u pacientky rozvinula leukocytopenie a neutrocytopenie – ač by se mohlo jednat o nežádoucí projev stávající revmatologické medikace, došlo k úplné úpravě a nález byl zhodnocen jako součást virového onemocnění. Během akutního virového infektu nebyla podána jedna dávka sarilumabu. Po odeznění infektu, včetně normalizace krevního obrazu, byla léčba opět nastavena. Nicméně za zhruba dva měsíce nastala další komplikace – nemocná prodělala renální koliku s hydronefrózou, která si vyžádala zavedení stentu a byla komplikována infekcí Pseudomonas aeruginosa a nutností antibiotické terapie. Léčba sarilumabem musela být opět přerušena. V tomto období došlo k relapsu artritidy, DAS 28: 5,31. Kvůli aktivitě onemocnění byla zvažována změna terapie RA – ovšem i vzhledem k preferenci nemocné a hematologické anamnéze nebyl proveden switch na jiný z možných bDMARDs, ale do medikace byly přechodně zavedeny glukokortikoidy. Stav se zlepšil a na kontrole po měsíci již bylo dosaženo remise a byla zahájena detrakce glukokortikoidů. V dalším průběhu se opět vyskytla uroinfekce, ovšem po zaléčení bez komplikací a bez deteriorace celkového stavu nemocné. Po dvou letech léčby sarilumabem se zhoršily nálezy lipidového metabolismu a u nemocné byla zavedena farmakoterapie dyslipidemie.
Diskuse
U nemocných s RA se velmi často vyskytují komorbidity, které ovlivňují terapii. U naší nemocné byla léčba RA zásadně ovlivněna současným velkobuněčným B lymfomem. Maligní onemocnění se mohou u nemocných s RA objevit častěji než v běžné populaci [3,4], pokud jde o výskyt lymfomů, ukazují se až dvojnásobně zvýšená rizika oproti běžné populaci [6]. Na lymfoproliferativních onemocněních se u RA podílí pravděpodobně řada faktorů – od zánětlivého nastavení organismu (například tumor nekrotizující faktor alfa [TNF] nebo interleukin [IL] 6 patří mezi růstové faktory pro rozvoj lymfomů a některé z polymorfismů TNF genu jsou spojeny s rozvojem velkobuněčného B lymfomu) přes infekce (zejména infekce virem Epsteina–Barrové) až po imunosupresivní terapii [7]. Recentní japonská retrospektivní práce ukazuje na možné vyšší riziko vzniku lymfomu nejčastěji v prvních 3–4 letech po zahájení léčby MTX nebo jeho kombinací s ostatními imunosupresivy oproti běžné populaci [8]. Vyšší riziko však nemusí být dáno léčbou, ale může souviset s některými společnými patogenetickými cestami u aktivního onemocnění – to by vysvětlovalo i fakt, že zvýšené riziko bylo v této studii zjištěno u nemocných s kombinovanou terapií používanou u vysoce aktivních nemocných s nedostatečným efektem samotného MTX. Další imunosupresivní léčba RA by po zjištění onkologického onemocnění měla být vedena ve spolupráci s onkologem/hematoonkologem. U naší nemocné byla nastavena kontraindikace k MTX a azathioprinu.
Záměna MTX za jiný z csDMARDs je dle doporučení pro léčbu RA možná, pokud je MTX kontraindikován a nejsou přítomny negativní prognostické znaky. Negativní prognostické znaky jsou definovány vysokou aktivitou onemocnění, sérologickými parametry (pozitivní revmatoidní faktory a/nebo přítomnost protilátek proti citrulinovaným proteinům) a časnými strukturálními změnami [9–11]. K dalším negativním faktorům patří zhoršené funkční parametry (hodnoceno pomocí Health Assessment Questionnaire [HAQ]), opožděné zahájení léčby nebo diagnózy, v doporučeních American College of Rheumatology (ACR) nacházíme i údaje o přítomnosti extraartikulárních manifestací [11]. Studie SWEFOT dále prokázala kouření jako nezávislý prediktor pro radiografickou progresi, nicméně ve studii ESPOIR toto nebylo potvrzeno, a omezení kouření tak patří k doporučeným nefarmakologickým postupům v léčbě RA [1,12,13]. Další negativní prognostické znaky, jako jsou genetické predispozice, přítomnost kostního edému na zobrazení magnetickou rezonancí (MR) nebo aktivity při vyšetření dopplerovskou ultrasonografií [14,15] či zjištění aktivity onemocnění pomocí multibiomarkerové analýzy (sérových hladin TNF receptoru 1, IL‑6, VCAM‑1, EGF, VEGF‑A, YKL40, MMP1, MMP3, SAA, leptinu a resistinu) [16] nepatří v současné době prozatím k markerům pro využití v běžné klinické praxi [17].
Dle recentního updatu 2022 pro léčbu RA je při přítomnosti negativních prognostických znaků a aktivitě onemocnění doporučeno přejít po selhání MTX k biologickým (b), resp. k cíleným syntetickým (ts)DMARDs. Nemocní, kteří jsou léčeni bDMARDs nebo tsDMARDs, by měli současně užívat csDMARDs – u nemocných, u nichž nelze csDMARDs použít jako komedikaci, je vhodné použít inhibitor IL‑6 nebo tsDMARDs [1]. Mezi tsDMARDs patří inhibitory Janus kináz (JAKi). V roce 2019 Yttenberg a kol. zveřejnili randomizovanou otevřenou studii, která zahrnula nemocné starší 50 let s přítomností kardiovaskulárních rizikových faktorů – 1 455 pacientů užívajících tofacitinib v dávce 5 mg, 1 456 pacientů užívajících tofacitinib v dávce 10 mg a 1 451 pacientů léčených inhibitory TNF (TNFi) [18]. Ve skupinách s tofacitinibem bylo zjištěno zvýšené riziko pro výskyt závažných nežádoucích kardiovaskulárních příhod, nádorových onemocnění a infekce herpes zoster. Obdobné výsledky ale nebyly potvrzeny v extenzích studií nebo v registrech [19,20]. Na podkladě těchto informací vyvstává řada otázek ohledně léčby nemocných s RA – nicméně u naší pacientky, která byla starší 65 let a měla anamnézu lymfomu, jsme nemohli JAKi využít. Rozhodli jsme se tedy, po konzultaci s hematoonkologem, pro léčbu inhibicí IL‑6.
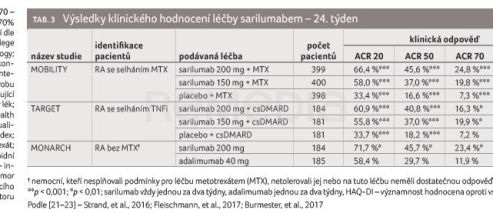 Sarilumab je lidská monoklonální protilátka typu imunoglobulinu G1 (IgG1), která se váže na solubilní i membránový receptor pro IL‑6 a inhibuje IL‑6 zprostředkovanou signální dráhu. Aplikace sarilumabu probíhá subkutánně, v dávce 200 mg nebo 150 mg. Klinická účinnost sarilumabu byla prokázána ve třech randomizovaných, dvojitě zaslepených kontrolovaných multicentrických studiích – MOBILITY, TARGET a MONARCH – u nemocných s aktivní RA starších 18 let (tab. 3). Ve studiích MOBILITY a TARGET byly testovány účinnost a bezpečnost použití sarilumabu v dávce 150 mg i 200 mg u nemocných se selháním MTX [21], resp. TNFi [22], studie MONARCH proběhla s aktivním komparátorem – adalimumabem [23]. Odpovědi ACR 20 jako primárního cíle se podařilo dosáhnout ve všech studiích, ve studiích MONARCH a TARGET došlo i k dosažení dalšího z primárních cílů – zlepšení funkčních schopností při hodnocení HAQ v týdnu 16, resp. 12, s přetrváváním do týdne 24 (tab. 3). Ve studii MOBILITY byl splněn i další primární cíl – snížení radiografické progrese: při hodnocení v 52. týdnu byla zjištěna signifikantně nižší radiografická progrese v celkovém modifikovaném Sharpově skóre, včetně skóre erozí u dávky sarilumabu 200 mg (0,25 a 0,05) i u dávky 150 mg (0,90 a 0,42) oproti placebu (2,78 a 1,46, vše p < 0,0001) a u obou dávek i ve skóre zúžení kloubní štěrbiny (placebo 1,32; sarilumab 200 mg 0,20; p < 0,0001 a sarilumab 150 mg 0,47; p < 0,001). Dvouletá data z návazné studie EXTEND ukázala nejlepší výstup v udržení nízké radiografické progrese u nemocných s iniciální dávkou 200 mg [24].
Sarilumab je lidská monoklonální protilátka typu imunoglobulinu G1 (IgG1), která se váže na solubilní i membránový receptor pro IL‑6 a inhibuje IL‑6 zprostředkovanou signální dráhu. Aplikace sarilumabu probíhá subkutánně, v dávce 200 mg nebo 150 mg. Klinická účinnost sarilumabu byla prokázána ve třech randomizovaných, dvojitě zaslepených kontrolovaných multicentrických studiích – MOBILITY, TARGET a MONARCH – u nemocných s aktivní RA starších 18 let (tab. 3). Ve studiích MOBILITY a TARGET byly testovány účinnost a bezpečnost použití sarilumabu v dávce 150 mg i 200 mg u nemocných se selháním MTX [21], resp. TNFi [22], studie MONARCH proběhla s aktivním komparátorem – adalimumabem [23]. Odpovědi ACR 20 jako primárního cíle se podařilo dosáhnout ve všech studiích, ve studiích MONARCH a TARGET došlo i k dosažení dalšího z primárních cílů – zlepšení funkčních schopností při hodnocení HAQ v týdnu 16, resp. 12, s přetrváváním do týdne 24 (tab. 3). Ve studii MOBILITY byl splněn i další primární cíl – snížení radiografické progrese: při hodnocení v 52. týdnu byla zjištěna signifikantně nižší radiografická progrese v celkovém modifikovaném Sharpově skóre, včetně skóre erozí u dávky sarilumabu 200 mg (0,25 a 0,05) i u dávky 150 mg (0,90 a 0,42) oproti placebu (2,78 a 1,46, vše p < 0,0001) a u obou dávek i ve skóre zúžení kloubní štěrbiny (placebo 1,32; sarilumab 200 mg 0,20; p < 0,0001 a sarilumab 150 mg 0,47; p < 0,001). Dvouletá data z návazné studie EXTEND ukázala nejlepší výstup v udržení nízké radiografické progrese u nemocných s iniciální dávkou 200 mg [24].
Bezpečnostní profil léčby byl ve studiích prokázán jako velmi dobrý – ve dvouleté extenzi studie MOBILITY patřily k nejčastějším nežádoucím účinkům neutropenie, lokální reakce v oblasti vpichu, infekce horních cest dýchacích, zvýšená aktivita alaninaminotransferázy, v menší míře se vyskytly močové infekce, nazofaryngitidy, bronchitidy, leukocytopenie, průjmy a hypertenze [24]. K dalším nežádoucím projevům patří elevace hodnoty celkového cholesterolu [25]. Letošní data z otevřených extenzí (studie EXTEND a MONARCH‑OLE) ukazují setrvalý bezpečnostní profil sarilumabu. U nemocných léčených monoterapií, při pokračování i změnách terapie se dále vzácně vyskytují závažné nežádoucí projevy, jako jsou kardiovaskulární příhody, tromboembolické komplikace nebo malignity. Nejčastějším nežádoucím projevem bývá neutropenie, která ale není spojena s vyšším výskytem infekcí [26].
Závěr
Léčbou sarilumabem jsme u naší pacientky docílili remise základního onemocnění a dále trvá i remise hematoonkologického onemocnění. Po dvou letech neshledáváme ani radiografickou progresi RA. Z nežádoucích projevů se vyskytly pouze známky lokálního podráždění během aplikace, které pacientka hodnotí jako tolerovatelné, a zvýšené koncentrace celkového cholesterolu. Během dvouleté terapie jsme jednou zaznamenali leukocytopenii a neutrocytopenii, nikoliv však v rámci nežádoucích účinků sarilumabu, ale spíše jako projev infekce covid‑19. Nemocná prodělala infekci covid‑19 s lehkým průběhem, aplikace molnupiraviru proběhla bez komplikací. Problémem zůstává opakování uroinfekcí. Zvýšený výskyt infekčních onemocnění může být konkomitantním projevem u nemocných s RA [27], zvláště na imunosupresivní terapii. V souladu s doporučením EULAR jsme u naší nemocné vzhledem k remisi onemocnění dosáhli ukončení terapie glukokortikoidy. Recentní práce ukazují na možný pokles výskytu infekcí u nemocných s RA starších 60 let, u kterých jsou glukokortikoidy detrahovány [28]. Detrakce glukokortikoidů je u naší nemocné důležitá i pro další komorbiditu, osteopenii. Lze shrnout, že léčba sarilumabem v dávce 200 mg aplikované jednou za 14 dní je účinná a bezpečná a může být využita i u nemocných trpících RA s různou mírou komorbidit.
Literatura
[1] Smolen JS, Landewé R, Bergstra SA, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs: 2022 update. Ann Rheum Dis 2023; 82: 3–18.
[2] Luque Ramos A, Redeker I, Hoffmann F, et al. Comorbidities in Patients with Rheumatoid Arthritis and Their Association with Patient‑reported Outcomes: Results of Claims Data Linked to Questionnaire Survey. J Rheumatol 2019; 46: 564–571.
[3] Dougados M, Soubrier M, Antunez A, et al. Prevalence of comorbidities in rheumatoid arthritis and evaluation of their monitoring: results of an international, cross‑sectional study (COMORA). Ann Rheum Dis 2014; 73: 62–68.
[4] Kłodziński Ł, Wisłowska M. Comorbidities in rheumatic arthritis. Reumatologia 2018; 56: 228–233.
[5] Al Zo’ubi M, Tarawneh BA, Zaydi MA, et al. Cardiovascular risk factors among Jordanian patients with rheumatoid arthritis: A cohort study. Int J Rheum Dis 2023; 26: 1337–1342.
[6] Simon TA, Thompson A, Gandhi KK, et al. Incidence of malignancy in adult patients with rheumatoid arthritis: a meta‑analysis. Arthritis Res Ther 2015; 17: 212. Erratum in: Arthritis Res Ther 2016; 18: 100.
[7] Gion Y, Iwaki N, Takata K, et al. Clinicopathological analysis of methotrexate‑associated lymphoproliferative disorders: Comparison of diffuse large B‑cell lymphoma and classical Hodgkin lymphoma types. Cancer Sci 2017; 108: 1271–1280.
[8] Inose R, Nakamura A, Omi R, et al. of malignant lymphoma in rheumatoid arthritis patients receiving methotrexate‑alone and in combination therapy compared with the general population: A study based on a Japanese medical claims database. Int J Clin Pharmacol Ther 2023; doi: 10.5414/CP204372. Epub ahead of print.
[9] Ferraccioli G, Tolusso B, Fedele AL, Gremese E. Do we need to apply a T2T strategy even in ACPA‑negative early rheumatoid arthritis? YES. RMD Open 2016; 2: e000263.
[10] Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2014; 73: 492–509.
[11] Singh JA, Furst DE, Bharat A, et al. 2012 update of the 2008 American College of Rheumatology recommendations for the use of disease‑modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2012; 64: 625–639.
[12] Saevarsdottir S, Rezaei H, Geborek P, et al. Current smoking status is a strong predictor of radiographic progression in early rheumatoid arthritis: results from the SWEFOT trial. Ann Rheum Dis 2015; 74: 1509–1514.
[13] Granger B, Combe B, Loet XL, et al. Performance of matrices developed to identify patients with early rheumatoid arthritis with rapid radiographic progression despite methotrexate therapy: an external validation study based on the ESPOIR cohort data. RMD Open 2016; 2: e000245.
[14] Sreerangaiah D, Grayer M, Fisher BA, et al. Quantitative power Doppler ultrasound measures of peripheral joint synovitis in poor prognosis early rheumatoid arthritis predict radiographic progression. Rheumatology (Oxford) 2016; 55: 89–93.
[15] Naredo E, Collado P, Cruz A, et al. Longitudinal power Doppler ultrasonographic assessment of joint inflammatory activity in early rheumatoid arthritis: predictive value in disease activity and radiologic progression. Arthritis Rheum 2007; 57: 116–124.
[16] Centola M, Cavet G, Shen Y, et al. Development of a multi‑biomarker disease activity test for rheumatoid arthritis. PLoS One 2013; 8: e60635. Erratum in: PLoS One 2014; 9: e99812.
[17] Albrecht K, Zink A. Poor prognostic factors guiding treatment decisions in rheumatoid arthritis patients: a review of data from randomized clinical trials and cohort studies. Arthritis Res Ther 2017; 19: 68.
[18] Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N Engl J Med 2022; 386: 316–326.
[19] Kremer JM, Bingham III CO, Cappelli LC, et al. Postapproval Comparative Safety Study of Tofacitinib and Biological Disease‑Modifying Antirheumatic Drugs: 5‑Year Results from a United States‑Based Rheumatoid Arthritis Registry. ACR Open Rheumatol 2021; 3: 173–184.
[20] Wollenhaupt J, Lee EB, Curtis JR, et al. Safety and efficacy of tofacitinib for up to 9.5 years in the treatment of rheumatoid arthritis: final results of a global, open‑label, long‑term extension study. Arthritis Res Ther 2019; 21: 89.
[21] Strand V, Kosinski M, Chen CI, et al. Sarilumab plus methotrexate improves patient‑reported outcomes in patients with active rheumatoid arthritis and inadequate responses to methotrexate: results of a phase III trial. Arthritis Res Ther 2016; 18: 198.
[22] Fleischmann R, van Adelsberg J, Lin Y, et al. Sarilumab and Nonbiologic Disease‑Modifying Antirheumatic Drugs in Patients With Active Rheumatoid Arthritis and Inadequate Response or Intolerance to Tumor Necrosis Factor Inhibitors. Arthritis Rheumatol 2017; 69: 277–290.
[23] Burmester GR, Lin Y, Patel R, et al. Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double‑blind, parallel‑group phase III trial. Ann Rheum Dis 2017; 76: 840–847.
[24] Genovese MC, vanAdelsberg J, Fan C, et al. Two years of sarilumab in patients with rheumatoid arthritis and an inadequate response to MTX: safety, efficacy and radiographic outcomes. Rheumatology (Oxford) 2018; 57: 1423–1431.
[25] Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab Plus Methotrexate in Patients With Active Rheumatoid Arthritis and Inadequate Response to Methotrexate: Results of a Phase III Study. Arthritis Rheumatol 2015; 67: 1424–1437.
[26] Burmester GR, Strand V, Kivitz AJ, et al. Long‑term safety and efficacy of sarilumab with or without background csDMARDs in rheumatoid arthritis. Rheumatology (Oxford) 2023: kead062.
[27] Doran MF, Crowson CS, Pond GR, et al. Frequency of infection in patients with rheumatoid arthritis compared with controls: a population‑based study. Arthritis Rheum 2002; 46: 2287–2293.
[28] Goto Y, Nagafuchi H, Kaga Y, Kawahata K. Association between glucocorticoid discontinuation and incidence of infection in older adults with rheumatoid arthritis: A retrospective cohort study. Int J Rheum Dis 2023; doi: 10.1111/1756‑185X.14851.