Lorlatinib v léčbě nemalobuněčného karcinomu plic
Souhrn:
Koubková L. Lorlatinib v léčbě nemalobuněčného karcinomu plic. Remedia 2020; 30: 353–358.
Cílená léčba inhibitory tyrozinkináz (TKI) u pacientů s pokročilým nemalobuněčným karcinomem plic (non‑small cell lung cancer, NSCLC) s prokázanými genetickými změnami, které predikují její účinnost, vede k výraznému zlepšení léčebných výsledků. Mezi genetické aberace léčené TKI patří také přestavba genu anaplastické lymfomové kinázy (ALK) a genu ROS1. Lorlatinib je selektivní tyrozinkinázový inhibitor ALK/ROS1 třetí generace, který prokázal svoji účinnost při selhání léčby TKI nižší generace. V květnu 2019 byl lorlatinib v monoterapii schválen Evropskou lékovou agenturou (EMA) k léčbě dospělých pacientů s pokročilým ALK pozitivním NSCLC, u nichž došlo k progresi onemocnění po léčbě alektinibem nebo ceritinibem nebo po léčbě krizotinibem a nejméně jedním dalším ALK TKI.
Summary:
Koubkova L. Lorlatinib in the treatment of non‑small cell lung cancer. Remedia 2020; 30: 353–358.
Targeted treatment with tyrosine kinase inhibitors (TKIs) in patients with advanced non‑small cell lung cancer (NSCLC) with proven genetic alterations that predict its efficacy leads to significant improvements in treatment outcomes. These genetic aberrations also include rearrangement of the ALK (anaplastic lymphoma kinase) gene and the ROS1 gene. Lorlatinib is a selective 3rd generation ALK/ROS1 tyrosine kinase inhibitor that has been shown to be effective in the failure of lower generation TKI therapy. In May 2019, lorlatinib monotherapy was approved by the European Medicines Agency (EMA) for the treatment of adult patients with advanced ALK‑positive NSCLC who developed disease progression after treatment with alectinib or ceritinib or after treatment with crizotinib and at least one other ALK TKI.
Key words: non‑small cell lung cancer, ALK and ROS1 gene rearrangement, lorlatinib
Úvod
Přestavba genu anaplastické lymfomové kinázy (ALK) se vyskytuje poměrně vzácně, asi u 4‒5 % případů nemalobuněčného plicního karcinomu (non small cell lung cancer, NSCLC). Nejčastěji se jedná o pacienty s adenokarcinomem, nekuřáky nebo slabé kuřáky, mladší pacienty, s mírnou převahou žen. Přestavba genu ROS1 se vyskytuje u podobné skupiny pacientů ještě vzácněji, odhaduje se na 1‒2 % NSCLC.
Gen kódující ALK se nachází na chromozomu 2 a kóduje tyrozinkinázový receptor. U ALK pozitivních NSCLC prochází gen ALK přeskupením (také známým jako translokace) uvnitř chromozomu. Translokace ALK představuje intrachromozomální přeskupení, které má za následek strukturální změnu chromozomu a fúzi dvou genů, což vede k expresi ALK fúzního proteinu. ALK fúzní proteiny podporují růst nádoru a přežívání prostřednictvím aberantní aktivace signálních drah, které se podílejí na regulaci přežití a proliferaci buněk. Nejčastějším fúzním partnerem pro ALK u NSCLC je EML4 (tj. fúzní onkogen EML4 ALK) [1].
Gen ROS1 (repressor of silencing 1) je transmembránový gen tyrozinkinázové rodiny inzulinových receptorů umístěný na q21 chromozomu 6. Přestavba genu ROS1 je soustředěna převážně v exonu 32–36. U NSCLC bylo nalezeno alespoň devět různých typů fúzí, mezi nimiž jsou běžné CD74 ROS1, EZR ROS1 a SLC34A2 ROS1. Fúze ROS1 se většinou vyskytuje samostatně a nebývá kombinována s jinými alteracemi, které se vyskytují u NSCLC [2].
Až u 40 % pacientů s ALK pozitivním (ALK+) a ROS1 pozitivním (ROS1+) NSCLC nacházíme mozkové metastázy již při stanovení diagnózy, u zbývající skupiny pacientů často dochází k progresi do CNS v dalším průběhu onemocnění.
Ačkoliv inhibitor ALK/ROS1 první
generace krizotinib změnil léčebné schéma u ALK a ROS1
pozitivních pacientů s pokročilým NSCLC, v důsledku
vzniku rezistence musíme po iniciální odpovědi počítat
s progresí onemocnění. Vznik rezistence musíme brát v úvahu
i při léčbě inhibitory ALK druhé generace.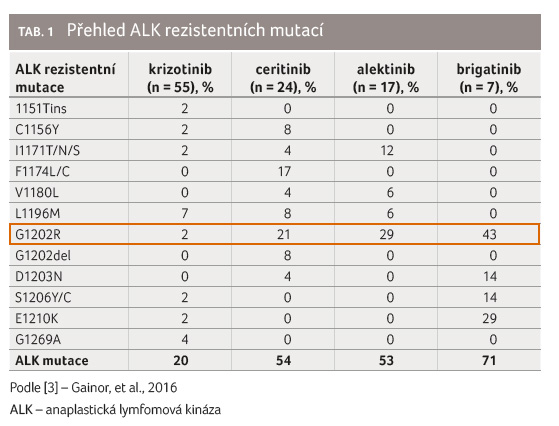
Na vzniku rezistence se podílí celá řada mechanismů, včetně rezistentních mutací [3,4]. V analýze biopsií nádoru ALK pozitivních pacientů, u kterých došlo k progresi, byly ALK rezistentní mutace nalezeny u 56 % osob (u ceritinibu v 54 %, u alektinibu v 53 % a u brigatinibu v 71 %). Každý inhibitor ALK měl odlišné spektrum ALK rezistentních mutací, což pravděpodobně odráží strukturální rozdíly mezi jednotlivými přípravky (tab. 1).
Lorlatinib
v klinických studiích
Lorlatinib (Lorviqua)
je selektivní inhibitor třetí generace působící
kompetitivně v adenosintrifosfát (ATP) vazebných místech
tyrozinkináz ALK a ROS1. V preklinických studiích
lorlatinib vykazoval značnou protinádorovou aktivitu u myší
s nádorovými xenografty exprimujícími protein EML4 fúzovaný
s ALK variantou 1, včetně ALK mutací L1196M, G1269A, G1202R
a I1171T. Dvě z těchto ALK mutací, G1202R a I1171T,
prokazatelně vedou k rezistenci nádoru na alektinib,
brigatinib, ceritinib a krizotinib (tab. 2). Lorlatinib byl také schopen pronikat
hematoencefalickou bariérou [5].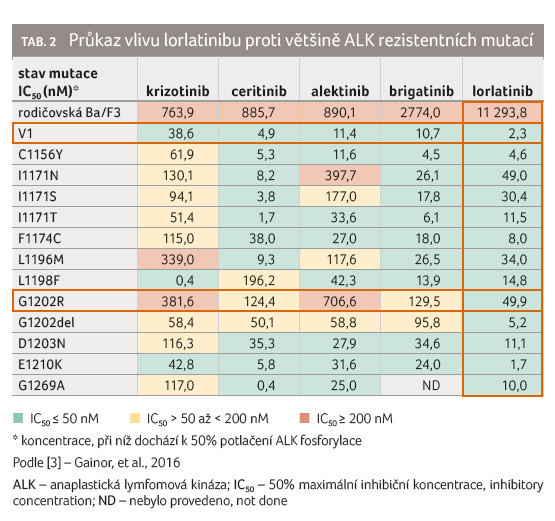
Postupně jsou prezentovány aktualizované výsledky studie fáze I/II s ALK+ a ROS1+ metastatickým NSCLC [6,7].
Na základě části studie fáze I zabývající se dávkou lorlatinibu byla doporučena dávka 100 mg jednou denně. Lorlatinib byl dobře tolerován, většina nežádoucích účinků byla stupně 1 a 2, nejčastější nežádoucí účinky představovaly hypercholesterolemie a periferní otoky. Medián doby trvání odpovědi (duration of response, DOR) u ALK a ALK/ROS1 pozitivních NSCLC byl 10,5, resp. 12,4 měsíce. Objektivní odpověď (objective response rate, ORR) činila 47 %, u pacientů s předchozí léčbou jedním inhibitorem ALK dosahovala 57 %, při léčbě dvěma a více inhibitory ALK 42 %. U ROS1 pozitivního NSCLC byla ORR 36,2 % a intrakraniální ORR (IC ORR) 56 %.
Aktualizované výsledky studie fáze II byly publikovány Salomonem a kol. v prosinci 2018 [6]. Zařazeni byli pacienti s histologicky nebo cytologicky pozitivním ALK nebo ROS1 pokročilým NSCLC s metastázami do CNS nebo bez nich, s výkonnostním stavem (performance status, PS) 0, 1 či 2. Pacienti byli zařazeni do šesti různých expanzních kohort (EXP1‒6) na základě ALK a ROS1 pozitivity a předchozí terapie a dostávali lorlatinib 100 mg perorálně jedenkrát denně kontinuálně v 21denních cyklech. Primárním cílovým ukazatelem byla ORR a IC ORR podle nezávislého centrálního hodnocení ve společných podskupinách ALK pozitivních pacientů. Sledování aktivity a bezpečnosti bylo založeno na souboru bezpečnostních analýz (tj. u všech nemocných, kteří dostávali alespoň jednu dávku lorlatinibu). Pacienti s měřitelnými metastázami do CNS při vstupu do studie byli zařazeni do analýzy intrakraniální aktivity. V této analýze byly uvedeny údaje o aktivitě lorlatinibu u ALK pozitivních pacientů (pouze EXP1‒5) a údaje o bezpečnosti u všech léčených pacientů (EXP1‒6). Uvedená studie stále probíhá a je registrována v databázi klinických studií ClinicalTrials.gov (NCT01970865).
V době mezi polovinou září
2015 a začátkem října 2016 bylo do studie zařazeno 276
pacientů: 30 osob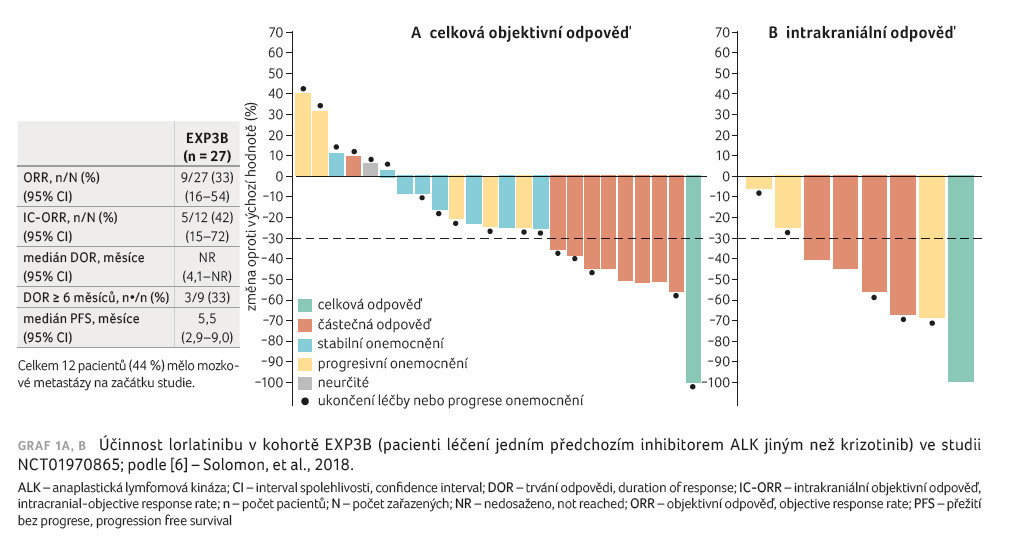 ALK+ a neléčených (EXP1), 59 osob
ALK+ a již léčených krizotinibem bez předchozí
chemoterapie (n = 27, EXP2) nebo s předchozí
chemoterapií (n = 32, EXP3A), 28 osob ALK+, jimž byl
podán jeden TKI ALK (kromě krizotinibu) s chemoterapií nebo
bez ní (EXP3B), 112 osob ALK+ a předléčených dvěma
(n = 66, EXP4) nebo třemi (n = 46, EXP5)
inhibitory ALK s chemoterapií nebo bez ní, 47 osob
ROS1+ s jakoukoliv předchozí léčbou (EXP6). Jeden
pacient v EXP4 zemřel před podáním lorlatinibu a byl
vyloučen z bezpečnostní analýzy. Ve skupině nemocných,
kteří dosud nebyli léčeni (EXP1), bylo dosaženo ORR u 27
z 30 osob (90,0 %; 95% interval spolehlivosti [CI]
73,5‒97,9). Tři pacienti v EXP1 měli měřitelné počáteční
léze v CNS podle nezávislého centrálního hodnocení
a IC ORR byly pozorovány u dvou pacientů (66,7 %;
95% CI 9,4‒99,2). Pokud jde o ALK pozitivní pacienty
s alespoň jedním předchozím inhibitorem ALK (EXP2‒5), bylo
ORR dosaženo u 93 (47,0 %; 95% Cl 39,9‒54,2)
ze 198 nemocných a IC ORR u 51 nemocných
s měřitelnou výchozí lézí v CNS (63,0 %; 95% Cl
51,5‒73,4) z celkového počtu 81 pacientů. ORR bylo
dosaženo u 41 (69,5 %; 95% CI 56,1‒80,8) z 59
acientů, kteří dostali jako předchozí léčbu pouze
krizotinib (EXP2‒3A), u celkem devíti (32,1 %; 95% CI
15,9‒52,4) z 28 pacientů s jedním předchozím
inhibitorem ALK jiným než krizotinib (EXP3B) a 43 (38,7 %;
95% Cl 29,6‒48,5) ze 111 pacientů s léčbou dvěma
nebo více předchozími inhibitory ALK (EXP4‒5). IC ORR bylo
dosaženo u 20 (87,0 %; 95% CI 66,4–97,2) z 23 pacientů
s měřitelnými výchozími lézemi v CNS v EXP2‒3A,
u pěti (55,6 %; 95% Cl 21,2‒86, 3) z devíti pacientů
v EXP3B a u 26 (53,1 %; 95% Cl 38,3‒67,5) ze 49
pacientů v EXP4‒5
ALK+ a neléčených (EXP1), 59 osob
ALK+ a již léčených krizotinibem bez předchozí
chemoterapie (n = 27, EXP2) nebo s předchozí
chemoterapií (n = 32, EXP3A), 28 osob ALK+, jimž byl
podán jeden TKI ALK (kromě krizotinibu) s chemoterapií nebo
bez ní (EXP3B), 112 osob ALK+ a předléčených dvěma
(n = 66, EXP4) nebo třemi (n = 46, EXP5)
inhibitory ALK s chemoterapií nebo bez ní, 47 osob
ROS1+ s jakoukoliv předchozí léčbou (EXP6). Jeden
pacient v EXP4 zemřel před podáním lorlatinibu a byl
vyloučen z bezpečnostní analýzy. Ve skupině nemocných,
kteří dosud nebyli léčeni (EXP1), bylo dosaženo ORR u 27
z 30 osob (90,0 %; 95% interval spolehlivosti [CI]
73,5‒97,9). Tři pacienti v EXP1 měli měřitelné počáteční
léze v CNS podle nezávislého centrálního hodnocení
a IC ORR byly pozorovány u dvou pacientů (66,7 %;
95% CI 9,4‒99,2). Pokud jde o ALK pozitivní pacienty
s alespoň jedním předchozím inhibitorem ALK (EXP2‒5), bylo
ORR dosaženo u 93 (47,0 %; 95% Cl 39,9‒54,2)
ze 198 nemocných a IC ORR u 51 nemocných
s měřitelnou výchozí lézí v CNS (63,0 %; 95% Cl
51,5‒73,4) z celkového počtu 81 pacientů. ORR bylo
dosaženo u 41 (69,5 %; 95% CI 56,1‒80,8) z 59
acientů, kteří dostali jako předchozí léčbu pouze
krizotinib (EXP2‒3A), u celkem devíti (32,1 %; 95% CI
15,9‒52,4) z 28 pacientů s jedním předchozím
inhibitorem ALK jiným než krizotinib (EXP3B) a 43 (38,7 %;
95% Cl 29,6‒48,5) ze 111 pacientů s léčbou dvěma
nebo více předchozími inhibitory ALK (EXP4‒5). IC ORR bylo
dosaženo u 20 (87,0 %; 95% CI 66,4–97,2) z 23 pacientů
s měřitelnými výchozími lézemi v CNS v EXP2‒3A,
u pěti (55,6 %; 95% Cl 21,2‒86, 3) z devíti pacientů
v EXP3B a u 26 (53,1 %; 95% Cl 38,3‒67,5) ze 49
pacientů v EXP4‒5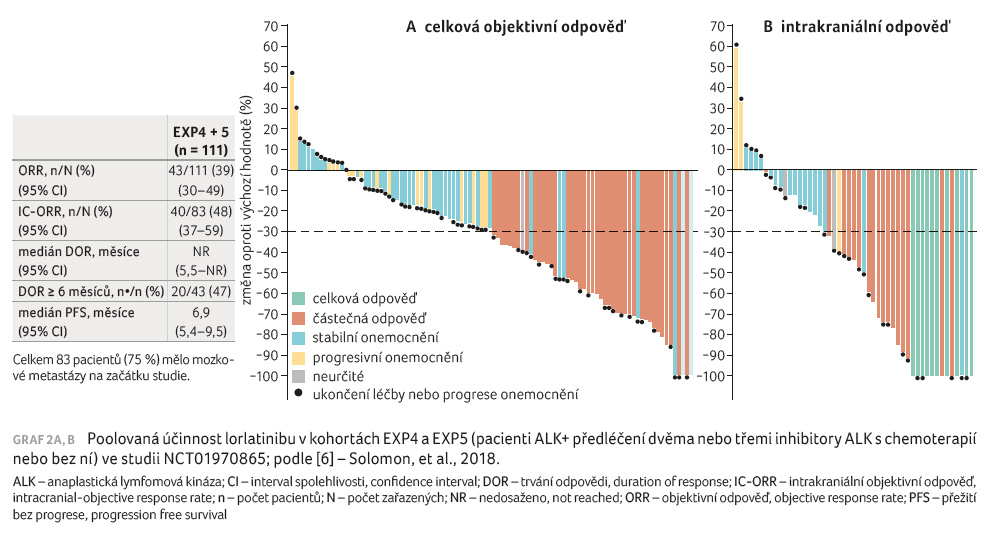 (graf 1A, B;
2A, B).
Nejčastějším nežádoucím účinkem souvisejícím s léčbou
u všech pacientů byly hypercholesterolemie (224 [81 %]
z celkového počtu 275 pacientů, u 43 [16 %]
stupně 3‒4) a hypertriglyceridemie (166 [60 %], u 43
[16 %] stupně 3‒4). Závažné nežádoucí příhody
související s léčbou se vyskytly u 19 (7 %) z 275
pacientů a sedm pacientů (3 %) trvale přerušilo léčbu
z důvodu nežádoucích účinků s ní spojených. Nebylo
hlášeno žádné úmrtí související s léčbou.
(graf 1A, B;
2A, B).
Nejčastějším nežádoucím účinkem souvisejícím s léčbou
u všech pacientů byly hypercholesterolemie (224 [81 %]
z celkového počtu 275 pacientů, u 43 [16 %]
stupně 3‒4) a hypertriglyceridemie (166 [60 %], u 43
[16 %] stupně 3‒4). Závažné nežádoucí příhody
související s léčbou se vyskytly u 19 (7 %) z 275
pacientů a sedm pacientů (3 %) trvale přerušilo léčbu
z důvodu nežádoucích účinků s ní spojených. Nebylo
hlášeno žádné úmrtí související s léčbou.
V roce 2017 publikovali Bess a kol. výsledky 47 ROS1 pozitivních pacientů [7]. Celkem 53 % nemocných mělo mozkové metastázy v době zařazení a 72 % bylo léčeno jedním či více inhibitory ALK (66 % pouze krizotinibem). Po mediánu sledování 9,9 měsíce (95% Cl 6,9‒12,5) činila ORR 36 % (95% Cl 23‒52) a u 22 pacientů (46,8 %) byla zaznamenána stabilizace nemoci (stabilization of disease, SD) jako nejlepší odpověď na léčbu lorlatinibem. IC ORR činila 56 % (95% Cl 34,9‒75,6), u devíti pacientů bylo dosaženo kompletní odpovědi. K datu tzv. cut off (rozhodovací meze, 15. 3. 2017) čtyři pacienti progredovali nebo zemřeli, 71 % ze 17 pacientů, kteří na léčbu odpověděli, mělo odpověď trvající šest nebo více měsíců. Pravděpodobnost přežití bez progrese (progression free survival, PFS) po 12 měsících představovala 47,7 % (95% Cl 29,5‒63,9) [8].
Lorlatinib ve studii prokázal podstatnou celkovou a intrakraniální aktivitu jak u pacientů bez předchozí léčby ALK+ a ROS1+ NSCLC, tak u těch, kteří progredovali při léčbě krizotinibem či inhibitory ALK druhé generace.
U 295 pacientů s ALK+ nebo ROS1+ NSCLC, kteří dostávali lorlatinib v dávce 100 mg jednou denně ve studii B7461001, patřily k nejčastějším (≥ 20 %) nežádoucím reakcím edém, periferní neuropatie, vliv na kognici, dyspnoe, únava, zvýšení tělesné hmotnosti, artralgie, ovlivnění nálady a průjem. Nejběžnějšími laboratorními abnormalitami byly hypercholesterolemie, hypertriglyceridemie, anémie, hyperglykemie, zvýšená hodnota aspartátaminotransferázy (AST), hypoalbuminemie, zvýšená hodnota alaninaminotransferázy (ALT), zvýšená hodnota lipázy a alkalické fosfatázy. Závažné nežádoucí účinky se objevily u 32 % z 295 pacientů, z nich nejčastější představovaly pneumonie (3,4 %), dyspnoe (2,7 %), pyrexie (2 %), změny duševního stavu (1,4 %) a selhání dýchání (1,4 %). Závažné nežádoucí účinky se vyskytly u 2,7 % pacientů a zahrnovaly pneumonii (0,7 %), infarkt myokardu (0,7 %), akutní plicní edém (0,3 %), embolii (0,3 %), okluzi periferní arterie (0,3 %). Trvalé přerušení léčby bylo nutné u 8 % pacientů, přibližně 48 % pacientů potřebovalo přerušení užívané léčby a 24 % vyžadovalo alespoň jedno snížení dávky léku. Doporučovaná redukce dávky je o 25 mg. Riziko rozvoje závažné hepatotoxicity je udáváno při souběžném užívání silných induktorů cytochromu P450 3A (CYP3A), například rifampicinu.
Zkušenosti
z klinické praxe
Na naší klinice jsme měli
možnost v rámci specifického léčebného programu
společnosti Pfizer získat první zkušenosti s léčbou
lorlatinibem. Jedná se o pacientku, které v době
stanovení diagnózy v květnu 2015 bylo 39 let. Na našem
pracovišti byl diagnostikován bronchogenní karcinom levého
horního laloku, histologicky adenokarcinom, T4N3M1b, stadium IV,
s generalizací do plic bilaterálně, do jater,
mozku, kalvy, páteře, ledvin, ovarií. Mutace EGFR byla negativní,
ALK IHC (imunohistochemické vyšetření) suspektně pozitivní,
FISH (fluorescenční in situ
hybridizace) pozitivní, ROS1 FISH pozitivní (zlom v oblasti
6q22.1). Pacientka na spádovém onkologickém oddělení
absolvovala zevní ozáření krania, byla u ní zahájena léčba
bisfosfonáty. Protože v době diagnózy nebyla v České
republice hrazena léčba inhibitory ALK v první linii,
podstoupila nemocná chemoterapii ve složení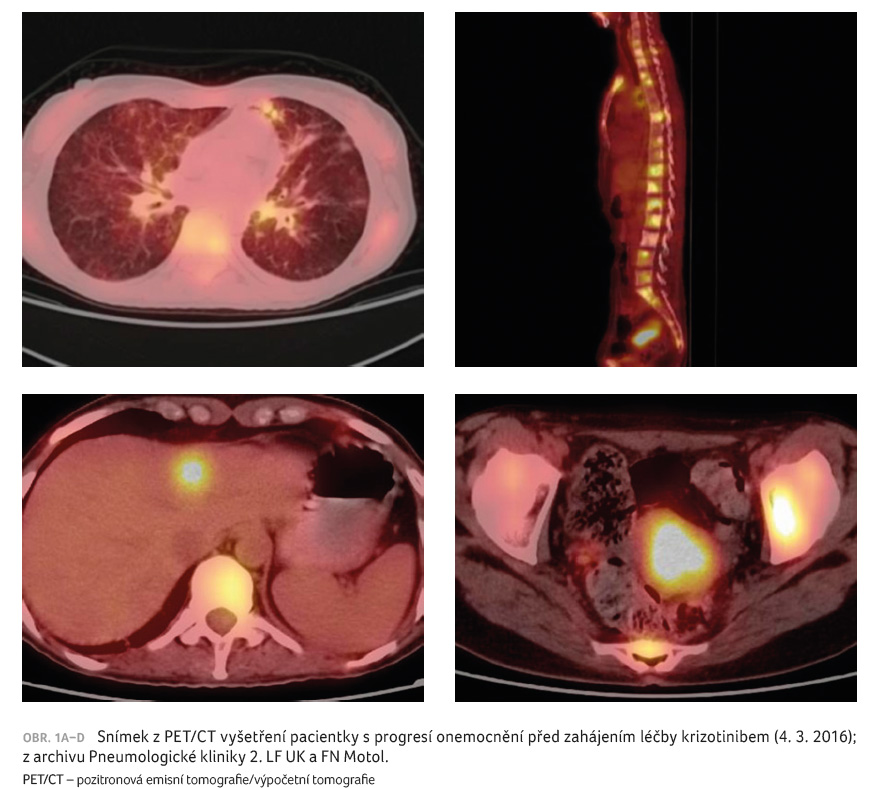 paklitaxel/karboplatina/bevacizumab v období od 24. června
2015 do 7. října 2015. Po šesti cyklech byla pomocí
vyšetření PET/CT (pozitronová emisní tomografie/výpočetní
tomografie) popsána částečná regrese karcinomu. Pacientka proto
pokračovala v udržovací léčbě bevacizumabem, po šestém
cyklu byla na PET/CT 4. března 2016 popsána progrese
plicního tumoru, přibylo plicních nodulů a tekutina v levé
pleurální dutině, progredoval nález v děloze (obr. 1A–D). Dne
7. března 2016 byla zahájena léčba krizotinibem, která
vedla k výraznému zlepšení klinického stavu pacientky
a k částečné regresi nálezu na PET/CT. V září
2017 však progredoval ložiskový nález v bederních
obratlech, objevila se další četná ložiska hypermetabolismu
glukózy ve skeletu, v lymfatické uzlině v mediastinu
vpravo, v horním vnitřním kvadrantu pravé mammy, v dutině
děložní a v obou ovariích. Na scintigrafickém
vyšetření skeletu v říjnu 2017 byla mnohočetná
metastatická ložiska indikována k aplikaci samaria. Pacientka
z tohoto důvodu ukončila 6. prosince 2017 terapii
krizotinibem a v rámci specifického léčebného programu
byla léčena alektinibem v období od 24. ledna 2018
do 25. dubna 2018. V dubnu 2018 byla na PET/CT
popsána výrazná progrese, a u nemocné byla proto
4. května 2018 zahájena chemoterapie pemetrexedem.
Na kontrolním PET/CT v srpnu 2018 byla patrná výrazná
částečná regrese, která trvala do února 2019, kdy byla
opět popsána progrese v mnohočetných kostních ložiscích.
Nález v lymfatických uzlinách, na pleuře vlevo, v levém
plicním hilu, v pravé nadledvině, v páteřním kanálu,
ve fundu děložním a ve vagině byl beze změn.
Vzhledem k tomu, že pacientka byla stále ve velmi dobrém
klinickém stavu (PS 1), byla u ní 19. března
2019 v rámci specifického léčebného programu zahájena
terapie lorlatinibem. Na kontrolním PET/CT v červnu 2019
byla popsána výrazná částečná regrese – vymizel
hypermetabolismus glukózy v levé plíci, v parasternálních
uzlinách vlevo, zřetelně ubylo hypermetabolických ložisek
ve skeletu, FDG (deoxyglukóza značená radioaktivním fluorem)
avidní neoplazie perzistuje při levém acetabulu a v obratli
L1, mírně suspektně i v kostech kyčelních a L3,
ve sternu, v levé klavikule, bez nových patologických
ložisek hypermetabolismu glukózy. Z důvodu ametabolického
hrudního výpotku byla opakovaně provedena hrudní punkce
a následně hrudní drenáž, maligní buňky nebyly zachyceny.
Na PET/CT byla opakovaně popsána trvající částečná
regrese, naposledy v březnu 2020 (obr. 2), a pacientka při velmi dobré kvalitě života
v léčbě lorlatinibem pokračuje. Z nežádoucích účinků
jsme zaznamenali pouze hypercholesterolemii zvládnutelnou běžnou
medikací hypolipidemiky.
paklitaxel/karboplatina/bevacizumab v období od 24. června
2015 do 7. října 2015. Po šesti cyklech byla pomocí
vyšetření PET/CT (pozitronová emisní tomografie/výpočetní
tomografie) popsána částečná regrese karcinomu. Pacientka proto
pokračovala v udržovací léčbě bevacizumabem, po šestém
cyklu byla na PET/CT 4. března 2016 popsána progrese
plicního tumoru, přibylo plicních nodulů a tekutina v levé
pleurální dutině, progredoval nález v děloze (obr. 1A–D). Dne
7. března 2016 byla zahájena léčba krizotinibem, která
vedla k výraznému zlepšení klinického stavu pacientky
a k částečné regresi nálezu na PET/CT. V září
2017 však progredoval ložiskový nález v bederních
obratlech, objevila se další četná ložiska hypermetabolismu
glukózy ve skeletu, v lymfatické uzlině v mediastinu
vpravo, v horním vnitřním kvadrantu pravé mammy, v dutině
děložní a v obou ovariích. Na scintigrafickém
vyšetření skeletu v říjnu 2017 byla mnohočetná
metastatická ložiska indikována k aplikaci samaria. Pacientka
z tohoto důvodu ukončila 6. prosince 2017 terapii
krizotinibem a v rámci specifického léčebného programu
byla léčena alektinibem v období od 24. ledna 2018
do 25. dubna 2018. V dubnu 2018 byla na PET/CT
popsána výrazná progrese, a u nemocné byla proto
4. května 2018 zahájena chemoterapie pemetrexedem.
Na kontrolním PET/CT v srpnu 2018 byla patrná výrazná
částečná regrese, která trvala do února 2019, kdy byla
opět popsána progrese v mnohočetných kostních ložiscích.
Nález v lymfatických uzlinách, na pleuře vlevo, v levém
plicním hilu, v pravé nadledvině, v páteřním kanálu,
ve fundu děložním a ve vagině byl beze změn.
Vzhledem k tomu, že pacientka byla stále ve velmi dobrém
klinickém stavu (PS 1), byla u ní 19. března
2019 v rámci specifického léčebného programu zahájena
terapie lorlatinibem. Na kontrolním PET/CT v červnu 2019
byla popsána výrazná částečná regrese – vymizel
hypermetabolismus glukózy v levé plíci, v parasternálních
uzlinách vlevo, zřetelně ubylo hypermetabolických ložisek
ve skeletu, FDG (deoxyglukóza značená radioaktivním fluorem)
avidní neoplazie perzistuje při levém acetabulu a v obratli
L1, mírně suspektně i v kostech kyčelních a L3,
ve sternu, v levé klavikule, bez nových patologických
ložisek hypermetabolismu glukózy. Z důvodu ametabolického
hrudního výpotku byla opakovaně provedena hrudní punkce
a následně hrudní drenáž, maligní buňky nebyly zachyceny.
Na PET/CT byla opakovaně popsána trvající částečná
regrese, naposledy v březnu 2020 (obr. 2), a pacientka při velmi dobré kvalitě života
v léčbě lorlatinibem pokračuje. Z nežádoucích účinků
jsme zaznamenali pouze hypercholesterolemii zvládnutelnou běžnou
medikací hypolipidemiky.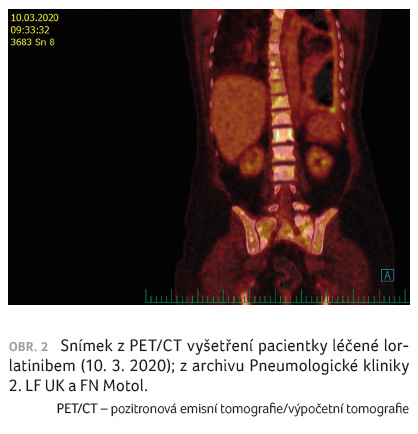
Závěr
Lorlatinib významně zlepšuje léčebné výsledky u pacientů, u kterých došlo k progresi onemocnění při vzniku rezistence na inhibitory ALK první a druhé generace, a to při velmi dobré kvalitě života pacientů. Prokázal svoji účinnost ve studii fáze I/II a probíhají další studie fáze II a III u ALK+ a ROS1+ NSCLC. V květnu 2019 byl lorlatinib v monoterapii schválen EMA k léčbě dospělých pacientů s pokročilým ALK pozitivním NSCLC, u nichž došlo k progresi onemocnění po léčbě alektinibem nebo ceritinibem nebo po léčbě krizotinibem a nejméně jedním dalším ALK TKI. V National Comprehensive Cancer Network guidelines již ve verzi 3.2019 je lorlatinib zmiňován i v doporučení ROS1 pozitivního NSCLC při selhání léčby krizotinibem nebo ceritinibem [9].
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN Motol.
Seznam použité literatury
- [1] Kwak EL, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non‑small‑cell lung cancer. N Engl J Med 2010; 363: 1693–1703.
- [2] Bergethon K, Shaw AT, Ou SH, et al. ROS1 Rearrangements Define a Unique Molecular Class of Lung Cancers. J Clin Oncol 2012; 30: 863–870.
- [3] Gainor JF, Dardaei L, Yoda S, et al. Molecular mechanisms of resistance to first‑ and second‑generation ALK inhibitors in ALK‑rearranged lung cancer. Cancer Discov 2016; 6: 1118‒1133.
- [4] Choi YL, Soda M, Yamashita Y, et al; ALK Lung Cancer Study Group. EML4‑ALK mutations in lung cancer that confer resistance to ALK inhibitors. N Engl J Med 2010; 363: 1734‒1739.
- [5] SPC Lorviqua. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/lorviqua‑epar‑product‑information_cs.pdf
- [6] Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK‑positive non‑small‑cell lung cancer: results from a global phase 2 study. Lancet Oncol 2018; 19: 1654‒1667.
- [7] Besse B, Shaw AT, Solomon BJ, et al. Preliminary Efficacy and Safety of Lorlatinib in Patients With ROS1‑Positive Non‑Small Cell Lung cancer (NSCLC). Presented at ESMO 2017, September 8‒12, Madrid, Spain. Abstr 1308PD.
- [8] Solomov BJ, Shaw AT, Ou S‑HI, et al. Phase 2 study of lorlatinib in patients with advanced ALK+/ROS1+ non‑small cell lung cancer. Paper presented at: IASLC WCLC 2017. Proceedings of the 18th AISLC World Conference on Lung Cancer; 2017 Oct 15‒18; Yokohama Japan.
- [9] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines): Non‑Small Cell Lung Cancer. Version 3.2019; 01/18/1.