Mepolizumab v léčbě těžkého astmatu – prospektivní studie z reálné klinické praxe REALITI‑A
Souhrn:
Voláková E. Mepolizumab v léčbě těžkého astmatu – prospektivní studie z reálné klinické praxe REALITI‑A. Remedia 2021; 31: 23–29.
Biologická léčba namířená proti interleukinu 5 (IL‑5) určená pro pacienty s těžkým refrakterním astmatem eozinofilního fenotypu se stává díky velmi dobré účinnosti a dostupnosti zlatým standardem terapie těchto nemocných. Vzhledem k dobré toleranci a příznivému bezpečnostnímu profilu je uvedená terapie jednoznačně preferována před udržovací léčbou perorálními kortikosteroidy. Jednou z anti‑IL‑5 monoklonálních protilátek určených k léčbě těžkého refrakterního astmatu je mepolizumab. Prospektivní multicentrická jednoramenná observační studie REALITI‑A představuje jednu ze studií navazujících na randomizovaná klinická hodnocení. Primárním cílem zde prezentované analýzy bylo zhodnotit a porovnat četnost klinicky významných exacerbací v období 12 měsíců před zahájením terapie mepolizumabem a 12 měsíců po zahájení této léčby. Jako sekundární cíle byly ve stejném období hodnoceny četnost exacerbací vyžadujících hospitalizaci a/nebo návštěvu pohotovosti či pouze hospitalizaci, podíl pacientů z celkového počtu, kteří při léčbě mepolizumabem neprodělali žádnou klinicky významnou exacerbaci, podíl pacientů z celkového počtu, u nichž došlo k poklesu počtu exacerbací o více než 50 %. Výsledky studie potvrzují bezpečnost i dobrou účinnost mepolizumabu v široké populaci pacientů s těžkým refrakterním eozinofilním astmatem.
Summary:
Volakova E. Mepolizumab in the treatment of severe asthma ‒ prospective study from real clinical practice REALITI‑A. Remedia 2021; 31: 23–29.
Biological therapy targeted at interleukin 5 (IL‑5) for patients with severe refractory eosinophilic asthma is becoming the gold standard thanks to very good efficacy and bioavailability. Due to high tolerance and beneficial safety profile, the therapy is unequivocally preferred to maintenance therapy with oral corticosteroids. Mepolizumab is one such anti‑IL‑5 monoclonal antibodies for the treatment of severe refractory asthma. Prospective, multicentric, single‑arm observational study REALITI‑A represents one of the studies extending randomized clinical trials. The primary endpoint of the presented analysis was to evaluate and compare the rate of clinically significant exacerbations during 12 months before initiating therapy with mepolizumab and 12 months after the initiation. Secondary endpoints in the same interval were the rate of exacerbations requiring hospitalization and/or a visit to the emergency room or solely hospitalization, a fraction of all patients treated with mepolizumab without any clinically significant exacerbation and a fraction of all patients with more than 50% reduction in the number of exacerbations. The results of the study confirm safety and high efficacy of mepolizumab in wide population of patients with severe refractory eosinophilic asthma.
Key words: eosinophilic asthma, biological therapy, mepolizumab, real clinical practice, exacerbation.
Úvod
Asthma bronchiale je heterogenní chronické zánětlivé onemocnění postihující celosvětově asi 300 milionů lidí [1]. Cílem léčby je dosažení kontroly nad nemocí, avšak dle různých zdrojů u 3,7‒10 % astmatiků není možné dosáhnout kontroly nad nemocí ani maximální konvenční terapií zahrnující kombinaci různých tzv. astma kontrolujících léků (inhalační kortikosteroidy, dlouhodobě působící bronchodilatancia, antileukotrieny) [2‒8]. U této skupiny pacientů dochází k opakovaným exacerbacím s potenciálním rizikem hospitalizace, respiračního selhání a úmrtí. Heterogenita onemocnění je úzce spojena s fenotypovou klasifikací a odvíjí se od typu zánětlivé imunitní odpovědi dýchacích cest. Těžké formy astmatu bývají často spojeny s eozinofilním fenotypem. Interleukin 5 (IL 5) je klíčovým mediátorem eozinofilního zánětu dýchacích cest. Ovlivňuje migraci eozinofilů do dýchacích cest a jejich diferenciaci a vyzrávání. Mepolizumab, humanizovaná monoklonální protilátka cílená na IL 5, tlumí vazbou na IL 5 eozinofilní zánětlivou reakci v dýchacích cestách těžkých astmatiků, čímž přispívá k významnému zlepšení kontroly astmatu.
Účinnost a bezpečnost mepolizumabu byla prověřena řadou randomizovaných klinických studií (RCT). Limitace těchto studií bývají často spatřovány v tom, že uvedená sledování jsou obvykle prováděna na vybraném, relativně homogenním vzorku populace, a výsledky těchto klinických studií tak mohou být vybraným vzorkem populace i uspořádáním hodnocení ovlivněny. I proto v posledních letech přibývají, a jsou žádány, studie z reálné klinické praxe (real world evidence, RWE). Přínosem RWE studií je hodnocení efektivity a bezpečnosti léčby v široké heterogenní populaci. Tyto studie mají potenciál potvrdit či upřesnit informace o bezpečnosti a efektivitě léků a léčebných strategií, případně přispět k rozšíření indikačních kritérií nových léků [9]. Zde předkládané průběžné výsledky studie REALITI A hodnotí v reálné klinické praxi účinnost a bezpečnost terapie mepolizumabem.
REALITI A je prospektivní observační studie, která hodnotí účinnost a bezpečnost terapie mepolizumabem u pacientů z reálné klinické praxe v průběhu 24měsíčního sledování. Zde jsou předloženy předběžné výsledky skupiny pacientů, kteří byli v prospektivním sledování nejméně 12 měsíců ke konci února 2019 a hodnocení bylo provedeno právě za interval dvanáctiměsíčního prospektivního sledování [10].
Studie REALITI A
Uspořádání studie
REALITI A (studie GSK 204710)
je prospektivní multicentrická jednoramenná observační studie.
Byli do ní zařazeni dospělí pacienti s diagnózou
těžkého eozinofilního astmatu, kteří podepsali informovaný
souhlas a byli pro astma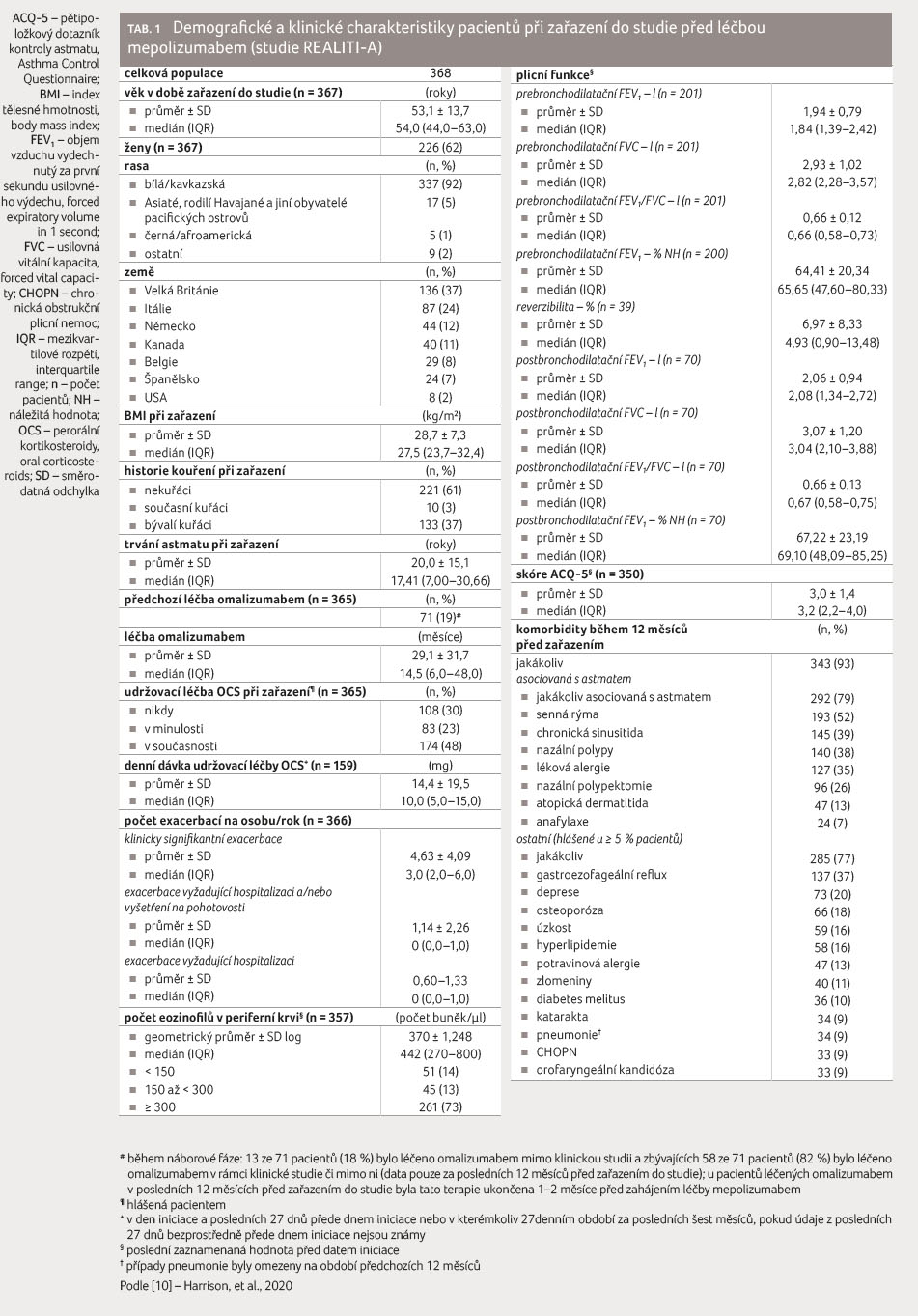 adekvátně léčeni po dobu
nejméně 12 měsíců před vstupem do studie. Pacienti mohli
být předléčeni jinou biologickou léčbou (reálně dostupný
v té době pouze omalizumab), z účasti ve studii
byli vyřazeni pacienti, kteří byli v posledních 12 měsících
před zařazením do studie léčeni mepolizumabem, a pacienti
aktuálně zařazení do některé z intervenčních
klinických studií. Do REALITI A bylo zařazeno
celkem 386 pacientů v 51 centrech sedmi zemí (tba. 1). Charakteristiky pacientů zařazených do studie jsou
rovněž uvedeny v tabulce 1, schematické
znázornění uspořádání studie pak na obrázku 1.
Jako den iniciace byl stanoven den první aplikace mepolizumabu.
Do studie mohli být pacienti zařazeni přede dnem iniciace
nebo po něm. Pacienti zařazení přede dnem iniciace až
do první aplikace mepolizumabu absolvovali různě dlouhou tzv.
run in fázi, v níž nebyla dlouhodobá terapie astmatu
měněna. Nemocní mohli být zařazeni do studie maximálně
do sedmi dnů ode dne iniciace. Zde je prezentována analýza
dat dvanáctiměsíčního prospektivního sledování pacientů,
kteří byli zařazeni do studie mezi prosincem 2016 a únorem
2018. Nábor všech pacientů byl ukončen 31. října 2019.
Analýza porovnává období 12 měsíců (365 + 1 den;
ev. + run in fáze) přede dnem iniciace s obdobím
12 měsíců (365 + 1 den) ode dne iniciace, současně
za splnění podmínky, že sledování nebylo ukončeno dříve
z důvodu úmrtí nebo odstoupení pacienta z dalšího
studijního sledování. Retrospektivně hodnocená data byla získána
od pacienta a ze zdravotní dokumentace.
adekvátně léčeni po dobu
nejméně 12 měsíců před vstupem do studie. Pacienti mohli
být předléčeni jinou biologickou léčbou (reálně dostupný
v té době pouze omalizumab), z účasti ve studii
byli vyřazeni pacienti, kteří byli v posledních 12 měsících
před zařazením do studie léčeni mepolizumabem, a pacienti
aktuálně zařazení do některé z intervenčních
klinických studií. Do REALITI A bylo zařazeno
celkem 386 pacientů v 51 centrech sedmi zemí (tba. 1). Charakteristiky pacientů zařazených do studie jsou
rovněž uvedeny v tabulce 1, schematické
znázornění uspořádání studie pak na obrázku 1.
Jako den iniciace byl stanoven den první aplikace mepolizumabu.
Do studie mohli být pacienti zařazeni přede dnem iniciace
nebo po něm. Pacienti zařazení přede dnem iniciace až
do první aplikace mepolizumabu absolvovali různě dlouhou tzv.
run in fázi, v níž nebyla dlouhodobá terapie astmatu
měněna. Nemocní mohli být zařazeni do studie maximálně
do sedmi dnů ode dne iniciace. Zde je prezentována analýza
dat dvanáctiměsíčního prospektivního sledování pacientů,
kteří byli zařazeni do studie mezi prosincem 2016 a únorem
2018. Nábor všech pacientů byl ukončen 31. října 2019.
Analýza porovnává období 12 měsíců (365 + 1 den;
ev. + run in fáze) přede dnem iniciace s obdobím
12 měsíců (365 + 1 den) ode dne iniciace, současně
za splnění podmínky, že sledování nebylo ukončeno dříve
z důvodu úmrtí nebo odstoupení pacienta z dalšího
studijního sledování. Retrospektivně hodnocená data byla získána
od pacienta a ze zdravotní dokumentace.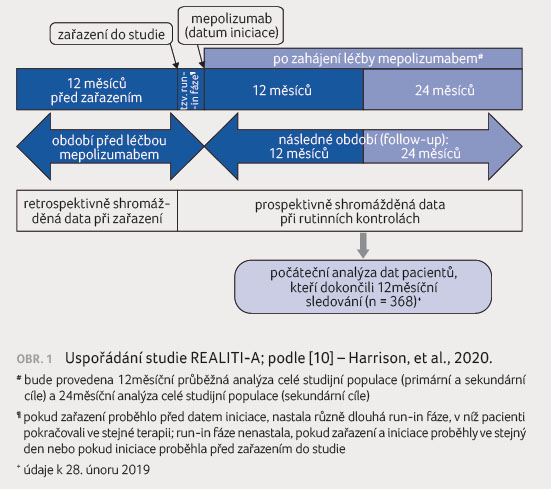
Cíle
Primárním cílem zde prezentované analýzy bylo zhodnotit a porovnat četnost klinicky významných exacerbací v období 12 měsíců před zahájením terapie mepolizumabem a 12 měsíců po zahájení této terapie. Jako klinicky významná exacerbace bylo definováno zhoršení astmatu, které si vyžádalo terapii systémovými kortikosteroidy (SKS) ‒ v jakkoliv vysoké dávce perorálně po dobu nejméně tří dnů, případně nejméně jedno podání SKS v parenterální formě (intravenózně či intramuskulárně) a/nebo hospitalizaci či návštěvu pohotovosti. U pacientů léčených udržovací perorální kortikoterapií (oral corticosteroids, OCS) bylo jako klinicky významná exacerbace hodnoceno zhoršení vedoucí k navýšení dávky udržovací OCS na dvojnásobek po dobu nejméně tří dnů. Opakované podání SKS u jednoho pacienta v době kratší než sedm dnů bylo hodnoceno jako jedna exacerbace, ne exacerbace opakovaná.
Jako sekundární cíle byly ve stejném období hodnoceny: četnost exacerbací vyžadujících hospitalizaci a/nebo návštěvu pohotovosti nebo pouze hospitalizaci, podíl pacientů ze všech, kteří při léčbě mepolizumabem neprodělali žádnou klinicky významnou exacerbaci, podíl pacientů ze všech, u kterých došlo k poklesu počtu exacerbací o ≥ 50 %. U pacientů před vstupem do studie s udržovací OCS byla hodnocena redukce dávky OCS a podíl pacientů, u nichž se podařilo při terapii mepolizumabem udržovací OCS ukončit. Byla hodnocena také změna (pokles) počtu eozinofilů v periferní krvi.
Bezpečnost terapie mepolizumabem byla hodnocena na základě hlášených nežádoucích událostí a hlášených závažných nežádoucích událostí. Posouzení souvislosti hlášené nežádoucí události s terapií mepolizumabem bylo pouze v kompetenci dispenzarizujícího lékaře a nepodléhalo žádné další revizi.
Analýza výsledků
Do hodnocení byli zahrnuti všichni pacienti, kteří obdrželi alespoň jednu dávku mepolizumabu. Kromě celkového hodnocení byly provedeny subanalýzy podskupin podle počtu eozinofilů v periferní krvi (< 150, ≥ 150 až < 300, ≥ 300 buněk/µl), hodnocení četnosti exacerbací v závislosti na dávce udržovací OCS před zařazením do studie (ano/ne, < 10 mg vs. ≥ 10 mg prednisonu denně), věku při vstupu do studie (< 65 let vs. ≥ 65 let), ev. terapie omalizumabem před vstupem do studie (ano/ne) a kombinovaná subanalýza podle počtu eozinofilů v periferní krvi a dávky udržovací OCS před zařazením do studie. Ve statistickém hodnocení byly použity metody analýz charakteru intent to treat (se záměrem léčit) shodné s těmi, které jsou používány v klinických studiích. Podrobně jsou popsány v původní publikaci [10].
Výsledky
Každý z 368 léčených pacientů obdržel alespoň jednu dávku mepolizumabu, přičemž průměrný počet dávek byl (± směrodatná odchylka, SD) 11,4 ± 3,11 a průměrná délka léčby byla (± SD) 340,4 ± 87,24 dne. Nejvíce nemocných zahrnutých do této analýzy bylo z britské kohorty (n = 136). Při vstupu do studie bylo udržovací dávkou OCS léčeno 174 (48 %) osob. Ze studie odstoupilo v průběhu dvanáctiměsíčního sledování celkem 70 pacientů z celkového počtu 368 (19 %). Pacienti odstupovali nejčastěji bez udání důvodu (27 z 368 osob ‒ 7 %) a nejčastěji udávaným důvodem k odstoupení ze studie byla nedostatečná účinnost terapie mepolizumabem (13 z 368 osob ‒ 4 %).
V celkovém souboru došlo
k poklesu výskytu klinicky významných exacerbací o 69 %,
a to ze 4,63 exacerbace za 12 měsíců před vstupem
do studie na 1,43 exacerbace za 12 měsíců při
terapii mepolizumabem. Pokles byl ještě o něco výraznější
ve skupině pacientů s hodnotou eozinofilů v periferní
krvi při vstupu do studie ≥ 300 buněk/µl
periferní krve (o 71 %). Podobných výsledků bylo dosaženo
také v rámci hodnocení exacerbací vyžadujících vyšetření
s návštěvou pohotovosti či hospitalizaci (graf 1).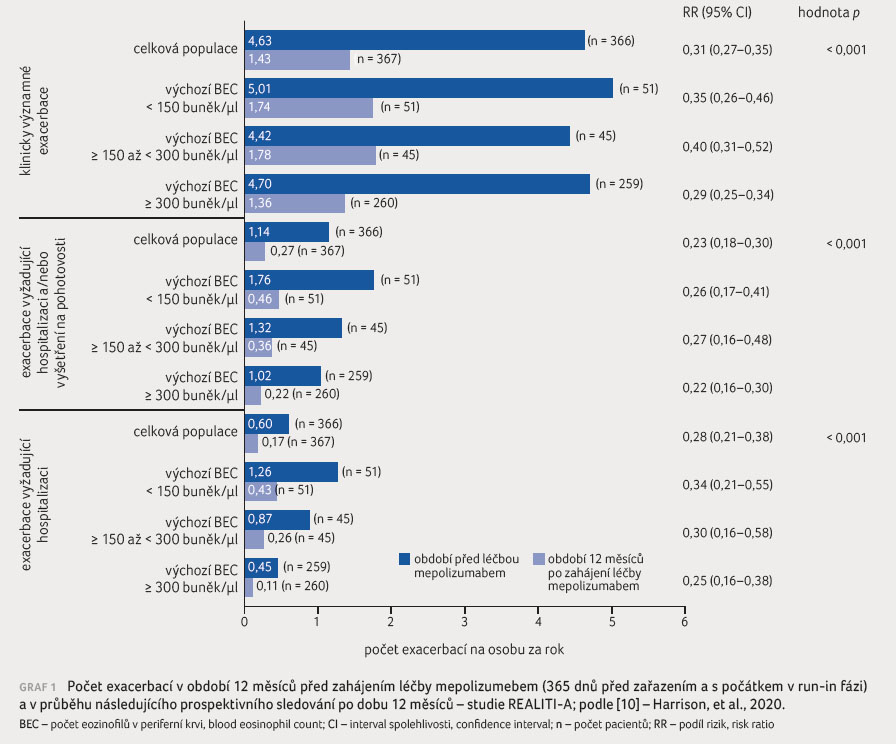
Celkem u 67 % pacientů (247 z 360) došlo k poklesu výskytu klinicky významných exacerbací o ≥ 50 %, a pokud byli z hodnocení poklesu počtu exacerbací o více než polovinu vyřazeni nemocní, kteří v posledním roce neprodělali žádnou klinicky významnou exacerbaci, došlo k redukci počtu klinicky významných exacerbací o ≥ 50 % celkem u 73 % pacientů (247 z 340). Současně při terapii mepolizumabem významně vzrost podíl pacientů, kteří v průběhu dvanáctiměsíčního sledování neprodělali žádnou klinicky významnou exacerbaci. Před léčbou to bylo 7 % pacientů, při terapii mepolizumabem pak 48 % (poměr šancí [OR] 12,13; 95% interval spolehlivosti [CI] 8,03–18,33; p < 0,001).
Vliv mepolizumabu na dávku
udržovací OCS byl hodnocen u 156 pacientů. V průběhu
léčby mepolizumabem došlo k poklesu mediánu (mezikvartilové
rozpětí, interquartile range, IQR) udržovací dávky OCS z 10,0
(5,0–15,0) mg/den – před terapií mepolizumabem –
na 5,0 (0,9–10,0) mg/den – v průběhu hodnocení
mezi 21.‒24. týdnem. Tento medián zůstal stejný rovněž
při hodnocení mezi 53.–56. týdnem (5,0 [0,0–7,5]
mg/den), což odpovídá redukci dávky OCS při terapii
mepolizumabem o 52 % ve srovnání s dávkou při
vstupu do studie (95% CI 50,0–75,0; 53.‒56. týden).
Ze 125 pacientů se známými údaji o dávce OCS mezi
53.‒56. týdnem terapie mepolizumabem zůstávalo při léčbě
OCS celkem 82 pacientů, z čehož vychází odhadované
ukončení terapie OCS po roce léčby mepolizumabem u 34 %
pacientů (graf 2).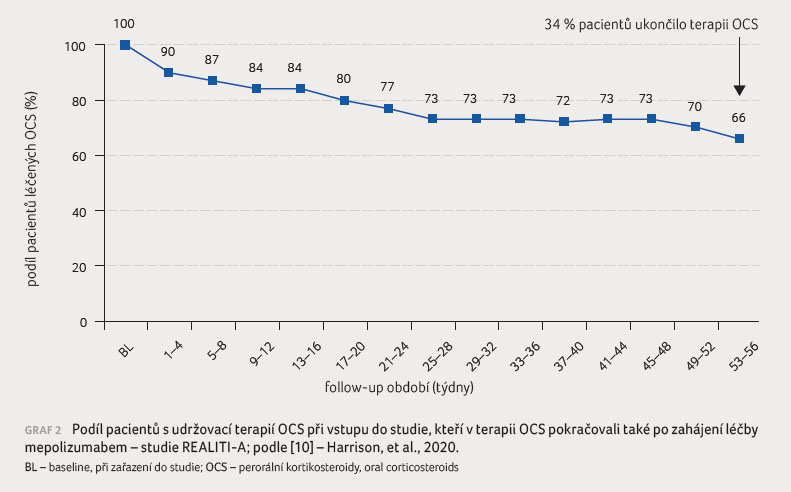
Při terapii mepolizumabem došlo k významnému poklesu počtu eozinofilů v periferní krvi, a to z 370 (95% CI 320–410) buněk/μl periferní krve při vstupu do studie na 60 (95% CI 50–80) buněk/μl periferní krve po 9‒12 měsících léčby (vyjádřeno jako geometrický průměr). Medián hodnoty eozinofilů poklesl z 442 (270–800) buněk/μl periferní krve při vstupu do studie na 90 (40–100) buněk/μl periferní krve po 9‒12 měsících léčby, což odpovídá redukci počtu eozinofilů v periferní krvi o 83 %. Největší pokles počtu eozinofilů byl pozorován v průběhu prvních tří měsíců, přičemž nízké hodnoty přetrvávaly do konce sledování.
Pouze u 14 % (53 pacientů
z celkového počtu 368) byla hlášena nežádoucí událost.
Mezi nejčastěji hlášené nežádoucí události patřily bolesti
hlavy a lokální reakce v místě vpichu. Závažná
nežádoucí událost byla hlášena pouze u dvou z počtu
368 pacientů (< 1 %). Šlo o alergickou reakci a otok
laryngu, úmrtí v souvislosti s léčbou mepolizumabem
zaznamenáno nebylo (tab. 2). U devíti z 368
pacientů (2 %) byla nežádoucí událost důvodem k ukončení
terapie mepolizumabem.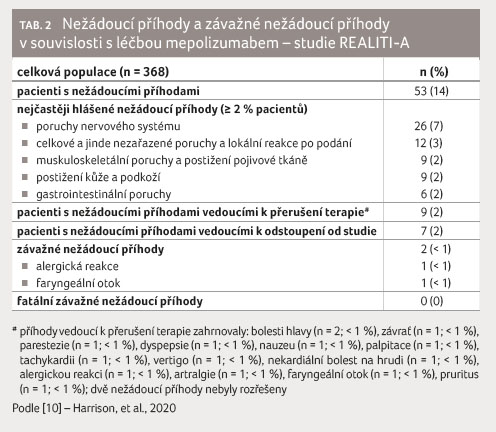
Diskuse
Výsledky prvních preklinických hodnocení účinnosti mepolizumabu na redukci počtu eozinofilů v periferní krvi a příznivého bezpečnostního profilu byly publikovány v roce 2001 [11]. Po dvou desetiletích považujeme biologickou antieozinofilní léčbu mepolizumabem a dalšími monoklonálními protilátkami za zlatý standard terapie těžkého eozinofilního astmatu. Terapie anti IL 5 v podobě přídatné udržovací léčby u pacientů s nejtěžšími formami astmatu se jako preferovaný standard (před OCS) objevuje poprvé v doporučení Globální iniciativy pro astma (Global Initiative for Asthma, GINA) v roce 2018 [12]. Terapie je určena pacientům s nedostatečnou kontrolou astmatu na pátém stupni léčby – tedy nemocným s nedostatečnou kontrolou onemocnění při léčbě vysokými dávkami inhalačních kortikosteroidů v kombinaci s další udržovací terapií při splnění podmínky dobré adherence k léčbě, revize správnosti inhalační techniky a ovlivnění komorbidit. Toto doporučení vychází z dokumentované účinnosti s potenciálem redukce exacerbací a kortikoid šetřícího efektu u pacientů s udržovací terapií OCS a většina publikovaných studií současně prezentuje navýšení ventilačních hodnot a zlepšení kvality života těžkých astmatiků při terapii mepolizumabem [13–16].
Zde prezentované předběžné výsledky studie REALITI A, která hodnotí účinnost a bezpečnost mepolizumabu v reálné klinické praxi, navazují na výsledky RCT a následných otevřených studií, jejichž cílem bylo zhodnocení účinnosti a bezpečnosti terapie mepolizumabem z dlouhodobého hlediska. Pro připomenutí to byly studie MENSA a MUSCA, které potvrdily redukci počtu klinicky významných exacerbací ve srovnání s placebem o 53 % a 59 % [13,14], studie SIRIUS, která prokázala redukci udržovací dávky OCS při terapii mepolizumabem o 50 % ve srovnání s placebem [15], studie COSMOS a COSMEX, které doložily dlouhodobý, prakticky trvalý efekt terapie mepolizumabem na redukci dávky OCS [16,17], a studie COLUMBA prokazující dlouhodobý efekt terapie mepolizumabem na prevenci exacerbací a dlouhodobě příznivý bezpečnostní profil (délka sledování až 4,5 roku) [18].
Se schválenou léčebnou indikací pak v průběhu posledních dvou let přibývají menší observační studie z reálné klinické praxe a výsledky těchto studií jsou vcelku konzistentní – mepolizumab i v reálné klinické praxi vykazuje velmi dobrou účinnost v terapii těžkého eozinofilního astmatu a velmi dobrý bezpečnostní profil. Heterogenita běžné populace ani komorbidity nesnižují účinnost ani bezpečnost této terapie. Heterogenita populace léčené mepolizumabem z RWE navíc vzrůstá v důsledku různé dostupnosti terapie v jednotlivých zemích. V České republice je například terapie možná na základě zvláštní žádosti či stanovených úhradových kritérií, jež v současnosti zahrnují věk 18 let, diagnózu těžkého refrakterního eozinofilního astmatu, status nekuřáka, dokumentovanou periferní eozinofilii ≥ 300 eozinofilů/µl periferní krve a nejméně čtyři těžké exacerbace astmatu v průběhu 12 měsíců před zahájením léčby navzdory vysokým denním dávkám inhalačních kortikosteroidů a přidané udržovací léčbě; nebo udržovací terapii OCS v dávce ekvivalentní nejméně 5 mg prednisonu denně po dobu alespoň šesti měsíců před zahájením léčby. V případě udržovací terapie OCS nejméně šest měsíců před zahájením léčby mepolizumabem je vyžadován průkaz eozinofilie ≥ 300 eozinofilů/µl periferní krve v průběhu 12 měsíců před zahájením terapie OCS. Zhodnocení účinnosti léčby je potřeba provést každých 12 měsíců a jako non respondér je hodnocen pacient, u kterého nedojde k redukci těžkých exacerbací alespoň o 50 %; nebo nedojde ke klinicky významnému snížení dávek OCS při udržení nebo zlepšení kontroly astmatu.
Terapie mepolizumabem na základě splnění výše uvedených úhradových kritérií je dostupná v ČR od září roku 2018. V prvním zhodnocení souboru 17 pacientů z vlastní klinické praxe jsme po 12 měsících terapii mepolizumabem hodnotili jako účinnou u 15 z nich (88 %) [19,20]. Do posledního hodnocení ze září 2020 pak bylo zahrnuto 22 pacientů a terapie byla hodnocena jako účinná u 18 z nich (82 %). V hodnoceném souboru převažovali nemocní s indikací k léčbě z důvodu udržovací terapie OCS, což jistě nepřekvapí s přihlédnutím k faktu, že jde o pacienty indikované k léčbě hned v začátcích její dostupnosti v ČR, kdy udržovací terapie OCS byla nejúčinnější možností ke zlepšení kontroly eozinofilního astmatu před érou biologické léčby. Průměrná dávka OCS v našem souboru pacientů představovala 11,2 (5‒25) mg prednisonu při zahájení terapie mepolizumabem a tato po 12 měsících léčby poklesla na 3,2 (0‒10) mg prednisonu, což představuje redukci dávky OCS o 71 %. Terapii OCS se podařilo ukončit zcela u 23 % pacientů. Těžké exacerbace poklesly z průměrného počtu 4,0/12 měsíců před zahájením terapie mepolizumabem na průměrných 0,8 exacerbace při terapii mepolizumabem (redukce o 79 %) a podíl pacientů se zkušeností bez exacerbace při terapii mepolizumabem činil 46 %. Non respondérství bylo důvodem k ukončení léčby u dvou pacientů (9 %), u nichž se nepodařilo zredukovat při terapii mepolizumabem dávku OCS, a z důvodu nežádoucích účinků byla léčba ukončena u jednoho pacienta (4,55 %). Hlášenou nežádoucí příhodou vedoucí k ukončení terapie byly bolesti hlavy.
Jak je vidět, rovněž výsledky naší malé studie jsou plně v souladu s prezentovanými daty studie REALITI A. Příznivý bezpečnostní profil posouvá navíc mepolizumab dále do nižších věkových kategorií, přičemž dnes je možné tuto terapii indikovat již u pacientů ve věku od šesti let.
Závěr
Účinnost a bezpečnost mepolizumabu v terapii těžkého eozinofilního astmatu jsou dnes neoddiskutovatelné. Přesto ani po dvaceti letech výzkum mepolizumabu a další antieozinofilní biologické léčby nekončí. Na jedné straně roste počet publikací, které hodnotí účinnost těchto léků také u jiných nemocí spojených s eozinofilií, jako jsou eozinofilní granulomatóza s polyangiitidou či chronická rinosinusitida s nosní polypózou, na straně druhé je zde snaha o hledání dalších prediktivních markerů dobré i nedostatečné odpovědi u této terapie.
Seznam použité literatury
- [1] WHO 2017 November 11. Dostupné na: https://www.who.int/news/
- [2] Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343–373.
- [3] The Global Asthma Network. The Global Asthma Report 2018. Dostupné na: www.globalasthmareport.org/Global%20Asthma%20Report%202018.pdf [navštíveno 14. 9. 2019].
- [4] Foster JM, McDonald VM, Guo M, et al. “I have lost in every facet of my life”: the hidden burden of severe asthma. Eur Respir J 2017; 50: 1700765.
- [5] Chastek B, Korrer S, Nagar SP, et al. Economic burden of illness among patients with severe asthma in a managed care setting. J Manag Care Spec Pharm 2016; 22: 848–861.
- [6] Kerkhof M, Tran TN, Soriano JB, et al. Healthcare resource use and costs of severe, uncontrolled eosinophilic asthma in the UK general population. Thorax 2018; 73: 116–124.
- [7] Zeiger RS, Schatz M, Dalal AA, et al. Utilization and costs of severe uncontrolled asthma in a managed‑care setting. J Allergy Clin Immunol Pract 2016; 4: 120–129.
- [8] Hekking PP, Wener RR, Amelink M, et al. The prevalence of severe refractory asthma. J Allergy Clin Immunol 2015; 135: 896‒902.
- [9] Katkade VB, Sanders KN, Zou KH. Real world data: an opportunity to supplement existing evidence for the use of long‑established medicines in health care decision making. J Multidiscip Healthc 2018; 11: 295–304.
- [10] Harrison T, Canonica GW, Chupp G, et al. Real‑world mepolizumab in the prospective severe asthma REALITI‑A study: initial analysis. Eur Respir J 2020; 56: 2000151.
- [11] Hart TK, Cook RM, Zia‑Amirhosseini P, et al. Preclinical efficacy and safety of mepolizumab (SB‑240563), a humanized monoclonal antibody to IL‑5, in cynomolgus monkeys. J Allergy Clin Immunol 2001; 108: 250‒257.
- [12] Global Strategy for Asthma Management and Prevention. GINA 2018. Dostupné na: https://ginasthma.org/wp‑content/uploads/2019/ 01/2018‑GINA.pdf
- [13] Ortega HG, Liu MC, Pavord ID, et al; MENSA Investigators. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371: 1198‒1207. Erratum in: N Engl J Med 2015; 372: 1777.
- [14] Chupp GL, Bradford ES, Albers FC, et al. Efficacy of mepolizumab add‑on therapy on health‑related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double‑blind, placebo‑controlled, parallel‑group, multicentre, phase 3b trial. Lancet Respir Med 2017; 5: 390‒400.
- [15] Bel EH, Wenzel SE, Thompson PJ, et al; SIRIUS Investigators. Oral glucocorticoid‑sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med 2014; 371: 1189‒1197.
- [16] Lugogo N, Domingo C, Chanez P, et al. Long‑term Efficacy and Safety of Mepolizumab in Patients With Severe Eosinophilic Asthma: A Multi‑center, Open‑label, Phase IIIb Study. Clin Ther 2016; 38: 2058–2070.
- [17] Khurana S, Brusselle GG, Bel EH, et al. Long‑term Safety and Clinical Benefit of Mepolizumab in Patients With the Most Severe Eosinophilic Asthma: The COSMEX Study. Clin Ther 2019; 41: 2041‒2056
- [18] Khatri S, Moore W, Gibson PG, et al. Assessment of the long‑term safety of mepolizumab and durability of clinical response in patients with severe eosinophilic asthma. J Allergy Clin Immunol 2019; 143: 1742‒1751.e7.
- [19] Voláková E. Mepolizumab – roční zkušenost s léčbou. Remedia 2019; 29: 505–511.
- [20] Voláková E, Zatloukal J. Mepolizumab in real‑life treatment of severe eosinophilic asthma. Eur Respir J 2020; 56(Suppl 64): 2213.