Nové indikace ixekizumabu – léčba axiální spondyloartritidy
Souhrn:
Šenolt L. Nové indikace ixekizumabu – léčba axiální spondyloartritidy. Remedia 2020; 30: stránka 575–580.
Léčba axiální spondyloartritidy (axSpA), radiografické formy (r‑axSpA) známé jako ankylozující spondylitida, ale i neradiografické formy (nr‑axSpA) zaznamenala v posledních letech významný posun. Kromě tumor nekrotizujícího faktoru (TNF) hraje v patogenezi axSpA klíčovou roli cytokinová osa interleukinu (IL) 23 a 17, což podtrhují klinické zkušenosti a účinnost biologické léčby namířené proti TNF a IL‑17. V první linii je možné podat oba přípravky, ale v současnosti se doporučuje léčbu zahájit inhibitory TNF a při jejich selhání je ve druhé linii možné nasadit inhibitory IL‑17. Ixekizumab je humanizovaná monoklonální protilátka proti IL‑17A, jejíž účinnost a bezpečnost byly studovány ve třech lékových hodnoceních u pacientů s r‑axSpA, kteří neměli dostatečnou odpověď na nesteroidní antiflogistika a dosud jim nebyla podávána biologická léčba (COAST‑V), u pacientů s r‑axSpA, u nichž léčba blokující TNF selhala (COAST‑W), a také u pacientů s nr‑axSpA (COAST‑X). V této přehledové práci budou diskutovány výsledky těchto tří klinických hodnocení, které prokázaly snížení aktivity onemocnění, zlepšení kvality života, fyzických funkčních schopností a intenzity aktivního zánětu na páteři a sakroiliakálních kloubech při léčbě ixekizumabem ve srovnání s placebem. Ixekizumab byl minimálně stejně tak účinný jako adalimumab u pacientů s r‑axSpA ve studii COAST‑V. Bezpečnostní profil ixekizumabu byl konzistentní s biologickou léčbou, v porovnání s placebem byly častější reakce v místě vpichu a mírné až středně závažné infekce, nejčastěji nazofaryngitida nebo infekce horních cest dýchacích. Ixekizumab představuje vhodnou alternativu k léčbě blokující TNF u pacientů s axSpA.
Summary:
Senolt L. New indications of ixekizumab – treatment of axial spondyloarthritis. Remedia 2020; 30: stránka 575–580.
In the last few years, important advances have happened in the treatment of axial spondyloarthritis (axSpA), both radiographic (r‑axSpA) known as ankylosing spondylitis and non‑radiographic (nr‑axSpA) form. Cytokine axis of interleukin (IL) 23 and 17 plays a key role in the pathogenesis of axSpA, besides tumor necrosis factor (TNF), underlined by clinical experience and efficacy of biologic treatment against TNF and IL‑17. It is possible to administer both medicinal products in the first line but currently it is recommended to initiate the treatment with TNF inhibitors. When they fail, it is possible to administer IL‑17 inhibitors in the second line. Ixekizumab is a humanized monoclonal antibody against IL‑17A with efficacy and safety studied in three clinical trials in patients with r‑axSpA without sufficient response to non‑steroidal anti‑inflammatory drugs and no biologic treatment so far (COAST‑V), in patients with r‑axSpA where TNF inhibitors failed (COAST‑W) and in patients with nr‑axSpA (COAST‑X). This article discusses the results of these three trials that showed decreased disease activity, increased quality of life, physical functional abilities and decreased intensity of active inflammation in the spine and sacroiliac joints when treated with ixekizumab compared with placebo. Ixekizumab was at least as efficacious as adalimumab in patients with r‑axSpA in COAST‑V trial. Safety profile of ixekizumab was consistent with biologic treatment; compared with placebo, local reactions at injection site were more frequent as well as mild to moderate infections, most frequently nasopharyngitis or upper respiratory infections. Ixekizumab represents a suitable alternative to TNF inhibitors in patients with axSpA.
Key words: ixekizumab, axial spondyloarthritis, interleukin ,efficacy, safety
Úvod
Axiální spondyloartritida (axSpA) je nejčastější zánětlivé imunitně podmíněné revmatické onemocnění, které patří do skupiny spondyloartritid zahrnujících několik dalších blízkých zánětlivých revmatických onemocnění s obdobnými klinickými projevy, např. psoriatickou artritidu, reaktivní artritidu nebo enteropatickou spondyloartritidu [1]. Pro axSpA je pravidlem postižení sakroiliakálních (SI) kloubů a páteře, v některých případech bývají postiženy i periferní klouby, většinou dolních končetin, časté jsou entezitidy, typicky při úponu Achillovy šlachy, méně často může být přítomen difuzní otok prstů (daktylitida). Mezi charakteristické extraartikulární projevy patří psoriáza, akutní přední uveitida a idiopatický střevní zánět [2].
Onemocnění se člení na neradiografickou axSpA (nr axSpA) a radiografickou axSpA (r axSpA neboli ankylozující spondylitidu). Prevalence axSpA se pohybuje kolem 1 % a přibližně dva až třikrát častěji jsou postiženi muži [3,4]. Probíhající zánět u neradiografické formy onemocnění nevede vždy v průběhu času k rozvoji strukturálního poškození SI kloubů a při diagnostice nebo hodnocení aktivity nemoci je třeba využít magnetickou rezonanci (MR) [5]. Neradiografickou formu nemoci lze považovat za časnou fázi nebo v některých případech za mírnější formu axSpA, která se vyskytuje skoro se stejnou frekvencí jako r axSpA, ale ženy postihuje stejně často, nebo i častěji než muže.
Péče o pacienty s axSpA je komplexní, vyžaduje aktivní zapojení pacienta, pravidelné cvičení a rehabilitaci. Základem farmakologické léčby jsou nesteroidní antirevmatika (NSA), při selhání účinku alespoň dvou NSA nebo při jejich intoleranci či kontraindikaci je v případech aktivního onemocnění indikována biologická léčba. V současnosti se zejména na podkladě delší zkušenosti doporučují v první linii inhibitory tumor nekrotizujícího faktoru (TNF), při jejich selhání je ve druhé linii možno podat inhibitory interleukinu (IL) 17 [6,7]. V této přehledové práci budou diskutovány výsledky tří klinických hodnocení s ixekizumabem, monoklonální protilátkou proti IL 17A, u pacientů s axSpA.
Farmakologické vlastnosti ixekizumabu
Ixekizumab je humanizovaná IgG4 monoklonální protilátka. Selektivně se váže na cytokin IL 17A a tlumí interakci s jeho receptorem, čímž zabraňuje uvolňování prozánětlivých cytokinů a chemokinů cílovými buňkami [8]. Střední doba do dosažení maximální koncentrace v plazmě po subkutánní injekci ixekizumabu v dávce 5−160 mg je v rozmezí 4−7 dní. Po počáteční dávce 160 mg ixekizumabu bylo ustáleného stavu dosaženo do osmého (10.) týdne při dávce 80 mg podávané každé dva (4) týdny. Ixekizumab má biologickou dostupnost 60–81 %. Distribuční objem je při rovnovážném stavu 7,11 litru. Biologický poločas ixekizumabu je 13 dnů.
Klíčová úloha IL 17 v patogenezi
axiální spondyloartritidy
Interleukin 17 patří do skupiny prozánětlivých cytokinů, které jsou zvýšeně tvořeny v zánětem postižených entezích a v kostní dřeni facetových a SI kloubů. Hraje důležitou roli v patogenezi axSpA a pod vlivem prozánětlivě působícího cytokinu IL 23, ale také IL 1, IL 6, IL 21 a transformujícího růstového faktoru beta (TGF β), je IL 17 zvýšeně tvořen lymfocyty Th17, přirozenými lymfoidními buňkami typu 3 (ILC3), NK buňkami (natural killer cells, přirození zabíječi) a γδ T lymfocyty [9]. Nezávisle na stimulaci cytokinem IL 23 je IL 17 uvolňován z neutrofilních leukocytů a mastocytů. Cytokinovou rodinu IL 17 tvoří šest členů (IL 17A−F), přičemž hlavní prozánětlivé působení má IL 17A a velmi podobnými účinky se vyznačuje IL 17F. Interleukin 17 podporuje migraci a aktivaci neutrofilních leukocytů, tvorbu antimikrobiálních peptidů, chemokinů a dalších cytokinů, které podporují efektorovou fázi zánětu a kostní remodelaci [10].
Klinická hodnocení s ixekizumabem
u axiální spondyloartritidy
Program klinického hodnocení fáze III s ixekizumabem u pacientů s axSpA byl rozdělen do tří hlavních studií (obr. 1):
- Ixekizumab byl podáván pacientům s r axSpA, kteří neměli dostatečnou odpověď na konvenční léčbu a dosud nedostávali biologickou terapii (COAST V),
- pacientům s r axSpA, u nichž léčba inhibitory TNF selhala (COAST W),
- a nakonec pacientům s nr axSpA (COAST X).
Ixekizumab byl podáván jednou za dva týdny nebo jednou za čtyři týdny s úvodní dávkou 80 mg nebo 160 mg. Klinická hodnocení s ixekizumabem byla kontrolována placebem, v klinickém hodnocení COAST V bylo navíc aktivní rameno s adalimumabem.
Pro první dvě klinická hodnocení museli pacienti splňovat kritéria rentgenově potvrzené sakroiliitidy podle modifikovaných newyorských klasifikačních kritérií (prováděno bylo centrální čtení) a museli mít alespoň jeden příznak SpA. Onemocnění muselo vykazovat známky aktivity podle BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) ≥ 4, stupeň bolesti zad hodnocený pomocí Vizuální analogové škály bolesti jako 4 a více (VAS ≥ 4) a nedostatečnou odpověď na alespoň dvě NSA nebo jejich nesnášenlivost. V případě klinického hodnocení COAST W museli pacienti vykazovat selhání jednoho nebo dvou inhibitorů TNF. Pacienti s nr axSpA v klinickém hodnocení COAST X museli vykazovat objektivní příznaky zánětu, a to buď prostřednictvím známek zánětu na MR SI kloubů, nebo zvýšené hodnoty C reaktivního proteinu (CRP).
Primárním cílovým ukazatelem všech klinických hodnocení byla odpověď ASAS40 (Assessment in SpondyloArthritis International Society 40) v 16. týdnu a v klinickém hodnocení COAST X navíc i v 52. týdnu. Odpověď ASAS40 je definována jako relativní zlepšení alespoň o 40 % a absolutní zlepšení alespoň o 2 jednotky na stupnici 0−10 nejméně ve třech z následujících čtyř domén: globální hodnocení pacientem, hodnocení bolesti pacientem, funkce (Bath Ankylosing Spondylitis Functional Index, BASFI) a zánětu (poslední dvě otázky hodnocení BASDAI, Bath Ankylosing Spondylitis Disease Activity Index), aniž by bylo dokumentováno zhoršení ve zbývající doméně.
Mezi hlavní sekundární cíle patřilo zlepšení podle ASAS20, BASDAI50 (50% zlepšení podle BASDAI), dosažení inaktivního onemocnění podle ASDAS (Ankylosing Spondylitis Disease Activity Score; hodnota < 1,3) a nízké aktivity podle ASDAS (< 2,1), změna v indexech ASDAS a BASDAI, ve funkčím indexu BASFI, SF 36 (36 Item Short Form) a změna ve zdravotním indexu ASAS. V klinických hodnoceních u pacientů s r axSpA byla hodnocena MR páteře a u nr axSpA byla hodnocena MR SI kloubů na podkladě skórovacího indexu SPARCC (The Spondyloarthritis Research Consortium of Canada).
Studie COAST V
COAST V byla randomizovaná, dvojitě zaslepená, aktivním přípravkem a placebem kontrolovaná studie fáze III, jež hodnotila účinnost a bezpečnost ixekizumabu u pacientů s aktivní r axSpA, kteří nebyli dříve léčeni biologickými léky [11]. Ve studii bylo randomizováno celkem 341 pacientů do čtyř různých ramen: k podávání placeba (n = 87), adalimumabu (n = 90), ixekizumabu aplikovaného jednou za dva týdny (n = 83) nebo jednou za čtyři týdny (n = 81). Podíl pacientů, kteří dokončili 16týdenní zaslepenou fázi studie, byl 99 % ve skupině s placebem, 98 % u adalimumabu a 95−96 % při léčbě ixekizumabem.
Primární cíl studie byl splněn
(graf 1); větší podíl pacientů dosáhl v 16. týdnu
odpovědi ASAS40 ve skupině nemocných, kteří dostávali
ixekizumab a adalimumab, ve srovnání se skupinou pacientů
léčených placebem (52−48 % a 36 % vs. 18 %;
p < 0,0001 a p = 0,0053).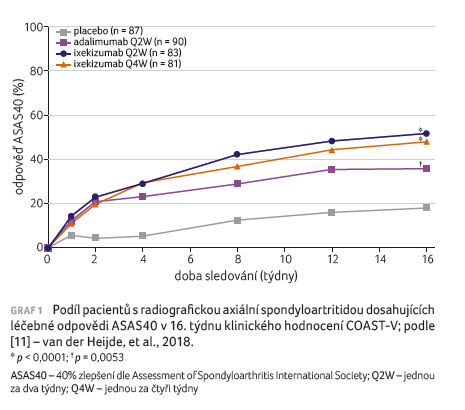
Všechny sekundárn
í cíle studie byly také splněny. Větší podíl pacientů léčených ixekizumabem a adalimumabem ve srovnání s placebem dosáhl nízké aktivity nemoci podle ASDAS (42−43 % a 38 % vs. 13 %; p < 0 001 pro všechna porovnání). Podobně bylo dosaženo statisticky významného zlepšení ostatních parametrů a
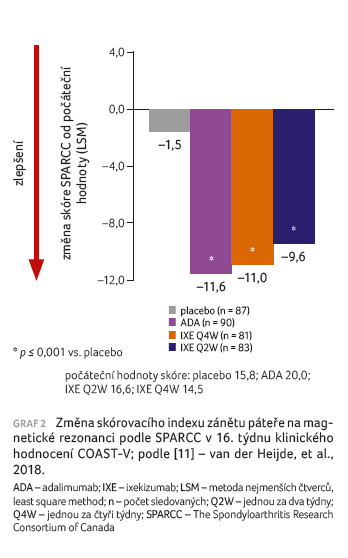
ktivity onemocnění, včetně funkčních schopností. Významné potlačení intenzity zánětu páteře na MR bylo pozorováno u pacientů ve skupinách s ixekizumabem a adalimumabem ve srovnání s placebem (graf 2). Celkově byl randomizován relativně malý počet pacientů, klinické hodnocení tak nemělo dostatečnou sílu na zhodnocení rozdílu mezi ixekizumabem a adalimumabem.
Studie COAST W
COAST W byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III, jež hodnotila účinnost a bezpečnost ixekizumabu u pacientů s aktivní r axSpA, kteří měli předchozí nedostatečnou odpověď nebo nesnášenlivost na jeden nebo dva přípravky blokující TNF [12]. Klinické hodnocení zahrnovalo 316 pacientů randomizovaných do tří ramen: s placebem (n = 104) nebo s ixekizumabem podávaným jednou za dva týdny (n = 98) nebo jednou za čtyři týdny (n = 114). Podíl pacientů, kteří dokončili 16týdenní zaslepenou fázi studie, byl 89,4 % u placeba a 91,8−86,8 % u ixekizumabu.
Primární cíl studie byl splněn
(graf 3). Větší podíl pacientů, kteří
dostávali ixekizumab jednou za dva týdny a jednou
za čtyři týdny, v porovnání s těmi, jimž bylo
podáváno placebo, dosáhl na odpověď ASAS40 v 16. týdnu
(30,6 % a 25,4 % vs. 12,5 %; p = 0,003
a p = 0,017). Statisticky významné zlepšení
bylo pozorováno již od prvního týdne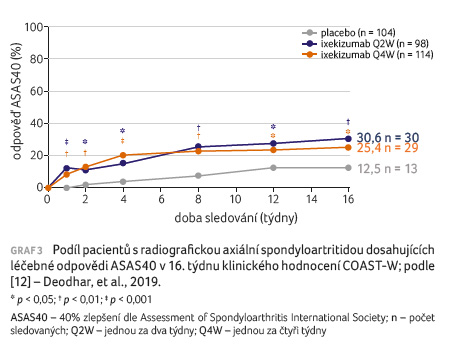 léčby ixekizumabem.
Počáteční dávka 160 mg oproti 80 mg nevedla ke zlepšení
účinnosti pozorované v 16. týdnu.
léčby ixekizumabem.
Počáteční dávka 160 mg oproti 80 mg nevedla ke zlepšení
účinnosti pozorované v 16. týdnu.
Klíčové sekundární cíle, odpověď ASAS20 a navození nízké aktivity onemocnění (ASDAS < 2,1), byly splněny. Podíl pacientů, kteří dosáhli odpovědi ASAS20 v 16. týdnu, byl vyšší ve skupině s ixekizumabem
podávaným jednou za dva týdny nebo jednou za čtyři týdny v porovnání s placebem (46,9 % a 48,2 % vs. 29,8 %; p < 0,05 a p < 0,001). Významně větší podíl pacientů dosáhl nízké aktivity onemocnění v 16. týdn
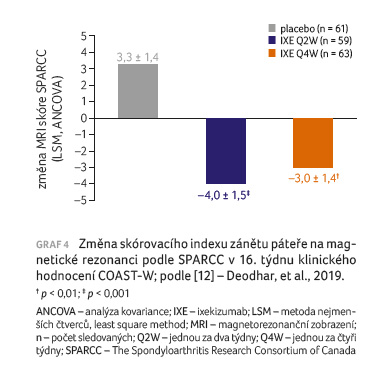
u ve skupině s ixekizumabem podávaným jednou za dva týdny nebo jednou za čtyři týdny v porovnání se skupinou pacientů z placebové větve (16,3 % a 17,3 % vs. 4,8 %; p < 0,01). U pacientů, kteří dostávali ixekizumab, došlo v 16. týdnu k významnějšímu zmírnění intenzity zánětu páteře na MR v porovnání s placebem (graf 4).
Studie COAST X
COAST X byla 52týdenní
randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie
fáze III s paralelními skupinami, která hodnotila účinnost
a bezpečnost ixekizumabu u pacientů s aktivní
nr axSpA, kteří měli nedostatečnou odpověď na léčbu
NSA nebo nesnášenlivost NSA [13]. Celkem bylo do klinického
hodnocení zařazeno 303 pacientů, kteří byli randomizováni
do tří ramen: s placebem (n = 105) nebo
s ixekizumabem podávaným jednou za dva týdny (n = 102)
nebo jednou za čtyři týdny (n = 96). Změna
standardní léčby na pozadí studijního přípravku nebo
přechod do otevřené fáze s podáváním ixekizumabu
jednou za dva týdny byly povoleny po 16. týdnu podle
uvážení zkoušejícího. Pacienti, kteří přešli do otevřené
fáze, byli v logistické regresní analýze posuzováni jako
neodpovídající. Podíl všech pacientů, kteří dokončili
16týdenní zaslepenou fázi studie a celých 52 týdnů, byl
96 %, resp. 87 %, včetně pacientů, kteří přešli
do otevřené fáze klinického hodnocení. Celé období 52
týdnů dokončilo s původně přiřazenou studijní léčbou
32 % pacientů ve skupině s placebem a 51 % nebo
54 % pacientů ve skupině s ixekizumabem podávaným
jednou za dva týdny nebo jednou za čtyři týdny.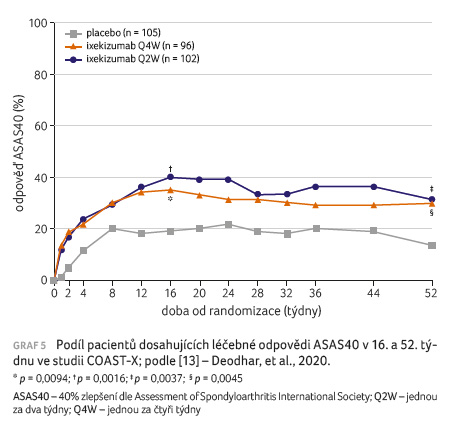
Oba primární cílové parametry byly splněny (graf 5). V 16. týdnu bylo dosaženo odpovědi ASAS40 u většího podílu pacientů, kteří dostávali ixekizumab jednou za dva týdny a jednou za čtyři týdny v porovnání s placebem (40 % a 35 % vs. 19 %; p = 0,0016 a p = 0,0094). Podobně bylo dosaženo v 52. týdnu odpovědi ASAS40 u většího podílu pacientů, kteří dostávali ixekizumab jednou za dva týdny a jednou za čtyři týdny, v porovnání s pacienty ze skupiny s placebem (31 % a 30 % vs. 13 %; p = 0,004 a p = 0,005). Větší podíl pacientů léčených ixekizumabem dosáhl odpovědi ASAS40 v porovnání s pacienty z placebové skupiny, a to bez ohledu na výchozí sérové koncentrace CRP nebo zánětlivé postižení SI kloubů podle MR. Statisticky významné klinické zlepšení bylo pozorováno již od prvního týdne. Počáteční dávka 160 mg oproti 80 mg nevedla ke zlepšení účinnosti pozorované v týdnu 16 ani v týdnu 52.
Klíčové sekundární cíle byly také
splněny, významně větší podíl pacientů dosáhl nízké
aktivity onemocnění podle ASDAS v 16. i 52. týdnu
ve skupině pacientů, kteří dostávali ixekizumab jednou
za dva týdny nebo jednou za čtyři týdny,
v porovnání se skupinou pacientů s placebem (16. týden:
32 % a 28 % vs. 12 %; p = 0,0009
a p = 0,008; 52. týden: 27 % a 30 %
vs. 9 %; p = 0,0009 a p = 0,003).
Stejně tak byl zaznamenán významnější pokles aktivity nemoci
podle ASDAS nebo BASDAI a zlepšení funkčních schopností při
podávání ixekizumabu proti placebu. Pacienti, kteří dostávali
ixekizumab, měli v porovnání s pacienty z placebové
větve významnější snížení skóre zánětu na SI kloubech
v 16. i 52. týdnu (graf 6). Snížení
sérových koncentrací CRP bylo výraznější při léčbě
ixekizumabem než při podávání placeba v 16. a 52. týdnu,
ale rozdíly nedosáhly statistické významnosti.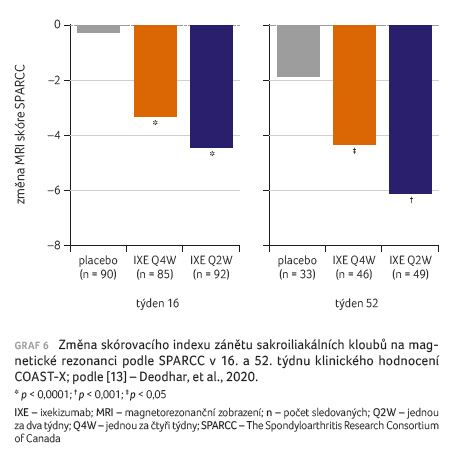
Bezpečnost
Ixekizumab byl v lékových hodnoceních obecně dobře tolerován. Ve studii COAST V bylo ve skupině pacientů s ixekizumabem numericky o něco více nežádoucích účinků ve srovnání s placebem, většina z nich mírné až střední závažnosti [11]. Během zaslepené fáze se jedna závažná infekce vyskytla v každém z léčebných ramen: při podávání ixekizumabu jednou za dva týdny (1 %), jednou za čtyři týdny (1 %) a stejně i při terapii adalimumabem (1 %), přičemž v rameni s placebem nebyla hlášena žádná. Nebyly hlášeny oportunní infekce, malignity ani úmrtí, jež by měly souvislost s léčbou.
Ve studii COAST W bylo ve srovnání s placebem zaznamenáno více nežádoucích účinků souvisejících s léčbou ixekizumabem a většina z nich byla také mírné až střední závažnosti [12]. Nejčastěji hlášenými událostmi byly infekce horních cest dýchacích a reakce v místě vpichu. Mírné infekce zahrnovaly kandidózu a herpes zoster ve skupině s ixekizumabem. Závažné infekce byly hlášeny u dvou pacientů v rameni s ixekizumabem aplikovaným jednou za čtyři týdny. Mírná neutropenie (stupeň 1) se vyskytla častěji ve skupině ixekizumabu než ve skupině placeba a měla přechodný charakter. U jednoho pacienta léčeného ixekizumabem byla zaznamenána neutropenie 4. stupně a čtyři týdny po zahájení léčby se u něj vyvinula akutní promyelocytární leukemie. Při podávání ixekizumabu byla hlášena také jedna smrt (sebevražda), která nastala u pacienta se zdokumentovanou anamnézou depresivního syndromu. Žádná z těchto dvou příhod nebyla hodnocena jako související se studijní léčbou.
U čtyř (1 %) pacientů s nr axSpA ve studii COAST X byl zjištěn závažný nežádoucí účinek [13]. Frekvence závažných nežádoucích účinků a přerušení léčby v důsledku nežádoucích účinků byly napříč všemi třemi rameny stejné. Mírná neutropenie se objevovala přibližně stejně často při léčbě ixekizumabem jako při podávání placeba (8−13 %). Neutropenie těžkého stupně byla hlášena u jednoho pacienta v placebové větvi. Mezi oportunními infekcemi byly dva případy herpes zoster ve skupině s ixekizumabem aplikovaným jednou za čtyři týdny a jeden případ v placebové skupině. Jeden případ orální kandidózy byl popsán ve skupině pacientů s placebem. Nejčastěji hlášenými nežádoucími účinky při léčbě ixekizumabem byly nazofaryngitida a reakce v místě vpichu.
V otevřené fázi lékového hodnocení do 52. týdne nebyly pozorovány u pacientů s r axSpA žádné nové bezpečnostní signály [14]. Pro nežádoucí účinky ukončilo svoji účast ve studii COAST V 2,4 % pacientů a ve studii COAST W 3,6 % pacientů. Nejčastěji se vyskytovaly nazofaryngitida, reakce v místě vpichu a infekce horních cest dýchacích. Infekce byly hlášeny u 31,3 % pacientů ve studii COAST V a u 33,5 % pacientů ve studii COAST W; tyto reakce byly většinou mírné nebo středně závažné. Závažné infekce byly hlášeny ve třech případech (celulitida, pneumonie a tonzilitida) ve studii COAST V a ve třech případech (gastroenteritida, pneumonie a sinusitida) ve studii COAST W; v jednom případě došlo k přerušení účasti v lékovém hodnocení. Kvasinkové infekce byly hlášeny u dvou pacientů ve studii COAST V a u dvou pacientů ve studii COAST W, u všech byla doložena mírná až střední závažnost, jeden z těchto pacientů studii ukončil.
Závažné nežádoucí účinky byly hlášeny u 5,5 % pacientů ve studii COAST V a u 3,2 % pacientů ve studii COAST W. Mezi dvěma dávkovacími režimy ixekizumabu nebyl pozorován rozdíl ve frekvenci závažných nežádoucích účinků. Alergické reakce a hypersenzitivita byly hlášeny ve 4,3 % případů ve studii COAST V i COAST W. Reakce v místě vpichu byla hlášena u 12,8 % pacientů ve studii COAST V a u 6,4 % pacientů ve studii COAST W. Většina z nich byla mírné až střední závažnosti; jeden pacient klinické hodnocení z tohoto důvodu ukončil.
Imunogenicita pravděpodobně nepředstavuje zásadní problém, protilátky proti léku byly detekovány u méně než 5 % pacientů, neutralizační protilátky byly v nízkém titru přítomny pouze ve studii COAST W, jejich výskyt nepřesahoval 1 % a neměly vztah k účinnosti a nežádoucím projevům, včetně reakce v místě vpichu nebo hypersenzitivity.
Ve studii COAST V byly hlášeny dva případy nově vzniklé Crohnovy choroby a dva pacienti s předchozí diagnózou ulcerózní kolitidy prodělali její exacerbaci. Ve studii COAST W nebyl hlášen žádný případ nespecifického střevního zánětu.
Závěr
Axiální spondyloartritida je chronické imunitně podmíněné onemocnění postihující preferenčně axiální skelet. Onemocnění zahrnuje radiografickou formu známou jako ankylozující spondylitida a formu neradiografickou. Přibližně třetina pacientů s aktivní axSpA nemá dostatečnou odpověď na terapii inhibitory TNF nebo se v průběhu léčby vyskytují nežádoucí účinky [15,16]. Existuje mnoho dokladů o tom, že cytokinová dráha IL 23/IL 17 je klíčovým faktorem patogeneze axSpA a že signalizace IL 17 je u pacientů s axSpA účinným terapeutickým cílem [17,18]. V léčbě axSpA, ale také psoriázy a psoriatické artritidy je využíván sekukinumab, plně humánní monoklonální protilátka proti IL 17A [19]. Ixekizumab podobně prokázal účinnost v léčbě radiografické i neradiografické axSpA, vedl k významnému snížení aktivity onemocnění, zlepšení kvality života, fyzických funkčních schopností a k utlumení intenzity aktivního zánětu na páteři a v SI kloubech. Bezpečnostní profil byl konzistentní s biologickou léčbou, v porovnání s placebem se při léčbě ixekizumabem častěji vyskytovaly reakce v místě vpichu a infekce, nejčastěji nazofaryngitida nebo infekce horních cest dýchacích mírné až střední závažnosti. Na podkladě výstupů z výše zmíněných lékových hodnocení je ixekizumab schválen lékovými kontrolními úřady EMA (European Medicines Agency) a FDA (U.S. Food and Drug Administration) od srpna 2019 pro léčbu aktivní r axSpA a od června 2020 pro léčbu aktivní nr axSpA. Doporučenou iniciální dávkou je 160 mg aplikovaných subkutánní injekcí, která je následována podáváním dávky 80 mg každé čtyři týdny. Závěrem lze konstatovat, že ixekizumab představuje vhodnou alternativu k léčbě blokující TNF u pacientů s axSpA.
Seznam použité literatury
- [1] Proft F, Poddubnyy D. Ankylosing spondylitis and axial spondyloarthritis: recent insights and impact of new classification criteria. Ther Adv Musculoskelet Dis 2018; 10: 129−139.
- [2] Azzolin I, Massazza G, Iagnocco A. Spondyloarthritis: not only enthesitis. Clin Exp Rheumatol 2020; 38: 157−163.
- [3] Akkoc N, Khan MA. Is Axial Spondyloarthritis More Common Than Rheumatoid Arthritis? Curr Rheumatol Rep 2020; 22: 54.
- [4] López‑Medina C, Moltó A. Update on the epidemiology, risk factors, and disease outcomes of axial spondyloarthritis. Best Pract Res Clin Rheumatol 2018; 32: 241−253.
- [5] Maksymowych WP. The role of imaging in the diagnosis and management of axial spondyloarthritis. Nat Rev Rheumatol 2019; 15: 657−672.
- [6] van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS‑EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 978−991.
- [7] Ward MM, Deodhar A, Gensler LS, et al. 2019 Update of the American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis Rheumatol 2019; 71: 1599−1613.
- [8] Kiwalkar S, Beier S, Deodhar A. Ixekizumab for treating ankylosing spondylitis. Immunotherapy 2019; 11: 1273−1282.
- [9] Sieper J, Poddubnyy D, Miossec P. The IL‑23‑IL‑17 pathway as a therapeutic target in axial spondyloarthritis. Nat Rev Rheumatol 2019; 15: 747−757.
- [10] McGonagle DG, McInnes IB, Kirkham BW, et al. The role of IL‑17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies [published correction appears in Ann Rheum Dis 2020; 79: e12]. Ann Rheum Dis 2019; 78: 1167−1178.
- [11] van der Heijde D, Cheng‑Chung Wei J, Dougados M, et al. Ixekizumab, an interleukin‑17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease‑modifying anti‑rheumatic drugs (COAST‑V): 16 week results of a phase 3 randomised, double‑blind, active‑controlled and placebo‑controlled trial. Lancet 2018; 392: 2441−2451.
- [12] Deodhar A, Poddubnyy D, Pacheco‑Tena C, et al. Efficacy and Safety of Ixekizumab in the Treatment of Radiographic Axial Spondyloarthritis: Sixteen‑Week Results From a Phase III Randomized, Double‑Blind, Placebo‑Controlled Trial in Patients With Prior Inadequate Response to or Intolerance of Tumor Necrosis Factor Inhibitors. Arthritis Rheumatol 2019; 71: 599−611.
- [13] Deodhar A, van der Heijde D, Gensler LS, et al. Ixekizumab for patients with non‑radiographic axial spondyloarthritis (COAST‑X): a randomised, placebo‑controlled trial. Lancet 2020; 395: 53−64.
- [14] Dougados M, Wei JC, Landewé R, et al. Efficacy and safety of ixekizumab through 52 weeks in two phase 3, randomised, controlled clinical trials in patients with active radiographic axial spondyloarthritis (COAST‑V and COAST‑W) [published correction appears in Ann Rheum Dis 2020; 79: e75]. Ann Rheum Dis 2020; 79: 176−185.
- [15] Poddubnyy D, Sieper J. Treatment of Axial Spondyloarthritis: What Does the Future Hold? Curr Rheumatol Rep 2020; 22: 47.
- [16] Maguire S, Sengupta R, O'Shea F. The Future of Axial Spondyloathritis Treatment. Rheum Dis Clin North Am 2020; 46: 357−365.
- [17] Pedersen SJ, Maksymowych WP. The Pathogenesis of Ankylosing Spondylitis: an Update. Curr Rheumatol Rep 2019; 21: 58.
- [18] Maguire S, Sengupta R, O'Shea F. The Future of Axial Spondyloathritis Treatment. Rheum Dis Clin North Am 2020; 46: 357−365.