Obinutuzumab v první linii léčby chronické lymfocytární leukemie ‒ zkušenosti z klinické praxe
Souhrn:
Zuchnická J, Fečková Mihályová J, Ištvániková L, Hájek R. Obinutuzumab v první linii léčby chronické lymfocytární leukemie – zkušenosti z klinické praxe. Remedia 2018; 28: 377–381.
Chronická lymfocytární leukemie je nejčastější leukemií v dospělém věku. Z důvodu přítomnosti antigenu CD20 na povrchu nádorových lymfocytů byla jedním z prvních onemocnění, u něhož byla úspěšně použita monoklonální protilátka rituximab. V současné době se do klinické praxe dostávají i nové monoklonální protilátky vyvíjené s cílem zvýšení protinádorového účinku. Jednou z nich je humanizovaná monoklonální protilátka obinutuzumab, která má na rozdíl od generačně starších protilátek některé terapeutické výhody. Obinutuzumab v kombinaci s chlorambucilem je v České republice schválen k terapii chronické lymfocytární leukemie u dosud neléčených pacientů s přidruženými onemocněními, kteří nemohou podstoupit léčbu fludarabinovým režimem.
Summary:
Zuchnicka J, Feckova Mihalyova J, Istvanikova L, Hajek R. Obinutuzumab in the first line of treatment of chronic lymphocytic leukemia ‒ experience from clinical practice. Remedia 2018; 28: 377–381.
Chronic lymphocytic leukemia is the most common leukemia in adulthood. Due to the presence of the CD20 antigen on the surface of tumor lymphocytes, it was one of the first diseases where the monoclonal antibody rituximab was successfully used. Currently, new monoclonal antibodies developed to increase the antitumor effect are appearing in clinical practice. One of these is the humanized monoclonal antibody obinutuzumab. Compared with older antibodies, it has some therapeutic benefits. Obinutuzumab in combination with chlorambucil is approved in the Czech Republic for the treatment of chronic lymphocytic leukemia in previously untreated patients with associated conditions who cannot undergo fludarabine treatment.
Key words: chronic lymfocytic leukemia, monoclonal antibodies, obinutuzumab
Úvod
Chronická lymfocytární leukemie (CLL) je nejčastější leukemií v dospělém věku. Onemocnění je téměř dvakrát častější u mužů než u žen. Medián věku při diagnóze se pohybuje kolem 71 let, až 43 % případů je diagnostikováno u nemocných ve věku 75 let a více [1,2]. Onemocnění je většinou diagnostikováno náhodně v počátečních stadiích nevyžadujících léčbu. Zahájení terapie bývá potřebné za 4‒5 let od diagnózy, stává se často aktuálním až po 75. roce života [3]. V posledním desetiletí bylo zaznamenáno mnoho nových poznatků v oblasti diagnostiky CLL. Výzkum v oblasti molekulárně biologických a cytogenetických aberací změnil pohled na etiopatogenezi, průběh a prognózu onemocnění. Je k dispozici řada účinných a cílených léčebných možností. U starších nemocných jsme při jejich výběru limitováni jednak fyziologickým poklesem funkce orgánů souvisejícím s věkem (snížením renálních funkcí, snížením rezervy kostní dřeně, zhoršením kognitivních funkcí), jednak přítomností přidružených onemocnění. V neposlední řadě je nutno přihlížet k užívání většího množství léků, ke změnám farmakokinetiky těchto léků a k možnostem jejich interakce s protinádorovou terapií [4].
Volba léčebného postupu v první linii
Na základě nových poznatků v diagnostice, zlepšení prognostické stratifikace a účinnějších terapeutických postupů je volba první linie léčby pro konkrétního nemocného s přihlédnutím k jeho celkové zdravotní kondici velmi důležitým faktorem ovlivňujícím kvalitu života, dobu do progrese choroby a celkové přežití nemocného. Kritéria pro zahájení léčby jsou dobře definována a stále platná [5]. Před zahájením úvodní léčby onemocnění je nutno definovat biologické vlastnosti a prognostické faktory choroby u konkrétního nemocného [6], zhodnotit jeho celkový zdravotní stav, výkonnost a přidružená onemocnění [7], definovat cíl léčby a zohlednit preference a přání nemocného. Dříve se udávalo, že hlavní příčinou úmrtí u starších nemocných s CLL jsou jiné v populaci běžné nemoci. Současná data však vypovídají o opaku, většina starších pacientů umírá z důvodu progrese CLL nebo na její komplikace [8]. Volba adekvátního terapeutického postupu pro úvodní linii léčby je pro další prognózu nemocného zásadní.
Zhodnocení celkového stavu nemocného před zahájením léčby nám umožní rozdělit pacienty s CLL do tří skupin. První skupinu tvoří tzv. fit pacienti ve věku do 65 let bez významných přidružených onemocnění a také nemocní ve věku 65‒75 let bez významných komorbidit s dobrou funkční rezervou a s dobrou funkcí ledvin. Mladší z nich mají být léčeni intenzivní imunochemoterapií FCR (fludarabin, cyklofosfamid, rituximab), pro fit nemocné vyššího věku s nezávažnými přidruženými onemocněními volíme méně toxický režim BR (bendamustin, rituximab), který dosahuje podobných výsledků s nižší frekvencí výskytu nežádoucích účinků [9]. Výjimku tvoří nemocní s chromozomovou delecí 11q, u nichž režim BR nedosahuje optimální léčebné odpovědi a mediánu přežití bez progrese (progression free survival, PFS). Imunochemoterapie selhává u nemocných s delecí 17p či s mutací TP53, zde je nutno volit léčbu novými inhibitory B buněčného receptoru (ibrutinib, idelalisib s rituximabem) a inhibitorem antiapoptotického proteinu BCL 2 (venetoklax) a mladé pacienty v dobré kondici s dostupným HLA identickým dárcem je potřeba včas směrovat k alogenní transplantaci krvetvorných buněk. Přes všechny pokroky v diagnostice a léčbě zůstává alogenní transplantace krvetvorných buněk jedinou možností, která je schopna onemocnění vyléčit, je však zatížena významnými komplikacemi.
Druhou skupinou na opačné straně spektra jsou pacienti velmi křehcí, většinou ve věku nad 85 let a/nebo s významnými přidruženými onemocněními, s velmi omezenou funkční rezervou a nezřídka i s kognitivními poruchami. Tito pacienti jsou kandidáty paliativní terapie, jejímž cílem je redukovat nejvýraznější příznaky onemocnění. Doba dožití je u nich limitována nezávisle na přítomnosti CLL.
Mezi těmito dvěma skupinami se nachází poměrně heterogenní skupina nemocných, které označujeme jako tzv. unfit, jsou starší 70 let, trpí významnějšími přidruženými onemocněními. Komplexní posouzení jejich výkonnostního stavu a správná volba úvodní terapie CLL s ohledem na možné komplikace má zásadní vliv na jejich celkové přežití (overall survival, OS).
Obinutuzumab v kombinaci s chlorambucilem v iniciální léčbě starších nemocných
Úvodní léčba starších unfit pacientů by měla mít dobrý protinádorový efekt s dosažením vyššího počtu kompletních remisí, případně i s negativitou minimální zbytkové nemoci. Terapie by měla prodloužit interval PFS, oddálit nutnost podání další terapie a prodloužit OS. Zároveň by měla mít příznivý profil akutní i oddálené toxicity a neměla by zhoršovat kvalitu života. Tyto požadavky v současné době splňuje kombinace obinutuzumabu s chlorambucilem (G Clb). Výjimkou jsou pacienti s delecí 17p či s mutací TP53, pro něž imunoterapie není přínosem a výhodou je pro ně léčba novými inhibitory (ibrutinib, idelalisib s rituximabem, po jejich selhání či při intoleranci venetoklax). Použití těchto nových molekul je v České republice zatím vázáno na schválení plátcem podle §16 zákona č. 48/1997 Sb.
Mechanismus účinku obinutuzumabu
Obinutuzumab (Gazyvaro, GA101) je glykosylací upravená humanizovaná monoklonální protilátka anti CD20 II. typu třídy IgG1. Váže se na odlišný epitop antigenu CD20 než rituximab či ofatumumab. Ve srovnání s protilátkami anti CD20 I. typu má několik terapeutických výhod. Má výrazně zvýšenou protilátkou indukovanou cytotoxickou reakci (antibody dependent cell mediated cytotoxicity, ADCC) a působí také jako silnější induktor přímé buněčné smrti (direct cell death, DCD). Nevede ke snížení počtu (internalizaci) CD20 molekul na povrchu nádorové buňky, cytotoxicita závislá na komplementu je naopak nižší [10].
Výsledky klinických studií
Obinutuzumab byl testován u nemocných
s CLL především ve dvou klinických sledováních:
GAUGUIN (klinická studie fáze I/II) a CLL11 (klinická
studie fáze III). Studie GAUGU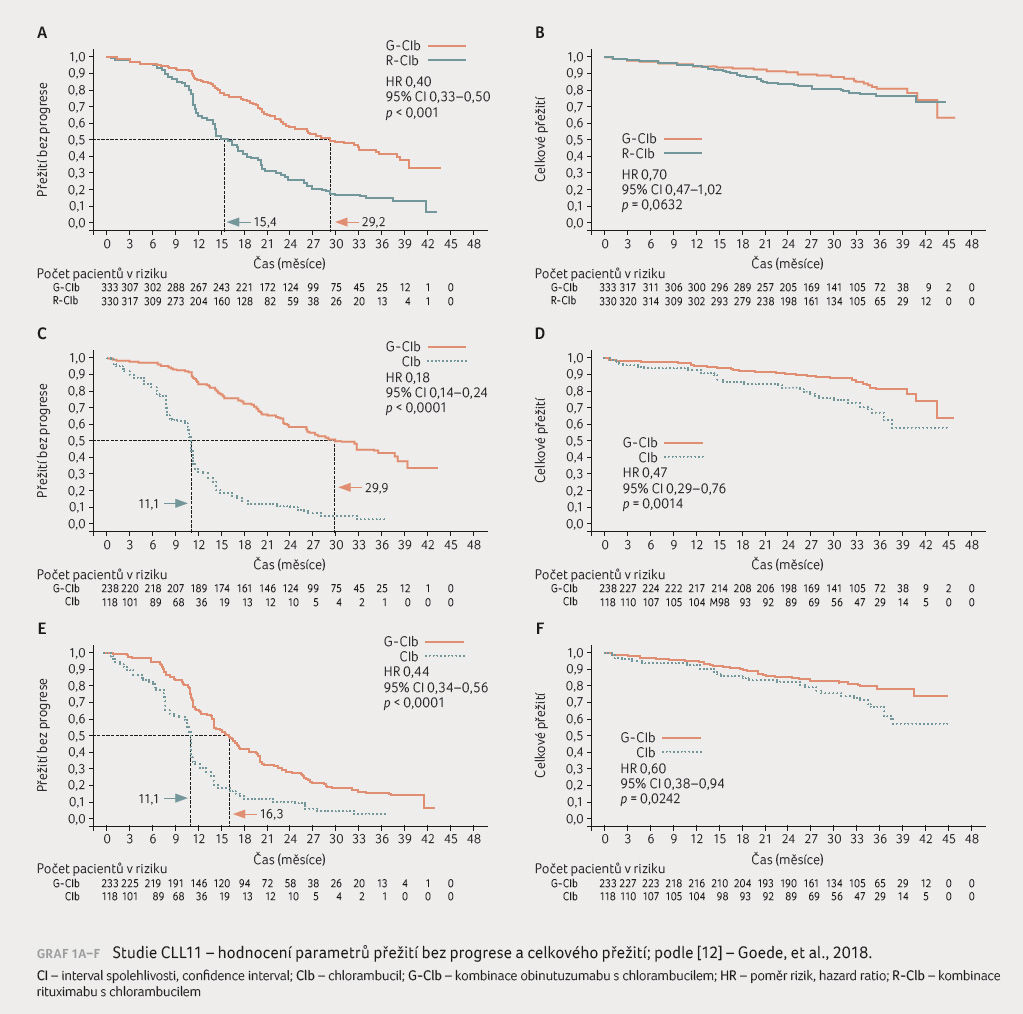 IN byla zaměřena na výrazně
předléčené nemocné s CLL bez významnějších přidružených
onemocnění, na základě studie fáze I bylo
identifikováno standardní dávkování obinutuzumabu [11].
Studie CLL11 srovnávala účinnost režimů obinutuzumab
s chlorambucilem (G Clb), rituximab s chlorambucilem
(R Clb) a chlorambucil v monoterapii (Clb) u dosud
neléčených pacientů s CLL se závažnými přidruženými
onemocněními. Výsledky studie CLL11 ukázaly, že kombinace G Clb
je účinnější než kombinace R Clb, případně než Clb
v monoterapii. V obou ramenech s monoklonálními
protilátkami byla v porovnání s chlorambucilem
pozorována vyšší četnost odpovědí na léčbu (overall
response rate, ORR: G Clb 77,3 % vs. R Clb 65,7 % vs.
Clb 31,4 %) včetně kompletních remisí. Obinutuzumab prodloužil
PFS (medián při léčbě G Clb 29,2 měsíce vs.
R Clb 15,4 měsíce vs. Clb 11 měsíců) i OS (mediánu
u G Clb nebylo dosaženo vs. R Clb 73,1 měsíce).
Nejčastější závažné nežádoucí účinky ve studii
CLL11 v rameni G Clb představovaly reakce spojené
s infuzí (G Clb 20 % vs. R Clb 4 %), neutropenie
(G Clb 33 % vs. R Clb 28 % vs. Clb 16 %) a infekce
(G Clb 12 % vs. R Clb 14 % vs. Clb 14 %) [12].
Vývoj parametrů PFS a OS znázorňuje graf 1A‒F.
IN byla zaměřena na výrazně
předléčené nemocné s CLL bez významnějších přidružených
onemocnění, na základě studie fáze I bylo
identifikováno standardní dávkování obinutuzumabu [11].
Studie CLL11 srovnávala účinnost režimů obinutuzumab
s chlorambucilem (G Clb), rituximab s chlorambucilem
(R Clb) a chlorambucil v monoterapii (Clb) u dosud
neléčených pacientů s CLL se závažnými přidruženými
onemocněními. Výsledky studie CLL11 ukázaly, že kombinace G Clb
je účinnější než kombinace R Clb, případně než Clb
v monoterapii. V obou ramenech s monoklonálními
protilátkami byla v porovnání s chlorambucilem
pozorována vyšší četnost odpovědí na léčbu (overall
response rate, ORR: G Clb 77,3 % vs. R Clb 65,7 % vs.
Clb 31,4 %) včetně kompletních remisí. Obinutuzumab prodloužil
PFS (medián při léčbě G Clb 29,2 měsíce vs.
R Clb 15,4 měsíce vs. Clb 11 měsíců) i OS (mediánu
u G Clb nebylo dosaženo vs. R Clb 73,1 měsíce).
Nejčastější závažné nežádoucí účinky ve studii
CLL11 v rameni G Clb představovaly reakce spojené
s infuzí (G Clb 20 % vs. R Clb 4 %), neutropenie
(G Clb 33 % vs. R Clb 28 % vs. Clb 16 %) a infekce
(G Clb 12 % vs. R Clb 14 % vs. Clb 14 %) [12].
Vývoj parametrů PFS a OS znázorňuje graf 1A‒F.
Způsob podání
Monoklonální protilátka obinutuzumab se podává naředěná fyziologickým roztokem v intravenózní infuzi. Během aplikace je nutný dohled zkušeného zdravotnického personálu s okamžitě dostupným vybavením pro resuscitaci. První dávka se rozděluje na dvě části z důvodu prevence a minimalizace závažných reakcí spojených s infuzí. Každý pacient je premedikován intravenózními kortikosteroidy, antipyretiky a antihistaminiky. U nemocných s velkou nádorovou masou, s vysokými počty lymfocytů v periferní krvi (> 25 × 109/l) a/nebo s poruchou funkce ledvin (clearance kreatininu [CrCl] < 70 ml/min), a tedy s vysokým rizikem syndromu nádorového rozpadu (tumor lysis syndrome, TLS), je nutno zajistit odpovídající hydrataci, podávání urikostatik a/nebo urátoxidázy 12‒24 hodin před zahájením infuze obinutuzumabu. Vždy je potřeba dodržovat rychlost infuze, tento proces je podrobně popsán v souhrnu údajů o přípravku (SPC). Doporučuje se podávat profylakticky kotrimoxazol (prevence pneumocystické pneumonie) a u vybraných rizikových nemocných antivirotika.
Nežádoucí účinky
Nejčastěji pozorovaným nežádoucím účinkem u pacientů léčených obinutuzumabem jsou reakce spojené s infuzí (infusion related reaction, IRR). Vyskytují se zejména při prvním podání, souvisejí s aktivací cytotoxických buněk ADCC reakce, s uvolněním cytokinů a s rychlou deplecí B lymfocytů. Frekvence IRR se významně snižuje důslednou premedikací, vynecháním antihypertenzní léčby ráno v den podání infuze a rozdělením první dávky obinutuzumabu na dvě části podané ve dvou následujících dnech. U pacientů léčených obinutuzumabem byly hlášeny anafylaktické reakce, někdy obtížně odlišitelné od IRR. U nemocných s anafylaktickou reakcí po obinutuzumabu musí být léčba trvale ukončena. Syndromem TLS jsou ohroženi nemocní s velkou nádorovou masou, s vysokými počty leukocytů a s poruchou renálních funkcí, tato skupina pacientů vyžaduje speciální přípravu, jak bylo výše uvedeno, a pečlivou monitoraci. Dalším významným nežádoucím účinkem je hematologická toxicita (zejména neutropenie, trombocytopenie), infekční komplikace včetně reaktivace hepatitidy B. Byly hlášeny i případy progresivní multifokální leukoencefalopatie (PML). Na tuto komplikaci je nutno myslet u všech pacientů, u nichž se objeví nové neurologické příznaky nebo se změní příznaky preexistujícího neurologického onemocnění. Další možné nežádoucí účinky a opatření k jejich řešení jsou podrobně popsány v SPC.
Kombinace obinutuzumabu s chlorambucilem v klinické praxi
Použití obinutuzumabu demonstrujeme na případu starší nemocné s CLL. Diagnóza CLL byla stanovena v roce 2011 zcela náhodně. Mírného zvětšení axilárních lymfatických uzlin oboustranně (30 mm v dlouhé ose) si pacientka nevšimla, bylo zjištěno při preventivním mamografickém vyšetření. V době diagnózy neměla žádné potíže, v laboratorních hodnotách byla přítomna pouze mírná leukocytóza, lymfocytóza, ostatní parametry krevního obrazu byly v normě. Jednalo se o fit nemocnou, v době diagnózy jí bylo 69 let, neměla žádná závažná přidružená onemocnění, nesplňovala indikační kritéria pro zahájení terapie.
Během let došlo k progresi CLL,
přibývala přidružená onemocnění. Před zahájením léčby
pacientka trpěla recidivujícími respiračními infekcemi
vyžadujícími opakovaně léčbu antibiotiky a substituci
imunoglobulinů (před substitucí byly hodnoty sérového
imunoglobulinu 3,23 g/l). Progredovala lymfocytóza, anémie
a trombocytopenie, postupně došlo k progresi uzlinovéh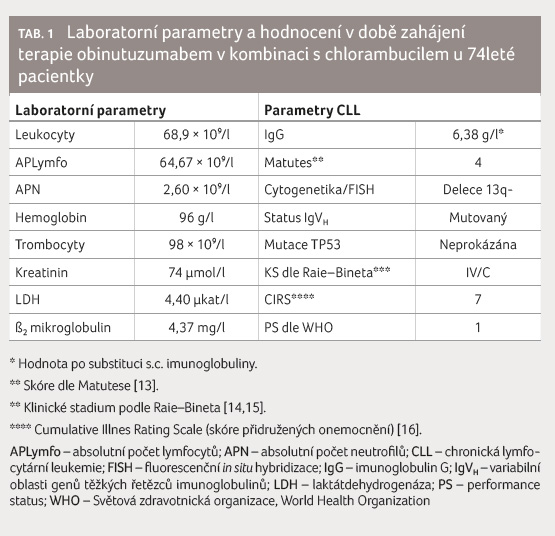 o
syndromu a splenomegalie. V době zahájení léčby
v lednu 2016 byla nemocná ve věku 74 let, s několika
přidruženými onemocněními. Klinicky i laboratorně byla
jednoznačně splněna indikační kritéria pro zahájení léčby
[5]. Laboratorní nález i parametry
CLL v době zahájení terapie jsou podrobně uvedeny v tabulce 1.
o
syndromu a splenomegalie. V době zahájení léčby
v lednu 2016 byla nemocná ve věku 74 let, s několika
přidruženými onemocněními. Klinicky i laboratorně byla
jednoznačně splněna indikační kritéria pro zahájení léčby
[5]. Laboratorní nález i parametry
CLL v době zahájení terapie jsou podrobně uvedeny v tabulce 1.
Pacientka byla léčena šesti 28denními cykly obinutuzumabu s chlorambucilem v dávkování podle studie CLL11 (obinutuzumab: 100 mg i.v. 1. den, 900 mg i.v. 2. den, 1 000 mg i.v. 8. a 15. den 1. cyklu, 1 000 mg i.v. 1. den 2.‒6. cyklu; chlorambucil: 0,5 mg/kg 1. a 15. den každého cyklu) [12]. Při podávání obinutuzumabu jsme postupovali podle SPC, aplikace proběhla bez reakce, bez projevů syndromu TLS. Nemocná užívala preventivně kotrimoxazol, byly substituovány imunoglobuliny. Jedinou komplika
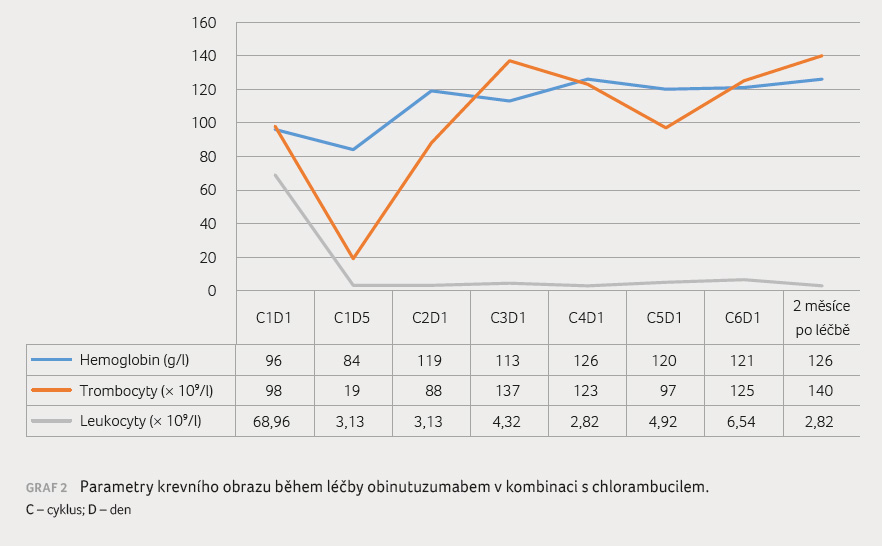
cí během léčby byla hematologická toxicita (neutropenie 4. stupně, trombocytopenie 3. stupně, anémie 2. stupně). Parametry krevního obrazu během léčby jsou uvedeny v grafu 2. Pacientka dosáhla kompletní remise onemocnění, minimální reziduální nemoc hodnocená z periferní krve byla negativní (vyšetřeno průtokovou cytometrií). Aktuálně je pacientka v kompletní remisi onemocnění, klinicky zcela bez potíží.
Závěr
Zavedení obinutuzumabu do klinické praxe znamená důležité rozšíření spektra léčebných možností pro pacienty s CLL. Kombinace obinutuzumabu s chlorambucilem přináší pro starší nemocné s významnými přidruženými onemocněními zvýšený počet celkových odpovědí na léčbu včetně kompletních remisí, prodloužení doby bez progrese a doby do nutnosti zahájit další protinádorovou terapii. Léčba je dobře tolerována, kromě infuzních reakcí spojených s první aplikací obinutuzumabu není zatížena významnější akutní ani dlouhodobou toxicitou, nesnižuje kvalitu života nemocných. Kombinace této anti CD20 protilátky s dalšími léky (bendamustin, ibrutinib, venetoklax) může být v budoucnu významným faktorem zlepšujícím léčebné výsledky a prognózu nemocných s CLL.
Seznam použité literatury
- [1] National Cancer Institute. Dostupné na: https://seer.cancer.gov/statfacts/html/clyl.html
- [2] Cancer Research UK. Dostupné na: http://www.cancerresearchuk.org/health‑professional/cancer‑statistics/statistics‑by‑cancer‑type/leukaemia‑cll/incidence#heading‑Two
- [3] Zoellner AK, Höhler T, Fries S, et al. Altered treatment of chronic lymphocytic leukemia in Germany during the last decade. Ann Hematol 2016; 95: 853–861.
- [4] Extermann M, Hurria A. Comprehensive geriatric assessment for older patients with cancer. J Clin Oncol 2007; 25: 1824–1831.
- [5] Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute‑Working Group 1996 guidelines. Blood 2008; 111: 5446‒5456.
- [6] Hallek M. Chronic lymphocytic leukemia: 2017 update on diagnosis, risk stratification, and treatment. Am J Hematol 2017; 92: 946‒996.
- [7] Thurmes P, Call T, Slager S, et al. Comorbid conditions and survival in unselected, newly diagnosed patients with chronic lymphocytic leukemia. Leuk Lymphoma 2008; 49: 49‒56.
- [8] Pulte D, Redaniel MT, Bird J, et al. Survival for patients with chronic leukemia in the US and Britain: age‑related disparities and changes in the early 21st century. Eur J Haematol 2015; 94: 540–545.
- [9] Eichhorst B, Fink AM, Bahlo J, et al. First‑line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open‑label, randomised, phase 3, non‑inferiority trial. Lancet Oncol 2016; 17: 928–942.
- [10] Herting F, Friess T, Bader S, et al. Enhanced anti‑tumor activity of the glycoengineered type II CD20 antibody obinutuzumab (GA101) in combination with chemotherapy in xenograft models of human lymphoma. Leuk Lymphoma 2014; 55: 2151–2160.
- [11] Cartron G, de Guibert S, Dilhuydy MS, et al. Obinutuzumab (GA101) in relapsed/refractory chronic lymphocytic leukemia: final data from the phase 1/2 GAUGUIN study. Blood 2014; 124: 2196‒2202.
- [12] Goede V, Fischer K, Dyer M, et. al. Overall survival benefit of obinutuzumab over rituximab when combined with chlorambucil in patients with chronic lymphocytis leukemia and comorbidities: final survival analysis of study CLL11, EHA 2018, Abstract: S151.
- [13] Moreau EJ, Matutes E, A’Hern RP, et al. Improvement of the chronic lymphocytic leukemia scoring system with the monoclonal antibody SN8 (CD79b). Am J Clin Pathol 1997; 108: 378–382.
- [14] Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48: 198‒206.
- [15] Rai KR, Sawitsky A, Cronkite EP, et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46: 219–234.
- [16] Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc 2008; 56: 1926–1931.