Ofatumumab – novinky a porovnání s ostatními depletory CD20+ lymfocytů v léčbě relabující‑remitující roztroušené sklerózy
Souhrn:
Elišák M. Ofatumumab – novinky a porovnání s ostatními depletory CD20+ lymfocytů v léčbě relabující‑remitující roztroušené sklerózy. Remedia 2022; 32: 169–173.
V posledních letech dochází k vývoji konceptů patofyziologie roztroušené sklerózy (RS), mimo jiné jde o prokázání klíčové role B lymfocytů. Právě identifikace tohoto nového terapeutického cíle při prokázání vysoké účinnosti a příznivého bezpečnostního profilu selektivních B buněčných deplečních terapií (jako jsou monoklonální protilátky proti povrchovému znaku CD20 lymfocytů) rozšířila možnosti léčby RS. V tomto roce byla schválena úhrada ofatumumabu – plně lidské monoklonální protilátky proti CD20 pozitivním lymfocytům. Dále je schválena rekombinantní humanizovaná protilátka okrelizumab a v tzv. off‑label indikaci je také užívána chimérická monoklonální protilátka rituximab. Byť je biologický efekt těchto protilátek stejný, odlišují se v řadě farmakokinetických i farmakodynamických parametrů. Cílem článku je uvést recentní údaje o nejnovější anti‑CD20 monoklonální protilátce – ofatumumabu – a upozornit na rozdíly mezi jednotlivými anti‑CD20 monoklonálními protilátkami.
Summary:
Elisak M. Ofatumumab – updates and comparison with other CD20+ lymphocyte depletion therapies in the relapsing‑remitting multiple sclerosis. Remedia 2022; 32: 169–173.
In recent years, concepts of the pathophysiology of multiple sclerosis (MS) have evolved, including the demonstration of the key role of B lymphocytes. Identifying this new therapeutic target has expanded the treatment options for MS demonstrating the high efficacy and favorable safety profile of selective B‑cell depletion therapies (such as monoclonal antibodies against the surface feature of CD20 lymphocytes). This year, the monoclonal antibody approved for reimbursement against CD20 positive lymphocytes is ofatumumab, a fully human monoclonal antibody. In addition, the recombinant humanized antibody ocrelizumab is approved, and the chimeric monoclonal antibody rituximab is also used in off‑label indication. Although the biological effect of these antibodies is the same, they differ in many pharmacokinetic and pharmacodynamic parameters. The aim of this article is to present recent data on the newest anti‑CD20 monoclonal antibody – ofatumumab – and to highlight the differences between the different anti‑CD20 drugs.
Key words: ofatumumab, CD20, lymphocytes, multiple sclerosis, subcutaneous delivery.
Úvod
Pohled na úlohu B lymfocytů v patogenezi roztroušené sklerózy (RS) se v posledních letech vyvíjí. Aktivita RS není zprostředkována výlučně T lymfocyty, ale v rozvoji relapsů jsou klíčové obousměrné interakce mezi několika typy imunitních buněk, včetně B lymfocytů, a to jak na periferii, tak v centrálním nervovém systému (CNS) [1]. Na rozdíl například od neuromyelitis optica se nezdá být v patogenezi RS dominantní protilátkami zprostředkovaná autoimunitní reakce, ale jde spíše o úlohu B lymfocytů jako antigen prezentujících buněk, o produkci zánětlivých, respektive sníženou produkci protizánětlivých chemokinů [1].
Existují důkazy o přímém vzájemném ovlivňování mezi CNS a periferií u pacientů s RS, které je zprostředkováno zejména vyvíjejícími se B lymfocyty [2]. V současné době se má za to, že k dozrávání B lymfocytů u pacientů s RS dochází v drenážních krčních lymfatických uzlinách. Tyto lymfocyty musejí překonat několik imunitních bariér a následně dochází k jejich klonální expanzi s produkcí oligoklonálních imunoglobulinů a k podpoře lymfangiogeneze v CNS [3]. B lymfocyty pacientů s RS jsou také schopny produkovat komplement a faktory nezávislé na imunoglobulinech, které jsou in vitro toxické pro neurony a oligodendrocyty [2]. U časných aktivních fokálních demyelinizačních lézí se nacházejí CD20+ B lymfocyty převážně fokálně v perivaskulárním prostoru pouze jedné nebo několika větších žil, naopak u pacientů s progresivní RS lze v perivaskulárním prostoru a v meningách nalézt hojnější infiltrát plazmatických buněk [4]. Dochází ke kompartmentalizaci zánětu v CNS a ke vzniku zánětlivých agregátů, které jsou bohaté na B lymfocyty, připomínají terciární lymfatické folikuly a lze je nalézt v meningách pacientů s RS, především v hlubokých kortikálních sulcích, ale také v perivaskulárních prostorech. Tyto zánětlivé agregáty v CNS mohou poskytovat prostředí, jež podporuje usídlení B lymfocytů, jejich přežívání a aktivaci [5], a tím přispívat k degenerativním mechanismům v rámci progresivní fáze onemocnění.
Povrchový znak CD20 je transmembránový neglykosylovaný fosfoprotein, který je exprimován především na B lymfocytech (od pre B lymfocytů vyskytujících se v kostní dřeni přes zralé a paměťové B buňky vyskytující se v krvi, lymfatických orgánech a v likvoru) [6] a přibližně na 6 % T lymfocytů [7]. Není exprimován na kmenových buňkách a pro B lymfocytech, které se vyskytují v kostní dřeni, a na dlouho žijících plazmatických buňkách v kostní dřeni a lymfatické tkáni [6].
Za patofyziologicky významné se nepovažují všechny B lymfocyty, ale pouze omezené podskupiny B buněk, například prozánětlivé paměťové CD27 B lymfocyty. Dále i při absolutní eliminaci CD20 pozitivních B lymfocytů přetrvává významná část CD20 negativních B lymfocytů s možnou patogenní úlohou. Jelikož CD20 není exprimován na povrchu plazmatických buněk ani pro B buněk, zatímco CD19 lze detekovat na většině plazmatických buněk v sekundárních lymfatických orgánech (např. ve slezině a tonzilách), na všech krevních plazmatických buňkách a u více než 50 % plazmatických buněk kostní dřeně, zbylé CD19 pozitivní B lymfocyty mohou stále exprimovat MHC II (tj. lidský leukocytární antigen [HLA] DR), a přetrvává tedy například jejich úloha jako antigen prezentujících buněk [3].
Farmakologické údaje
Mechanismus deplece B lymfocytů
Jednotlivé monoklonální protilátky
proti povrchovému znaku lymfocytů CD20 (anti CD20) se mohou
vázat na rozdílný epitop CD20. Rituximab a okrelizumab
se vážou na velkou extracelulární smyčku CD20, zatímco
ofatumumab se váže na velkou a malou extracelulární
smyčku. Epitop rozpoznávaný okrelizumabem se překrývá
s epitopem, který je rozpoznáván rituximabem, ale ofatumumab
má jedinečný epitop na velké mimobuněčné smyčce CD20.
Ofatumumab se váže na CD20 těsněji a má pomalejší
disociaci od CD20 než rituximab. Ofatumumab vykazoval účinnější
depo C3b a známky lýzy buněk vyvolané komplementem
ve srovnání s rituximabem [8].
Kvůli aminokyselinovým mutacím v Fc části vážou
rituximab a ofatumumab komplement C1q silněji než okrelizumab
a vedou k aktivaci komplementu a k cytotoxicitě
závislé na komplementu. Rituximab vyžaduje k vyvolání
komplementem zprostředkované cytotoxicity desetkrát vyšší
koncentraci CD20 na povrchu cílových buněk než
ofatumumab. To naznačuje, že ofatumumab je méně
závislý na hustotě CD20 na povrchu cílových buněk
ve srovnání s rituximabem. Naproti tomu okrelizumab
silněji podporuje buněčnou cytotoxicitu závislou na protilátce
a fagocytózu prostřednictvím interakce s receptory Fcγ
na NK (natural killers) buňkách, monocytech, makrofázích
a neutrofilech 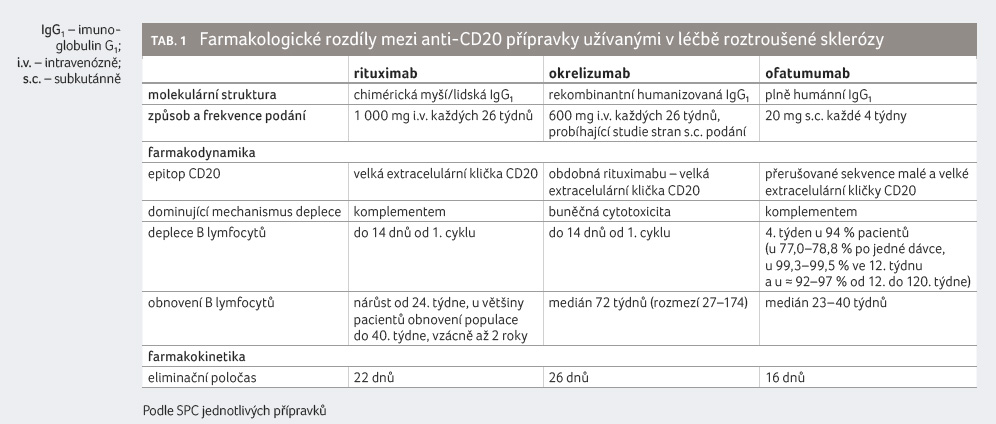
Infuze anti CD20 protilátky vede během několika hodin k zahájení deplece CD20+ lymfocytů, k níž dochází především v játrech. Tato deplece dosahuje konstantní nulové úrovně CD20+ lymfocytů obvykle po osmi týdnech a může přetrvávat sedm týdnů až desítky měsíců podle dávkování a vlastností konkrétní anti CD20 protilátky (tab. 1).
Způsob aplikace
Ofatumumab je jedinou dosud schválenou anti CD20 monoklonální protilátkou pro subkutánní injekční aplikaci (v současné době probíhá studie OCARINA II monitorující efekt subkutánní aplikace okrelizumabu). Subkutánní aplikace se farmakokineticky liší od aplikace intravenózní. Míra absorpce subkutánně podávaných léčiv závisí mimo jiné na řadě fyziologických faktorů pacienta (hmotnost, věk, pohlaví, fyzická aktivita). Biofarmaka větší než 16 kDa, jako jsou monoklonální protilátky (~150 kDa), nemohou projít přímou absorpcí do krve, a předtím než se dostanou do systémového krevního oběhu, musejí být transportovány přes intersticium do lymfatického systému [9]. Efekt ofatumumabu v uzlinách a dalších tkáních byl popsán na modelu makaka, kdy po subkutánní aplikaci ofatumumabu došlo k úplné depleci B lymfocytů v perifolikulárních a interfolikulárních prostorech, a to i včetně mízních uzlin, které přímo nedrénovaly místo injekce. Naopak žádné molekulární změny nebyly nalezeny ve slezině a pouze mírné změny byly pozorovány v oblasti marginální zóny lymfatických uzlin [10]. Eliminace CD20+ lymfocytů v uzlinách by mohla být jednou z výhod subkutánní aplikace oproti aplikaci intravenózní, byť důkazy pro toto tvrzení zatím chybějí.
Subkutánní forma aplikace je velmi dobře tolerována. Reakce související s injekcí jsou obvykle nezávažné a k přerušení léčby vedou raritně — z 1 969 sledovaných pacientů ukončili z toho důvodu léčbu čtyři, z toho dva po první injekci [11]. Vzhledem k dobré toleranci a minimu nežádoucích účinků si pacienti mohou ofatumumab aplikovat po zácviku sami doma. Díky těmto vlastnostem má ofatumumab vysokou adherenci, pouze dva z 1 882 pacientů přerušili léčbu z důvodu nedodržování léčebných postupů [11].
Potenciální výhody ofatumumabu v oblasti nákladové efektivity spočívají v absenci nutnosti trávit čas na klinice a v nulových nákladech na infuzi [12].
Eliminace
- Anti CD20 protilátky jsou eliminovány dvěma způsoby:
- cílově zprostředkovanou cestou, která souvisí s vazbou na B lymfocyty,
cílově nezávislou cestou zprostředkovanou nespecifickou endocytózou následovanou intracelulárním katabolismem jako u jiných molekul imunoglobulinu G (IgG).
CD20+ B lymfocyty přítomné na počátku léčby mají za následek větší míru cílově zprostředkované eliminace ofatumumabu při zahájení terapie. Opakované podání anti CD20 protilátky vede k silné depleci B lymfocytů, což znamená pokles celkové clearance. Eliminační poločas v ustáleném stavu byl odhadován na přibližně 16 dní po opakovaném subkutánním podání ofatumumabu v dávce 20 mg [13].
Sledování deplece B lymfocytů, repopulace
U anti CD20 protilátek platí, že farmakodynamický efekt deplece CD20+ B lymfocytů přetrvává výrazně delší dobu, než trvá eliminace léku, což je vhodné brát v potaz například při plánování těhotenství nebo při očkování. Měření míry deplece B lymfocytů se stanovuje pomocí proteinu CD19, který se během diferenciace B lymfocytů do značné míry překrývá s CD20, protože je méně náchylný k potenciální interferenci v přítomnosti monoklonálních protilátek anti CD20. Úplné údaje o návratu aktivity onemocnění po přerušení léčby ve vztahu k farmakodynamice a farmakokinetice mají hodnotu nejen pro stanovení terapeutické hranice, ale také pro zjištění, které podskupiny B lymfocytů mají největší význam pro potlačení aktivity a progrese onemocnění. Současné údaje jsou pro stanovení terapeutické hranice B lymfocytů u relabující RS nedostatečné. U ofatumumabu ve studii MIRROR počet CD19+ lymfocytů nižší než 32 buněk/µl vedl k více než 90% potlačení gadolinium (Gd) enhancujících lézí [14].
Repopulace B lymfocytů začíná v kostní dřeni a slezině a následně v krvi, přičemž rychlost repopulace jednotlivých podytpů se liší [15]. Obnovení populace B lymfocytů je podle různých autorů definováno jako stav, kdy počet CD19+ lymfocytů dosáhne 1–2 % celkového počtu lymfocytů [16]. Medián doby do doplnění B lymfocytů na spodní hranici normálu (definovaná jako 40 buněk/µl) nebo na výchozí hodnotu před zahájením léčby je u ofatumumabu 24,6 týdne od ukončení léčby.
Klinické údaje
Účinnost ofatumumabu
Vysokou účinnost ofatumumabu u relabující remitující RS potvrdily studie ASCLEPIOS I a II porovnávající ofatumumab s teriflunomidem [17], shrnutí v české literatuře viz např. článek prof. Kubala Havrdové v Remedia 3/2021 [18].
Současné poznatky zdůrazňující význam zahájení léčby vysoce účinnou terapií (high efficacy therapy, HET) na začátku onemocnění [19] zohledňují současná indikační omezení úhrady schválená v České republice. Ta umožňují zahájit léčbu anti CD20 protilátkami, konkrétně ofatumumabem a okrelizumabem, u pacientů s aktivní formou relabující remitující RS a zároveň s významným nálezem na magnetické rezonanci (MR) definovaným jako přítomnost T1 Gd+ léze a/nebo infratentoriální léze a/nebo spinální léze. Potvrzení efektu časného zahájení léčby přinesla subanalýza nově diagnostikovaných pacientů studií ASCLEPIOS I a II, v nichž měl ofatumumab lepší poměr přínosů a rizik ve srovnání s teriflunomidem s téměř úplným vymizením zánětlivé aktivity onemocnění. Ofatumumab u těchto pacientů oproti teriflunomidu snížil riziko roční míry relapsů o 50 %, šestiměsíčního potvrzeného zhoršení disability o 46 % a šestiměsíční progrese nezávislé na závažnosti relapsu o 56 %. Parametru NEDA 3 (no evidence of disease activity) v prvním roce léčby dosáhlo 47,0 % léčených ofatumumabem oproti 24,7 % léčených teriflunomidem, ve druhém roce 92,1 % oproti 46,8 % a od počátku léčby do druhého roku 44,6 % oproti 17,7 % [20]. Vysoká míra dosažení NEDA 3 v prvních dvou letech by mohla odrážet i dlouhodobý preventivní účinek na aktivitu onemocnění a zhoršení disability — dosažení NEDA 3 během prvních dvou let léčby RS je spojeno s nižší pravděpodobností zhoršení disability i po sedmi letech [21].
Bezpečnost ofatumumabu
Stran bezpečnosti byla publikována data po 3,5 roku léčby u 1 969 pacientů [11]. Jeden a více nežádoucích účinků bylo hlášeno u 83,8 % osob, ale pouze u 9,7 % osob byly hodnoceny jako závažné. Šlo zejména o infekce, nejčastěji apendicitidy, záněty dýchacích cest (včetně sedmi pneumonií spojených s nemocí COVID 19, z nichž byla jedna letální) a infekce močových cest. Průměrné koncentrace IgG zůstaly podobné výchozím hodnotám, průměrné koncentrace IgM se v průběhu času snižovaly, nicméně u většiny pacientů zůstávaly koncentrace IgM po celou dobu nad dolní hranicí normy. Celkem 179 pacientů (9,1 %) přerušilo léčbu pro nízké koncentrace IgM (podle protokolu studií byla léčba přerušena při poklesu o více než 10 % dolní hranice normy) a 65 pacientů (3,3 %) z tohoto důvodu léčbu ukončilo. K přerušení léčby kvůli nízkým koncentracím IgG došlo u dvou pacientů (0,1 %) a k trvalému ukončení léčby u čtyř pacientů (0,2 %). Nebyla pozorována žádná souvislost mezi sníženými koncentracemi imunoglobulinů a rizikem závažných infekcí. Nebyly dosud hlášeny oportunní infekce včetně progresivní multifokální leukoencefalopatie.
COVID 19 hlásilo 245 (COVID 19 potvrzený: 210 případů; suspektní: 35 případů) z 1 703 pacientů (14,3 %) zařazených do studie ALITHIOS, kteří dostávali ofatumumab (medián expozice 2,45 roku). Většinou byl průběh COVID 19 mírný (44,1 %) nebo středně závažný (46,5 %). Závažných případů bylo 24 (9,8 %), přičemž 23 pacientů bylo hospitalizováno a dva zemřeli. U 39 (15,9 %) pacientů byla léčba ofatumumabem dočasně přerušena. Před nástupem COVID 19 byly koncentrace IgG v normě u všech pacientů postižených COVID 19, zatímco koncentrace IgM < 0,4 g/l byly zaznamenány u 23 (9,4 %) pacientů. U žádného pacienta nedošlo k reinfekci. Celkem bylo očkováno 559 pacientů (plná vakcinace u 476, částečná u 74, neurčená u devíti pacientů). Průlomová infekce byla hlášena u 1,5 % (7/476) pacientů a 11 pacientů hlásilo COVID 19 po částečném očkování [22].
Bylo hlášeno celkem 11 malignit — šlo o bazaliomy, bazocelulární karcinomy, karcinomy prsu, maligní melanom in situ a recidivující nehodgkinský lymfom. S delší expozicí ofatumumabu se riziko závažných infekcí nebo malignit nezvýšilo.
Mezi další hlášené nežádoucí účinky, které se vyskytly alespoň u 5 % léčených pacientů, u nichž ale nebyla ve všech případech prokázána příčinná souvislost s léčbou, patří bolesti hlavy, zad a kloubů, dále průjem a únava [11].
Postavení ofatumumabu mezi ostatními
chorobu modifikujícími léky
Vzhledem k faktu, že jedinými komparativními studiemi s ofatumumabem jsou ASCLEPIOS I a II, byla vypracována síťová metaanalýza, která naznačuje, že ofatumumab může být stejně účinný jako monoklonální protilátky alemtuzumab, natalizumab a okrelizumab. Ve sledovaných parametrech, jimiž byly roční míra relapsů a progrese disability, měl ofatumumab ve srovnání s ostatními analyzovanými chorobu modifikujícími léky (disease modifying therapy, DMT), jimiž byly kladribin, dimetylfumarát, fingolimod, glatiramer acetát, interferon beta a teriflunomid, lepší nebo stejné výsledky [23].
Zatímco kanadští plátci zdravotní péče nepovažují ofatumumab za nákladově efektivní ve srovnání s deseti dalšími DMT [24], britský National Institute for Health and Care Excellence (NICE) se domnívá, že ofatumumab by mohl být nákladově efektivní a pro určení místa ofatumumabu v léčbě považuje NICE za vhodné doplnit další údaje o účinnosti a snášenlivosti (ideálně ze studií s delším trváním) a/nebo přímé srovnání s jinými DMT [25]. Recentní německá modelová studie nákladů a efektivity simulovala různé scénáře léčby ofatumumabem v porovnání s léčbou dimetylfumarátem a glatiramer acetátem: okamžité zahájení léčby ofatumumabem, časný přechod na ofatumumab po jednom roce léčby, pozdní přechod po pěti letech nebo beze změny léčby. Pozdní změna ve srovnání s okamžitou léčbou ofatumumabem vedla k nižšímu podílu pacientů s hodnotou na Expanded Disability Status Scale (EDSS) 0–3 (o 7,5 % u dimetylfumarátu, o 10,3 % u glatiramer acetátu), k větší roční míře relapsů (o 0,72 u dimetylfumarátu, o 1,23 u glatiramer acetátu) a k nižší míře zaměstnanosti (o 4,0 % u dimetylfumarátu, o 5,6 % u glatiramer acetátu). Vyšší náklady léčby ofatumumabem ve scénářích jeho okamžitého nasazení a časného přechodu byly téměř kompenzovány nižšími náklady na péči o pacienty a zachováním jejich produktivity [26].
Vzhledem k nepřímé povaze uvedených srovnání a nedostatku údajů o dlouhodobých klinických výsledcích je však třeba výsledky těchto analýz interpretovat s opatrností.
Seznam použité literatury
- [1] Li R, Patterson KR, Bar‑Or A. Reassessing B cell contributions in multiple sclerosis. Nat Immunol 2018; 19: 696–707.
- [2] Graf J, Mares J, Barnett M, et al. Targeting B Cells to Modify MS, NMOSD, and MOGAD. Part 2. Neurol Neuroimmunol Neuroinflamm 2020; 8: e919.
- [3] Graf J, Mares J, Barnett M, et al. Targeting B Cells to Modify MS, NMOSD, and MOGAD: Part 1. Neurol Neuroimmunol Neuroinflamm 2020; 8: e918.
- [4] Machado‑Santos J, Saji E, Tröscher AR, et al. The compartmentalized inflammatory response in the multiple sclerosis brain is composed of tissue‑resident CD8 T lymphocytes and B cells. Brain 2018; 147: 2066–2082.
- [5] Touil H, Kobert A, Lebeurrier N, et al. Human central nervous system astrocytes support survival and activation of B cells: implications for MS pathogenesis. J Neuroinflammation 2018; 15: 114.
- [6] St Clair EW. Good and bad memories following rituximab therapy. Arthritis Rheum 2010; 62: 1–5.
- [7] Palanichamy A, Jahn S, Nickles D, et al. Rituximab efficiently depletes increased CD20‑expressing T cells in multiple sclerosis patients. J Immunol 2014; 193: 580–586.
- [8] Cotchett KR, Dittel BN, Obeidat AZ. Comparison of the Efficacy and Safety of Anti‑CD20 B Cells Depleting Drugs in Multiple Sclerosis. Mult Scler Relat Disord 2021; 49: 102787.
- [9] Viola M, Sequeira J, Seiça R, et al. Subcutaneous delivery of monoclonal antibodies: How do we get there? J Control Release 2018; 286: 301–314.
- [10] Theil D, Smith P, Huck C, et al. Imaging Mass Cytometry and Single‑Cell Genomics Reveal Differential Depletion and Repletion of B‑Cell Populations Following Ofatumumab Treatment in Cynomolgus Monkeys. Front Immunol 2019; 10: 1340.
- [11] Hauser SL, Cross AH, Winthrop K, et al. Safety experience with continued exposure to ofatumumab in patients with relapsing forms of multiple sclerosis for up to 3.5 years. Mult Scler 2022; doi: 10.1177/13524585221079731.
- [12] Stoner KL, Harder H, Fallowfield LJ, Jenkins VA. Intravenous versus Subcutaneous Drug Administration. Which Do Patients Prefer? A Systematic Review. Patient 2014; doi:10.1007/s40271‑014‑0075‑y.
- [13] SPC Kesimpta. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/kesimpta‑epar‑product‑information_cs.pdf
- [14] Bar‑Or A, Grove RA, Austin DJ, et al. Subcutaneous ofatumumab in patients with relapsing‑remitting multiple sclerosis: The MIRROR study. Neurology 2018; 90: e1805–e1814.
- [15] Cencioni MT, Mattoscio M, Magliozzi R, et al. B cells in multiple sclerosis – from targeted depletion to immune reconstitution therapies. Nat Rev Neurol 2021; 17: 399–414.
- [16] Xu J, Cheng X‑X, Xu J‑R. Responsiveness to reduced dosage of rituximab in Chinese patients with neuromyelitis optica. Neurology 2014; 82: 547.
- [17] Hauser SL, Bar‑Or A, Cohen JA, et al. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020; 383: 546–557.
- [18] Kubala Havrdová E. Ofatumumab. Remedia 2021; 31: 263–268.
- [19] He A, Merkel B, Brown JWL, et al. Timing of high‑efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol 2020; 19: 307–316.
- [20] Gärtner J, Hauser SL, Bar‑Or A, et al. Efficacy and safety of ofatumumab in recently diagnosed, treatment‑naive patients with multiple sclerosis: Results from ASCLEPIOS I and II. Mult Scler 2022; doi: 10.1177/13524585221078825.
- [21] Rotstein DL, Healy BC, Malik MT, et al. Evaluation of No Evidence of Disease Activity in a 7‑Year Longitudinal Multiple Sclerosis Cohort. JAMA Neurology 2015; 72: 152–158.
- [22] Cross AH, Delgado S, Habek M, et al. COVID‑19 Outcomes and Vaccination in People with Relapsing Multiple Sclerosis Treated with Ofatumumab. Neurol Ther 2022; doi:10.1007/s40120‑022‑00341‑z.
- [23] Samjoo IA, Worthington E, Drudge C, et al. Comparison of ofatumumab and other disease‑modifying therapies for relapsing multiple sclerosis: a network meta‑analysis. J Comp Eff Res 2020; 9: 1255–1274.
- [24] Canada’s Drug and Health Technology Agency. Review Ofatumumab. Dostupné na: https://www.cadth.ca/ofatumumab
- [25] NICE. Ofatumumab for treating relapsing multiple sclerosis. Technology appraisal guidance 2021. Dostupné na: https://www.nice.org.uk/guidance/ta699
- [26] Koeditz D, Frensch J, Bierbaum M, et al. Comparing the long‑term clinical and economic impact of ofatumumab versus dimethyl fumarate and glatiramer acetate in patients with relapsing multiple sclerosis: A cost‑consequence analysis from a societal perspective in Germany. Mult Scler J Exp Transl Clin 2022; doi: 10.1177/20552173221085741.