Osimertinib v terapii pokročilého neskvamózního nemalobuněčného plicního karcinomu
Souhrn:
Zemanová P, Zemanová M. Osimertinib v terapii pokročilého neskvamózního nemalobuněčného plicního karcinomu. Remedia 2022; 32: 232–234.
Kazuistika popisuje případ 76letého pacienta s diagnózou generalizovaného nemalobuněčného plicního adenokarcinomu. Pro průkaz rezistentní mutace EGFR T790M byl pacient léčen EGFR tyrozinkinázovým inhibitorem osimertinibem.
Summary:
Zemanova P, Zemanova M. Osimertinib in treating advanced non‑squamous non‑small cell lung cancer. Remedia 2022; 32: 232–234.
The case report describes a 76‑year‑old patient diagnosed with metastatic non‑small cell lung adenocarcinoma. The patient was treated with osimertinib, an EGFR tyrosine kinase inhibitor, after detecting the EGFR T790M mutation.
Key words: non‑small cell lung cancer, EGFR mutation, osimertinib.
Kazuistika
Kazuistika popisuje případ 76letého pacienta, celoživotního nekuřáka. Pacient užívá inhibitor angiotenzin konvertujícího enzymu z důvodu arteriální hypertenze a statin pro léčbu dyslipidemie.
V květnu 2018 byl v rámci interního vyšetření před plánovanou operací pravostranné tříselné kýly proveden skiagram hrudníku, na němž bylo zachyceno plicní ložisko v levém dolním plicním poli. Doplněné vyšetření pozitronovou emisní tomografií/výpočetní tomografií (PET/CT) prokázalo vysoce FDG (fluorodeoxyglukóza) avidní ložisko v levém dolním plicním laloku velikosti 34 mm × 30 mm a vyloučilo generalizované postižení. Ložisko nebylo dostupné bronchoskopické verifikaci. Provedený endobronchiální výplach neprokázal infekční původ patologie. Endobronchiální ultrasonografií nebyly nalezeny zvětšené hilové a mediastinální lymfatické uzliny. Vzhledem k malignímu vzhledu plicního ložiska na PET/CT zobrazení a k normálním ventilačním parametrům včetně plicní difuze byla indikována chirurgická resekce. Dne 18. června 2018 pacient podstoupil levostrannou dolní lobektomii se samplingem mediastinálních lymfatických uzlin.
Nemalobuněčný plicní adenokarcinom velikosti 25 mm byl nalezen při histologickém vyšetření plicního resekátu a stejný nádor byl prokázán v jedné levostranné hilové uzlině z osmi resekovaných ipsilaterálních lymfatických uzlin. Patologický staging byl tedy dle klasifikace zhoubných novotvarů uzavřen jako pT1c pN1. Při vyšetření molekulárních prediktorů byla detekována aktivační mutace receptoru epidermálního růstového faktoru (EGFR) v exonu 19 (del19). Mutace genů ALK a ROS1 stejně jako exprese PD L1 (ligand receptoru programované buněčné smrti 1) byly negativní. Vzhledem ke klinickému stadiu IIB byly podány čtyři cykly adjuvantní chemoterapie ve složení CBDCA AUC 5 (karboplatina v dávce dle plochy pod křivkou plazmatické koncentrace) a paklitaxel v dávce 200 mg/m2 každé tři týdny. Pacient byl následně sledován pravidelnými klinickými kontrolami a zobrazovacími metodami v intervalu každé tři měsíce.
V červnu 2019 bylo na CT
trupu a následně na PET/CT zobrazeno FDG avidní plicní
ložisko velikosti 9 mm v S3 levého horního laloku, FDG
pozitivní noduly na levostranné pleuře a solitární
kostní metastáza obratle Th10.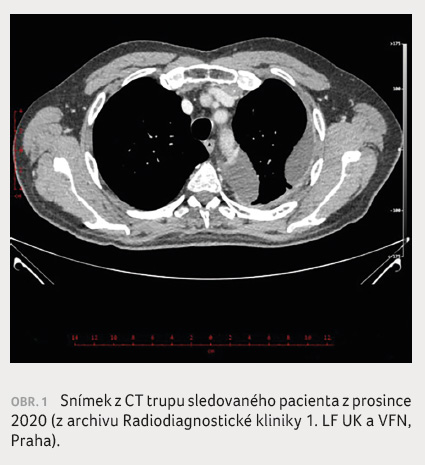 Magnetická rezonance (MRI) mozku
prokázala tři mozkové metastázy (vpravo temporálně, vlevo
cereberálně a vpravo cereberálně) velikosti 1 cm
v průměru. Pacient nejevil žádné symptomy plynoucí
z generalizovaného nádorového onemocnění. Bylo indikováno
ozáření mozkových metastáz gama nožem a byla zahájena
terapie EGFR tyrozinkinázovým inhibitorem afatinibem v dávce
40 mg/den perorálně a antiresorpční terapie denosumabem
120 mg každé čtyři týdny. Na restagingovém CT trupu
a MRI mozku bylo dosaženo parciální remise nádorového
onemocnění. Přes výskyt kožní toxicity stupně 1, řešené
lokální léčbou, toleroval pacient terapii afatinibem poměrně
dobře.
Magnetická rezonance (MRI) mozku
prokázala tři mozkové metastázy (vpravo temporálně, vlevo
cereberálně a vpravo cereberálně) velikosti 1 cm
v průměru. Pacient nejevil žádné symptomy plynoucí
z generalizovaného nádorového onemocnění. Bylo indikováno
ozáření mozkových metastáz gama nožem a byla zahájena
terapie EGFR tyrozinkinázovým inhibitorem afatinibem v dávce
40 mg/den perorálně a antiresorpční terapie denosumabem
120 mg každé čtyři týdny. Na restagingovém CT trupu
a MRI mozku bylo dosaženo parciální remise nádorového
onemocnění. Přes výskyt kožní toxicity stupně 1, řešené
lokální léčbou, toleroval pacient terapii afatinibem poměrně
dobře.
K progresi nádorového onemocnění dochází po 19 měsících léčby afatinibem. Na CT trupu byl v prosinci 2020 zachycen levostranný pleurální výpotek při metastatickém postižení pleury (obr. 1). Výpotek byl punktován se ziskem 700 ml hemoragické tekutiny. Fluidotorax byl charakteru exsudátu, kultivace nezachytila infekční agens. Při cytologickém vyšetření výpotku byly prokázány nádorové buňky charakteru nemalobuněčného plicního adenokarcinomu. Kvůli podlimitnímu počtu nádorových buněk nutných k dovyšetření statusu EGFR při cytologickém vyšetření vzorku fluidotoraxu byla provedena molekulární analýza označovaná jako tekutá biopsie s průkazem rezistentní mutace EGFR T790M.
V druhé linii anti EGFR
léčby byl indikován osimertinib v dávce 80 mg denně
perorálně. Po sedmi dnech užívání osimertinibu pacient
přišel na kontrolu pro svědivou kožní vyrážku charakteru
makulopapulózního exantému. Kvůli postižení více než 50 %
kožního povrchu byl kožní exantém hodnocen stupněm 3.
Dermatolog uzavřel jako nejpravděpodobnější příčinu kožního
postižení toxoalergickou reakci – spíše než lékem
indukovanou kožní toxicitu. Nemocnému byl aplikován depotní
glukokortikoid (Depo Medrol 80 mg), byly mu předepsány
topické masti se steroidy, do medikace bylo přidáno
antihistaminikum a byla přerušena terapie osimertinibem.
Po třech týdnech zavedené léčby došlo ke zmírnění
kožního postižení na stupeň 1. Vzhledem k ústupu
exantému a absenci jiné adekvátní léčby byl osimertinib
v redukované dávce (40 mg/den) vrácen zpět do medikace
za současného užívání antialergické medikace (prednison
40 mg/den v postupné deeskalaci o 10 mg/týden,
cetirizin 10 mg tbl. 1 × 1). Po vyloučení recidivy
kožního exantému po vysazení glukokortikoidů byla dávka
osimertinibu navýšena na standardní dávkování
za současného užívání antihistaminika. Pacient dále
toleruje osimertinib bez výskytu alergických projevů a projevů
lékem indukované toxicity. Na kontrolním CT trupu bylo
dosaženo kompletní remise, která trvá dodnes včetně absence
metastáz v centrálním nervovém systému (CNS), obrázek 2.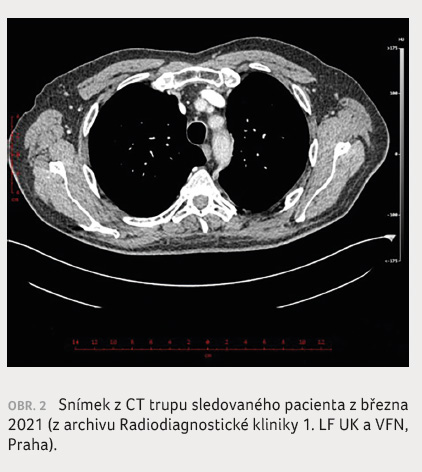
Diskuse
Nemalobuněčný plicní karcinom (non small cell lung cancer, NSCLC) tvoří 85 % všech plicních karcinomů a je histologicky členěn do dvou hlavních subtypů: neskvamózní a skvamózní. Nemalobuněčný neskvamózní karcinom zaujímá histologicky heterogenní skupinu nádorů, v níž je nejpočetněji zastoupen adenokarcinom [1]. U neskvamózních NSCLC je indikováno stanovení tzv. driver neboli řídicích mutací, tedy genetických změn, které odpovídají za nádorovou transformaci. Přítomnost těchto genových alterací predikuje lepší výsledky cílené léčby v porovnání s konvenční chemoterapií NSCLC. První vyšetřovanou a v klinické praxi léčebně zacílenou mutací u neskvamózního NSCLC je mutace EGFR s četností 8–10 % NSCLC u evropské populace a až 30 % u asijského obyvatelstva [2]. EGFR je tyrozinkinázový receptor patřící do širší rodiny erbB receptorů. Navázání ligandu na nemutovaný tzv. wild type receptor indukuje konformační změnu receptoru podmiňující autofosforylaci jeho tyrozinkinázové domény a následnou aktivaci signálních drah typu RAS/RAF/MAPK, STAT, PI3K/AKT řídících buněčnou proliferaci, přežívání a migraci buněk. Mutací genu EGFR dochází k trvalé, na přítomnosti ligandu nezávislé aktivaci EGFR signální kaskády vedoucí k malignímu chování buňky [3]. Přítomnost aktivační mutace v exonech 18–21 kódujících tyrozinkinázovou doménu EGFR receptoru predikuje senzitivitu NSCLC na tyrozinkinázové inhibitory. Aktivita inhibitorů EGFR se odvíjí od typu mutace EGFR, přičemž delece párů bází v exonu 19 (del19) a bodová mutace v exonu 21 (např. L858R) patří mezi genové alterace nejlépe odpovídající na léčbu terapií anti EGFR. Naopak inzerce v exonu 20 je příčinou primární rezistence k anti EGFR terapii [2].
U 60 % pacientů, kteří jsou léčeni inhibitorem EGFR první (erlotinib, gefinitib) nebo druhé generace (afatinib, dakomitinib), se vyvine v genu EGFR sekundární rezistentní mutace T790M v exonu 20, jejímž podkladem je bodová mutace v kodonu 790 nahrazující methionin za threonin. Mutace T790M obnovuje afinitu tyrozinkinázové domény EGFR k vazbě adenosintrifosfátu (ATP), a tedy aktivuje transdukční signální dráhy podporující proliferaci a přežívání nádorových buněk. Osimertinib patřící do třetí generace inhibitorů EGFR vykazuje aktivitu proti této rezistenci. Vytváří ireverzibilní kovalentní vazbu na cysteinový zbytek v ATP vazebném místě tyrozinkinázy mutovaného EGFR, a tím brání trvalé fosforylaci jeho kinázové domény [4].
Klinická studie fáze III AURA3 zahrnovala 419 pacientů s diagnózou pokročilého NSCLC a s prokázanou rezistentní mutací EGFR T790M po selhání léčby inhibitory EGFR nižší generace. Pacienti byli randomizováni v poměru 2 : 1 do ramene s osimertinibem (80 mg/den) nebo s chemoterapií (CBDCA AUC 5 nebo cisplatina 75 mg/m2 + pemetrexed 500 mg/m2 každé tři týdny, šest cyklů). Studie splnila vytyčený primární cíl, tedy prodloužení mediánu přežití bez nádorové progrese (median progression free survival, mPFS) v rameni s osimertinibem v porovnání s chemoterapií (10,1 měsíce vs. 4,4 měsíce; poměr rizik [HR] 0,30; 95% interval spolehlivosti [CI] 0,23–0,41; p < 0,001). Osimertinib dosáhl objektivní léčebné odpovědi (objective response rate, ORR) 71 % vs. 31 % v rameni s chemoterapií [5].
Klinická studie fáze III FLAURA hodnotí otázku superiority osimertinibu (80 mg/den) nad erlotinibem (150 mg/den) nebo gefitinibem (250 mg/den) u doposud neléčených EGFR pozitivních lokálně pokročilých nebo generalizovaných NSCLC. Kohorta s osimertinibem měla signifikantně delší mPFS 18,9 měsíce vs. 10,2 měsíce (HR 0,46; 95% CI 0,37–0,57; p < 0,001) i medián celkového přežití (median overall survival, mOS 38,6 měsíce vs. 31,8 měsíce; HR 0,8; 95% CI 0,64–1,00; p = 0,046). Objektivní léčebná odpověď byla vysoká v obou ramenech (ORR 80 % vs. 76 %), ale trvání léčebné odpovědi bylo delší u osimertinibu (median duration of response, mDOR 17,2 měsíce vs. 8,5 měsíce) [6].
U 25 % pacientů s EGFR mutovaným NSCLC jsou metastázy do CNS detekovány již v době diagnózy a až u 50 % pacientů se metastatické postižení CNS vyvine v průběhu tohoto nádorového onemocnění [7]. Osimertinib vykazuje i vysokou intrakraniální aktivitu díky vyšší penetraci do CNS přes hematoencefalickou bariéru ve srovnání s tyrozinkinázovými inhibitory nižší generace. V již výše zmiňované studii FLAURA mělo 21 % pacientů mozkové metastázy. Osimertinib ve skupině nemocných s metastázami v CNS dosáhl mPFS 15,2 měsíce vs. 9,6 měsíce v rameni s EGFR tyrozinkinázovým inhibitorem první generace (HR 0,47; 95% CI 0,3–0,47; p < 0,001) [6].
Rozvoj sekundární rezistence limituje trvání léčebné odpovědi. Mezi mechanismy získané rezistence patří již zmiňovaná mutace T790M, ale i mutace na osimertinib rezistentní – C797S, G724S – nebo aktivace alternativních drah signální kaskády, např. MET nebo HER2 amplifikace, mutace KRAS nebo BRAF, mutace PIK3CA, transformace do malobuněčného plicního karcinomu a další [8]. Otázkou dalšího směřování léčby EGFR pozitivních NSCLC je vývoj léčiv vedoucích k překonání jmenovaných rezistencí.
Nutno poznamenat, že osimertinib se vyznačuje příznivým bezpečnostním profilem. Mezi nežádoucí účinky léčby inhibitory EGFR patří průjem, snížená chuť k jídlu, kožní toxicita (akneiformní vyrážka, suchá kůže, paronychia) a elevace hodnot jaterních testů [5–6].
Seznam použité literatury
- [1] Molina JR, Yang P, Cassivi SD, et al. Non‑small cell lung cancer: epidemiology, risk factors, treatment, and survivorship. Mayo Clinic proceedings 2008; 83: 584–594.
- [2] Sharma SV, Bell DW, Settleman J, Haber DA. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007; 7: 169–181.
- [3] Sabbah DA, Hajjo R, Sweidan K. Review on Epidermal Growth Factor Receptor (EGFR) Structure, Signaling Pathways, Interactions, and Recent Updates of EGFR Inhibitors. Curr Top Med Chem 2020; 20: 815–834.
- [4] Ricciuti B, Baglivo S, Paglialunga L, et al. Osimertinib in patients with advanced epidermal growth factor receptor T790M mutation‑positive non‑small cell lung cancer: rationale, evidence and place in therapy. Ther Adv Med Oncol 2017; 9: 387–403.
- [5] Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum‑pemetrex in EGFR T790M‑positive lung cancer. N Engl J Med 2017; 376: 629–640.
- [6] Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR‑mutated advanced non‑small‑cell lung cancer. N Engl J Med 2018; 378: 113–125.
- [7] Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR‑mutated or ALK‑rearranged non‑small‑cell lung cancers. Lung Cancer 2015; 88: 108–111.
- [8] Yu HA, Arcila ME, Rekhtman N, et al. Analysis of tumor specimens at the time of acquired resistance to EGFR‑TKI therapy in 155 patients with EGFR‑mutant lung cancers. Clin Cancer Res 2013; 19: 2240–2247.