Perorální léčba u roztroušené sklerózy, adherence a perzistence ve vztahu k dlouhodobé léčbě
Souhrn:
Zapletalová O. Perorální léčba u roztroušené sklerózy, adherence a perzistence ve vztahu k dlouhodobé léčbě. Remedia 2019; 29: 164–168.
Roztroušená skleróza (RS) je chronické onemocnění podmíněné autoimunitními zánětlivými a degenerativními procesy, které postihují centrální nervový systém. Patogeneze je komplexní děj, který kombinuje genové predispozice se zevními vlivy a s individuální imunitní reaktivitou. Výsledky současného výzkumu imunopatologie RS přinesly nové terapeutické možnosti, léčiva s různým mechanismem účinku, způsobem aplikace a bezpečnostním profilem. Perorální podání imunomodulační léčby (disease modyfying drugs, DMD) ve srovnání s DMD v injekční formě předpokládá větší pohodlí a spolupráci pacienta při terapii stejně jako větší adherenci k léčbě a její perzistenci. Příjemná cesta podání léku by měla být vždy zohledněna vzhledem k farmakogenomice, individuální reaktivitě, stadiu a průběhu nemoci a možným závažným nežádoucím účinkům, které mohou převážit komfort perorální léčby. Individuální přístup ke stanovení léčebného plánu je nezbytný.
Summary:
Zapletalova O. Peroral treatment in multiple sclerosis, long‑term treatment adherence and persistence. Remedia 2019; 29: 164–168.
Multiple sclerosis (MS) is an autoimmune chronic disease characterized by immunopathogenetic inflammation and degeneration of the central nervous system. The complexity of pathogenesis in MS combines the genetic predisposition, extraneous environmental impacts and individual immune reactivity. Recent research results brought up numerous effective drugs with diverse mechanisms of action, routes of administration and benefit/risk profiles. The oral route of administration of disease‑modifying therapies (DMTs) compared to injectable DMTs presumes patient’s satisfaction and compliance hand in hand with greater adherence and persistence to therapy. Pharmacogenomics, individual reactivity, progress of MS and possible severe side effects might outweight comfort of the peroral therapy. Rational treatment schedule should be considered for each individual.
Key words: multiple sclerosis, disease modifying drugs,immunosuppressants – DMD, peroral drugs, adherence, persistence
Úvod
Etiopatogeneze roztroušené sklerózy
(RS) je komplexní. Je ovlivněna genetickými predispozicemi
a působením proměnných faktorů z vnějšího prostředí
[1]. V klinickém průběhu RS nejdříve dominují zánětlivé
změny a demyelinizace, ale i v časném období,
a zvláště pak v progresivním stadiu se může rozvíjet
plíživý, avšak setrvalý pokles funkcí bez reakce na léčbu.
S tímto stavem korelují progredující neurodegenerativní
změny a rostoucí ztráta objemu mozku a míchy. Postupně
přibývá znalostí o procesech a mechanismech, které
vedou k poškození až zániku neuroaxonálního cytoskeletu.
Terapie léčivy modifikujícími chorobu (disease modifying drugs,
DMD) je indikována k redukci relapsů a ke zpomalení
progrese, její účinnost je prokázána v klinických studiích
a potvrzena klinickou praxí. Rozšiřování palety léčiv
s imunomodulačním, imunosupresivním a selektivně
imunosupresivním účinkem přináší nové terapeutické úspěchy.
Léčebná účinnost je přímo korelována s rizikem rozvoje
závažných nežádoucích účinků [1].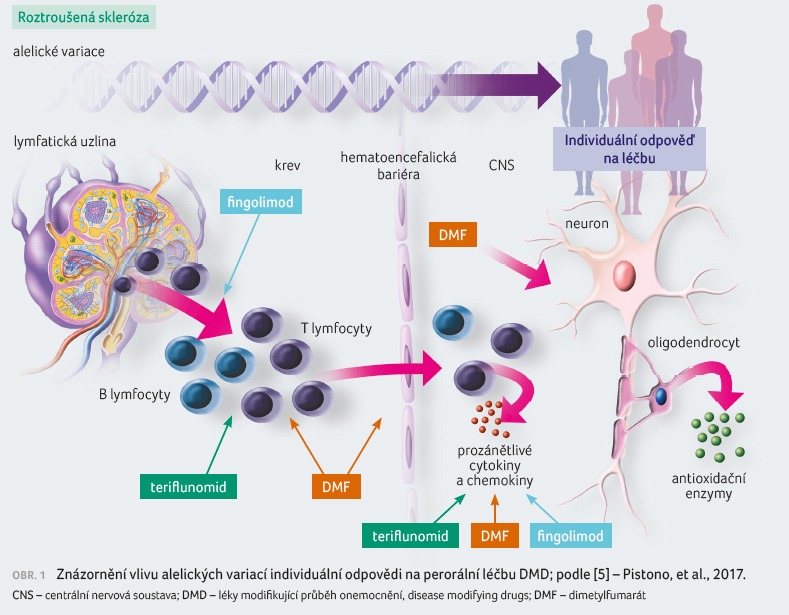
Léčebné schéma u RS a dlouhodobá prognóza
Roztroušená skleróza je chronické onemocnění, které většinou postihuje mladé jedince včetně dětí. Snahou je zastavit, nebo alespoň zpomalit rozvoj patologických imunitních okruhů a kaskád a v počáteční fázi dosáhnout stabilizace bez progrese klinického nálezu a aktivity na magnetické rezonanci (MR), tedy stavu označovaného jako NEDA (No Evidence of Disease Activity). O zdárném průběhu a úspěchu léčby rozhoduje výběr vhodného přípravku, který nejen odpovídá typu a fázi RS, charakteru potíží a neurologickému postižení, ale musí co nejvíce vyhovovat pacientovi a jeho stylu života. Léčebné schéma se v průběhu nemoci mění v souvislosti s omezenou účinností, s možnými nežádoucími účinky DMD a s aktivitou nemoci. Jsou zaváděny nové a účinnější lékové formy, vývoj onemocnění a dlouhodobá prognóza nemoci se lepší [2]. Struktura léčby RS se stále mění, je obohacena o léky s imunomodulačním, selektivně imunosupresivním a nově s imunorekonstitučním efektem. Tyto DMD působí dlouhodobé ovlivnění imunitního systému, což může přinášet i vážné nežádoucí účinky [3].
Perorální léčba DMD
Od roku 2010 byly schváleny americkými a evropskými institucemi (Úřadem pro kontrolu potravin a léčiv [Food and Drug Administration, FDA], Evropskou lékovou agenturou [European Medicines Agency, EMA] a následně Státním ústavem pro kontrolu léčiv [SÚKL]) perorální léky k terapii relabující remitující RS (RR RS): fingolimod, teriflunomid, dimetylfumarát a nově kladribin. Tyto léky mají rozdílný mechanismus účinku, klinickou účinnost a bezpečnostní profil. Jejich různorodost pak obohacuje možnost dosažení léčebných cílů a zlepšuje individuální přístup v léčbě [6]. Perorální cesta užívání je jednodušší, pohodlnější a někteří pacienti ji jednoznačně preferují. Důvodem je často psychogenní zábrana před injekční aplikací – strach z jehly (needle fobie), lokální reakce u subkutánní a intramuskulární aplikace, devastace kůže dlouhodobě opakovanými injekčními vpichy, dále pak nežádoucí účinky jako chřipkové příznaky, artralgie, celkové reakce. Někdy je problém s aplikací při poruše jemné motoriky horních končetin. Při intravenózní aplikaci je problémem insuficientní žilní vstup nebo jednoruký pacient. Někdy je dána kontraindikace podkožní nebo intramuskulární aplikace přidruženými chorobami, jako jsou choroby kůže (např. psoriáza, dermatitidy rozlišné etiologie), otoky, hematologická problematika, komedikace antikoagulancii a jiné.
Perorální DMD pro léčbu RR RS
Fingolimod
Fingolimod (obr. 2) je první perorální lék schválený pro léčbu
RR RS. V České republice začala léčba fingolimodem
v dávce 0,5 mg podávané jednou denně per
os v roce 2012 (FDA schváleno v roce 2010)
[4,6]. Lék byl zařazen do druhé linie DMD léčby, později
v ČR do „mezilinie“. Podle úhradové vyhlášky může
být fingolimod používán u nemocných, u nichž došlo
navzdory terapii lékem první linie k jednomu středně těžkému
nebo těžkému relapsu, nebo u pacientů s rychle
progredující závažnou formou RR RS, kteří prodělali
nejméně dva relapsy v jednom roce a současně vykazují
jednu nebo více lézí vychytávajících gadolinium na MR
mozku nebo zvýšení objemu T2 lézí ve srovnání
s předchozím MR vyšetřením.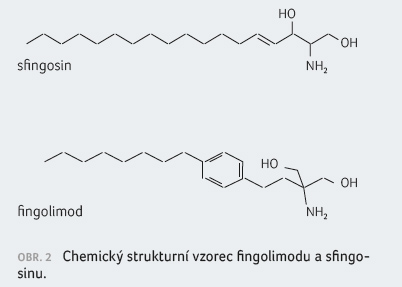
Účinnost fingolimodu je vysoká, řadíme jej do skupiny léčby kontinuální – udržovací, imunosupresivní [7]. Jde o selektivní modulátor receptorů pro sfingosin 1 fosfát (S1P) na T lymfocytech. Aktivní metabolit fingolimodu (fingolimod 1 fosfát) brání vycestování T lymfocytů z lymfatických orgánů. Navázání fingolimodu na receptory pro S1P vede k jejich rychlé internalizaci a degradaci [8,9].
V důsledku mechanismu účinku vzniká lymfopenie, čímž dochází k poklesu obranyschopnosti proti infekcím, především respiračním. K závažným infekčním komplikacím patří primoinfekce herpetickými viry. Vzhledem k vazbě na S1P receptory dalších struktur (např. kardiální myocyty, hladká svalovina cév, buňky sítnice) se mohou objevit nežádoucí účinky jako bradykardie po první dávce, hypertenze [10] a makulární edém. Dále se vyskytují abnormality hodnot jaterních testů, častější výskyt bazocelulárního karcinomu a jsou popsány obávané oportunní infekce, jako je progresivní multifokální leukoencefalopatie (PML) nebo kryptokokóza [8,9,11].
Teriflunomid
Teriflunomid (TRF, obr. 3) je lékem první linie, první a doposud jedinou
tabletovou lékovou formou v této skupině. V ČR je
indikován k léčbě RR RS od listopadu 2014 a pro
léčbu klinicky izolovaného syndromu od dubna 2015 (FDA 2012)
[4,6]. Schválená dávka je 14 mg podávaných jednou denně per
os.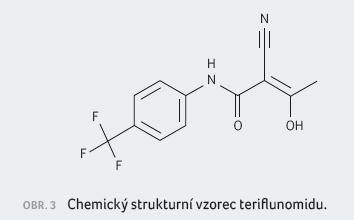
Teriflunomid vykazuje střední účinnost, se svým antiproliferativním a protizánětlivým účinkem patří do skupiny kontinuálních imunomodulačních léků se střední účinností na aktivitu RR RS. Jeho imunosupresivní účinek není definován [7]. Teriflunomid působí selektivní, nekompetitivní a reverzibilní inhibici mitochondriálního enzymu dihydroorotát dehydrogenázy (DHODH). Tento enzym je klíčový v dráze syntézy pyrimidinů de novo, což vede ke snížené proliferaci aktivovaných T a B lymfocytů bez vyvolání buněčné smrti [12]. Důsledkem inhibice je blokáda nové syntézy pyrimidinu, který je potřebný pro rychle se dělící aktivované lymfocyty k replikaci DNA. Následkem toho je redukována aktivita T a B buněk na periferii, jejich proliferace a mění se reakce na autoantigeny [13]. Současně jsou ušetřeny klidové lymfocyty, což se zdá jako elegantní cesta k ovlivnění přemrštěné buněčné reakce, která provokuje složitou patologickou imunitní odpověď. Proces nezasahuje homeostatický metabolismus a léčba není provázena cytotoxickými projevy [14]. Eliminace TRF je pomalá, v průměru trvá osm měsíců, ale pokles lékové koncentrace může trvat až dva roky. V případě nutnosti měnit léčbu nebo při plánování gravidity je doporučeno provést zrychlenou eliminaci podáváním kolestyraminu nebo aktivního uhlí.
Nežádoucími účinky při léčbě TRF jsou řídnutí vlasů, bolest hlavy, gastrointestinální příznaky, zvýšení aktivity jaterních enzymů, leukopenie, významná porucha funkce kostní dřeně nebo snížení koncentrace krevních elementů a závažné infekce [1,3,7].
Dimetylfumarát
Dimetylfumarát (DMF, obr. 4) je zařazen k léčbě RR RS do tzv.
mezilinie. V ČR byla schválena úhrada léčby DMF na podzim
2015 (FDA 2013) [4,6]. Podle úhradové vyhlášky je indikována
u nemocných s RR RS, u kterých došlo navzdory
léčbě nejméně jedním lékem první linie k rozvoji alespoň
jednoho středně těžkého nebo těžkého relapsu, nebo u pacientů
s rychle progredující závažnou formou RR RS, kteří
prodělali nejméně dva relapsy v jednom roce a současně
vykazují jednu nebo více gadolinium vychytávajících lézí na MR
mozku nebo zvýšení objemu T2 lézí ve srovnání
s předchozím vyšetřením MR.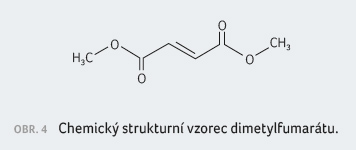
Účinnost DMF je střední až vysoká,
jeho podávání má kontinuální imunosupresivní efekt. Plné
dávkování DMF je 240 mg podávaných dvakrát denně per
os [7]. Doporučuje se, aby první týden nemocný užíval
poloviční dávku. Mechanismus účinku je založen na aktivaci
endogenních procesů zaměřených na omezení oxidativního
stresu. Je aktivován nukleární faktor N2F erythroid 2 related
factor 2 [15,16]. Předpokládá se, že DMF působí několika
dalšími imunomodulačními vlivy u RS včetně řízení
imunitní odpovědi Th1 lymfocytů [15]. Hlavními nežádoucími
účinky jsou zrudnutí (návaly horka) po aplikaci,
gastrointestinální příhody (průjem, nauzea, bolest břicha,
bolest v horní části břicha). Zrudnutí (návaly horka)
a gastrointestinální příznaky se většinou objevují
na počátku léčby DMF, mohou však přetrvávat v celém
jejím průběhu. Dále pak se vyskytují lymfopenie, zvýšení
aktivity jaterních enzymů, proteinurie a PML.
Kladribin
V ČR byla léčbě kladribinem (20 dní perorální léčby ve dvou letech) přidělena úhrada od 1. října 2018 (EMA 8/2017). Léčba je hrazena u nemocných s RR RS se známkami nepříznivé prognózy onemocnění, u kterých došlo navzdory léčbě nejméně jedním lékem první linie k rozvoji alespoň jednoho středně těžkého nebo těžkého relapsu. Dávkování je ve dvou pulzech podaných v prvním a druhém roce léčby. Pulz trvá pět dnů a je podáván v prvním a pátém týdnu daného léčebného roku. Celková dávka kladribinu je 3,5 mg/kg tělesné hmotnosti, celková doba léčby je maximálně 20 dnů v průběhu dvou let.
Kladribin je vysoce účinný, mechanismem účinku představuje novou kategorii léčby RS – tzv. selektivní imunorekonstituční terapii (SIRT) [7,17]. Principem je selektivní snížení počtu T a B lymfocytů patřících ke specifické imunitě, bez zásadního ovlivnění imunity vrozené. Dojde k dlouhodobým kvalitativním změnám imunitního systému [6,17]. Výhodou kladribinu je, že nevzniká tzv. rebound fenomén (reaktivace nemoci) při přerušení nebo ukončení léčebného pulzu, nehrozí ani riziko sekundárních autoimunitních nemocí. Plánování těhotenství je možné od devátého měsíce druhého léčebného roku.
Hlavním nežádoucím účinkem je lymfopenie, která je vzhledem k mechanismu působení kladribinu očekávaná, bývá převážně lehčího nebo středního stupně a přechodná. Častější jsou herpetické infekce – labiální a herpes zoster. Také výskyt malignit může být četnější. Doposud nebyl hlášen žádný případ PML [7,18,19].
Diskuse
Léčba RS je rozmanitá a vzhledem k charakteru onemocnění s chronickým průběhem dlouhodobá. Výběr vhodného léku představuje složitou proceduru – je třeba přihlédnout k individuální reaktivitě pacienta, jeho osobnosti a stylu života. Efektivita DMD léčby je ovlivněna mnoha faktory včetně adherence k terapii a perzistence. Důvěra k lékaři a spolupráce nemocného se zdravotníky je často rozhodující v celém dalším průběhu nemoci. Odhad efektivity léčiv probíhá již během klinických studií, ale studijní podmínky se významně liší od praxe. Skutečný stav je prověřován v klinických sledováních, přičemž jsou využívána data z lokálních nebo mezinárodních registrů. Je zkoumána užitná hodnota konkrétních přípravků používaných v terapii RR RS a dlouhodobá perzistence. Skupina autorů z New Jersey hodnotila adherenci a perzistenci pacientů léčených perorálními DMD v průběhu 12 měsíců. Je uvedeno, že slabá adherence a perzistence ve vztahu k léčbě DMD je běžným jevem, k němuž dochází z rozličných důvodů i v případě podávání jiných chronických léčiv a samozřejmě přináší negativní léčebné výsledky [4]. Australská studie REALITY zkoumala perzistenci u 720 pacientů léčených perorálními i injekčními léky a bylo zjištěno, že v této skupině je největší perzistence u léčby fingolimodem [20]. Stejný výsledek byl zaznamenán při srovnání perzistence pacientů na léčbě fingolimodem s nálezem ze světového registru MS Base (mezinárodní online databáze ustanovená v roce 2004). Účinnost, způsob, profil nežádoucích účinků a některé specifické okolnosti (jako je například pozitivita JC viru u natalizumabu) mají vliv na přerušení léčby a jejich rozbor skýtá užitečný náhled na pozorované rozdíly [21]. Zkušenosti z registrů jsou důležité, individualizace léčby je nezbytná. Nelze podcenit trpělivou komunikaci s nemocným, nutný je pečlivý výběr léku, kterému by pacient důvěřoval a pochopil význam pravidelné aplikace i přes některé problémy a nepohodlí.
Závěr
Roztroušená skleróza je chronické onemocnění, které doposud neumíme vyléčit, ale existuje široká paleta účinných DMD, jež dovedou natolik ovlivnit průběh onemocnění, že je možná jeho stabilizace a dosažení principu NEDA. Do roku 2010 byla dostupná pouze injekční aplikace – podkožní, intramuskulární nebo intravenózní. Nyní jsou postupně zavedeny do portfolia DMD účinné perorální formy, jejichž aplikace je pro nemocné příjemnější. Obě skupiny se doplňují, každý lék má své místo a výběr musí být individuální podle průběhu, typu RS, charakteru přípravku a stylu života a osobnosti pacienta.
Seznam použité literatury
- [1] Krejsek J. Léčba roztroušené sklerózy mozkomíšní – imunomodulační, či imunosupresivní zásahy? Remedia 2016; 26: 547−551.
- [2] Capra R, Cordioli C, Rasia S, et al. Assessing long‑term prognosis improvement as a consequence of treatment pattern changes in MS. Mult Scler 2017; 23: 1757−1761.
- [3] Pardo G, Jones DE. The sequence of disease‑modifying therapies in relapsing multiple sclerosis: safety and immunologic considerations. J Neurol 2017; 264: 2351−2374.
- [4] Johnson KM, Zhou H, Lin F, et al. Real‑world adherence and persistence to oral disease‑modifying therapies in multiple sclerosis patients over 1 year. J Manag Care Spec Pharm 2017; 23: 844−852.
- [5] Pistono C, Osera C, Boiocchi C, et al. Whatʼs new about oral treatments in Multiple Sclerosis? Immunogenetics still under question. Pharmacol Res 2017; 120: 279−293.
- [6] D’Amico E, Leone C, Caserta C, et al. Oral drugs in multiple sclerosis therapy: an overview and a critical appraisal. Expert Rev Neurother 2015; 15: 803−824.
- [7] Giovannoni G. Disease‑modifying treatments for early and advanced multiple sclerosis: a new treatment paradigm. Curr Opin Neurol 2018; 31: 233−243.
- [8] Singer BA. Fingolimod for the treatment of relapsing multiple sclerosis. Expert Rev Neurother 2013; 13: 589−602.
- [9] Kappos L, Cohen J, Collins W, et al. Fingolimod in relapsing multiple sclerosis: An integrated analysis of safety findings. Mult Scler Relat Disord 2014; 3: 494−504.
- [10] Camm J, Hla T, Bakshi R, et al. Cardiac and vascular effects of fingolimod: mechanistic basic and clinical implications. Am Heart J 2014; 168: 632−644.
- [11] Cohen JA, Chun J. Mechanisms of fingolimodʼs efficacy and adverse effects in multiple sclerosis. Ann Neurol 2011; 69: 759−777.
- [12] Bar‑Or A, Pachner A, Menguy‑Vacheron F, et al. Teriflunomide and its mechanism of action in multiple sclerosis. Drugs 2014; 74: 659−674.
- [13] Bar‑Or A, Wiendl H, Miller B, et al. Randomized study of teriflunomide effects on immune responses to neoantigen and recall antigens. Neurol Neuroimmunol Neuroinflamm 2015; 2: e70.
- [14] Claussen MC, Korn T. Immune mechanisms of new therapeutic strategies in MS: teriflunomide. Clin Immunol 2012; 142: 49−56.
- [15] Scannevin RH, Chollate S, Jung MY, et al. Fumarates promote cytoprotection of central nervous system cells against oxidative stress via the nuclear factor (erythroid‑derived 2)‑like 2 pathway. J. Pharmacol Exp Ther 2012; 341: 274−284.
- [16] Bomprezzi R. Dimethyl fumarate in the treatment of relapsing‑remitting multiple sclerosis: an overview. Ther Adv Neurol Disord 2015; 8: 20−30.
- [17] Wiendl H. Cladribine – an old newcomer for pulsed immune reconstitution in MS. Nat Rev Neurol 2017; 13: 573−574.
- [18] Giovannoni G. Cladribine to treat relapsing forms of multiple sclerosis. Neurotherapeutics 2017; 14: 874−887.
- [19] Mavenclad. [online]. Státní ústav pro kontrolu léčiv. 2010. [cit. 2019‑01‑09]. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?kod=0222417
- [20] Schulz M, Arora B, Chung E, et al. Real‑world evidence (RWE) on long‑term persistence to medications for relapsing‑remitting multiple sclerosis (RRMS) in the Australian community (REALITY). Poster ECTRIMS, October 25−28, 2017, Paris, France.
- [21] Spelman T, Schulz M, Arora B, et al. Persistent to fingolimod compared with other disease modifying therapies in the Australian Real‑world setting using the MSBase registry. Poster ECTRIMS, October 25‑28, 2017, Paris, France.