Pětiletá studie GAP pro prevenci astmatu u dětí trpících alergií na pyl trav s užitím sublinguální imunoterapie přípravkem Grazax
Souhrn:
Alergenová imunoterapie je cílena na imunologickou podstatu alergické rinokonjunktivitidy a alergického astmatu a má potenciál změnit přirozený průběh alergického onemocnění. Studie GAP (Grazax Asthma Prevention) si kladla za hlavní cíl zjistit, zda sublinguální imunoterapie ovlivní ve srovnání s placebem riziko vzniku astmatu v dětském věku. Do studie bylo zařazeno 812 dětí (ve věku 5–12 let) s klinicky relevantní historií alergické rinokonjunktivitidy s vazbou na pyl trav a bez anamnézy nebo příznaků astmatu. Hodnocení bylo randomizované, dvojitě zaslepené, placebem kontrolované a zahrnovalo tříletou
kontinuální sublinguální imunoterapii přípravkem Grazax 75 000 SQ‑T s následným dvouletým sledováním. Grazax je perorální lyofilizát standardizovaného alergenového extraktu z travního pylu bojínku lučního. Ve výsledcích nebyl sice zaznamenán časový rozdíl v počátku vzniku astmatu dle předem stanovených kritérií, v rámci dalších cílových ukazatelů však bylo jednoznačně prokázáno ve skupině dětských alergiků léčených sublinguální imunoterapií výrazné snížení příznaků astmatu a užívání léků na astma již od druhého roku studie, v následném dvouletém sledování a v závěru studie (odds ratio 0,66; p < 0,036). Z hlediska alergické rinokonjunktivitidy byla signifikantně snížena spotřeba farmakoterapie, v závěru studie až o 27 % vůči placebu (p < 0,001). V aktivní skupině byly hodnoty celkových a specifických IgE protilátek (pyl trav) a reaktivita kožního prick testu signifikantně nižší ve srovnání s placebovou skupinou.
Sublinguální léčba tabletou Grazax kontinuálně podávanou po tři roky prokázala modifikující vliv alergenové imunoterapie na přirozený průběh choroby. To bylo vyjádřeno zejména zabráněním progresi alergického onemocnění, zmírněním tíže alergické rinokonjunktivitidy a alergického bronchiálního astmatu. Důležitost včasného zahájení léčby přípravkem Grazax v raném věku byla zřejmá, protože počet dětí, které bylo potřeba léčit, se zvyšoval s věkem.
Studie GAP je průlomovou studií v historii alergenové imunoterapie. Jedná se o dosud nejrozsáhlejší pediatrické hodnocení alergenové imunoterapie a je první velkou dvojitě zaslepenou, placebem kontrolovanou studií, která hodnotí prevenci astmatu ve vztahu k sublinguální imunoterapii.
Key words: children – alergen immunotherapy – allergic rhinoconjunctivitis – alergic asthma – long‑term study – GAP (Grazax Asthma Prevention).
Summary:
Allergen immunotherapy is targeted at the immunological basis of allergic rhinoconjunctivitis and allergic asthma and it has the potential to modify the natural course of the allergic disease. GAP study (Grazax Asthma Prevention) aimed to evaluate whether sublingual immunotherapy influences the risk of asthma development in childhood in comparison with placebo. Eight hundred and twelve children (5–12 years of age) with clinically relevant history of allergic rhinoconjunctivitis related to grass pollen and without history or symptoms of asthma were included in the study. The evaluation was randomized, double blind, placebo‑controlled and it included a three‑year continual sublingual immunotherapy with Grazax 75 000 SQ‑T with subsequent two‑year follow‑up. Grazax is an oral lyophilizate of standardized allergen extract from grass pollen of common cat’s tail. Although no difference was found in the results in the time of onset of asthma according to pre‑defined criteria, marked decrease in asthma symptoms and asthma medication use was clearly demonstrated in other endpoints already since the second year of the study, in the subsequent two‑year follow‑up and at the end of the study (odds ratio 0.66; p < 0.036) in the group of children with asthma treated with sublingual immunotherapy. Regarding allergic rhinoconjunctivitis, the use of pharmacotherapy was significantly decreased, up to 27% compared to placebo (p < 0.001) by the end of the study. In the active group, the levels of overall and specific IgE antibodies (grass pollen) and cutaneous prick test reactivity was significantly lower in comparison with placebo group.
Sublingual therapy with Grazax tablets continually administered over three years demonstrated modifying influence of allergen immunotherapy on the natural course of the disease. This translated mainly into the prevention of progression of the allergic disease, the decrease in severity of allergic rhinoconjunctivitis and allergic bronchial asthma. The importance of early initiation of treatment with Grazax was apparent, since the number needed to treat increased with age. GAP study is a breakthrough study in the history of allergen immunotherapy. So far, it is the largest paediatric evaluation of allergen immunotherapy and it is the first large, double blind, placebo‑controlled trial that assesses the prevention of asthma with connection to sublingual immunotherapy.
Úvod
Bronchiální astma je heterogenní onemocnění dýchacích cest vyznačující se chronickým zánětem a remodelací průdušek spojenými s jejich hyperreaktivitou a variabilní (většinou reverzibilní) obstrukcí. Celosvětově trpí bronchiálním astmatem přibližně 300 milionů jedinců a toto chronické celoživotní onemocnění je považováno za závažný zdravotní problém postihující všechny věkové skupiny [1]. Alergické astma představuje časté chronické onemocnění v dětství a významně zatěžuje pacienty, jejich rodiny a systémy zdravotní péče [2]. Alergická rinokonjunktivitida (allergic rhinoconjunctivitis, ARC) je uznávaným rizikovým faktorem pro vývoj astmatu [3,4]. Alergenová imunoterapie (AIT) cílí na imunologickou podstatu respiračních alergických příznaků zprostředkovaných IgE protilátkami cestou modulace imunologické alergické reaktivity. Kromě zmírnění symptomů ARC a spotřeby antialergické farmakoterapie AIT prokázala potenciál měnit přirozený průběh a vývoj k progresi alergických onemocnění [4‒6]. Na současné úrovni poznání by AIT mohla představovat nejen efektivní léčbu příznaků ARC, ale zejména významný způsob prevence astmatu. Výsledky některých otevřených studií naznačují, že AIT může snížit riziko vzniku příznaků astmatu u alergických rinitiků [7,8].
Studie GAP (Grazax Asthma Prevention) je první, která hodnotí modifikující účinek AIT ve velkém randomizovaném, dvojitě zaslepeném a placebem kontrolovaném sledování v dětské populaci [9]. Ve studii byla k AIT zvolena sublinguální tableta s obsahem pylu bojínku lučního (Phleum pratense) ‒ GRAZAX 75 000 SQ T/2 800 BAU, ALK, Dánsko. Jedná se o imunoterapeutický přípravek ve formě tablety (se standardizovaným počtem jednotek kvality), která se rychle rozpouští pod jazykem.
Cílem studie GAP bylo zkoumat vliv sublinguální imunoterapie (SLIT) v období tří po sobě jdoucích let ve srovnání s placebem se zaměřením na riziko rozvoje astmatu. Do sledování byly zařazeny alergické děti senzibilizované na pyl trav trpící projevy ARC bez příznaků astmatu. Vliv AIT byl sledován v průběhu celé studie, jak v období screeningu, tak v tříletém období léčby a v následném dvouletém sledování. Zdravotní stav z hlediska astmatu byl opětně dle určených kritérií zhodnocen na konci studie. Taktéž byl zkoumán efekt léčby na výskyt příznaků ARC, spotřebu medikace a na imunologické parametry.
Jedná se o průkopnickou studii ‒ GAP je největším pediatrickým hodnocením s AIT, jež bylo dosud provedeno, a je první z rozsáhlých, dvojitě zaslepených, placebem kontrolovaných studií, které se zabývaly prevencí astmatu u dětské populace v souvislosti s AIT. Její výsledky by mohly změnit indikaci AIT směrem k jejímu včasnému zahájení u dětské populace.
Metody
Studie byla randomizovaná v poměru
1 : 1, s paralelními skupinami, dvojitě zaslepená,
placebem kontrolovaná, 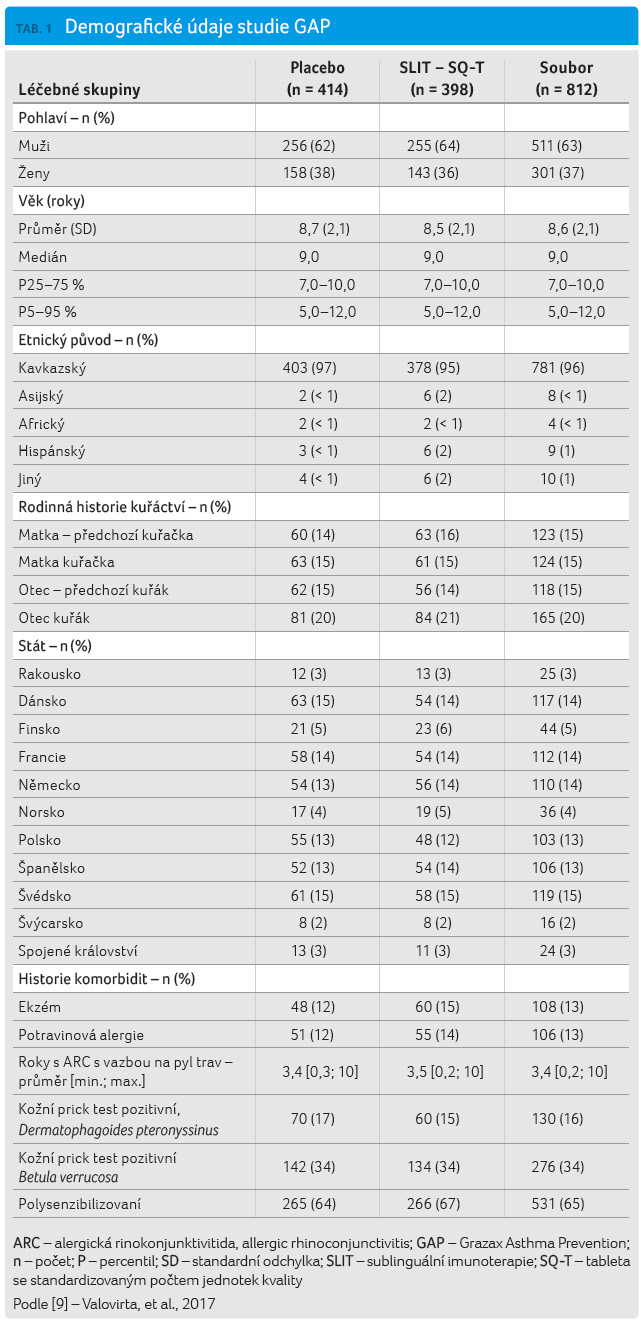 prováděná v souladu se zásadami
Helsinské deklarace a v souladu s pokyny o Správné
klinické praxi. Protokol a jeho změny schválily příslušné
národní etické komise a regulační orgány. Studie
(EudraCT 2009 011235 12, NCT01061203) byla realizována
na 101 místech v 11 evropských zemích
a zahrnovala 812 dětí. Do sledování byly zařazeny děti
ve věku 5‒12 let při randomizaci, které měly pozitivní
reakci na kožní prick test ≥ 3 mm a zvýšenou
hodnotu specifických IgE protilátek proti pylu bojínku lučního
(≥ 0,70 kU/l) (tab. 1).
Děti měly příznaky ARC s vazbou na pyl trav vyžadující
farmakoterapii v průběhu dvou posledních pylových sezon
a byly zcela bez anamnézy astmatu (a/nebo sípání). Stejně
tak zařazení dětští pacienti nesměli mít příznaky astmatu
v průběhu posledních dvou let nebo od věku 5 let.
Randomizace byla provedena zvlášť pro každé studijní místo.
Pacienti byli léčeni v průběhu celé pětileté studie
adekvátní farmakoterapií.
prováděná v souladu se zásadami
Helsinské deklarace a v souladu s pokyny o Správné
klinické praxi. Protokol a jeho změny schválily příslušné
národní etické komise a regulační orgány. Studie
(EudraCT 2009 011235 12, NCT01061203) byla realizována
na 101 místech v 11 evropských zemích
a zahrnovala 812 dětí. Do sledování byly zařazeny děti
ve věku 5‒12 let při randomizaci, které měly pozitivní
reakci na kožní prick test ≥ 3 mm a zvýšenou
hodnotu specifických IgE protilátek proti pylu bojínku lučního
(≥ 0,70 kU/l) (tab. 1).
Děti měly příznaky ARC s vazbou na pyl trav vyžadující
farmakoterapii v průběhu dvou posledních pylových sezon
a byly zcela bez anamnézy astmatu (a/nebo sípání). Stejně
tak zařazení dětští pacienti nesměli mít příznaky astmatu
v průběhu posledních dvou let nebo od věku 5 let.
Randomizace byla provedena zvlášť pro každé studijní místo.
Pacienti byli léčeni v průběhu celé pětileté studie
adekvátní farmakoterapií.
Tableta pro SLIT obsahuje extrakt
alergenu z pylu bojínku lučního. Jedná se o rychle se
rozpouštějící perorální lyofilizát pro sublinguální
podávání. Denní dávkou je jedna tableta určená pro podání
v domácím prostředí s výjimkou první aplikace, která
má proběhnout pod vedením lékaře. Léčebným placebem byly
tablety vizuálně identické, ale bez extraktu pylu bojínku
lučního. Uspořádání studie je znázorněno na obrázku 1.![Uspořádání studie GAp; podle [9] – valovirta, et al., 2017. GAp – Grazax Asthma Prevention; v – návštěva](https://www.remedia.cz/photo-a-31310---.jpg)
S cílem analyzovat, zda dochází k rozvoji astmatu v průběhu studie, bylo při každé návštěvě hodnoceno fyzikální vyšetření dítěte se zaměřením na příznaky astmatu (přítomnost sípání/pískotů při dýchání nebo přítomné uvedené symptomy při usilovném výdechovém objemu za jednu sekundu – forced expiratory volume, FEV1). Při každé návštěvě byly hodnoceny projevy astmatu od poslední kontroly ‒ sípání, kašel trvající déle než 10 po sobě jdoucích dnů, dušnost, tíseň na hrudi. Současně byly děti tázány na užitou medikaci k léčbě astmatu od poslední návštěvy. Antiastmatické léky zahrnovaly β2 agonisty, inhalační kortikosteroidy, antileukotrieny, dlouhodobě působící β2 agonisty, teofylin s prodlouženým uvolňováním, kromoglykáty, systémové kortikosteroidy. Spirometrie byla prováděna včetně posouzení reverzibility bronchiální obstrukce.
Primárním cílovým ukazatelem studie byl čas do vzniku astmatu měřený ve dnech od bodu randomizace. Astma bylo definováno jako splnění jednoho nebo více z následujících tři kritérií hodnocených při každé návštěvě:
- Nejméně jedna epizoda pískotů, kašle, dušnosti, tísně na hrudi a reverzibilita hodnoty FEV1 ≥ 12 % po inhalaci β2 agonisty.
- Pískoty při fyzikálním vyšetření v průběhu výdechu či v průběhu usilovného prodlouženého výdechu a aplikace léků na astma s klinicky relevantním účinkem.
- Pískoty při fyzikálním vyšetření v průběhu výdechu či v průběhu usilovného prodlouženého výdechu a reverzibilita hodnoty FEV1 ≥ 12 % po inhalaci β2 agonisty.
Dle protokolu byl počátek vzniku astmatu uvažován v binárním modu („astma ano/astma ne“). Děti byly klasifikovány jako astmatici, pokud kritéria byla splněna již při jediné návštěvě. Pacienti s častým hlášením příznaků astmatu, ale bez pozorovatelného reverzibilního poklesu plicních funkcí nebyli klasifikováni jako astmatici. Symptomy astmatu a stav léčby astmatu na konci studie (v období od zimní návštěvy pátého roku do návštěvy v pylové sezoně trav) byly předem definovaným sekundárním cílovým ukazatelem studie. Podíl dětí s příznaky astmatu a/nebo s astmatickou medikací v průběhu studie byl dále analyzován pro celé studijní a následné dvouleté období.
Sekundární cílové ukazatele studie z hlediska rinokonjunktivitidy zahrnovaly vizuální analogovou škálu (VAS) 1× ročně v pylové sezoně trav, VAS skóre denně po dobu 2 týdnů před návštěvou v pylové sezoně trav v pátém roce; skóre medikace užívané pro ARC denně 2 týdny před návštěvou v pylové sezoně trav v pátém roce; imunologické parametry IgE a IgG4.
V rámci studie byly pochopitelně zaznamenávány nežádoucí události a závažné nežádoucí události včetně přerušení léčby v důsledku nežádoucí příhody.
Statistické analýzy byly provedeny sponzorem studie.
Výsledky
Celková analýza zahrnovala 1 192 dětí, z nichž následně bylo 380 vyřazeno v rámci screeningu. Do randomizace postoupilo 812 dětí; 414 dětí bylo v placebové skupině a 398 v aktivní větvi s užitím sublinguální tablety s obsahem extraktu pylu bojínku lučního. Celkem 608 dětí dokončilo studii. Vyšší podíl dětí přerušil studii z důvodu nežádoucí události v aktivní skupině (n = 39) ve srovnání s placebem (n = 13).
Klinická kritéria
Primární analýza účinnosti (čas
do nástupu astmatu) dle definovaných kritérií diagnózy
astmatu neprokázala rozdíl mezi aktivní skupinou a placebovou
skupinou. Celkem 73 dětí v souboru splnilo kritéria
diagnostiky astmatu, ale některé z těchto dětí neměly
příznaky astmatu při následných návštěvách během dvouletého
období sledování bez léčby. Ze 73 pacientů, kteří
splnili kritéria, se u 51 dětí objevily příznaky
astmatu a/nebo užívaly léky v rámci diagnózy astmatu během
dvouletého období sledování. Z tohoto počtu uvádělo
43 dětí (29 dětí v placebové větvi a 14 dětí
ve větvi se SLIT) jak symptomy, tak léčbu astmatu (tab. 2).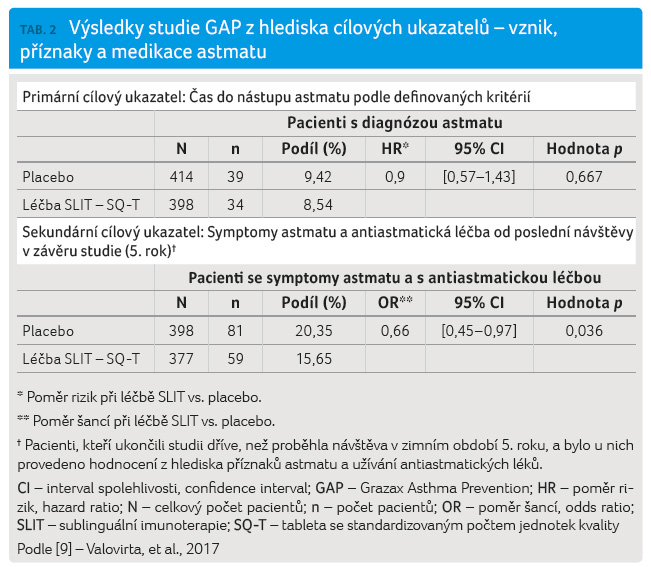
Z počtu 739 dětí bez definované diagnózy astmatu podle přesných kritérií protokolu jich 147 hlásilo příznaky astmatu nebo užívání léků na astma během dvouletého sledovacího období. Z tohoto souboru hlásilo 66 dětí (41 dětí ve skupině s placebem a 25 dětí ve skupině léčené SLIT) příznaky astmatu i jeho léčbu. Analýza dat z hlediska účinnosti na symptomy astmatu a užití antiastmatické léčby v závěru studie (5. rok, pylová sezona trav) prokázala, že aktivní soubor ve srovnání s placebovou skupinou tvořil nižší počet dětí s příznaky astmatu či s medikací astmatu (poměr šancí, odds ratio [OR] = 0,66; p = 0,036), což odpovídá snížení relativního rizika o 29,4 %. Podíl dětí s příznaky astmatu nebo užívajících léčbu byl charakterizován každým rokem během pětileté studie v post hoc analýzách. Léčba SLIT versus placebo vyzněla ve prospěch aktivní skupiny od druhého roku studie a následně s redukcí relativního rizika od 36,2 % do 50,7 % (graf 1).
Pokud porovnáme skupiny dětí, které v rámci diagnostických kritérií astmatu měly dokumentovanou reverzibilitu hodnoty FEV1 ≥ 12 %, byl statisticky významně nižší počet dětí v aktivní skupině (p = 0,028) (graf 2).
Pokud by![poměr šancí pro symptomy astmatu, antiastmatickou léčbu a pro oba cílové ukazatele – tříleté období terapie a následné dvouleté sledování ve studii GAp; podle [9] – valovirta, et al., 2017. Ci – interval spolehlivosti, confi dence interval; GAp – Grazax Asthma Prevention; or – poměr šancí, odds ratio; SliT – sublinguální imunoterapie; SQ‑T – tableta se standardizovaným počtem jednotek kvality](https://www.remedia.cz/photo-a-31312---.jpg) la analýza opakována pouze
pro návštěvy v zimním období nebo pouze pro návštěvy
v průběhu sezony trav, byly výsledky obdobné a opětně
ve prospěch aktivní skupiny. Příznivý terapeutický vliv
byl prokázán celoročně a rozdíly mezi oběma studijními
skupinami se v průběhu studie stávaly výraznějšími. Vliv
SLIT na příznaky astmatu byl přednostně účinný na snížení
výskytu pískotů, tísně na hrudi a na dušnost.
Účinky SLIT na užití antiastmatické medikace byly
přednostně zřetelné v užití β2 agonistů (graf 3).
la analýza opakována pouze
pro návštěvy v zimním období nebo pouze pro návštěvy
v průběhu sezony trav, byly výsledky obdobné a opětně
ve prospěch aktivní skupiny. Příznivý terapeutický vliv
byl prokázán celoročně a rozdíly mezi oběma studijními
skupinami se v průběhu studie stávaly výraznějšími. Vliv
SLIT na příznaky astmatu byl přednostně účinný na snížení
výskytu pískotů, tísně na hrudi a na dušnost.
Účinky SLIT na užití antiastmatické medikace byly
přednostně zřetelné v užití β2 agonistů (graf 3).
Účinnost léčby byla vyhodnocena
jako nezávislá na věku. Čím dříve bylo započato
s léčbou, tím vyšší bylo procento dětí, u nichž
bylo zabráněno příznakům astmatu a užití terapie v období
následné fáze.![podíl pacientů se symptomy astmatu, s antiastmatickou léčbou, s prokázanou reverzibilitou hodnoty fEv1, s užitím inhalačních kortikosteroidů (studie GAp); podle [9] – valovirta, et al., 2017. Ci – interval spolehlivosti, confi dence interval; fEv1 – usilovný výdechový objem za jednu sekundu, forced expiratory volume; GAp – Grazax Asthma Prevention; or – poměr šancí, odds ratio; SliT – sublinguální imunoterapie; SQ‑T – tableta se standardizovaným počtem jednotek kvality](https://www.remedia.cz/photo-a-31313---.jpg)
V průběhu pylové sezony trav
byly každoročně vyhodnocovány příznaky ARC při návštěvách
pomocí VAS. Skóre VAS bylo vyhodnoceno na stupnici od 0 mm
(žádné příznaky) do 100 mm (závažné příznaky). Děti
zaznamenávaly denně hodnotu VAS 14 dní před návštěvou a dále
bylo skóre opětně vyšetřeno při návštěvě lékaře. Pro
všechny tři léčebné roky a dva následující roky bylo
dokladováno průměrné skóre VAS statisticky významně nižší
(tj. nižší závažnost symptomů) ve skupině s užitím
sublinguální tablety extraktu bojínku lučního ve srovnání
s placebovou skupinou (rozdíly v rozsahu 22‒30 %).![podíl pacientů se symptomy astmatu (studie GAp); podle [9] – valovirta, et al., 2017. GAp – Grazax Asthma Prevention; or – poměr šancí, odds ratio; SliT – sublinguální imunoterapie; SQ‑T – tableta se standardizovaným počtem jednotek kvality](https://www.remedia.cz/photo-a-31314---.jpg)
Použití léčby v rámci ARC bylo zaznamenáváno denně v deníku během 14 dnů před návštěvou v průběhu pylové sezony trav v pátém roce (2015) a bylo počítáno tzv. skóre léčby. Spotřeba medikace v pátém roce byla statisticky významně nižší v aktivní skupině ve srovnání s placebovou skupinou, pokles spotřeby léčby představoval 27 %.
Laboratorní parametry
Na počátku léčby byly průměrné hodnoty specifických IgE protilátek proti pylu trav obdobné pro obě studijní skupiny. V průběhu studie byl postupně zaznamenán nárůst koncentrací specifických IgE protilátek v obou skupinách, průměrné navýšení oproti výchozím hodnotám bylo významně nižší u dětí léčených SLIT než v placebové skupině po třech letech léčby a po následném dvouletém sledovacím období (p < 0,001).
Stejná dynamika byla pozorována
u hodnoty celkových IgE protilátek v séru. Účinky
léčby na koncentrace specifických IgE protilátek
byly v souladu s redukovanou reakcí po kožním prick
testu s alergeny travních pylů ve skupině se SLIT
(p < 0,05)
na závěr studie, tj. dva roky od dokončení léčby
(graf 4). Průměrné
koncentrace specifických IgG4 protilátek pro pyl trav byly taktéž
na počátku léčby obdobné pro obě studijní skupi![Hodnoty prick testů (extrakt pylu Phleum pratense) – studie GAp; podle [9] – valovirta, et al., 2017. GAp – Grazax Asthma Prevention; SliT – sublinguální imunoterapie; SQ‑T – tableta se standardizovaným počtem jednotek kvality](https://www.remedia.cz/photo-a-31315---.jpg) ny. Změny
oproti výchozím hodnotám vykazovaly statisticky významný nárůst
v aktivní skupině (p < 0,001).
ny. Změny
oproti výchozím hodnotám vykazovaly statisticky významný nárůst
v aktivní skupině (p < 0,001).
Bezpečnostní profil
Byla prokázána bezpečnost léčebného přípravku SQ T, extraktu pylu bojínku lučního určeného k sublinguální aplikaci.
Celkově 765 (94 %) dětí hlásilo
během studie celkem 7 797 nežádoucích příhod a podíl
dětí byl obdobný jak v aktivní, tak v placebové
skupině (95 % vs. 93 %). Většina hlášených nežádoucích
příhod (88 %) nevedla k přerušení studijní medikace
a studie, naprostá většina příhod (97 %) byla vyřešena.
Závažné nežádoucí události byly hlášeny u 73 (9 %)
dětí, celkem bylo zaznamenáno 98 závažných nežádoucích
příhod. Ve skupině se SLIT bylo zaznamenáno více závažných
nežádoucích událostí (11 %) ve srovnání s dětmi
z placebové skupiny. Padesát dva (6 %) dětí ukončilo
studii, tento podíl byl vyšší ve skupině aktivní (10 %
vs. 3 %). Nejčastěji hlášené nežádoucí příhody uvedené
u ≥ 5 % dětí ve skupině se SLIT byly:
nazofaryngitida, ARC, pruritus v dutině ústní, kašel
a gastroenteritida (graf 5).![podíl pacientů s nejčastěji hlášenými nežádoucími příhodami (≥ 5 %) – studie GAp; podle [9] – valovirta, et al., 2017. GAp – Grazax Asthma Prevention; SliT – sublinguální imunoterapie; SQ‑T – tableta se standardizovaným počtem jednotek kvality](https://www.remedia.cz/photo-a-31316---.jpg)
Podíl nežádoucích příhod posuzovaných v možné souvislosti s podáním studijní medikace činil 15 % v aktivní skupině a 4 % ve skupině s placebem. Nejčastěji byly hlášeny: orální pruritus, podráždění hrdla, svědění jazyka, svědění v oblasti ušní. Vyšší podíl dětí byl zaznamenán ve skupině se SLIT (n = 244, 61 %), menší v placebové skupině (n = 95, 23 %). Většina nežádoucích příhod byla hodnocena jako intenzity velmi mírné (74 %) nebo mírné (23 %). U dvou nejčastěji hlášených nežádoucích událostí spojených se studijní medikací (orální pruritus a podráždění hrdla) byl celkový medián nástupu jeden den (den prvního příjmu studijní medikace). Průměrný počet dnů od začátku příhody až do té doby, kdy se již nežádoucí příznak nevyskytl, činil 14,5 dne pro orální pruritus a 5 dní pro podráždění krku ve skupině se SLIT.
V průběhu studie nedošlo k žádnému úmrtí, žádné události nebyly hlášeny jako závažné systémové alergické reakce.
Pouze 7 závažných nežádoucích příhod bylo uvedeno jako v možné souvislosti se studijní medikací (jedno dítě v placebové skupině: diabetes mellitus 1. typu; 6 dětí ve skupině se SLIT: dyspnoe, generalizované tonicko klonické záchvaty, astma, imunitní trombocytopenická purpura, anémie, abdominální bolest).
Diskuse
Alergická rinokonjunktivitida je uznávaným rizikovým faktorem pro rozvoj bronchiálního astmatu [3]. Příčinná léčba alergické rinitidy by tak mohla představovat atraktivní způsob prevence astmatu u rizikových jedinců [8,10,11]. Grazax Asthma Prevention je první velkou randomizovanou, dvojitě zaslepenou, placebem kontrolovanou studií se zaměřením na prevenci astmatu s užitím AIT. Vhodný konsenzus pro obecně použitelný diagnostický algoritmus k identifikaci astmatických dětí v rané fázi onemocnění je stále oblastí odborných diskusí. Kritéria diagnostiky astmatu používaná ve studii GAP se do značné míry opírala o prokázání reverzibilní plicní obstrukce vyhodnocené třemi definovanými způsoby: hlášení příznaků astmatu a změny hodnoty FEV1 ≥ 12 % po podání β2 agonisty, pozorované sípání, které se zmírnilo při léčbě astmatu; nebo pozorované sípání a změny hodnoty FEV1 ≥ 12 % po podání β2 agonisty.
Dle těchto kritérií bylo ve studii GAP u 73 dětí diagnostikováno astma, ale ne všechny děti měly následně příznaky astmatu během hodnocení nebo následného dvouletého sledovacího období či v závěru studie. Údaje získané ve studii ukazují, že nástup astmatu není dichotomickou událostí „ano/ne“, ale spíše dynamickým procesem příznaků s vazbou na léčbu a režimová opatření. U řady dětí ve studii nebylo prokázáno astma dle definovaných kritérií, přesto však vykazovaly symptomy astmatu. Diagnóza astmatu nemůže být založena na jednom časovém bodu vyšetření, objektivnější je kombinované klinické hodnocení získané během delšího období [1,2]. Podle protokolu studie a definovaných diagnostických kritérií pro vznik astmatu studie GAP neprokázala vliv SLIT s extraktem pylu bojínku lučního na časový bod vzniku astmatu. Avšak při vyhodnocení symptomů astmatu a užití léčby na astmatické příznaky dokladovala studie konzistentní příznivý efekt AIT. Tento účinek byl patrný jak během kontrol v období pylové sezony trav, tak v zimním období, a v průběhu studie se rovněž dále prohluboval. Podíl dětí hlásících symptomy astmatu byl nižší v aktivní skupině jak v průběhu tříleté léčby, tak v následujících dvou letech bez léčby [9,13].
Léčba AIT byla tedy účinná jak na příznaky ARC, tak pro omezení symptomů astmatu. Včasné nasazení AIT významně ovlivnilo tíži alergického bronchiálního astmatu. Užití extraktu pylu bojínku lučního ve formě tablet prokázalo statisticky významné zmírnění příznaků ARC o 22‒30 % ve srovnání s placebem (p < 0,002) během tříleté léčby a v následujících dvou letech. S vazbou na zmírnění příznaků se v aktivní skupině snížila i spotřeba medikace o 27 % ve srovnání s placebovou skupinou v závěru studie (p < 0,001).
Výsledky dvojitě zaslepené studie GAP nepřímo podporují i výsledky různých otevřených studií či sledování [6]. Účinnost AIT na prevenci příznaků astmatu byla dokladována retrospektivní studií [14]. Jednalo se o rozsáhlou kohortovou studii dětských pacientů s alergickou rýmou, ale bez diagnózy astmatu (n = 118 754). Pacienti léčení AIT (n = 2 431) měli nižší riziko astmatu (definované symptomy a 2 a více předpisy inhalačních kortikosteroidů) ve srovnání s pacienty, kteří byli bez aplikace AIT (OR 0,60; 95% CI [interval spolehlivosti] 0,42‒0,84) ve sledovaném úseku 5 let od ukončené imunoterapie. Skupina s AIT byla primárně léčena subkutánní imunoterapií. Pouze 10 pacientů v analýze bylo léčeno sublinguální imunoterapií SQ T, neboť sledování bylo provedeno krátce po schválení přípravku regulačními orgány. Žádný z těchto 10 pacientů neměl astma v následném období v letech 2007‒2012. Autoři uvádějí, že AIT v rutinní péči se může podílet až na 40% snížení rizika vzniku astmatu u pacientů s alergickou rýmou.
V další studii dospělých pacientů, která zkoumala dlouhodobý účinek SLIT pomocí tablet SQ s travním extraktem (Grazax), bylo průměrné skóre symptomů ARC sníženo o 25‒36 % v aktivní skupině. Jednalo se o tříletou kontinuální léčbu a následné dvouleté sledování [15]. Účinek modifikující chorobu (disease modifying effect, DME), který přetrvával i po ukončené léčbě a byl prokázán ve studii GAP, je v souladu s výsledky předchozích studií s dospělými alergiky.
Závěr
Léčba SLIT s extraktem pylu bojínku lučního významně redukovala příznaky astmatu a antiastmatickou léčbu v populaci alergických dětí. Účinek léčby přetrvával i po ukončení terapie bez ohledu na zimní období či období pylu trav. Klinické nálezy byly dokladovány paralelně s imunologickými nálezy, kdy děti v aktivní skupině měly nižší celkovou a specifickou hodnotu IgE protilátek a měly sníženou reaktivitu na pyl trav v kožním prick testu ve srovnání s placebovou skupinou. Klinické údaje, které se týkaly bezpečnosti, potvrdily již známý bezpečnostní profil přípravku Grazax.
Tento dokladovaný efekt prokázal imunomodulační účinek AIT a jednoznačně posouvá tuto léčbu od terapie zaměřené na příznaky k terapii, která modifikuje alergické onemocnění k nižší tíži ARC a alergického astmatu. Rozsáhlou a dlouhodobou studii GAP lze hodnotit jako průlomovou, neboť přinesla přesvědčivé argumenty o pozitivním účinku včasného užití AIT v dětské populaci. Studie dokladovala DME, který je v současné době v odborné literatuře hojně diskutován [5,8,16]. V roce 2016 nastala významná změna v přístupu k alergickému astmatu, neboť do mezinárodního dokumentu GINA (Globální iniciativa pro astma) byla nově do stupňovité léčby astmatu zařazena alergenová imunoterapie SQ tabletami s obsahem alergenu roztočů. Domnívám se, že studie GAP přinesla racionální argumenty pro zařazení AIT s extrakty pylu trav do téhož segmentu léčby astmatu. Ostatně v klinických praxích imunologů/alergologů to již více let takto vnímáme.
Seznam použité literatury
- [1] Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention 2016. Dostupné na: http://www.ginaasthma.org [navštíveno 16. 8. 2016]
- [2] Bacharier LB, Boner A, Carlsen KH, et al. Diagnosis and treatment of asthma in childhood: a PRACTALL consensus report. Allergy 2008; 63: 5–34.
- [3] Bousquet J, Schunemann J, Samolinski B, et al. Allergic Rhinitis and its Impact on Asthma (ARIA). J Allergy Clin Immunol 2012; 130: 1049–1062.
- [4] Jacobsen L. Preventive aspects of immunotherapy: prevention for children at risk of developing asthma. Ann Allergy Asthma Immunol 2001; 87: 43–46.
- [5] Holt PG, Sly PD, Sampson HA, et al. Prophylactic use of sublingual allergen immunotherapy in high‑risk children: A pilot study. J Allergy Clin Immunol 2013; 132: 991–993.
- [6] Pajno GB, Barberio G, de Luca F, et al. Prevention of new sensitizations in asthmatic children monosensitized to house dust mite by specific immunotherapy. A six‑year follow‑up study. Clin Exp Allergy 2001; 31: 1392–1397.
- [7] Jacobsen L, Niggemann B, Dreborg S, et al. Specific immunotherapy has long‑term preventive effect of seasonal and perennial asthma: 10‑year follow‑up on the PAT study. Allergy 2007; 62: 943–948.
- [8] Moller C, Dreborg S, Ferdousi HA, et al. Pollen immunotherapy reduces the development of asthma in children with seasonal rhinoconjunctivitis (the PAT‑study). J Allergy Clin Immunol 2002; 109: 251–256.
- [9] Valovirta E, Petersen TH, Piotrowska T, et al. Results from the 5‑year SQ grass SLIT‑tablet asthma prevention (GAP) trial in children with grass pollen allergy. J Allergy Clin Immunol. doi:10.1016/j.jaci.2017.06.014
- [10] Larsen JN, Broge L, Jacobi H. Allergy immunotherapy: the future of allergy treatment. Drug Discov Today 2016; 21: 26–37.
- [11] Niggemann B, Jacobsen L, Dreborg S, et al. Five‑year follow‑up on the PAT study: specific immunotherapy and long‑term prevention of asthma in children. Allergy 2006; 61: 855–859.
- [12] British Thoracic Society and Scottish Intercollegiate Guidelines Network. British guideline on the management of asthma 2016: 1–214.
- [13] Dahl R, Roberts G, de Blic J, et al. SQ grass sublingual allergy immunotherapy tablet for disease‑modifying treatment of grass pollen allergic rhinoconjunctivitis. Allergy Asthma Proc 2016; 37: 92–104.
- [14] Schmitt J, Schwarz K, Stadler E, Wustenberg EG. Allergy immunotherapy for allergic rhinitis effectively prevents asthma: Results from a large retrospective cohort study. J Allergy Clin Immunol 2015; 136: 1511–1516.
- [15] Durham SR, Emminger W, Kapp A, et al. SQ‑standardized sublingual grass immunotherapy: Confirmation of disease modification 2 years after 3 years of treatment in a randomized trial. J Allergy Clin Immunol 2012; 129: 717–725.
- [16] Zolkipli ChZ, Roberts G, Cornelius V, et al. Randomized controlled trial of primary prevention of atopy using house dust mite allergen oral immunotherapy in early. J Allergy Clin Immunol 2015; 136: 1541–1547.