Regorafenib – postavení léčiva v současné běžné onkologické praxi
Souhrn:
Linke Z. Regorafenib – postavení léčiva v současné běžné onkologické praxi. Remedia 2018; 28: 370–376.
Regorafenib je multikinázový inhibitor domén receptorů pro proliferaci nádorových buněk (inhibice KIT, PDGFR, RET), inhibitor neoangiogeneze (inhibice VEGFR1‒3, TIE2, EGF podobná doména) a inhibitor nádorového mikroprostředí (inhibice FGFR, PDGFR). Aktuálně je používán jako standardní třetí linie terapie pokročilého gastrointestinálního stromálního tumoru, kde podle registrační studie GRID bylo dosaženo ve skupině pacientů s regorafenibem přežití bez známek progrese (PFS) 4,8 měsíce oproti skupině nemocných s placebem (0,9 měsíce). Zajímavým zjištěním byla účinnost regorafenibu bez závislosti na mutačním stavu tumoru (tj. podobný efekt i u nepříznivých mutací genu KIT exonu 9 či u nemutované wild type formy KIT). Druhou standardní indikací regorafenibu je pokročilý kolorektální karcinom po předchozí léčbě oxaliplatinou, fluoropyrimidiny, irinotekanem, po antiangiogenní terapii, u wild type RAS případů a také po anti‑EGFR terapii. U takto výrazně předléčených pacientů aplikace regorafenibu prodlužovala celkové přežití (OS) pacientů oproti placebové skupině jak v rámci registrační studie CORRECT (6,4 měsíce vs. 5,0 měsíce), tak v rámci asijské studie CONCUR (8,8 měsíce vs. 6,3 měsíce). Existují však i zajímavá data o účinnosti u pacientů s pokročilým hepatocelulárním karcinomem refrakterním na terapii sorafenibem, dále data o změnách OS u pacientů s pokročilým kolorektálním karcinomem léčených druhou paliativní linií terapie v závislosti na posloupnosti zahájení léčby regorafenibem oproti chemoterapii s cetuximabem. Probíhající klinické studie mají za cíl vyhodnotit efektivitu regorafenibu v léčbě pokročilého karcinomu žlučových cest, karcinomu pankreatu, karcinomu žaludku a gastroezofageální junkce.
Summary:
Linke Z. Regorafenib – role of the drug in the current real‑life oncological practice. Remedia 2018; 28: 370–376.
Regorafenib is a multi‑kinase cancer‑cell proliferation receptor domain inhibitor (inhibition of KIT, PDGFR, RET), angiogenesis inhibitor (inhibition of VEGFR1‒3, TIE2, EGF‑like domain) and tumor microenvironment inhibitor (inhibition of FGFR, PDGFR). Currently, it is used as a standard third line therapy of advanced gastrointestinal stromal tumor. According to the GRID registration study, progression free survival of 4.8 months was reached in the regorafenib group, compared with 0.9 months in the placebo group. Interestingly, the regorafenib efficacy was not dependent on the tumor mutation status (i.e, similar efficacy with adverse KIT gene exon 9 mutations and the wild‑type allele). Second standard indication fro regorafenib is advanced colorectal carcinoma after previous treatment with oxaliplatina, fluoropyrimidines, irinotekan, after anti‑angiogenic treatment, and after anti‑EGFR therapy in wild‑type RAS cases. In these highly pre‑treated patients, regorafenib significantly prolonged overall survival (OS) compared to the placebo group, both in the CORRECT registration study (6.4 months versus 5.0 months) and in the Asian CONCUR study (8.8 months versus 6.3 months). There are also important data about the efficacy in patients with advanced hepatocellular carcinoma refractory to sorafenib treatment as well as data about changes in OS in patients with advanced colorectal carcinoma treated with second palliative line of treatment, depending on the treatment initiation sequence with regorafenib compared with cetuximab chemotherapy. The aim of ongoing studies is to evaluate regorafenib efficacy in the treatment of advanced billiary tract cancer, pancreatic cancer, and gastric and esophageal junction cancer.
Key words: regorafenib, GRID study, CORRECT study, CONCUR study, gastrointestinal stromal tumor, advanced colorectal carcinoma
Charakteristika léčiva
Regorafenib (BAY 73 4506) je inhibitor tyrozinkinázových domén u celé řady receptorů, jeho chemické schéma je doloženo na obrázku 1. Tento multikinázový inhibitor blokuje celou řadu tyrozinkinázových domén – proliferaci nádorových buněk (inhibice KIT, PDGFR4 [receptoru pro destičkový růstový faktor] a protoonkoge
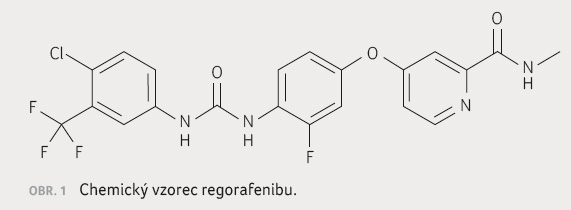
nu RET), neoangiogenezi (VEGFR 1–3 [receptoru vaskulárního endoteliálního růstového faktoru], TIE2 [rozpustné tyrozinkinázy s doménou podobnou imunoglobulinu a epidermálnímu růstovému faktoru]) a inhibuje nádorové mikroprostředí (FGFR [receptor pro fibroblastový růstový faktor], PDGFRβ).
Přehled základních klinických studií u pokročilých nádorů s využitím regorafenibu
V rámci preklinických zkoušení regorafenibu byly prezentovány výsledky aplikace u lidských linií gastrointestinálního stromálního tumoru, kolorektálního karcinomu, karcinomu ledviny a ovaria a hepatocelulárního karcinomu [1,2]. První klinické studie fáze I byly prezentovány u pacientů s pokročilým kolorektálním karcinomem, karcinomem ovaria, karcinomem ledviny, s osteosarkomem, s pokročilými sarkomy měkkých tkání a s maligními melanomy [3].
V rámci léčby pokročilého
gastrointestinálního stromálního tumoru (GIST) refrakterního
na imatinib a sunitinib byl regorafenib použit poprvé
v klinické studii fáze II [4], kde u 33 pacientů
proběhlo vyhodnocení klinického prospěchu (nemocní s kompletní
a parciální remisí a se stabilizací choroby). Medián
trvání přežití bez progrese (progression free
survival, PFS) dosáhl 13 měsíců, celkové přežití (overall
survival, OS) 27 měsíců; 75 % pacientů mělo z léčby
klinický prospěch. Zásadní prací u multirezistentního GIST
se stala klinická studie fáze III GRID [5]. V tomto dvojitě
zaslepeném hodnocení u celkem 199 zařazených subjektů byly
výsledky PFS signifikantně zlepšeny v rameni s regorafenibem
oproti rameni s placebem – 4,8 měsíce vs. 0,9 měsíce
(graf 1), rovněž
mediá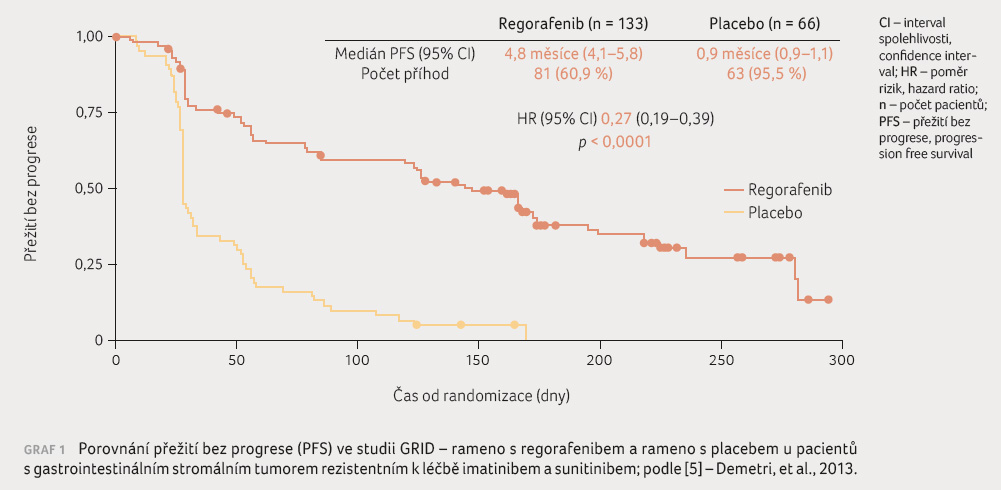 n trvání léčby byl delší v rameni s regorafenibem
oproti rameni s placebem – 22,9 týdne oproti 7,0 týdne.
Více než 85 % pacientů využilo tzv. cross over
z placeba na regorafenib. Pacienti převedení
z podávání placeba na léčbu regorafenibem opět
dosáhli zajímavé hodnoty PFS 5,0 měsíce prakticky identické
s PFS u pacientů primárně léčených aktivním
regorafenibem do první progrese. V rameni s regorafenibem
bylo dosaženo kontroly choroby u 52,6 % pacientů
a v placebovém rameni pouze u 9,1 % pacientů.
n trvání léčby byl delší v rameni s regorafenibem
oproti rameni s placebem – 22,9 týdne oproti 7,0 týdne.
Více než 85 % pacientů využilo tzv. cross over
z placeba na regorafenib. Pacienti převedení
z podávání placeba na léčbu regorafenibem opět
dosáhli zajímavé hodnoty PFS 5,0 měsíce prakticky identické
s PFS u pacientů primárně léčených aktivním
regorafenibem do první progrese. V rameni s regorafenibem
bylo dosaženo kontroly choroby u 52,6 % pacientů
a v placebovém rameni pouze u 9,1 % pacientů.
Dále bylo do další klinické
studie [6] zařazeno 36 nemocných s pokročilým
hepatocelulárním karcinomem třídy A podle Childovy‒Pughovy
klasifikace s dosaženým mediánem OS 13,8 měsíce
a s mediánem PFS 4,3 měsíce. Další probíhající
studie hodnotí účinnost regorafenibu po selhání sorafenibu
u hepatocel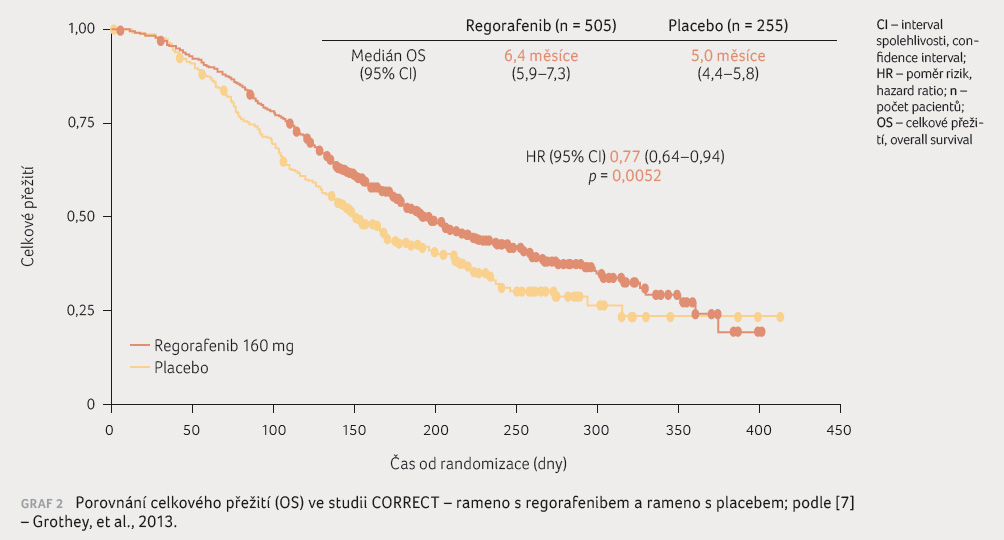 ulárního karcinomu (NCT01774344) či účinnost
regorafenibu u pokročilého karcinomu žlučových cest
(NCT02115542), u pokročilého karcinomu pankreatu (NCT02080260)
nebo u gastroezofageálních karcinomů (NCT01913639).
ulárního karcinomu (NCT01774344) či účinnost
regorafenibu u pokročilého karcinomu žlučových cest
(NCT02115542), u pokročilého karcinomu pankreatu (NCT02080260)
nebo u gastroezofageálních karcinomů (NCT01913639).
Klinická studie fáze III CORRECT (graf 2) prokázala efektivitu regorafenibu v monoterapii u pacientů s vyčerpanou kauzální terapií kolorektálního karcinomu; bylo prokázáno signifikantní zlepšení OS v rameni s regorafenibem oproti komparačnímu rameni s placebem (6,4 měsíce vs. 5,0 měsíce [7]) a PFS 1,9 měsíce vs. 1,7 měsíce. Podobně souběžně byla uspořádána studie CONCUR u identické pacientské populace v asijských centrech [8]. I v tomto hodnocení bylo dokumentováno zlepšení OS v rameni s regorafenibem oproti rameni s placebem (8,8 měsíce vs. 6,3 měsíce), stejně tak PFS (3,2 měsíce vs. 1,7 měsíce).
Z ostatních klinických studií s regorafenibem v časnějších liniích léčby pokročilého kolorektálního karcinomu lze zmínit sledování REVERCE [9] fáze II hodnotící posloupnost regorafenibu a chemoterapie s cetuximabem u pacientů s wild type RAS kolorektálním karcinomem předléčených první paliativní linií léčby (podmínkou bylo předléčení fluoropyrimidiny, oxaliplatinou nebo irinotekanem, přitom 95 % nemocných bylo předléčeno i bevacizumabem) – 1. rameno s posloupností regorafenib → cetuximab + chemoterapie versus 2. rameno s posloupností cetuximab + chemoterapie → regorafenib. Zajímavým zjištěním bylo prodloužení OS na 17,4 měsíce v rameni s posloupností regorafenib → chemoterapie s cetuximabem oproti 11,6 měsíce v rameni chemoterapie s cetuximabem → regorafenib (p = 0,0293). Další klinické studie hodnotí účinnost regorafenibu s chemoterapií FOLFOX (NCT01289821) či s chemoterapií FOLFIRI (NCT01298570). Rozsáhlá klinická studie fáze III COAST hodnotící adjuvantní indikaci regorafenibu u pacientů s pokročilým kolorektálním karcinomem po radikální jaterní metastazektomii neměla zatím prezentována data, nábor subjektů byl dokončen v říjnu 2017 – pacienti byli randomizováni do ramene s adjuvantní léčbou regorafenibem či do kontrolního ramene s placebem (NCT01939223).
Kazuistika pacienta s pokročilým metastatickým kolorektálním karcinomem léčeného regorafenibem
Pacient, ročník 1966, mužského pohlaví, nevykazoval pozitivitu rodinné onkologické anamnézy. Do doby diagnózy kolorektálního karcinomu netrpěl žádnými závažnými interními chorobami, s ničím se neléčil, v anamnéze byl záznam pouze o alergickém exantému po ampicilinu.
Od února 2010 začal pacient intermitentně pociťovat bolesti levé poloviny břicha a pro nově se objevivší nepravidelnosti stolice bylo indikováno endoskopické vyšetření tlustého střeva. Diagnostická kolonoskopie 4. 6. 2010 prokázala tumorózní stenózu v oblasti lienální flexury, pro endoskopický přístroj byla omezeně prostupná. Odebraná histologie prokázala přítomnost tubulárního adenokarcinomu se středním stupněm diferenciace a s frustní hlenotvorbou. Proto byl proveden urychlený úvodní staging, kde CT vyšetření ze dne 8. 10. 2010 prokázalo kromě primárního tumoru lienální flexury a ileózního stavu nad touto tumorózní překážkou i mnohočetná metastatická ložiska v počtu nad 10 nodulů v obou jaterních lalocích o velikosti 10–25 mm a zvětšení perihepatálních lymfatických uzlin. Další metastázy nebyly vyšetřením CT prokázány, přesto iniciální jaterní resekce nebyla indikována. Pro progredující ileózní stav byl pacient akutně operován – 8. 10. 2010 byla provedena břišní revize, axiální transverzostomie, peroperačně zhodnocen primární tumor, kde bylo potvrzeno jeho prorůstání do slinivky břišní a sleziny, dále mnohočetné jaterní metastázy se spotřebováním minimálně dvou třetin levého jaterního laloku metastatickým procesem. Vstupní hodnota onkologických markerů byla významně zvýšena – CEA (karcinoembryonální antigen) > 100 μg/l, CA 19 9 (tumorový marker) 88,5 kU/l. V průběhu první paliativní linie léčby byla 16. 7. 2010 potvrzena pozitivita receptoru pro epidermální růstový faktor (EGFR), ale následně 29. 7. 2010 mutace genu KRAS v kodonu 12 Cys.
Od 29. 6. 2010 byla u pacienta zahájena první paliativní linie chemoterapie FOLFOX, která byla ihned po 1. cyklu komplikována febrilní neutropenií s nutností aplikace antibiotik a růstových faktorů bílé krevní řady (G CSF). Proto od 2. cyklu byly růstové faktory bílé krevní řady aplikovány již profylakticky. Po vyhodnocení mutace KRAS a po schválení plátcem byla od 3. cyklu první paliativní linie léčby FOLFOX rozšířena o aplikaci bevacizumabu. Po 7. cyklu léčby prokázalo kontrolní CT vyšetření zmenšení perihepatální lymfadenopatie, velmi výrazné zmenšení metastáz jaterních při stejném počtu přibližně 10 nodulů, výraznou regresi primárního tumoru lienálního ohbí. Efekt byl hodnocen dle kritérií RECIST 1.1 jako výrazná parciální remise, nicméně operační řešení s ohledem na původní rozsah choroby nebylo nadále doporučeno – účinek léčby nebyl dle očekávání konverzní. Potvrzení parciální remise proběhlo během dalšího CT vyšetření 28. 12. 2010. I přes dobrý paliativní efekt první linie terapie muselo být podávání oxaliplatiny přerušeno z důvodu progredující periferní neuropatie zejména na dolních končetinách, a to po 15. cyklu terapie FOLFOX + bevacizumab (i po předchozí redukci dávky oxaliplatiny a zahájení podávání neuroprotektiv). Poslední oxaliplatina byla aplikována 14. 2. 2011, posléze v rámci pokračující první paliativní linie následovalo podávání kombinace kapecitabinu s bevacizumabem.
Takto bylo pokračováno dalšími 12 cykly až do 7. 11. 2011 s tím, že na kontrolním snímku PET/CT vyšetření byla konstatována PET kompletní remise a dle CT složky s intravenózním kontrastem bylo potvrzeno trvání výrazné parciální remise. Léčba kapecitabinem musela být kvůli atakám průjmu 2.‒3. stupně a hand‒foot syndromu 2.‒3. stupně přerušena, nicméně nadále bylo v rámci první paliativní linie pokračováno v aplikaci monoterapie bevacizumabem. V jejím průběhu proběhla opakovaná CT vyšetření s potvrzením trvání parciální léčebné odpovědi, naposledy dne 11. 6. 2012, ještě v červenci 2012 s tímto korelovaly negativní onkologické markery (CEA 2,9 μg/l). Právě onkologické markery však byly prvním signálem progrese během aplikace monoterapie bevacizumabem – dne 1. 10. 2012 byla zjištěna hodnota markeru CEA 12,57 μg/l, v téže době bylo provedeno PET/CT vyšetření, které opětovně prokázalo progresi – dvě metastázy v laterální části a v kupule pravého jaterního laloku a jedno metastatické ložisko v epigastriu, pravděpodobně v lymfatické uzlině. Opět byla diskutována chirurgická intervence a opět nebyla doporučena pro lokalizaci jaterních metastáz.
Proto i s ohledem na mutaci KRAS byla pacientovi nabídnuta účast v klinické studii druhé paliativní linie standardní chemoterapie FOLFIRI s dvojitě zaslepenou studijní medikací – tehdy se zkoušeným antiangiogenním léčivem anti VEGFR ramucirumabem – kontrolovanou placebem. Tato paliativní terapie byla započata 17. 10. 2012. Vstupní CT vyšetření prokazovalo tři metastázy jaterní o velikosti 19 mm × 15 mm, 12 mm × 15 mm a nejmenší ložisko 9 mm × 10 mm s centrální kalcifikací a primární tumor 26 mm × 54 mm v oblasti lienální flexury. V průběhu této linie terapie bylo již od 3. cyklu dne 4. 12. 2012 docíleno nepotvrzené výrazné parciální remise – primární tumor nebyl na CT detekován, největší jaterní metastáza se zmenšila na 9 mm × 8 mm, menší na 12 mm × 13 mm a nejmenší non target ložisko s centrální kalcifikací zůstalo bez velikostní změny. Parciální remise byla potvrzena v rámci následného CT vyšetření 29. 1. 2013 po 6. cyklu léčby a její trvání pak opakovanými CT vyšetřeními dle protokolu klinické studie bylo potvrzováno po 9., 12., 15., 18. i 24. cyklu léčby. Po krátkém přerušení bylo větší jaterní ložisko o velikosti 13 mm × 12 mm dne 8. 11. 2013 ošetřeno radiofrekvenční ablací, intervenční výkon nebyl nikterak komplikován. Po 33. cyklu studijní terapie druhé linie byla dle CT vyšetření ze dne 28. 2. 2014 potvrzena progrese podle kritérií RECIST (suma nejdelších rozměrů target lézí o 47 % větší oproti nejlepší léčebné odpovědi; bez detekce nových lézí). Proto byla tato chemoterapie FOLFIRI + ramucirumab/placebo z důvodu progrese nemoci ukončena.
Vzhledem k mutaci KRAS nebylo možno uvažovat o nasazení anti EGFR protilátek, na druhou stranu pro přítomnost pouze primárního tumoru a monoorgánového postižení metastázami (játra) byla opět zvážena možnost chirurgické resekce. Dne 8. 4. 2014 byla v Ústřední vojenské nemocnici v Praze provedena laparotomie. Peroperačně byla detekována mnohočetná drobná jaterní metastatická ložiska s maximem v pravém jaterním laloku, ale zamýšlená pravostranná hepatektomie nemohla být provedena kvůli nedostatečnému volumu levého jaterního laloku, který by nemohl funkci jater pooperačně kompenzovat. Proto bylo přistoupeno k metastazektomii největší jaterní metastázy (5 cm) v segmentu SVI jaterního laloku a posléze k postupné metastazektomii dalších menších subkapsulárně uložených metastáz. V „jedné době“ bylo následně pokračováno v resekci primárního tumoru lienální flexury s levostrannou hemikolektomií a anastomózou end to end. Histologicky byl prokázán dle očekávání středně diferencovaný cylindrocelulární adenokarcinom jak z největší jaterní metastázy v segmentu SVI, tak i v resekátu primárního tumoru slezinného ohbí. Další menší čtyři jaterní ložiska byla histologicky negativní stran nádoru, bylo prokázáno pouze hyalinní vazivo s částmi tkáňových nekróz. Výkon byl v pooperačním období komplikován vznikem periportálního abscesu, 18. 4. 2014 byla provedena drenáž abscesu pod CT kontrolou s desetidenní aplikací intravenózních antibiotik. Pooperačně byla zvažována po „radikální“ resekci metastatické choroby buď pooperační léčba s návratem k chemoterapii FOLFOX/XELOX, nebo pouhá observace.
Při kontrolním PET/CT vyšetření
ze dne 27. 5. 2014 byl však prokázán velmi rychlý
relaps nemoci (obr. 2).
V jaterní kupule byla nově detekována dvě silně PET
akumulující ložiska 15 mm a 13 mm, která byla technicky
nepřístupná radiofrekvenční ablaci i resekci, jak bylo
potvrzeno rentgenologem i chirurgem. Kvůli progresi choroby při
léčbě na bázi fluoropyrimidinů, oxaliplatiny, irinotekanu,
antiangiogenní biologické terapie bevacizumabem a z d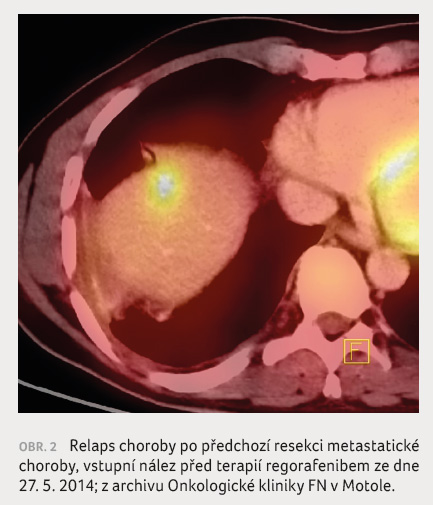 ůvodu
pouze měsíčního intervalu od metastazektomie do další
progrese byla logickým následným krokem aplikace regorafenibu.
Tehdy bylo možno zahájit léčbu regorafenibem po schválení
plátcem péče. Po tomto schválení úhrady přípravku
plátcem byla terapie regorafenibem zahájena 23. 6.
2014 v obvyklém dávkování – 160 mg 1× denně
1.‒21. den s následnou týdenní pauzou.
ůvodu
pouze měsíčního intervalu od metastazektomie do další
progrese byla logickým následným krokem aplikace regorafenibu.
Tehdy bylo možno zahájit léčbu regorafenibem po schválení
plátcem péče. Po tomto schválení úhrady přípravku
plátcem byla terapie regorafenibem zahájena 23. 6.
2014 v obvyklém dávkování – 160 mg 1× denně
1.‒21. den s následnou týdenní pauzou.
V průběhu prvních dvou cyklů
léčby regorafenibem se objevily jen nezávažné průjmy 1. stupně
a regorafenibem indukovaná, přechodná sekundární hypertenze
1. stupně bez nutnosti zavedení antihypertenzní terapie.
PET/CT vyšetření z 18. 8. 2014 prokázalo vymizení PET
hyperakumulace a dle CT složky tohoto vyšetření došlo
k jasnému zmenšení metastáz s jejich hraniční
detekcí. Léčebná odpověď byla hodnocena jako významná
parciální remise (obr. 3).
Před 4. cyklem léčby regorafenibem došlo k jejímu
odkladu a následně k redukci z důvodu výskytu
trombocytopenie 2. stupně a průjmu 2. stupně
s minimálním efektem podání loperamidu. Proto byl
od 4. cyklu regorafenib aplikován v dávce
120 mg/den.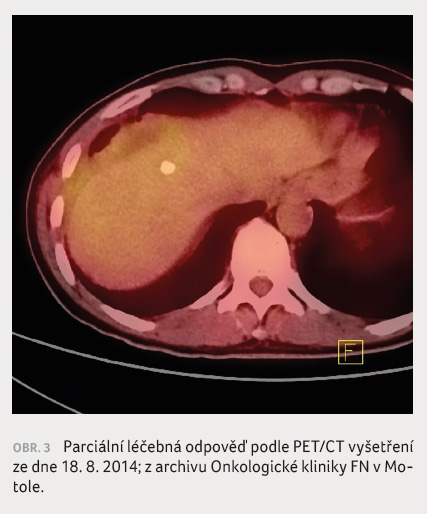
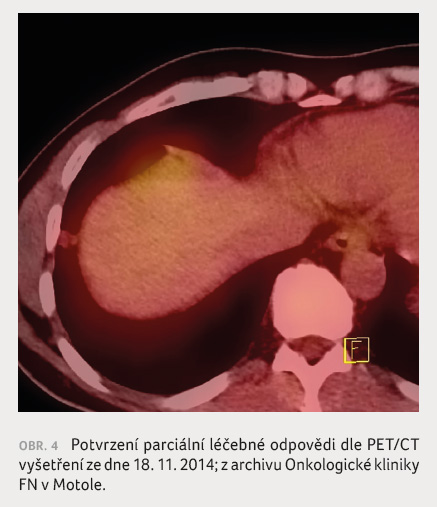
Po 5. cyklu léčby regorafenibem bylo opět opakováno PET/CT vyšetření (18. 11. 2014; obr. 4) a ani zde nebyla detekována progrese choroby, a to i přes jistý vzestup hodnoty onkologického markeru CEA. Ta se po celou dobu terapie regorafenibem pohybovala okolo 25 μg/l, po 5. cyklu se hodnota CEA náhle dvojnásobně zvýšila – na 47,2 μg/l. Nicméně terapie regorafenibem pokračovala na podkladě neprokázané progrese na zobrazovacích vyšetřeních. Tolerance terapie byla ze strany pacienta dobrá – kromě chronických průjmů 1.‒2. stupně byla zaznamenána asymptomatická hypokalemie a hypomagnezemie 1. stupně s účinnou perorální suplementací. Naopak hypertenze již nebyla detekována a obávaný a limitující hand‒foot syndrom nebyl po celou dobu terapie zaznamenán.
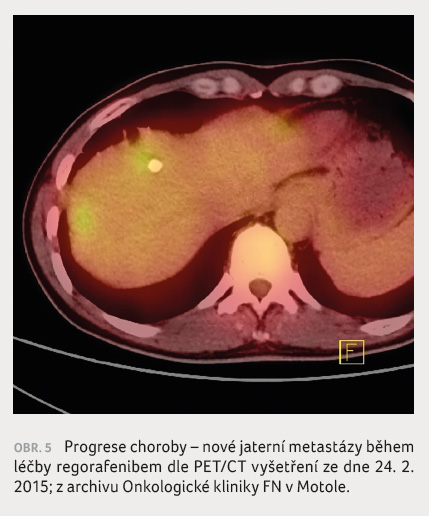
Sedmý cyklus terapie regorafenibem bylo nutno odložit o 10 dnů kvůli limitující trombocytopenii, a to i přes předchozí redukci dávky regorafenibu. Poslední, 7. cyklus léčby byl dokončen 24. 2. 2015 a právě tento den bylo provedeno další kontrolní PET/CT vyšetření, které bohužel opět prokázalo multifokální progresi jaterní. Bylo detekováno sedm ložisek hyperakumulace glukózy, jejichž velikost se pohybovala mezi 10–20 mm (obr. 5). Progresi nemoci odpovídal i další vzestup hodnoty onkomarkeru CEA na 85,8 μg/l. Tímto musela být konstatována progrese choroby při terapii regorafenibem, a tato terapie byla tedy po 7. cyklu ukončena.
Následně byla po vyčerpání standardní kauzální terapie pacientovi nabídnuta účast v klinické studii, kde byl klinicky zkoušen nový perorální tyrozinkinázový inhibitor nintedanib, komparátorem bylo placebo; další možností byl návrat k aplikaci salvage chemoterapie – oxaliplatiny. Byly aplikovány dva cykly perorálního nintedanibu/placeba v období mezi dubnem a květnem 2015 s další potvrzenou prim
ární progresí choroby, pacient byl tedy od června 2015 indikován k nejlepší podpůrné péči. Další pokusy o léčbu – znovuzahájení terapie oxaliplatinou – nemocný již odmítal, a navíc nastalo rychlé horšení jeho zdravotního stavu. K očekávanému úmrtí pacienta při terminálním jaterním selhání došlo 11. 8. 2015.
Celkově lze charakterizovat terapii regorafenibem u tohoto pacienta jako velmi dobře snášenou. Toxicita byla obvyklá a očekávaná, indukce průjmu, hypomagnezemie a hypokalemie byly bez komplikací zvládnuty suplementační medikací, trombocytopenie dosahovala maximálně 2. stupně. Naopak hand‒foot syndrom nebyl u tohoto pacienta detekován! Redukce dávky regorafenibu na 120 mg/den vedla ke zmírnění potíží za současného užívání podpůrné medikace. Pacient absolvoval celkem sedm cyklů terapie regorafenibem, výraznější odklad nastal až před 7. cyklem léčby, a to právě z důvodu výskytu trombocytopenie 2. stupně. Za velmi dobré kvality života nemocného bylo od srpna 2014 docíleno významné parciální remise, která trvala do počátku února 2015. Regorafenib byl u tohoto pacienta podáván více než osm měsíců a pravděpodobně významně prodloužil bezpříznakové období, a to u nemocného významně předléčeného systémovou chemoterapií.
Kazuistika pacienta s gastrointestinálním stromálním tumorem léčeného regorafenibem
Pacient, ročník 1946, mužského pohlaví, vykazoval pozitivitu rodinné onkologické anamnézy – jeho dcera byla operována a následně adjuvantně léčena z důvodu časného HER2 pozitivního adenokarcinomu prsu, v aktuální době trvá remise tohoto onemocnění. Další anamnéza byla s ohledem na výskyt malignit v rodině pacienta negativní.
Nemocný má ve své osobní anamnéze zaznamenán výskyt osteoporózy s prolomením krycí plotny 4. bederního obratle v roce 2008, kdy byl léčen pouze konzervativně, a dále v témže roce absolvoval 28. 4. 2008 implantaci náhrady 1. bederního obratle kvůli jeho borcení zapříčiněnému osteoporózou. Kromě tohoto absolvoval v roce 1978 operaci pravého kolenního menisku z důvodu poúrazových degenerativních změn, od roku 2003 je sledován pro pokročilé kloubní degenerace 3. stupně – koxartróza 3. stupně vpravo a gonartróza 3. stupně vpravo –, jejichž léčba probíhá jako konzervativní. V roce 1990 a 1999 prodělal vždy mírnou tranzitorní ischemickou mozkovou ataku s krátkodobým výpadkem zorného pole; příčinou těchto atak byla zjištěná stenóza karotid bilaterálně. Byl indikován ke konzervativní terapii bez operační intervence, při léčbě venofarmaky a acetylsalicylovou kyselinou se potíže už dále neobjevily. Z interních komorbidit pacient před diagnózou GIST netrpěl hypertenzí, diabetes mellitus, ischemickou chorobou srdeční, chorobami ledvin, štítné žlázy, neprodělal hepatitidu ani TBC.
Iniciálním příznakem choroby byly akutně vzniklé bolesti břicha v pravém dolním břišním kvadrantu dne 21. 8. 2009, k tomu se přidaly teploty, peritoneální symptomy a zvracení dne 22. 8. 2009, nález byl vyhodnocen jako suspektní perforační apendicitida. Proto byl nemocný dne 24. 8. 2009 akutně operován na regionálním chirurgickém oddělení v severočeské nemocnici. Peroperačně byla nalezena chronická apendicitida, ale také tumor v ileocekálním přechodu velikosti přibližně 6‒8 cm s drobnou perforací velikosti „špendlíkové hlavičky“ v místě jeho centrální ulcerace. Peroperačně nebyly zjištěny metastázy na omentu a peritoneu, nebyla nalezena suspektní lymfadenopatie, peroperační ultrasonografie jater nevykazovala suspekci na metastázy jaterní. Byla provedena resekce terminálního ilea, apendixu a slepého tračníku. Pooperačně byl pacient zajištěn intravenózním gentamicinem a metronidazolem. Histologicky byl potvrzen vřetenobuněčný tumor s minimální složkou epiteloidních buněk o velikosti 6 cm s drobnou perforací, bez prokazatelné angio a lymfangioinvaze, částečně prokrvácený a s fokálními výraznějšími buněčnými atypiemi, mitózy místy dosahovaly 6‒8/50 HPF (high power field). Apendix nebyl tumorem postižen, čtyři přilehlé lymfatické uzliny byly rovněž nádoru prosty. Imunohistochemické vyšetření tumoru bylo dokončováno na fakultní patologii, v jejímž rámci byla potvrzena vysoká a difuzní pozitivita receptoru c kit (CD117) a proteinu DOG 1. Další vyšetření CD34, S100 byla negativní. I na vyšším pracovišti patologie byla diagnóza GIST potvrzena, s ohledem na velikost tumoru více než 5 cm, na počet mitóz více než 5/50 HPF a na lokalizaci v kyčelníku byl tumor podle Fletcherovy i Miettinenovy klasifikace hodnocen jako vysokého stupně rizika agresivního chování (M8936/3).
Pooperačně pacient absolvoval úvodní stagingové vyšetření CT, které nepotvrdilo metastatickou chorobu, drobná jaterní ložiska do 5 mm v oblasti jater byla hodnocena jako jaterní cysty. V rámci klinické studie CSTI571JDE74 byla u pacienta od 8. 10. 2009 zahájena tehdy doporučovaná roční adjuvantní terapie imatinibem v dávce 400 mg/den perorálně. Tato terapie byla snášena velmi dobře – v jejím průběhu se u nemocného objevily mírné, při užívání imatinibu obvyklé periorbitální otoky 1. stupně. Kontrolní CT vyšetření ze dne 4. 1. 2010, 21. 6. 2010 a 6. 10. 2010 byla negativní stran průkazu metastatické nemoci a 6. 10. 2010 byla roční adjuvance imatinibem ukončena.
Dále byl pacient observován, CT vyšetření z 1. 4. 2011 bylo bez průkazu relapsu choroby. Pravidelné další CT vyšetření ze dne 24. 10. 2011 však prokázalo recidivu choroby – mnohočetné peritoneální a omentální metastázy do velikosti 20 mm. K relapsu tedy došlo po 13 měsících od skončené adjuvance imatinibem. Proto byla od 4. 11. 2011 znovu zahájena léčba imatinibem v dávce 400 mg/den v paliativní indikaci. Terapie byla opět kromě mírných periorbitálních otoků a průjmu 1. stupně tolerována velmi dobře a kontrolní CT vyšetření ze dne 2. 1. 2012 prokazovalo výraznou parciální remisi metastáz peritonea a omenta, ložiska byla sotva detekovatelná, největší dosahovalo 7 mm. Trvání parciální remise bylo potvrzeno na CT vyšetření ze dne 4. 5. 2012. Další vyšetření CT z 19. 9. 2012 však prokázalo nejednoznačné nové ložisko v epigastriu, a proto bylo indikováno dodatečně PET/CT vyšetření. Toto vyšetření bylo provedeno 20. 11. 2012 a potvrdilo progresi v podobě nových ložisek v intraabdominálním tuku a na peritoneu, dávka imatinibu byla z tohoto důvodu navýšena na 800 mg/den od 26. 11. 2012. Eskalace imatinibu nebyla doprovázena subjektivními potížemi ani výraznějšími laboratorními abnormalitami. Nicméně již první kontrolní vyšetření PET/CT během eskalace imatinibu na 800 mg/den z 25. 1. 2013 potvrdilo trvající progresi intraabdominálních tumorů na peritoneu, v omentu a v intraabdominálním tuku, největší ložisko dosahovalo 37 mm, a aplikace eskalovaného imatinibu byla ukončena dne 31. 1. 2013. Byla provedeno chirurgické konzilium a pokus o metastazektomii s ohledem na uložení a multifokalitu metastatického procesu nebyl doporučen.
Dne 4. 2. 2013 byla proto zahájena druhá linie paliativní léčby sunitinibem v dávce 50 mg/den 1.‒4. týden s následnou dvoutýdenní pauzou. Takto pacient absolvoval dva cykly léčby, poslední dávku sunitinibu užil 21. 4. 2013 a kontrolní PET/CT bylo provedeno 24. 4. 2013. Podávání sunitinibu bylo komplikováno obvyklými nežádoucími účinky – průjem, orální mukozitida, artralgie a myalgie, flu like příznaky, vše 1. stupně; hypertenze a hand‒foot syndrom nebyly zaznamenány. Ale již první kontrolní vyšetření PET/CT prokázalo fulminantní progresi – v břišní dutině přítomnost minimálně 10 tumorózních uzlů s PET vysokou akumulací, a to v intraabdominálním tuku, v pánvi, na peritoneu, na omentu, v mezenteriu – velikost metastáz 20–53 mm. Podávání sunitinibu muselo být ukončeno z důvodu primární progrese choroby, a to již po dvou cyklech, prognóza pacienta se zdála být krajně nepříznivá s velmi omezeným life expectancy.
Proto byla 10. 5. 2013 zahájena
třetí linie paliativní léčby regorafenibem v iniciální
dávce 160 mg/den 21 dnů s následnou sedmidenní pauzou
(v uvedené době prostřednictvím specifického léčebného
programu IDIS). V průběhu prvních dvou cyklů se objevily
obvyklé nežádoucí účinky – hypertenze 2. stupně,
hand‒foot syndrom 2. stupně, únava 2. stupně, orální
mukozitida 1. stupně, průjem 2. stupně. Kontrolní
PET/CT vyšetření z 27. 6. 2013 však prokázalo jasnou
regresi pozitivity na PET skenu, dle CT složky většina
ložisek regredovala, některá vymizela, hodnoceno klinikem jako PET
komplexní léčebná odpověď s parciální remisí dle CT
složky vyšetření. Z tohoto důvodu pacient absolvoval
s plnou dávkou regorafenibu ještě 3. a 4. cyklus
do 27. 8. 2013, ale poté byl 5. cyklus odložen
a redukován na dávku 120 mg/den 1.‒21. den
se sedmidenní pauzou kvůli progredujícímu hand‒foot
syndromu 3. stupně (obr. 6), nově se objevil i vomitus
1. stupně a mírná hypomagnezemie a hypokalemie.
Blokátory kalciových kanálů, antidiaroikum loperamid, salicylové
a kortikoidové masti a antihistaminika potíže pacienta
výrazně utlumily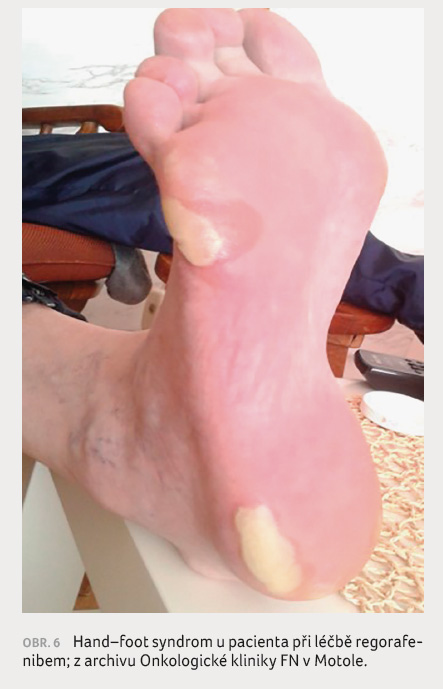 a pokračující cykly již nebylo třeba
odkládat či dále redukovat.
a pokračující cykly již nebylo třeba
odkládat či dále redukovat.
Kontrolní PET/CT vyšetření ze dne 31. 10. 2013 a 18. 12. 2013 opět prokázala trvání parciální remise dle CT složky a dle PET složky ústup aktivity v metastázách. V průběhu léčby byl pacient krátce hospitalizován na spádovém chirurgickém oddělení od 30. 1. 2014 do 2. 2. 2014 pro subileózní stav se spontánní úpravou, příčinou byla nejspíše dietní chyba. Za trvající velmi dobré tolerance bylo provedeno kontrolní PET/CT vyšetření dne 19. 3. 2014, kde bylo potvrzeno trvání parciální remise, jen největší ložisko bylo izolovaně o 4 mm větší, nová ložiska či nová PET akumulace nebyla potvrzena. Identický nález se objevil i na dalších PET/CT vyšetřeních v průběhu pokračování léčby regorafenibem – 16. 5. 2014 po 13. cyklu regorafenibu a 15. 8. 2015 po 16. cyklu regorafenibu. Po 19. cyklu léčby regorafenibem bylo provedeno opět PET/CT vyšetření 6. 11. 2014; tentokrát při stejných rozměrech intraabdominálních tumorů se v některých opět nově objevila velmi mírná PET akumulace radiofarmaka, ale dle kritérií RECIST bylo toto vyšetření vyhodnoceno jako trvání parciální remise.
Proto pacient pokračoval v aplikaci regorafenibu až do 22. cyklu, do 3. 2. 2015. V pauze mezi 22. a potencionálním 23. cyklem léčby bylo provedeno PET/CT vyšetření dne 11. 2. 2015. Tentokrát však již byla potvrzena významná progrese choroby; stávající tumory se zvětšily, významně se zvýšila jejich PET akumulace, ojediněle i nová ložiska, celkově bylo detekováno přibližně 14 intraabdominálních tumorů. Proto byla terapie regorafenibem kvůli progresi choroby po 22 cyklech ukončena.
Následně byl požádán plátce péče o uhrazení jistě kontroverzní léčby imatinibem (koncepce „Glivec po Glivecu“), která má omezená data o účinnosti znovuzahájené terapie tímto léčivem. Dále byla systémová terapie GIST vyčerpána. K úhradě tohoto typu léčby nebyl dle očekávání vydán plátcem péče souhlas. Následně byl pacient indikován k nejlepší podpůrné léčbě, postupně docházelo k progresi algického syndromu, k rozvoji koagulopatie a jaterní insuficience a dne 4. 1. 2016 pacient zemřel.
Celkově lze charakterizovat terapii regorafenibem u tohoto nemocného jako velmi dobře snášenou. Toxicita byla obvyklá a očekávaná, indukce hypertenze, průjmu, hypomagnezemie a hypokalemie byla bez komplikací zvládnuta zahájenou medikací, hand‒foot syndrom limitoval pokračování podávání regorafenibu v plné dávce, ale její mírná redukce na 120 mg/den vedla ke zmírnění potíží za současného užívání podpůrné medikace. Pacient absolvoval celkem 22 cyklů terapie regorafenibem s minimálními odklady, léčba trvala 22 měsíců. Za velmi dobré kvality života nemocného bylo od června 2013 docíleno parciální remise onemocnění, která trvala do února 2015, tj. 20 měsíců. Regorafenib dozajista u tohoto pacienta významně prodloužil přežití a bezpříznakové období choroby. Je rovněž nutno podotknout, že délka trvání efektu terapie regorafenibem u tohoto nemocného byla výrazně delší než účinnost sunitinibu v druhé paliativní indikaci (tři měsíce), ale byla též delší než celá první linie paliativní terapie imatinibem včetně jeho eskalace (19 měsíců).
Aktuální výsledky činí z regorafenibu léčivo, které je jednoznačně indikováno pro léčbu pacientů s pokročilým GIST s předchozí progresí při terapii imatinibem i sunitinibem. Jeho výhodou je účinnost v léčbě bez ohledu na mutační stav receptoru c kit.
Seznam použité literatury
- [1] Schmieder R, Hoffmann J, Becker M, et al. Regorafenib (BAY 73‑4506) antitumor and antimetastatic activities in preclinical models of colorectal cancer. Int J Cancer 2014; 135: 1487‒1496.
- [2] Carr BI, Cavallini A, Lippolis C, et al. Fluoro‑Sorafenib (Regorafenib) effects on hepatoma cells growth inhibition, quiscence, and recovery. J Cell Physiol 2013; 228: 292‒297.
- [3] Mross K, Frost A, Steinbild S, et al. A phase I dose‑escalation study of regorafenib (BAY 73‑4506), an inhibitor of oncogenic, angiogenic, and stromal kinases, in patients with advanced solid tumors. Clin Cancer Res 2012; 18: 2658‒2667.
- [4] George S, Feng Y, von Mehren M, et al. Prolonged survival and disease control in the academic phase II trial of regorafenib in GIST: response on genotype. ASCO Meet Abstr 2013; 31: 10511.
- [5] Demetri GD, Reichardt P, Kang YK, et al. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo‑controlled, phase 3 trial. Lancet 2013; 381: 295‒302.
- [6] Bruix J, Tak WY, Gasbarrini A, et al. Regorafenib as second line therapy for intermediate or advanced hepatocelullar carcinoma: multicentre, open‑label, phase II safety study. Eur J Cancer 2013; 49: 3412‒3419.
- [7] Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal Cancer (CORRECT); an international, multicentre, randomized, placebo‑controlled, phase 3 trial. Lancet 2013; 338: 303‒312.
- [8] Li J, Qin S, Yau T, et al. CONCUR: a randomised, double‑blind, placebo‑controlled phase 3 study of regorafenib monotherapy in Asian patients with previously treated metastatic colorectal cancer (mCRC). Ann Oncol 2014; 225(Suppl 2): ii114‒i115.
- [9] Shitara K, Yanmanaka T, Denda T, et al. REVERCE: Randomized phase II study of regorafenib followed by cetuximab versus the reverse sequence for metastatic colorectal cancer patients previously treated with fluoropyrimidine, oxaliplatin, and irinotecan. J Clin Oncol 2018; 36(Suppl 4): 557.