Rychlý a dlouhodobě přetrvávající efekt anti-TNF léčby u širokého spektra pacientů Komentář ke studii REALISTIC
Certolizumab je humanizovaná monoklonální protilátka proti TNF-a, která na rozdíl od infliximabu a adalimumabu neobsahuje Fc část. Účinnost certolizumab pegolu (CZP) byla prokázána u širokého spektra pacientů s revmatoidní artritidou. REALISTIC byla studií fáze IIIb, jejímž cílem bylo posoudit účinnost CZP v klinickém sledování blížícím se běžné klinické praxi. Do studie byli zařazeni pacienti s nedostatečnou odpovědí na léčbu DMARDs (chorobu modifikující antirevmatické léky) a nebo anti-TNF v minulosti. Většina pacientů byla léčena kombinací CZP plus DMARDs, ale 20 % dostávalo monoterapii CZP.
Primárním cílem studie bylo dosažení odpovědi ACR 20 (20% zlepšení dle kritérií American College of Rheumatology). Tohoto cíle bylo dosaženo – účinnost CZP představovala 51,1 % vs. 25,9 % po podávání placeba. Významného zlepšení bylo dosaženo již po dvou týdnech léčby. Nebyl zjištěn signifikantní rozdíl v účinnosti u pacientů, kteří v minulosti byli nebo nebyli léčeni anti-TNF preparáty. Léčba CZP byla dobře tolerována a výskyt závažných nežádoucích účinků se statisticky nelišil od placeba. Lokální tolerance léčby byla velmi dobrá.
CZP je novým anti-TNF preparátem s rychlým nástupem účinku, setrvalým efektem, ovlivněním rentgenové progrese a s přijatelným bezpečnostním profilem.
Úvod
Bi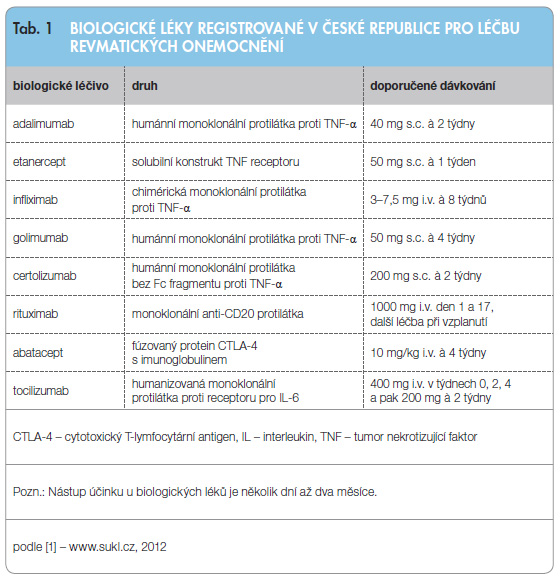 ologická léčba revmatoidní artritidy (RA) zcela zásadně zlepšila výsledky terapie tohoto závažného chronického autoimunitního onemocnění. Registrované biologické léky se dají rozdělit na skupinu léků blokujících hlavní prozánětlivý cytokin – tumor nekrotizující faktor alfa (TNF-a) – a na skupinu s jiným mechanismem účinku (tab. 1). První anti-TNF léky byly zavedeny do klinické praxe před 13 lety, takže klinické zkušenosti s jejich aplikací jsou dnes obrovské a počty léčených pacientů dnes již dosahují milionů. Nejdůležitější data o účinnosti poskytly randomizované, dvojitě slepé klinické studie, které jsou základem medicíny založené na důkazech a stále představují zlatý standard při průkazu účinnosti. Velmi cenná data pak poskytují registry biologické léčby, které jsou naopak důležitější při průkazu především dlouhodobé bezpečnosti.
ologická léčba revmatoidní artritidy (RA) zcela zásadně zlepšila výsledky terapie tohoto závažného chronického autoimunitního onemocnění. Registrované biologické léky se dají rozdělit na skupinu léků blokujících hlavní prozánětlivý cytokin – tumor nekrotizující faktor alfa (TNF-a) – a na skupinu s jiným mechanismem účinku (tab. 1). První anti-TNF léky byly zavedeny do klinické praxe před 13 lety, takže klinické zkušenosti s jejich aplikací jsou dnes obrovské a počty léčených pacientů dnes již dosahují milionů. Nejdůležitější data o účinnosti poskytly randomizované, dvojitě slepé klinické studie, které jsou základem medicíny založené na důkazech a stále představují zlatý standard při průkazu účinnosti. Velmi cenná data pak poskytují registry biologické léčby, které jsou naopak důležitější při průkazu především dlouhodobé bezpečnosti.
Biologická léčba
V čem se tedy biologická léčba odlišuje od konvenční léčby RA např. chemickými DMARDs (disease-modifying anti-
rheumatic drugs – chorobu modifikující antirevmatické léky), jako je metotrexát (MTX)? Anti-TNF léčba již byla navržena po lepším pochopení patogeneze RA, takže se jedná již o léčbu cílenou na určitou molekulu, kterou je v tomto případě cytokin TNF-α. Účinnost anti-TNF léčby je tedy podstatně mohutnější a rychlejší, což se projevuje jak na úrovni subjektivních příznaků (bolest, ztuhlost, funkce, kvalita života), tak na úrovni laboratorní (např. CRP, sedimentace). Anti-TNF preparáty kromě ovlivnění zánětlivé aktivity zpomalují až zastavují rentgenovou progresi RA. R![Obr. 1 Schéma konceptu Léčba k cíli (Treat to target – T2T); podle [2] – Smolen, et al., 2010.](https://www.remedia.cz/photo-a-29220---.jpg) entgenová progrese je spojena s narůstající ireverzibilní disabilitou, takže zásadní zpomalení rentgenové progrese znamená pro pacienta zlepšení vyhlídek na udržení funkčních schopností a např. možnosti pracovat.
entgenová progrese je spojena s narůstající ireverzibilní disabilitou, takže zásadní zpomalení rentgenové progrese znamená pro pacienta zlepšení vyhlídek na udržení funkčních schopností a např. možnosti pracovat.
Též do běžné klinické praxe se šíří používání validizovaných kompozitních skórovacích systémů, jako je např. DAS28 (Disease Activity Score), CDAI (Clinical Disease Activity Index) nebo SDAI (Simplified Disease Activity Index), které nejlépe hodnotí celkovou aktivitu RA a také úspěšnost terapeutické intervence. Pravidelné měření aktivity RA je také základem konceptu Léčba k cíli (Treat to target – T2T) [2], viz obr. 1. Cílem léčby pacienta by mělo být navození klinické remise. Tato může být definována jako DAS28 < 2,6 a tohoto cíle by mělo být dosaženo u každého pacienta v intervalu 3–6 měsíců od zahájení léčby. U pacientů s dlouhodobým trváním léčby je akceptabilní i dosažení stavu nízké aktivity onemocnění (low disease activity, LDA < 3,2).
Podávání anti-TNF léčby
Anti-TNF preparáty jsou indikovány dle Doporučení EULAR (The European League Against Rheumatism) [3] a ČRS (Česká revmatologická společnost) [4] pro léčbu aktivní RA nedostatečně reagující na podání alespoň jednoho DMARD, kterým by měl být v první řadě MTX, a to v dávce alespoň 25 mg podávané po dobu 3–6 měsíců. Prahová aktivita RA pro podávání anti-TNF léčby byla snížena z DAS28 = 5,1 na 3,9. Anti-TNF léčba by tedy měla být podávána u pacientů s vysokou aktivitou onemocnění, s nedostatečnou odpovědí na MTX a s negativními prognostickými ukazateli relativně časně. Při časném podání anti-TNF léčby je také nejvyšší naděje na docílení remise. Anti-TNF léčbu je možné podávat v monoterapii nebo v kombinaci s MTX, přičemž kombinační léčba je účinnější než monoterapie.
Certolizumab pegol
Certolizumab pegol (CZP) je anti-TNF preparátem druhé generace. Je to monoklonální protilátka, která neutralizuje ![Obr. 2 Tři různé způsoby inhibice TNF-a: fúzovaný protein, monoklonální protilátky a PEGylovaný Fab´ fragment; podle [5] – Weir, et al., 2006.](https://www.remedia.cz/photo-a-29221---.jpg) TNF-a. Jedná se o Fab fragment humanizované protilátky proti TNF-a, která na rozdíl od infliximabu a adalimumabu neobsahuje Fc část (obr. 2). Vazba polyethylenglykolu (PEG) zajištuje dlouhý biologický poločas a přispívá k preferenční distribuci v zánětlivě změněné tkáni. Vzhledem ke skutečnosti, že CZP neobsahuje Fc fragment, nedochází k fixaci komplementu. Nedochází také k apoptóze monocytů či lymfocytů z periferní krve a nenastává degranulace neutrofilů.
TNF-a. Jedná se o Fab fragment humanizované protilátky proti TNF-a, která na rozdíl od infliximabu a adalimumabu neobsahuje Fc část (obr. 2). Vazba polyethylenglykolu (PEG) zajištuje dlouhý biologický poločas a přispívá k preferenční distribuci v zánětlivě změněné tkáni. Vzhledem ke skutečnosti, že CZP neobsahuje Fc fragment, nedochází k fixaci komplementu. Nedochází také k apoptóze monocytů či lymfocytů z periferní krve a nenastává degranulace neutrofilů.
Zásadními studiemi, které prokázaly účinnost certolizumabu u RA, byly studie RAPID 1 a RAPID 2 [6, 7]. Obě studie doložily účinnost certolizumabu v kombinaci s MTX u pacientů s nedostatečnou odpovědí na MTX. Studie RAPID 1 byla prováděna s lyofilizovanou formou a studie RAPID 2 s formou tekutou. Studie RAPID 1 a 2 přinesly některé nové poznatky. Obě ukázaly poměrně velmi rychlý nástup účinku certolizumabu, přičemž statisticky významných rozdílů bylo dosaženo již po jednom týdnu podávání. Časná odpověď po 12 týdnech byla také důležitým prediktivním faktorem pro získání odpovědi po jednom roce. Zpomalení rentgenové progrese bylo průkazné již po 16 týdnech
léčby. Třetí významnou studií je studie označená akronymem FAST4WORD, která prokázala účinnost certolizumabu v monoterapii u pacientů, u nichž došlo v minulosti k selhání léčby nejméně jedním DMARD [8].
Studie REALISTIC
S![Obr. 3 Design studie REALISTIC; podle [9] – Weinblatt, et. al., 2012.](https://www.remedia.cz/photo-a-29222---.jpg) tudie REALISTIC (RA EvALuation In Subjects receiving TNF Inhibitor Certolizumab pegol) byla studií fáze IIIb v trvání 12 týdnů. Cílem studie bylo hodnotit účinnost CZP v monoterapii nebo v kombinaci s DMARD u podskupin nemocných s předcházející léčbou anti-TNF preparáty nebo bez ní [9]. Design studie se tedy již blížil běžné klinické praxi (obr. 3).
tudie REALISTIC (RA EvALuation In Subjects receiving TNF Inhibitor Certolizumab pegol) byla studií fáze IIIb v trvání 12 týdnů. Cílem studie bylo hodnotit účinnost CZP v monoterapii nebo v kombinaci s DMARD u podskupin nemocných s předcházející léčbou anti-TNF preparáty nebo bez ní [9]. Design studie se tedy již blížil běžné klinické praxi (obr. 3).
Metodika studie
Bylo použito dávkování, které je již definitivně schváleno v SPC léčivého přípravku – CZP 400 mg v týdnu 0, 2 a 4 následované podáváním 200 mg každé dva týdny s.c. Ve druhé větvi studie dostávali pacienti placebo. Randomizace byla stratifikována podle předcházejícího používání anti-TNF léčby, současného používání MTX a podle délky trvání onemocnění. Primárním cílem bylo dosažení odpovědi ACR 20 (20% zlepšení dle kritérií American College of Rheumatology) v týdnu 12.
Do studie bylo zařazeno celkem 1063 pacientů, přičemž 400 (37,6 %) užívalo již dříve anti-TNF léčbu. Celkem 216 (20,3 %) pacientů dostávalo monoterapii CZP. Při podávání kombinované léčby CZP + DMARD se nejčastěji objevovala kombinace s MTX (52 %), leflunomidem (55,1 %) nebo se sulfasalazinem (56,9 %).
Výsledky studie
Primárního cíle bylo dosaženo, rozdíl mezi CZP (51,1 %) a placebem (25,9 %) byl statisticky významný a rovněž rozdíly v silnějších ukazatelích účinnosti, jako je ACR 50 a ACR 70 (50%, resp. 70% zlepšení dle kritérií American College of Rheumatology), byly statisticky významné. Nástup účinku CZP byl velmi rychlý a signifikantního zlepšení bylo po přidání CZP docíleno již po dvou týdnech léčby.
Při analýze podskupin byla míra odpovědi mírně vyšší u skupiny nemocných, kteří anti-TNF léčbu dosud nedostávali (tzv. anti-TNF naivní), než u skupiny, která již byla v minulosti léčena anti-TNF (v anglickém písemnictví jsou tito pacienti označováni jako anti-TNF failures). Rozdíl však nebyl statisticky signifikantní (53 % vs. 47 %). Tento fakt je nutné považovat za překvapivý, protože obecně je ze studií známo, že odpovědi ACR 20 bývá dosahováno u naivních pacientů častěji než u nemocných, u nichž anti-TNF léčba selhává (odpověď u anti-TNF naivních pacientů obvykle dosahuje 60–70 %, u anti-TNF failures kolem 50 % v dimenzích ACR 20).
Ve studii REALISTIC také nebyl zjištěn rozdíl v odpovědi mezi skupinou nemocných, u nichž selhala první anti-TNF léčba z důvodů neúčinnosti a z důvodů nežádoucích účinků. I tento nález je nutné považovat za překvapivý. Např. v britském registru biologické léčby byla dokumentována lepší účinnost druhého anti-TNF léku u nemocných, u nichž selhala první anti-TNF léčba kvůli nežádoucím účinkům, než u nemocných, u nichž k selhání léčby došlo z důvodů primární neúčinnosti prvního anti-TNF léku.
Ve studii REALISTIC také nebyl zaznamenán rozdíl v účinnosti mezi prvním, druhým, třetím a dalším anti-TNF přípravkem, přičemž většina registrů ovšem ukazuje na snížení účinnosti u dalších sérií anti-TNF léků.
Dalším zajímavým nálezem ve studii REALISTIC byl fakt, že nebyl zjištěn signifikantní rozdíl mezi skupinou léčenou monoterapií CZP a skupinou léčenou kombinací CZP s dalším DMARD. Některé další studie ukazují totiž lepší účinnost, když je anti-TNF preparát kombinován s MTX či s jiným DMARD [10].
Ve studii REALISTIC byl dále podrobně zkoumán problém tzv. pacientem hlášených ukazatelů, jako je únavnost, bolest a poruchy spánku. CZP výrazně ovlivňoval tyto parametry, a to signifikantně již od 2. týdne aplikace.
Léčba CZP byla dobře tolerována a výskyt nežádoucích účinků a závažných nežádoucích účinků se statisticky nelišil (14,7 vs. 16,3/100 pacientoroků). Lokální tolerance léčby byla velmi dobrá.
Závěr
Studie REALISTIC prokázala velmi rychlou a mohutnou účinnost CZP po přidání do léčebného schématu u širokého spektra pacientů s RA. CZP byl stejně účinný v monoterapii jako v kombinační léčbě s různými DMARD a stejně účinný u nemocných s kratším či delším trváním onemocnění. Další subanalýza ukázala, že CZP byl stejně účinný nezávisle na počtu předchozích aplikací DMARD či anti-TNF léků.
CZP představuje nový anti-TNF preparát jedinečné konstrukce, který se vyznačuje velmi rychlým nástupem účinku, setrvalým efektem, ovlivněním rentgenové progrese a který má přijatelný bezpečnostní profil.
Seznam použité literatury
- [1] www.sukl.cz, citováno 16. září 2012.
- [2] Smolen J, Aletaha D, Bjilsma JW, et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69: 631–637.
- [3] Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2010; 69: 964–975.
- [4] Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Čes Revmatol 2010; 4: 182–191.
- [5] Weir N, Athwal D, Brown D, et al. A new generation of high-affinity humanized PEGylated Fab´ fragment anti-tumor necrosis factor-α monoclonal antibodies. Therapy 2006; 3: 535–545.
- [6] Keystone EC, Combe B, Smolen J, et al. Sustained efficacy of certolizumab pegol added to methotrexate in the treatment of rheumatoid arthritis: 2-year results from the RAPID 1 trial. Rheumatology 2012; 51: 1628–1638.
- [7] Smolen J, Landewé RB, Mease P, et al. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: the RAPID 2 study. A randomised controlled trial. Ann Rheum Dis 2009; 68: 797–804.
- [8] Ramiro S, van Tubergen AM, Landewé RB. RAPID and FAST4WORD trials: certolizumab pegol for rheumatoid arthritis. Expert Rev Clin Immunol 2010; 6: 713–720.
- [9] Weinblatt ME, Fleischmann R, Huizinga TW, et al. Efficacy and safety of certolizumab pegol in a broad population of patients with active rheumatoid arthritis: Results from a Phase IIIb study. Rheumatology 2012, published online August 25, doi: 10.1093/rheumatology/kes150.
- [10] Klareskog L, van der Heijde D, de Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. The Lancet 2004; 363: 675–681.