Rychlý nástup účinku bimekizumabu u pacienta s psoriatickou erytrodermií
Souhrn
Tomšíková I. Rychlý nástup účinku bimekizumabu u pacienta s psoriatickou erytrodermií. Remedia 2023; 33: 167–172.
Psoriáza je chronické systémové zánětlivé onemocnění podmíněné geneticky. Keratinocyty mají důležitou roli v patogenezi psoriázy, jejich poškození vlivem různých nox vede k uvolnění vzorů vnitřního poškození – DAMP (damage associated molecular patterns). Po rozpoznání vzorů DAMP dendritickými buňkami dochází k tvorbě prozánětlivých cytokinů. Důležitými cytokiny v patogenezi psoriázy jsou regulační interleukin (IL) 12 a IL‑23 a efektorové IL‑17, IL‑22 a tumor nekrotizujíc faktor alfa (TNFα). Biologická léčba cílí na rozdílné mediátory patofyziologického procesu. Posledním registrovaným biologikem se schválenou úhradou pro léčbu psoriázy v ČR je bimekizumab – humanizovaná monoklonální IgG1 protilátka, která neutralizuje účinky IL‑17A a IL‑17F. V kazuistice je prezentován případ 37letého pacienta s psoriatickou erytrodermií úspěšně léčeného bimekizumabem.
Klíčová slova: psoriáza – cytokiny – cytokinová rodina IL‑17 – biologická léčba – bimekizumab.
Summary
Tomsikova I. Fast achievement of bimekizumab effect in a patient with psoriatic erythroderma. Remedia 2023; 33: 167–172.
Psoriasis is a chronic systemic inflammatory disease, genetically conditioned. Keratinocytes have an important role in the pathogenesis of psoriasis, their damage due to various noxious stimuli resulting in the release of damage‑associated molecular patterns (DAMP). Upon recognition of DAMP by dendritic cells, pro‑inflammatory cytokines are being produced. Important cytokines in the pathogenesis of psoriasis comprise the regulatory interleukin (IL) 12, IL‑23 and the effector IL‑17, IL‑22 and TNFα. Biological treatment targets different mediators of the pathophysiological process. The last registered biologic with approved reimbursement for the treatment of psoriasis in the Czech Republic is bimekizumab – a humanized monoclonal IgG1 antibody that neutralizes IL‑17A and IL‑17F. This case study presents a case of a 37‑year‑old patient with psoriatic erythroderma successfully treated with bimekizumab.
Key words: psoriasis – cytokines – cytokines IL‑17 – biological treatment – bimekizumab.
Úvod
Psoriáza je chronické systémové zánětlivé imunopatologické onemocnění podmíněné geneticky [1–3]. Postihuje především kůži, nehty, kštici a klouby [2]. Psoriáza je spojena s řadou komorbidit, kterými jsou především kardiovaskulární onemocnění, hypertenze, obezita, metabolický syndrom zahrnující dyslipidemii, diabetes mellitus či nealkoholickou steatohepatitidu, ale i zánětlivá střevní onemocnění, uveitidu a psychiatrické poruchy nebo malignity [2]. Odhaduje se, že 2–4 % západní populace trpí psoriázou [4]. Dětská psoriáza je naštěstí spíše méně častá – s prevalencí 0,7 % [3]. Nejčastější formou je chronická ložisková psoriáza, mezi další formy patří gutátní, inverzní, nehtová, palmoplantární či pustulózní psoriáza [2]. Závažné až život ohrožující formy představují erytrodermická psoriáza a generalizovaná pustulózní psoriáza. Onemocnění je pro většinu pacientů velmi společensky zatěžující, spojené často s řadou nepříjemných subjektivních pocitů, pálením, svěděním až bolestí kůže. Neadekvátně léčená psoriáza výrazně zhoršuje kvalitu života pacientů, vykazuje vliv na progresi rozvoje komorbidit a nepříznivě ovlivňuje i pracovní aktivitu nemocných [2]. Mezi spouštěcí faktory patří fyzikální a chemické vlivy vnějšího prostředí, psychický stres, bakteriální, především streptokoková infekce, virové infekce, zahájení podávání nových léků [1,3]. Psoriáza není choroba dědičná, ale geneticky podmíněná – je identifikována řada tzv. psoriatických genů, což jsou geny vnímavosti pro psoriázu. Jako jeden z nejdůležitějších lokusů se jeví PSORS1 na chromozomu 6p. PSORS1 obsahuje jako jeden z genů známý HLA‑Cw6, který hraje klíčovou roli ve vzniku psoriázy [3].
Patogeneze psoriázy – aspekty imunopatologie
![OBR. 1A, B Imunopatogeneze psoriázy; podle [1] – Krejsek, et al., 2016. 2-23-74](https://www.remedia.cz/photo-pg-1038---.jpg) Psoriáza je onemocnění, při němž dochází ke ztrátě homeostatických regulací zánětu a rozvíjí se zánět poškozující organismus. Tento proces postupuje na podkladě genetické predispozice pod vlivem působení zevních i vnitřních faktorů, změn mikrobioty kůže a abnormální individuální reaktivity [1]. Samotná genetická predispozice nestačí pro rozvoj psoriázy. Mezi faktory působící na tento terén a podporující vznik psoriázy patří škodliviny, především chemické noxy obsažené v zevním prostředí a tabákovém kouři. Významnou roli v patogenezi psoriázy hraje narušená kožní mikrobiota. U nemocných s psoriázou jsou prokázány defekty v tvorbě antimikrobiálních peptidů, tím dochází k narušení fyziologického osídlení kůže mikroorganismy a k přemnožení patologické mikrobioty, která pak poškozuje keratinocyty [1]. Konkrétní klíčový patogen pro patogenezi psoriázy zatím není znám. Keratinocyty hrají důležitou roli v patogenezi psoriázy, jejich poškození patologickou mikrobiotou, ale i různými noxami zevního prostředí způsobuje uvolňování vzorů vnitřního poškození – DAMP (damage associated molecular patterns). Rozpoznání vzorů DAMP, tzv. alarminů, příslušnými receptory dendritických buněk pak vede k lokální i systémové tvorbě prozánětlivých cytokinů (obr. 1A, B) [1]. Aktivované kožní dendritické buňky cíleně migrují do sekundárních lymfatických orgánů, kde prezentují antigeny T lymfocytům. V případě poškozujícího zánětu u nemocných s psoriázou jsou vytvořeny podmínky pro preferenční funkční vyzrávání Th0 lymfocytů do subsetů Th1, Th17 a Th22, které poté vstupují nejen do cévního řečiště, ale usídlují se i ve specifických místech v kůži, což bylo prokázáno imunohistologickým vyšetřením psoriatických lézí [1]. K vyzrávání subsetů Th1, Th17 a Th22 dochází za přítomnosti cytokinů, především IL‑12 a IL‑23. Interleukin 23 představuje klíčový, tzv. regulační cytokin nezbytný pro přežívání Th17 lymfocytů. Subsety Th1, Th17 a Th22 se stávají zdrojem efektorových cytokinů, které jsou součástí poškozujícího zánětu u nemocných s psoriázou. Všechny zmiňované subsety T lymfocytů spojuje abnormální tvorba prozánětlivého cytokinu tumor nekrotizujícího faktoru alfa (TNFα). Jednotlivé subsety se liší v tvorbě specifických cytokinů. Th1 lymfocyty tvoří především interferon gama (IFNγ), Th17 lymfocyty skupinu cytokinů rodiny IL‑17 (se šesti členy IL‑17A–IL‑17F) klíčových při iniciaci a udržování zánětu [1,5]. Tvoří se i další prozánětlivé cytokiny. Tvorba chemokinu IL‑8 je zodpovědná za cílenou migraci granulocytů z dermis do stratum corneum, kde jsou součástí pro psoriázu typických Munroových mikroabscesů. Interleukin 22 tvořený Th22 lymfocyty je odpovědný za abnormální proliferaci keratinocytů, která je příčinou jejich hyperplazie při psoriáze. Interleukin 22 brání terminální diferenciaci keratinocytů a stimuluje v nich tvorbu TNFα. Hlavními poškozujícími cytokiny u psoriázy jsou IL‑22, IL‑17, TNFα a IFNγ [1].
Psoriáza je onemocnění, při němž dochází ke ztrátě homeostatických regulací zánětu a rozvíjí se zánět poškozující organismus. Tento proces postupuje na podkladě genetické predispozice pod vlivem působení zevních i vnitřních faktorů, změn mikrobioty kůže a abnormální individuální reaktivity [1]. Samotná genetická predispozice nestačí pro rozvoj psoriázy. Mezi faktory působící na tento terén a podporující vznik psoriázy patří škodliviny, především chemické noxy obsažené v zevním prostředí a tabákovém kouři. Významnou roli v patogenezi psoriázy hraje narušená kožní mikrobiota. U nemocných s psoriázou jsou prokázány defekty v tvorbě antimikrobiálních peptidů, tím dochází k narušení fyziologického osídlení kůže mikroorganismy a k přemnožení patologické mikrobioty, která pak poškozuje keratinocyty [1]. Konkrétní klíčový patogen pro patogenezi psoriázy zatím není znám. Keratinocyty hrají důležitou roli v patogenezi psoriázy, jejich poškození patologickou mikrobiotou, ale i různými noxami zevního prostředí způsobuje uvolňování vzorů vnitřního poškození – DAMP (damage associated molecular patterns). Rozpoznání vzorů DAMP, tzv. alarminů, příslušnými receptory dendritických buněk pak vede k lokální i systémové tvorbě prozánětlivých cytokinů (obr. 1A, B) [1]. Aktivované kožní dendritické buňky cíleně migrují do sekundárních lymfatických orgánů, kde prezentují antigeny T lymfocytům. V případě poškozujícího zánětu u nemocných s psoriázou jsou vytvořeny podmínky pro preferenční funkční vyzrávání Th0 lymfocytů do subsetů Th1, Th17 a Th22, které poté vstupují nejen do cévního řečiště, ale usídlují se i ve specifických místech v kůži, což bylo prokázáno imunohistologickým vyšetřením psoriatických lézí [1]. K vyzrávání subsetů Th1, Th17 a Th22 dochází za přítomnosti cytokinů, především IL‑12 a IL‑23. Interleukin 23 představuje klíčový, tzv. regulační cytokin nezbytný pro přežívání Th17 lymfocytů. Subsety Th1, Th17 a Th22 se stávají zdrojem efektorových cytokinů, které jsou součástí poškozujícího zánětu u nemocných s psoriázou. Všechny zmiňované subsety T lymfocytů spojuje abnormální tvorba prozánětlivého cytokinu tumor nekrotizujícího faktoru alfa (TNFα). Jednotlivé subsety se liší v tvorbě specifických cytokinů. Th1 lymfocyty tvoří především interferon gama (IFNγ), Th17 lymfocyty skupinu cytokinů rodiny IL‑17 (se šesti členy IL‑17A–IL‑17F) klíčových při iniciaci a udržování zánětu [1,5]. Tvoří se i další prozánětlivé cytokiny. Tvorba chemokinu IL‑8 je zodpovědná za cílenou migraci granulocytů z dermis do stratum corneum, kde jsou součástí pro psoriázu typických Munroových mikroabscesů. Interleukin 22 tvořený Th22 lymfocyty je odpovědný za abnormální proliferaci keratinocytů, která je příčinou jejich hyperplazie při psoriáze. Interleukin 22 brání terminální diferenciaci keratinocytů a stimuluje v nich tvorbu TNFα. Hlavními poškozujícími cytokiny u psoriázy jsou IL‑22, IL‑17, TNFα a IFNγ [1].
Léčba
V léčbě psoriázy se uplatňují následující postupy.
Lokální terapie a systémová konvenční léčba
Lokální terapie psoriázy zahrnuje podávání kortikosteroidů, analog vitaminu D3, aplikaci cignolinu, emoliencií, ichtamolu a keratolytik. K systémové konvenční léčbě řadíme fototerapii, balneoterapii, balneofototerapii, lázeňskou léčbu, podávání cyklosporinu, acitretinu, metotrexátu.
Biologická léčba
![OBR. 2 Systémová terapie psoriázy dle současných evropských doporučení; upraveno podle [6] – Nast, et al., 2020. 2-23-75](https://www.remedia.cz/photo-pg-1039---.jpg) S dynamickým výzkumem patogeneze psoriázy souvisí stále nový vývoj biologik, která cílí na rozdílné mediátory patofyziologického procesu. První úspěšná biologika neutralizují poškozující účinky TNFα (adalimumab, etanercept, infliximab a certolizumab). Další biologika cílí na osu IL‑12/23 (ustekinumab). Interleukin 17 blokují biologika secukinumab a ixekizumab, na receptor pro IL‑17 pak cílí brodalumab. Mezi anti‑IL‑23 patří biologika guselkumab, risankizumab, tildrakizumab (obr. 2) [1,3,5,6].
S dynamickým výzkumem patogeneze psoriázy souvisí stále nový vývoj biologik, která cílí na rozdílné mediátory patofyziologického procesu. První úspěšná biologika neutralizují poškozující účinky TNFα (adalimumab, etanercept, infliximab a certolizumab). Další biologika cílí na osu IL‑12/23 (ustekinumab). Interleukin 17 blokují biologika secukinumab a ixekizumab, na receptor pro IL‑17 pak cílí brodalumab. Mezi anti‑IL‑23 patří biologika guselkumab, risankizumab, tildrakizumab (obr. 2) [1,3,5,6].
Posledním registrovaným biologikem se schválenou úhradou pro léčbu psoriázy v ČR je bimekizumab (viz obr. 2). Jak již bylo výše řečeno, IL‑17 patří ke klíčovým cytokinům v zánětlivém procesu psoriázy. Dosud se biologická léčba soustředila na izoformu IL‑17A (secukinumab, ixekizumab) nebo na její receptor IL‑17RA (brodalumab) [7]. Bimekizumab je humanizovaná monoklonální IgG1 protilátka, která neutralizuje IL‑17A a IL‑17F. Interleukin 17F je biologicky méně aktivní izoformou než izoforma IL‑17A, jeho koncentrace v psoriatickém plaku a séru jsou však vyšší. Interleukiny 17A a 17F tvoří homodimery a heterodimery (IL‑17A/17A, IL‑17A/17F, IL‑17F/17F) [7]. Oba interleukiny sdílejí stejný receptorový komplex (IL‑17 receptor A a C). Duální neutralizace izoforem A a F u IL‑17 má synergický účinek v léčbě psoriázy [7].
Kazuistika
Pacient ve věku 37 let byl odeslán spádovým ambulantním dermatologem k hospitalizaci na naše oddělení v listopadu 2022 pro zhoršení psoriázy. Uvedené zhoršení stavu nastalo po prodělaném onemocnění covid‑19 v prosinci 2021. Ambulantně byl léčen jen lokálními přípravky (kombinovaným přípravkem kalcipotriol/betametason‑dipropionát a emoliencii), systémovou léčbu ani fototerapii nepodstoupil.
Anamnéza
Z rodinné anamnézy vyplývá, že babička i maminka mají psoriázu. Kromě psoriázy pacient neudává jiná závažná onemocnění. Výsevy ložiskové psoriázy se u něj objevují od období adolescence. Trvale žádné léky neužívá, alergii nemá. Pacient je registrován u psychologa z důvodu úzkostných stavů. Pracuje jako dělník, je ženatý, má dvě zdravé děti. Alkohol pije příležitostně, dříve kouřil až 30 cigaret denně, od roku 2021 nekouří.
Průběh léčby
Při přijetí na oddělení měl pacient rozsáhlé projevy psoriázy na trupu, v tříslech, na genitálu a ve kštici. Ložiska psoriázy byla zarudlá, infiltrovaná, s výraznou deskvamací a místy splývala až do začínající erytrodermie. Postižení nehtů jsme neprokázali, bolesti kloubů neudával. Skóre PASI (Psoriasis Area and Severity Index) vykázalo hodnotu 32,3, BSA (Body Surface Area) 56 % a PEST (Psoriasis Epidemiology Screening Tool) 0 – to znamená, že pacient nevykazoval známky psoriatické artritidy. Hmotnost pacienta byla 88 kg, výška 175 cm, index tělesné hmotnosti (BMI) 28,7.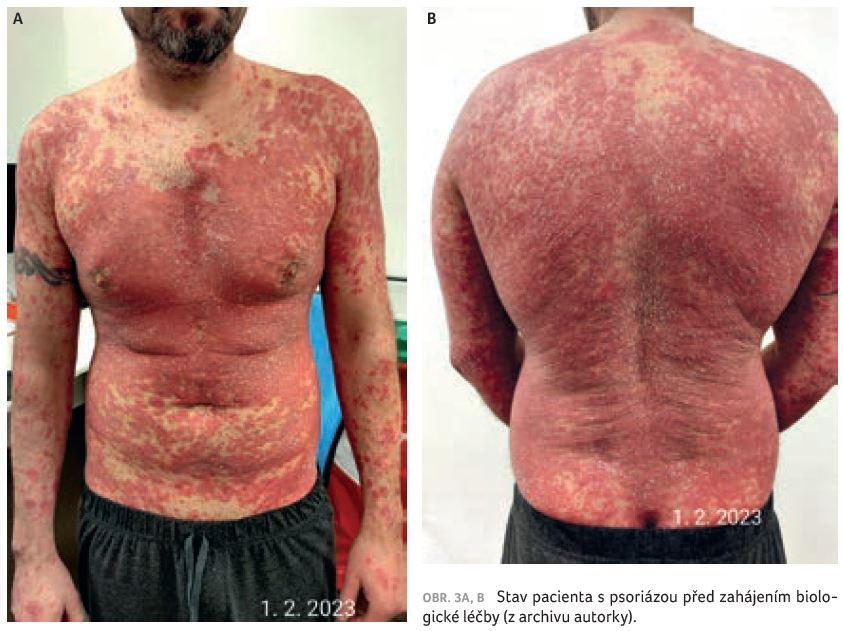
Provedená laboratorní vyšetření – hodnota C‑reaktivního proteinu (CRP), krevní obraz a diferenciální rozpočet, jaterní testy, hodnota urey, kreatininu, minerály, lipidové spektrum, moč a sediment – byla bez patologie. Další vyšetření přinesla následující parametry: anti‑streptolysin O v séru negativní, krevní tlak v normě, výtěr z krku a nosu na kultivaci a citlivost s průkazem běžné flóry, protilátky proti hepatitidám negativní, Quantiferonový test na TBC negativní.
Rozhodli jsme pro zahájení léčby cyklosporinem v dávce dvakrát 150 mg, tj. 3,3 mg/kg/den. Léčbu cyklosporinem jsme zvolili vzhledem k rychlejšímu nástupu účinku v porovnání s ostatními typy systémové léčby (acitretinem a metotrexátem). Z lokálních přípravků pacient aplikoval kombinovaný přípravek (kalcipotriol/betametason‑dipropionát) tři dny v týdnu a kůži promazával emoliencii. Po třech týdnech léčby cyklosporinem došlo k ústupu projevů psoriázy, k vyblednutí ložisek a pacient se cítil lépe. Kontrolní laboratorní vyšetření (moč + sediment, urea, kreatinin, ionty, jaterní testy, lipidové spektrum) a krevní tlak byly v normě, z nežádoucích účinků uváděl pacient mírnou bolest hlavy, ale v léčbě chtěl pokračovat. Na další kontrole po sedmi týdnech léčby cyklosporinem ovšem udával zažívací potíže, již úpornou bolest hlavy a zejména vleklý infekt (angína, otitida). Psoriáza se sice zmírňovala, ale léčbu cyklosporinem jsme vzhledem k nežádoucím účinkům ukončili a týden poté jsme zahájili fototerapii UVB 311 nm. Fototerapii však pacient netoleroval, udával podráždění kůže, svědění, pálení a patrné bylo i zhoršení erytému, z tohoto důvodu byla léčba ukončena. Závažnost psoriázy se poměrně rychle zhoršovala. Rozhodli jsme se tedy pro zahájení biologické léčby. Předtím jsme doplnili plicní vyšetření, které bylo bez patologie, a vyšetření na přítomnost viru lidské imunodeficience (HIV), které bylo negativní.
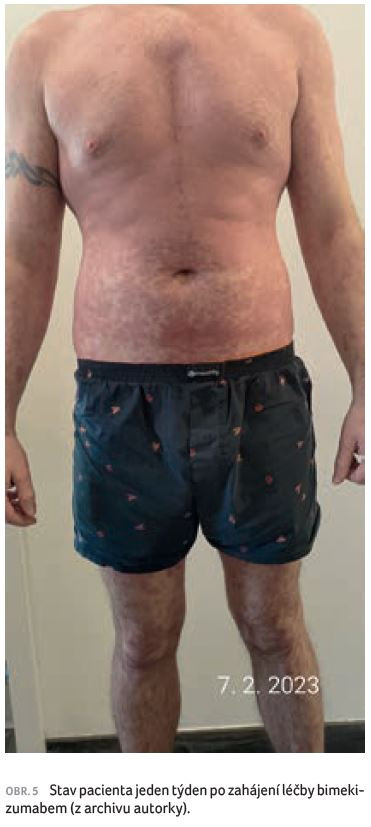
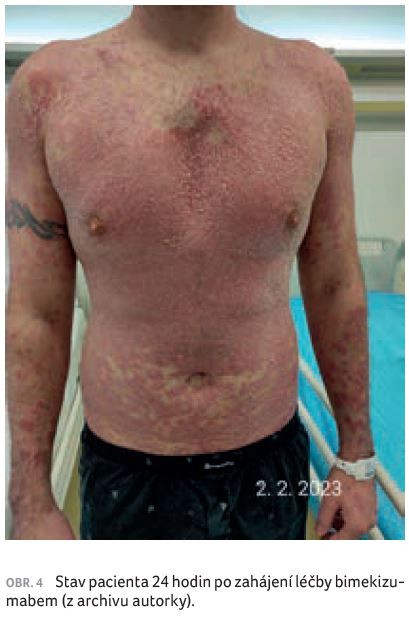 U pacienta docházelo k dalšímu zhoršování psoriatických projevů, které postupně přecházely až do psoriatické erytrodermie (obr. 3A, B). Kůže pacienta subjektivně svědila, pálila až bolela, laboratorně došlo ke zvýšení CRP na hodnotu 16. Před zahájením biologické léčby měl pacient PASI 52,4, BSA 77 %, DLQI (Dermatology Life Quality Index) 24, PEST 0, výsledek dotazníku na depresi (Self‑Rating Depression Scale, SDS) 60–69, tj. středně depresivní. Z tohoto důvodu začal pacient užívat antidepresiva – escitalopram. Zahájili jsme biologickou léčbu bimekizumabem v dávce 320 mg, kterou jsme aplikovali ve dvou subkutánních dávkách po 160 mg. Již do 24 hodin od aplikace bimekizumabu nastalo subjektivní zlepšení, pálení a svědění kůže bylo mírnější. Objektivně došlo ke zřetelnému vyblednutí projevů onemocnění (obr. 4). Po týdnu od první dávky bimekizumabu se pacient cítil velmi dobře. Hodnocení PASI pokleslo na 15, projevy psoriázy byly zřetelně probledlé, bez infiltrace a deskvamace (obr. 5). Patrná byla jen suchost pokožky, pacient mohl zcela ukončit aplikaci lokálních kortikosteroidů a pokožku ošetřoval pouze indiferentními emoliencii. Cítil se velmi dobře a požadoval ukončení pracovní neschopnosti. Nemocný byl rovněž zařazen do registru biologické léčby (BIOREP).
U pacienta docházelo k dalšímu zhoršování psoriatických projevů, které postupně přecházely až do psoriatické erytrodermie (obr. 3A, B). Kůže pacienta subjektivně svědila, pálila až bolela, laboratorně došlo ke zvýšení CRP na hodnotu 16. Před zahájením biologické léčby měl pacient PASI 52,4, BSA 77 %, DLQI (Dermatology Life Quality Index) 24, PEST 0, výsledek dotazníku na depresi (Self‑Rating Depression Scale, SDS) 60–69, tj. středně depresivní. Z tohoto důvodu začal pacient užívat antidepresiva – escitalopram. Zahájili jsme biologickou léčbu bimekizumabem v dávce 320 mg, kterou jsme aplikovali ve dvou subkutánních dávkách po 160 mg. Již do 24 hodin od aplikace bimekizumabu nastalo subjektivní zlepšení, pálení a svědění kůže bylo mírnější. Objektivně došlo ke zřetelnému vyblednutí projevů onemocnění (obr. 4). Po týdnu od první dávky bimekizumabu se pacient cítil velmi dobře. Hodnocení PASI pokleslo na 15, projevy psoriázy byly zřetelně probledlé, bez infiltrace a deskvamace (obr. 5). Patrná byla jen suchost pokožky, pacient mohl zcela ukončit aplikaci lokálních kortikosteroidů a pokožku ošetřoval pouze indiferentními emoliencii. Cítil se velmi dobře a požadoval ukončení pracovní neschopnosti. Nemocný byl rovněž zařazen do registru biologické léčby (BIOREP).
 Bimekizumab je podáván ve dvou subkutánních dávkách po 160 mg v 0., 4., 8., 12. a 16. týdnu, dále pak každých osm týdnů. Mezi častější možné nežádoucí účinky, především v prvních měsících léčby, patří infekce horních cest dýchacích, nejčastěji nazofaryngitida a orální kandidóza.
Bimekizumab je podáván ve dvou subkutánních dávkách po 160 mg v 0., 4., 8., 12. a 16. týdnu, dále pak každých osm týdnů. Mezi častější možné nežádoucí účinky, především v prvních měsících léčby, patří infekce horních cest dýchacích, nejčastěji nazofaryngitida a orální kandidóza.
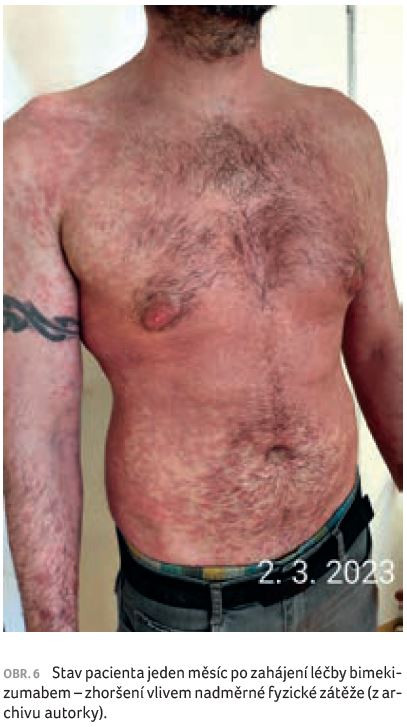
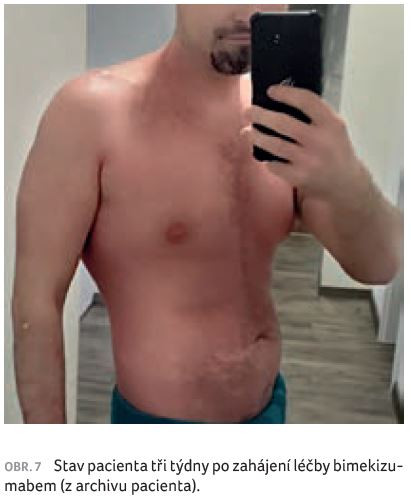 Plánovaná kontrola a druhá aplikace bimekizumabu proběhly u pacienta za čtyři týdny od začátku léčby. Očekávali jsme další ústup projevů psoriázy, zklamáním byl však klinický nález ve formě erytému, deskvamace, místy i mírné infiltrace projevů (obr. 6). Pacient ovšem uvedl, že psoriáza se po třech týdnech již téměř vyhojila, kůže byla bez suchosti, bez erytému (obr. 7), a neváhal tedy začít s intenzivní fyzickou zátěží, posilováním a běháním, aby se vrátil do fyzické kondice před zhoršením psoriázy. Následkem pak bylo opětovné, ačkoliv ne tak výrazné zhoršení nemoci. Je zřejmé, že extrémní zátěž organismu psoriázu zhoršuje. Pacienta jsme poučili, že by si měl vážit rychlého účinku biologické léčby, možnosti návratu k běžnému životu a organismus zatěžovat postupně. Týden po aplikaci druhé dávky bimekizumabu a po přerušení nadměrné fyzické zátěže došlo opět k výraznému zmírnění psoriázy. Na kůži byly patrné pouze pozánětlivé hyperpigmentace, bez erytému, indurace a deskvamace (obr. 8).
Plánovaná kontrola a druhá aplikace bimekizumabu proběhly u pacienta za čtyři týdny od začátku léčby. Očekávali jsme další ústup projevů psoriázy, zklamáním byl však klinický nález ve formě erytému, deskvamace, místy i mírné infiltrace projevů (obr. 6). Pacient ovšem uvedl, že psoriáza se po třech týdnech již téměř vyhojila, kůže byla bez suchosti, bez erytému (obr. 7), a neváhal tedy začít s intenzivní fyzickou zátěží, posilováním a běháním, aby se vrátil do fyzické kondice před zhoršením psoriázy. Následkem pak bylo opětovné, ačkoliv ne tak výrazné zhoršení nemoci. Je zřejmé, že extrémní zátěž organismu psoriázu zhoršuje. Pacienta jsme poučili, že by si měl vážit rychlého účinku biologické léčby, možnosti návratu k běžnému životu a organismus zatěžovat postupně. Týden po aplikaci druhé dávky bimekizumabu a po přerušení nadměrné fyzické zátěže došlo opět k výraznému zmírnění psoriázy. Na kůži byly patrné pouze pozánětlivé hyperpigmentace, bez erytému, indurace a deskvamace (obr. 8).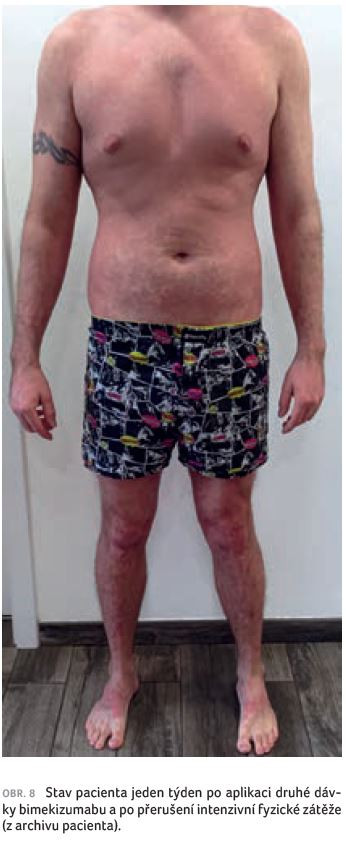
Závěr
Biologická léčba je významnou a nedílnou součástí léčby závažných dermatologických onemocnění, především psoriázy a atopické dermatitidy. Kožní oddělení Oblastní nemocnice Mladá Boleslav je novým centrem pro biologickou léčbu od ledna 2023. První zkušenosti s biologickou léčbou na našem pracovišti jsou pozitivní a naši pacienti nemusejí nadále dojíždět za touto terapií do jiných zařízení. Nový biologický lék – bimekizumab, který neutralizuje působení cytokinů Il‑17A a IL‑17F v patogenezi psoriázy – u uvedeného pacienta prokázal rychlý nástup účinku s promptní subjektivní úlevou u závažné erytrodermické formy psoriázy. Úleva vlivem této léčby byla tak zřejmá, že pacient neváhal již v prvním měsíci terapie zkusit extrémní fyzickou zátěž, která však navodila opětovné zhoršení projevů psoriázy. Během prvních dvou měsíců léčby bimekizumabem jsme u našeho pacienta nezaznamenali žádné nežádoucí účinky. Po přerušení intenzivní fyzické zátěže došlo do týdne opět k výraznému zmírnění psoriázy.
Literatura
[1] Krejsek J, Ctirad A, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016: 240–243.
[2] Cetkovská P, Kojanová M, Arenberger P, et al. Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy. Čes‑slov Derm 2017; 92: 1–52.
[3] Gkalpakiotis S, Cetkovská P, Kojanová M, et al. Psoriáza od teorie k praxi. Praha: Mladá fronta, 2020.
[4] Papp KA, Gniadecki JB, Beecker J, et al. Psoriasis Prevalence and Severity by Expert Elicitation. Dermatol Ther (Heidelb) 2021; 11: 1053–1064.
[5] Sivamani RK, Correa G, Ono Y, et al. Biological therapy of psoriasis. Indian J Dermatol 2010; 55: 161–170.
[6] Nast A, Smith C, Spuls PI, et al. EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris – Part 1: treatment and monitoring recommendations. J Eur Acad Dermatol Venerol 2020; 34: 2461–2498.
[7] Ruggiero A, Potestio L, Camela E, et al. Bimekizumab for the Treatment of Psoriasis: A Review of the Current Knowledge. Psoriasis (Auckl) 2022; 12: 127–137.