Sekukinumab v léčbě ankylozující spondylitidy
Souhrn:
Ciferská H. Sekukinumab v léčbě ankylozující spondylitidy. Remedia 2019; 29: 295–299.
Ankylozující spondylitida (AS) představuje zánětlivé revmatické onemocnění postihující axiální skelet, které je charakterizováno zánětli-vou bolestí zad a strukturálními změnami axiálního skeletu zachycenými zobrazovacími metodami. Tyto změny mohou vést ve svém dů-sledku k poškození páteře s následnými funkčními změnami. Včasná diagnóza spojená s adekvátní léčbou a režimovými opatřeními vede k dosažení remise, či alespoň nízké aktivity onemocnění. Sekukinumab je plně humánní monoklonální protilátka inhibující interleukin 17, která prokázala dobrou klinickou účinnost v programu klinických studií MEASURE a je nyní využívána nejen v terapii ankylozující spondylitidy a psoriatické artritidy.
Klíčová slova: ankylozující spondylitida ‒ biologická léčba – sekukinumab.
Summary:
Ciferska H. Secukinumab in the treatment of ankylosing spondylitis. Remedia 2019; 29: 295–299.
Ankylosing spondylitis (AS) is an inflammatory rheumatic disease that affects axial skeleton characterized by inflammatory back pain and structural changes of the axial skeleton that can be seen using imagining techniques. These changes may lead to spine damage with re-sulting functional changes. Timely diagnosis together with adequate treatment and regime adjustments leads to remission, or at least to low disease activity. Secukinumab is fully human monoclonal antibody inhibiting interleukine 17 that exhibited good clinical efficacy in the program of MEASURE clinical studies and is currently used not only in the therapy of ankylosing spondylitis and psoriatic arthritis.
Key words: ankylosing spondylitis, biologic therapy, secukinumab.
Ankylozující
spondylitida
Ankylozující spondylitida (AS) představuje autoimunitní
zánětlivé onemocnění neznámé etiologie náležící do skupiny
spondyloartritid (SpA). Prevalence AS se u evropské populace pohybuje mezi
0,5‒1,0 %
s převahou mužů nad ženami (3 : 1). Typicky začíná
u mladších nemocných ve věku do 40. roku s maximem
výskytu případů mezi druhou a třetí dekádou života. K typickým
manifestacím patří zánětlivá bolest zad, sakroiliitida, spondylitida,
artritida, zejména intervertebrálních kloubů, a v pokročilých
stadiích se tvoří přemosťující syndesmofyty mezi obratlovými těly. Vzhledem
k často vleklým obtížím zp očátku nevýrazného charakteru dochází
ke zpoždění diagnózy i o celou řadu let. Právě včasná diagnóza
spojená se zahájením léčby s režimovými opatřeními vede k navození
remise, či alespoň nízké aktivity onemocnění [1,2]. Starší diagnostická
modifikovaná newyorská kritéria zahrnovala kromě klinických příznaků (bolest,
zkrácení distancí) také již radiologické projevy, které jsou spjaty
s dlouhodobě etablovaným onemocněním a nejsou vhodné k detekci
časných stadií nemoci, u nichž ještě nejsou změny rozpoznatelné
na základě prostého rentgenového snímku (tab. 1)
[3]. Kritéria dle ASA
očátku nevýrazného charakteru dochází
ke zpoždění diagnózy i o celou řadu let. Právě včasná diagnóza
spojená se zahájením léčby s režimovými opatřeními vede k navození
remise, či alespoň nízké aktivity onemocnění [1,2]. Starší diagnostická
modifikovaná newyorská kritéria zahrnovala kromě klinických příznaků (bolest,
zkrácení distancí) také již radiologické projevy, které jsou spjaty
s dlouhodobě etablovaným onemocněním a nejsou vhodné k detekci
časných stadií nemoci, u nichž ještě nejsou změny rozpoznatelné
na základě prostého rentgenového snímku (tab. 1)
[3]. Kritéria dle ASA

S (Mezinárodní společnost pro hodnocení spondylartritid,
Assessement of Spondyloarthritis International Society) jsou vhodnější
k zachycení časných forem AS ještě před vznikem RTG detekovatelné
sakroiliitidy, zahrnují i vyšetření magnetickou rezonancí, která je
schopna rozlišit rovněž velmi časté změny v oblasti sakroiliakálního
skloubení (tab. 2) [4].
Klinické
symptomy
Ankylozující spondylitida postihuje nejen struktury
axiálního skeletu (spondylitida, sakroiliitida), ale může mít i periferní
projevy v podobě postižení kloubů a entezí. Rovněž mohou být přítomny
manifestace mimo muskuloskeletální systém (oční, kožní, gastrointestinální,
kardiovaskulární systém). Typická je i přítomnost antigenu HLA‑B27,
ačkoliv jeho negativita onemocnění nevylučuje. Ankylozující spondylitida
představuje heterogenní onemocnění a podle postižení rozeznáváme axiální
(postihující pouze páteřní struktury), rhizomelickou (ramena, kyčle)
a periferní (s postižením periferních kloubů 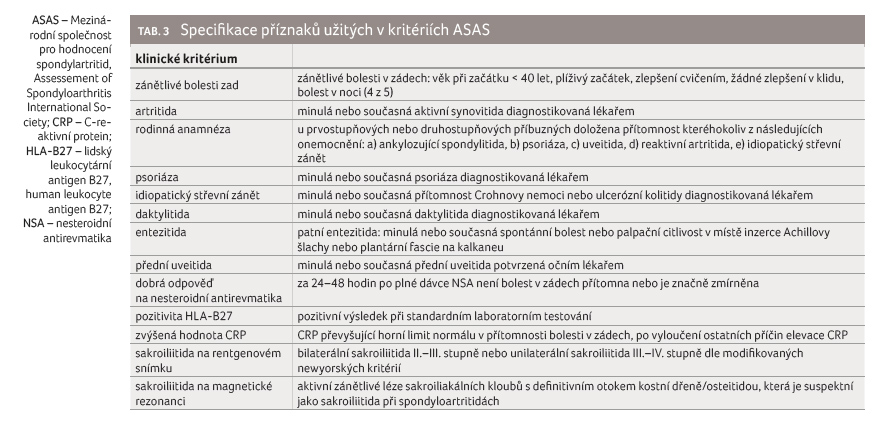 a entezí
k postižení páteře) formu. Kritéria ASAS s vysokou senzitivitou
a specificitou dokáží zachytit už časné formy choroby detekovatelné pomocí
magnetické rezonance (tab. 3). Axiální spondylartritida
se nyní dělí na tzv. non‑radiografickou axiální spondylartritidu, kdy jsou
změny detekovatelné magnetickou rezonancí, ale nejsou patrné
na ren
a entezí
k postižení páteře) formu. Kritéria ASAS s vysokou senzitivitou
a specificitou dokáží zachytit už časné formy choroby detekovatelné pomocí
magnetické rezonance (tab. 3). Axiální spondylartritida
se nyní dělí na tzv. non‑radiografickou axiální spondylartritidu, kdy jsou
změny detekovatelné magnetickou rezonancí, ale nejsou patrné
na ren

tgenovém snímku, a na radiografickou axiální
spondylartritidu neboli ankylozující spondylitidu (změny typické pro AS jsou
již patrny na rentgenovém snímku). Aktivita onemocnění je hodnocena dle indexu
BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), viz tabulku 4 [1,2,5].
Stručný
přehled terapie
Terapie AS vyžaduje komplexní přístup spojený
s kombinací nefarmakologických a farmakologických léčebných postupů.
Mezioborová spolupráce je nezbytná u extraartikulárních projevů choroby.
Samozřejmostí je individualizovaný přístup na základě jednotlivých
manifestací nemoci a přítomných komorbidit. Přiměřená fyzická aktivita
společně s fyzioterapií je bezpodmínečně nutná k zachování dobré
hybnosti a soběstačnosti nemocného. Lékem první volby jsou nesteroidní
antirevmatika (NSA) a společně s pravidelnou fyzioterapií dostatečným
léčebným prostředkem ke zvládnutí onemocnění. Efekt NSA nastupuje již
po 2‒3 dnech a pacienti je mohou užívat jen při exacerbaci obtíží,
nicméně u některých nemocných s aktivním onemocněním je preferováno
kontinuální podávání s přihlédnutím k nežádoucím účinkům spojeným
s jejich dlouhodobým užíváním. Klinická studie sledující působení
celekoxibu prokázala efektivnost tohoto léku ve zmírnění rozvoje
syndesmofytů v oblasti páteře. Celkové podávání glukokortikoidů
neprokázalo prospěch u AS, avšak lokální injekční aplikace
do bolestivého kloubu má často dobrý efekt. Rovněž nebyl prokázán efekt
při užívání syntetických chorobu modifikujících antirevmatických léků
(conventional synthetic disease‑modifying antirheumatic drug, csDMARD)
u axiální formy postižení. U periferní formy může mít podání
sulfasalazinu a metotrexátu jistý účinek. Pacienti s aktivním
onemocněním, u nichž došlo k selhání předchozí konvenční terapie,
jsou indikováni k podání biologické terapie (biological disease‑modifying
antirheumatic drug, bDMARD). Jsou to nemocní s vysokou zánětlivou
aktivitou choroby se zaznamenaným indexem BASDAI ≥ 40
(na škále 0–100) při dvou návštěvách po sobě v odstupu
minimálně čtyř týdnů. Další podmínkou je selhání minimálně dvou NSA, která musí
být podávána nejméně čtyři týdny v maximální doporučené nebo tolerované
dávce, nejsou‑li přítomny kontraindikace. Kritéria zahájení biologické léčby
dle České revmatologické společnosti zahrnují navíc přítomnost hodnoty C‑reaktivního
proteinu zvýšené nad 10 mg/l.
V současnosti jsou k dispozici dvě skupiny bDMARD ‒ inhibitory tumor
nekrotizujícího faktoru alfa (etanercept, infliximab, adalimumab, golimumab,
certolizumab pegol) a inhibitor interleukinu 17 (IL‑17) ‒ sekukinumab ‒
u AS. Chirurgické výkony jsou indikovány u nemocných při destrukcích
kloubů zánětlivým procesem či sekundárními změnami v rámci akcelerované
osteoartrózy, dále v případě korekční osteotomie u nemocných
s výraznou hyperkyfózou, kteří již nemají schopnost horizontálního pohledu
před sebe a mají obtíže při chůzi [1,2].
Kazuistika
Třiadvacetiletý pacient věnující se v předchorobí
vrcholovému sportu byl nucen svoji kariéru předčasně ukončit pro bolesti
v oblasti obou kyčlí omezující pohyb, zprvu přisuzované extrémní zátěži.
Byla provedena režimová opatření, zahájen klidový režim, podávána konvenční
analgetika a započata rehabilitace, to vše bez ústupu obtíží. Ortopedem
byla provedena magnetická rezonance kyčelních kloubů s průkazem synovitidy
a byla podána plná dávka NSA. Bolesti bederní páteře zánětlivého
charakteru se objevily až za dva roky od začátku bolestí kyčelních
kloubů. Efekt nesteroidních antirevmatik byl zprvu dostačující, nicméně
jednotlivá NSA musela být zaměněna za další z důvodu postupné ztráty
účinku. Byla zjištěna pozitivita antigenu HLA‑B27 (lidský leukocytární antigen)
a vyjádřeno podezření na zánětlivé autoimunitní revmatické onemocnění
charakteru AS, nemocný byl proto odeslán k revmatologovi. Pacient byl HLA‑B27
pozitivní, měl rentgenologický průkaz sakroiliitidy odpovídající AS druhého
stupně a byla přítomna zánětlivá bolest zad. Při fyzikálním vyšetření
nemocný vykazoval omezenou hybnost páteře (Thomayer 20 cm, Schrober 6 cm,
dechové exkurze 3 cm,
lateroflexe 20 cm).
Diagnostická kritéria AS byla splněna jak pro klasifikaci ASAS, tak pro
newyorská kritéria. Pro léčbu NSA byl vybrán diklofenak, který byl dobře
tolerován a zpočátku měl dobrý efekt na symptomy onemocnění včetně
poklesu hodnot zánětlivých parametrů, nicméně postupem doby došlo
k opětovnému nárůstu aktivity jak humorální, tak i klinické hodnocené
indexem BASDAI 6. Pacient trpěl relapsem bolestí zad a koxalgií
s nutností podání intramuskulárního diklofenaku k překlenutí akutních
obtíží. Sonografickým vyšetřením byla zjištěna koxitida, která je závažnou
komplikací AS vedoucí k postupné destrukci kyčelního kloubu. Vzhledem
ke zhoršení celkového stavu s nárůstem zánětlivé aktivity
a indexu aktivity BASDAI při selhání terapie NSA byl nemocný indikován
k zahájení biologické terapie sekukinumabem. Efekt je patrný již
v úvodu léčby, která vede k rychlému poklesu zánětlivé aktivity
a k ústupu klinických obtíží. Remise onemocnění bylo uspokojivě
dosaženo a efekt terapie trvá.
Sekukinumab –
stručná charakteristika
Sekukinumab (CosentyxÒ) je
schopen selektivní vazby na IL‑17A. Dochází k inhibici jeho interakce
s receptorem pro IL‑17 (rIL‑17), který je exprimován
na keratinocytech, endoteliálních buňkách, chondrocytech
a osteoblastech, což vede k negativnímu ovlivnění produkce
prozánětlivých cytokinů a chemokinů aktivovaných interakcí IL‑17A/rIL‑17
u zánětlivých a autoimunitních onemocnění. Mechanismus účinku
sekukinumabu na pohybový aparát u pacientů s AS vychází
z předpokladu negativního ovlivnění zvýšené exprese IL‑17 v subchondrální kostní
dřeni intervertebrálních kloubů a tím zabránění vzniku lokálního zánětu
[6‒8]. Doporučená dávka sekukinumabu je 150 mg
subkutánně s doporučenou indukční dávkou 150 mg
ve formě subkutánní injekce v týdnu 0, 1, 2, 3 a 4, po níž
následuje měsíční udržovací dávka 150 mg.
Sekukinumab je kontraindikován při známé alergické reakci na některé
složky podávaného přípravku, dále u závažné infekce včetně tuberkulózy.
Přípravek není dosud určen těhotným ženám. V průběhu léčby se nedoporučuje
podávat živé vakcíny a pacienti by měli být očkováni před zahájením
biologické terapie [6‒8].
Sekukinumab prokázal svou účinnost v celé řadě
klinických sledování u AS, za zmínku stojí studie fáze III programu
MEASURE. Klinické studie MEASURE 1 a 2 srovnávaly účinek subkutánního
sekukinumabu podávaného v dávkách 75 mg
a 150 mg.
V případě MEASURE 1 byla v úvodu podávána indukce intravenózním
sekukinumabem v dávce 10 mg/kg,
a to v týdnu 0, 2 a 4, dále pak následovala terapie 75 mg nebo 150 mg sekukinumabu podávaného
subkutánně každé čtyři týdny. Ve studii MEASURE 2 byla intravenózní
indukce vynechána, pacientům byl sekukinumab podán subkutánně v úvodní
dávce 75 mg nebo 150 mg v týdnu 0, 1, 2
a 3 a nadále pak každé čtyři týdny. Sekukinumab prokázal
v programu klinických studií MEASURE svou dobrou účinnost
a bezpečnost [9‒11].
Závěr
Ankylozující spondylitida patří mezi chronická zánětlivá
revmatická onemocnění, která představují diagnostický problém pro svůj většinou
plíživý začátek. Rentgenologicky detekovatelné změny se často rozvíjejí až
po několika letech trvání choroby. Magnetická rezonance proto představuje
cenný nástroj k odhalení časných forem nemoci a její využití patří
k součástem klasifikačních kritérií ASAS. Včasná diagnóza vede
k zahájení adekvátní nefarmakologické i farmakologické terapie,
jejímž účelem je navození remise onemocnění, či alespoň jeho nízké aktivity dle
doporučení České revmatologické společnosti. Kazuistika demonstruje příklad
mladého pacienta, u kterého postupně docházelo k selhání konvenční
terapie a byla zahájena biologická léčba s dosažením remise.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního
rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Seznam použité literatury
- [1] Sieper J, Poddubnyy D. New evidence on the management of spondyloarthritis. Nat Rev Rheumatol 2016; 12: 282‒295.
- [2] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Čes Revmatol 2012; 20: 4–11.
- [3] van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York Criteria. Arthritis Rheum 1984; 27: 361‒368.
- [4] Rudwaleit M, van der Heijde D, Landewe R. Development of ASAS for axial spondylarthritis, validation of final section. Ann Rheum Dis 2009; 68: 777‒783.
- [5] Sieper J, Rudwaleit M. Early referral recommendations for ankylosing spondylitis (including pre radiographic and radiographic forms) in primary care. Ann Rheum Dis 2005; 64: 659–663.
- [6] Miossec P. Update on interleukin 17: a role in the pathogenesis of inflammatory arthritis and implication for clinical practice. RMD Open 2017; 3: e000284.
- [7] Speeckaert R, Lambert J, Grine L, et al. The many faces of interleukin 17 in inflammatory skin diseases. Br J Dermatol 2016; 175: 892‒901.
- [8] SPC secukinumab (Cosentyx®). Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/003729/WC500183129.pdf [navštíveno 5. 5. 2019]
- [9] Baeten D, Sieper J, Braun J, et al. Secukinumab, an interleukin 17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015; 373: 2534–2548.
- [10] Sieper J, Deodhar A, Marzo Ortega H, et al. Secukinumab efficacy in anti TNF naive and anti TNF experienced subjects with active ankylosing spondylitis: results from the MEASURE 2 Study. Ann Rheum Dis 2017; 76: 571–592.
- [11] Kivitz A, Blanco R, Maradiaga M, et al. Secukinumab reduces sign and symptoms of active ankylosing spondylitis: results from a 16 week, randomised, placebo controlled phase 3 trial (abstract No 3287319). J Clin Rheumatol 2016; 22: 141.