Studie ADVOR
Souhrn
Špinarová L, Špinar J, Vítovec J. Studie ADVOR. Remedia 2023; 33: 138–140.
ADVOR (Acetazolamide in Decompensated heart failure with Volume OveRload) byla multicentrická, dvojitě zaslepená, placebem kontrolovaná studie, která zahrnula pacienty s dekompenzací srdečního selhání. Měla za cíl zjistit, zda přidání acetazolamidu ke kličkovým diuretikům přispěje ke snížení kongesce u těchto pacientů. Primární cílový ukazatel byl definován jako úspěšná dekongesce tři dny po randomizaci bez nutnosti eskalace dekongestivní terapie. Klíčový sekundární cílový ukazatel byl kombinovaný: celková mortalita a rehospitalizace pro srdeční selhání po třech měsících sledování a index hospitalizace. Bylo randomizováno celkem 519 pacientů. Přidání acetazolamidu ke standardní doporučené intravenózní dávce kličkových diuretik vedlo po třech dnech k výraznější dekongesci. Efekt byl mezi předdefinovanými podskupinami konzistentní. Pacienti ve skupině s acetazolamidem měli větší diurézu a natriurézu, byli kratší dobu hospitalizováni a při propuštění měli méně často dekongesci. Podání acetazolamidu bylo bezpečné, bez vyššího výskytu nežádoucích účinků než placebo.
Klíčová slova: akutní srdeční selhání – acetazolamid – dekongesce.
Summary
Spinarova L, Spinar J, Vitovec J. ADVOR trial. Remedia 2023; 33: 138–140.
ADVOR (Acetazolamide in Decompensated heart failure with Volume OveRload) was a multicentric, double‑blind, placebo‑controlled trial enrolling patients with decompensated heart failure. It’s aim was to find out whether adding acetazolamide to loop diuretics helps to reduce congestion in these patients. The primary endpoint was defined as successful decongestion within three days following randomization without need to escalate the decongestive therapy. The key secondary endpoint was a combined one: overall mortality and rehospitalization for heart failure during 3‑months of follow‑up and the hospitalization index. 519 patients were randomized. Adding acetazolamide to standard recommended intravenous dose of loop diuretics ensured a more pronounced decongestion during 3 days. The effect was consistent across all the predefined groups. Patients treated with acetazolamide achieved a more intensive diuresis and natriuresis, were hospitalized for a shorter time, and showed decongestion less often when being dismissed from the hospital. Acetazolamide treatment was safe and was not associated with more side effects than placebo.
Key words: acute heart failure – acetazolamide – decongestion.
Diuretika patří k základním symptomatickým lékům akutní dekompenzace srdečního selhání. Na snížení městnání jsou užívána kličková diuretika, jako další možnost do kombinace jsou v guidelines zmíněna thiazidová diuretika.
Acetazolamid – inhibitor karboanhydrázy – snižuje v proximálním tubulu reabsorpci sodíku. Kličková diuretika působí v Henleově kličce, tedy na jiném místě nefronu. Přidání acetazolamidu tak může zlepšit účinnost kličkových diuretik a přispět k dekongesci.
ADVOR (Acetazolamide in Decompensated heart failure with Volume OveRload) byla multicentrická, dvojitě zaslepená, placebem kontrolovaná studie, která zahrnula pacienty s dekompenzací srdečního selhání. Jejím cílem bylo zjistit, zda přidání acetazolamidu ke kličkovým diuretikům přispěje ke snížení kongesce u těchto pacientů. Vstupními kritérii byly: akutní dekompenzace srdečního selhání, přítomnost alespoň jednoho příznaku zavodnění (edém, pleurální výpotek nebo ascites), předchozí užívání nejméně 40 mg furosemidu denně déle než jeden měsíc, hodnota NT‑proBNP (N‑terminální frakce prohormonu natriuretického peptidu B) vyšší než 1 000 pg/ml nebo BNP (natriuretický peptid B) vyšší než 250 pg/ml. Vylučovací kritéria zahrnovala: předchozí užívání acetazolamidu, užívání inhibitorů kotransportéru pro glukózu a sodík (SGLT2), systolický tlak nižší než 90 mm Hg, pokles glomerulární filtrace (eGFR) na hodnotu nižší než 20 ml/min.
Pacienti byli randomizováni v poměru 1 : 1 k podávání 500 mg intravenózního acetazolamidu po dobu tří dnů nebo do vymizení kongesce oproti standardní diuretické léčbě. Při randomizaci byli pacienti převedeni z perorální dávky kličkových diuretik na dvojnásobnou intravenózní dávku, kterou dostávali jako bolus při randomizaci a další dva dny rozdělenou do dvou dávek. Bylo doporučeno, aby byla zachována dávka léků neurohumorální blokády. V den zařazení a v dalších dnech bylo počítáno skóre kongesce na škále 0–10 na základě součtu bodů za plicní kongesci (0–4 body), pleurální výpotek (0–3 body) a ascites (0–3 body). Toto skóre bylo počítáno každý den před podáním ranní dávky diuretik, při propuštění a po třech měsících od zahájení léčby. Primární cílový ukazatel byl definován jako úspěšná dekongesce, která znamenala nepřítomnost objemového přetížení (např. žádné známky edému, pleurálního výpotku nebo ascitu) tři dny po randomizaci bez nutnosti eskalace dekongestivní terapie. Klíčový sekundární cílový ukazatel byl kombinovaný – celková mortalita a rehospitalizace pro srdeční selhání za tři měsíce sledování a index hospitalizace, tj. počet dní do propuštění.
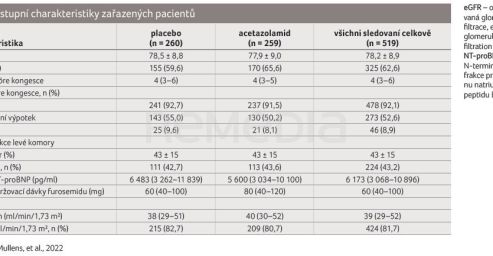 Celkově bylo screenováno 2 915 pacientů, 519 jich bylo randomizováno: 259 pacientů do léčebné větve s acetazolamidem a 260 pacientů do placebové větve. Sledování trvalo tři měsíce. Vstupní charakteristiky zařazených pacientů ukazuje tabulka 1.
Celkově bylo screenováno 2 915 pacientů, 519 jich bylo randomizováno: 259 pacientů do léčebné větve s acetazolamidem a 260 pacientů do placebové větve. Sledování trvalo tři měsíce. Vstupní charakteristiky zařazených pacientů ukazuje tabulka 1.
Úspěšné dekongesce bylo dosaženo u 42,2 % (108/256) pacientů ve skupině s acetazolamidem a u 30,5 % (79/259) pacientů v placebové skupině (p < 0,001), graf 1A. Pokud byli hodnoceni i pacienti, u kterých byla přítomna eskalace přídatné diuretické terapie, byl výsledek opět pozitivní pro pacienty, kteří dostávali acetazolamid: tři dny bez kongesce 44,9 % vs. 33,2 % (p = 0,001). V následujících dnech byl zaznamenán ústup kongesce u většího počtu pacientů ve skupině s aktivní léčbou než ve skupině s placebem (graf 1B).
V analýze podskupin byl efekt acetazolamidu na dosažení primárního cílového ukazatele konzistentní. Pouze pacienti, kteří měli vyšší dávku kličkových diuretik, neměli tento efekt tak jasně vyjádřený. Při analýze pacientů, kteří přežili a byli propuštěni, byl patrný rovněž prospěch z podávání acetazolamidu na dekongesci: 78,8 % (190/241) pacientů vs. 62,5 % (145/232) pacientů (p = 0,0001), graf 1C.![GRAF 1A–C Efekt acetazolamidu na dekongesci; podle [1] – Mullens, et al., 2022. GRAF 1A–C Efekt acetazolamidu na dekongesci; podle [1] – Mullens, et al., 2022.](https://www.remedia.cz/photo-pg-1020---.jpg)
Sekundární cílový ukazatel úmrtí nebo rehospitalizace pro srdeční selhání byl zaznamenán u 29,7 % (76/256) pacientů ve skupině acetazolamidu a u 27,8 % (72/259) v placebové skupině (nesignifikantní, NS). Střední délka hospitalizace byla 8,8 dne v aktivní větvi a 9,9 dne v placebové skupině (p = 0,016).
Celková podaná dávka intravenózních kličkových diuretik byla stejná v obou skupinách. Bezpečnost acetazolamidu byla srovnatelná s placebem a nevyskytl se žádný statisticky významný rozdíl ve výskytu nežádoucích účinků. Incidence kombinovaného renálního ukazatele bezpečnosti, hypokalemie a hypotenze, byla rovněž v obou skupinách srovnatelná.
Limitací studie je, že v doprovodné medikaci nebyly užity inhibitory kotransportéru pro glukózu a sodík SGLT2. V době studie ještě nebyly plně indikovány nebo jejich užívání nebylo povoleno.
Shrnutí
ADVOR byla největší studií s diuretiky u pacientů s akutní dekompenzací srdečního selhání zaměřená na dekongesci. Přidání acetazolamidu ke standardní doporučené intravenózní dávce kličkových diuretik vedlo po třech dnech k výraznější dekongesci. Efekt léčby byl konzistentní mezi předdefinovanými podskupinami. Pacienti ve skupině s acetazolamidem měli větší diurézu a natriurézu, byli kratší dobu hospitalizováni a při propuštění byla méně často přítomna dekongesce. Studie nezahrnula dostatečně velký počet účastníků, aby prokázala ovlivnění celkové mortality a hospitalizace pro srdeční selhání. Podání acetazolamidu bylo bezpečné, bez vyššího výskytu nežádoucích účinků ve srovnání s placebem. Acetazolamid je levný lék s nekomplikovaným dávkováním, který působí symptomatickou úlevu – zlepšení dekongesce.
Literatura
[1] Mullens W, Dauw J, Martens P, et al. Acetazolamid in acute decompensated heart failure with volume overload. N Engl J Med 2022: 387: 1185–1195.
[2] Mullens W. Acetazolamid in Decompensated heart failure with Volume Overload (ADVOR). Hot Line Session 2 ESC Congress 2022, August 27, Barcelona.