Studie EINSTEIN, rivaroxaban v léčbě hluboké žilní trombózy
EINSTEN-DVT je otevřená, randomizovaná studie, která srovnává perorální léčbu rivaroxabanem s podkožně aplikovaným enoxaparinem a následně podávaným warfarinem po dobu 3, 6 nebo 12 měsíců u pacientů s akutní symptomatickou HŽT (hlubokou žilní trombózou). Část pacientů po dokončení této studie pokračovala v 6–12měsíční léčbě rivaroxabanem, nebo placebem (studie EINSTEIN-EXT). Studie EINSTEIN-DVT prokázala ve srovnání se standardní léčbou rivoraxabanem stejnou účinnost s podobným rizikem krvácení, navíc léčbu rivaroxabanem bylo možno zahájit bez předléčení LMWH. Prodloužení terapie rivoraxabanem o dalších 6 nebo 12 měsíců je v prevenci recidivy velmi účinné a ve srovnání s placebem má přijatelné riziko krvácení. Ve studii nebyla prokázána hepatotoxicita rivaroxabanu.
Tromboembolická nemoc (TEN) představuje vedle srdečního infarktu a cévních mozkových příhod třetí nejčastější příčinu úmrtí z kardiovaskulárních příčin. Současná léčba nízkomolekulárním heparinem (LMWH) a warfarinem má mnoho známých nevýhod. V dohledné době bude tato terapie nahrazována perorálními inhibitory faktoru Xa, jako je rivaroxaban, apixaban, edoxaban (další inhibitory faktoru Xa jsou ve vývoji – betrixaban, YM150 a TAK-442), které budou znamenat významný pokrok v prevenci a léčbě TEN. Výhodou těchto látek je možnost podávání ve stálých dávkách, nepřítomnost interakcí se stravou a méně interakcí s jinými léčivými látkami. Na rozdíl od warfarinu probíhá eliminace v případě inhibitorů faktoru Xa více způsoby. Vylučování ledvinami dosahuje 66 % v případě rivaroxabanu, 25 % při léčbě apixabanem a 35 % u edoxabanu. Rovněž poločas účinku je ve srovnání s warfarinem (20–60 hodin) u těchto látek pouze 7–11 hodin. Jak ukázala studie EINSTEIN, rychlý nástup účinku znamená možnost vynechání úvodní léčby heparinem v akutní fázi žilní trombózy. Zároveň rychlý nástup účinku těchto látek může zlepšit bezpečnost jejich podávání. Všechny jsou metabolizovány na různých úrovních substráty cytochromu P-450 3A4 (CYP3A4). Proto je kontraindikováno současné užívání léků, které inhibují obě cesty vylučování, jakými jsou antifungální přípravky nebo inhibitory proteáz.
Rivaroxaban je v současnosti hlavním představitelem lékové skupiny přímých reverzibilních inhibitorů aktivovaného faktoru Xa a v řadě zemí (USA, EU) je již uveden na trh. Má dlouhou dobu účinku (t1/2 je 5–11 hod.) umožňující podávání 1krát denně a rychlý nástup účinku (cmax 2–4 hod.), který dovoluje vynechat úvodní léčbu LMWH.
Ve čtyřech klinických studiích s celkovým počtem 12 000 pacientů bylo potvrzeno, že perorálně podaný rivaroxaban má stejnou, a možná i vyšší účinnost než dávka 40 mg enoxaparinu podaná 1krát denně v prevenci TEN u dospělých pacientů podstupujících totální náhradu kyčelního nebo kolenního kloubu. Kromě toho rivaroxaban prokázal dobrou účinnost v prevenci cévní mozkové příhody u nemocných s fibrilací síní (studie ROCKET AF), očekávají se výsledky preventivního podávání u hospitalizovaných nemocných na interních odděleních (studie MAGELLAN) a vlivu na závažné kardiovaskulární příhody u pacientů s akutním koronárním syndromem (studie ATLAS ACS TIMI 51).
Ke zjištění účinnosti a bezpečnosti rivaroxabanu u nemocných s tromboembolickou nemocí byl v roce 2006 zahájen program EINSTEIN s celkovým počtem 9000 pacientů, který zahrnuje studii EINSTEIN-DVT u nemocných s hlubokou žilní trombózou (HŽT) a EINSTEN-EXT s prodloužením léčby o 6 nebo 12 měsíců po ukončení alespoň šestiměsíční léčby HŽT. Výsledky obou těchto studií byly publikovány v závěru roku 2010. Výsledky dosud probíhající studie EINSTEN-PE u pacientů s plicní embolií se očekávají koncem tohoto roku.
EINSTEN-DVT je otevřená, randomizovaná studie, která srovnává perorální léčbu rivaroxabanem (15 mg 2krát denně po dobu 3 týdnů, dále 20 mg 1krát denně) s podkožně aplikovaným enoxaparinem a následně podávaným warfarinem po dobu 3, 6 nebo 12 měsíců u pacientů s akutní symptomatickou HŽT. Po dokončení této studie mohli nemocní přejít do studie EINSTEIN-EXT, dvojitě slepé, randomizované studie, která srovnávala podávání samotného rivaroxabanu (20 mg 1krát denně) oproti placebu po dobu dalších 6 nebo 12 měsíců. Primárním cílem v obou studiích byla recidiva žilní trombózy a riziko většího nebo klinicky závažného krvácení.
Do studie EINSTEIN-DVT bylo zařazeno 3449 pacientů – 1731 do skupiny léčené rivaroxabanem a 1718 k léčbě enoxaparinem s antagonisty vitaminu K. Průměrný věk nemocných s akutní symptomatickou hlubokou žilní 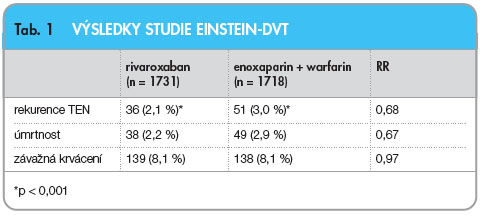 trombózou byl 56 let a 92 % nemocných mělo clearance kreatininu vyšší než 0,8 ml/s. Ve skupině nemocných léčených rivaroxabanem prodělalo recidivu HŽT nebo plicní embolii 36 (2,1 %) nemocných, ve skupině léčené enoxaparinem v kombinaci s warfarinem 51 (3,0 %) nemocných (RR 0,68, 95% CI 0,44–1,04; p < 0,001). Ke krvácení došlo u 8,1 % pacientů v každé skupině (tab. 1). Účinnost a bezpečnost léčby nebyla ovlivněna věkem, pohlavím či hmotností nemocných. Vaskulární příhody se vyskytly u 12 (0,7 %) nemocných v rivaroxabanové skupině a u 14 (0,8 %) nemocných ve skupině léčené LMWH a warfarinem. Elevace transamináz nebo bilirubinu byla zjištěna u 0,1 % nemocných léčených rivaroxabanem a u 0,2 % nemocných v kontrolní skupině.
trombózou byl 56 let a 92 % nemocných mělo clearance kreatininu vyšší než 0,8 ml/s. Ve skupině nemocných léčených rivaroxabanem prodělalo recidivu HŽT nebo plicní embolii 36 (2,1 %) nemocných, ve skupině léčené enoxaparinem v kombinaci s warfarinem 51 (3,0 %) nemocných (RR 0,68, 95% CI 0,44–1,04; p < 0,001). Ke krvácení došlo u 8,1 % pacientů v každé skupině (tab. 1). Účinnost a bezpečnost léčby nebyla ovlivněna věkem, pohlavím či hmotností nemocných. Vaskulární příhody se vyskytly u 12 (0,7 %) nemocných v rivaroxabanové skupině a u 14 (0,8 %) nemocných ve skupině léčené LMWH a warfarinem. Elevace transamináz nebo bilirubinu byla zjištěna u 0,1 % nemocných léčených rivaroxabanem a u 0,2 % nemocných v kontrolní skupině.
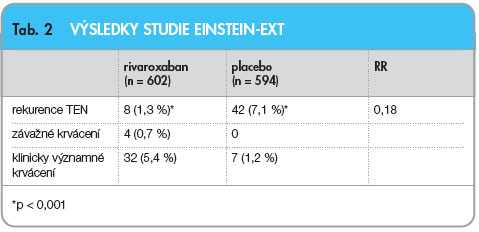 Studie EINSTEIN-EXT zahrnovala 602 pacientů léčených rivaroxabanem a 594 placebem (tab. 2). Ve skupině léčené rivaroxabanem se vyskytlo 8 (1,3 %) případů TEN, oproti tomu ve skupině s placebem 42 (7,1 %) případů TEN (RR 0,18, 95% CI 0,09–0,39; p < 0,001). V rivaroxabanové skupině byli postiženi nefatálním velkým krvácením 4 (0,7 %) pacienti, ve skupině s placebem větší krvácení zaznamenáno nebylo (p = 0,11). Hodnocen byl i klinický přínos léčby (tromboembolické příhody + krvácení), k němuž došlo u 12 (2,0 %) pacientů užívajících rivaroxaban a u 42 (7,1 %) pacientů, kteří dostávali placebo (RR 0,28, 95% CI 0,15–0,53; p < 0,001). Celkově zabránilo prodloužení léčby o 6 měsíců 34 recidivám HŽT za cenu čtyř větších krvácení. Výskyt menších krvácení byl zvýšen z 1,2 % v placebové skupině na 5,4 % ve skupině s rivaroxabanem. Tyto krvácivé příhody byly převážně slizniční a většina pacientů (81 %) pokračovala ve studii. Cévní příhody se objevily u tří pacientů ve skupině rivaroxabanu a u čtyř pacientů ve skupině s placebem. Nebyla zjištěna hepatotoxicita rivaroxabanu, protože u žádného pacienta v obou skupinách nebyla zjištěna během léčby vyšší než trojnásobná sérová hodnota alaninaminotransferázy nebo dvojnásobná koncentrace bilirubinu.
Studie EINSTEIN-EXT zahrnovala 602 pacientů léčených rivaroxabanem a 594 placebem (tab. 2). Ve skupině léčené rivaroxabanem se vyskytlo 8 (1,3 %) případů TEN, oproti tomu ve skupině s placebem 42 (7,1 %) případů TEN (RR 0,18, 95% CI 0,09–0,39; p < 0,001). V rivaroxabanové skupině byli postiženi nefatálním velkým krvácením 4 (0,7 %) pacienti, ve skupině s placebem větší krvácení zaznamenáno nebylo (p = 0,11). Hodnocen byl i klinický přínos léčby (tromboembolické příhody + krvácení), k němuž došlo u 12 (2,0 %) pacientů užívajících rivaroxaban a u 42 (7,1 %) pacientů, kteří dostávali placebo (RR 0,28, 95% CI 0,15–0,53; p < 0,001). Celkově zabránilo prodloužení léčby o 6 měsíců 34 recidivám HŽT za cenu čtyř větších krvácení. Výskyt menších krvácení byl zvýšen z 1,2 % v placebové skupině na 5,4 % ve skupině s rivaroxabanem. Tyto krvácivé příhody byly převážně slizniční a většina pacientů (81 %) pokračovala ve studii. Cévní příhody se objevily u tří pacientů ve skupině rivaroxabanu a u čtyř pacientů ve skupině s placebem. Nebyla zjištěna hepatotoxicita rivaroxabanu, protože u žádného pacienta v obou skupinách nebyla zjištěna během léčby vyšší než trojnásobná sérová hodnota alaninaminotransferázy nebo dvojnásobná koncentrace bilirubinu.
Výsledky studie EINSTEIN pro klinickou praxi lze shrnout do těchto bodů:
- Rivaroxaban podávaný v dávce 15 mg 2krát denně po dobu 3 týdnů, následně v dávce 20 mg 1krát denně ve srovnání se standardní léčbou HŽT prokazuje stejnou účinnost s podobným rizikem krvácení.
- Pohlaví, věk nebo hmotnost nemocných neovlivnily klinický účinek při výše uvedeném dávkování rivaroxabanu.
- Léčbu rivaroxabanem je možno zahájit bez předléčení LMWH, protože většina pacientů ve skupině s rivaroxabanem buď vůbec nedostala LMWH, nebo byli tito nemocní léčeni pouze jednou dávkou. Účinnost během prvních týdnů léčby byla podobná u obou skupin. Rivaroxaban tedy bude vhodným lékem pro ambulantní léčbu HŽT.
- Prodloužení léčby rivoraxabanem o dalších 6 nebo 12 měsíců je v prevenci recidivy velmi účinné a ve srovnání s placebem má přijatelné riziko krvácení.
- Nebyla prokázána hepatotoxicita rivaroxabanu.
Seznam použité literatury
- [1] The EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010; 363: 2499–2510.