Studie VERTIS‑CV
Souhrn:
Vítovec J, Špinarová L, Špinar J. Studie VERTIS‑CV. Remedia 2021; 31: 154–155.
Studie VERTIS‑CV testovala účinnost inhibitoru sodíko‑glukózového kotransportéru 2 (SGLT2i) ertugliflozinu, který je indikován jako perorální antidiabetikum pro nemocné s diabetes mellitus 2. typu (DM2). Multicentrická randomizovaná studie sledovala 8 246 pacientů s DM2 s kardiovaskulárním rizikem, kteří dostávali 5 mg nebo 15 mg ertugliflozinu oproti placebu. Hodnocení ukázalo, že ertugliflozin je non‑inferiorní z hlediska kardiovaskulární bezpečnosti ve srovnání s placebem.
Summary:
Vitovec J, Spinarova L, Spinar J. VERTIS‑CV trial. Remedia 2021; 31: 154–155.
The VERTIS‑CV trial tested the efficacy of SGLT2 inhibitor ertugliflozin indicated as oral antidiabetic drug in patients with type 2 diabetes mellitus (DM2). Multicentric randomized study evaluated 8,246 patients with DM2 with cardiovascular risk that were administered 5 mg or 15 mg of ertugliflozin, compared with placebo. The study revealed that ertugliflozin is non‑inferior from the point of view of cardiovascular safety compared with placebo.
Key words: SGLT2 inhibitors, ertugliflozin, clinical trial, cardiovascular safety
Úvod
Inhibitory sodíko glukózových kotransportérů (sodium glucose cotransporter inhibitors, SGLTi) jsou důležitou strategií v léčbě diabetes mellitus 2. typu (DM2). Ertugliflozin je novým vysoce selektivním a reverzibilním inhibitorem sodíko glukózového kotransportéru 2 (SGLT2i). Tento transportér je zodpovědný za renální reabsorpci glukózy. Ertugliflozin, obdobně jako další glifloziny, zvyšuje vylučování glukózy ledvinami, což vede k poklesu glykemie a ke zlepšení kompenzace diabetu bez rizika vzniku hypoglykemie. Jde o mechanismus účinku nezávislý na působení inzulinu. Ertugliflozin byl schválen Evropskou lékovou agenturou (EMA) pro léčbu DM2 v Evropě v březnu 2018, a to pro použití v monoterapii a jako přídatná léčba k dalším antidiabetikům. Podrobný popis farmakologických a klinických účinků je podán v přehledném článku E. Račické [1]. Ostatní SGLT2i (kanagliflozin, dapagliflozin, empagliflozin) byly prověřeny v klinických studiích z hlediska kardiovaskulárního působení [2]. Klinické hodnocení VERTIS CV (Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes) si dalo za cíl potvrdit stran kardiovaskulárních účinků non inferioritu ertugliflozinu při srovnání s placebem [3].
Metodika studie VERTIS CV
V multicentrické dvojitě zaslepené studii byli pacienti s DM2 a aterosklerotickým postižením kardiovaskulárního systému randomizováni do tří skupin – s léčbou ertugliflozinem 5 mg nebo 15 mg či s placebem v jedné denní dávce. Do konečné analýzy byli nemocní léčení ertugliflozinem sloučeni bez ohledu na velikost dávky. Primárním cílem bylo ukázat non inferioritu vůči placebu a dále určit výskyt závažných kardiovaskulárních příhod. Složený primární cílový ukazatel představoval úmrtí z kardiovaskulárních příčin, nefatální infarkt myokardu a nefatální cévní mozkovou příhodu – závažná kardiovaskulární příhoda (major adverse cardiovascular event, MACE). Tolerance non inferiority byla určena hodnotou 1,3 – horní hranice 95,6% intervalu spolehlivosti (confidence interval, CI) pro poměr rizik (hazard ratio, HR) ertugliflozin versus placebo. Sekundární cílový ukazatel se skládal z kardiovaskulárního úmrtí a hospitalizace pro srdeční selhání.
Výsledky
Do studie bylo randomizováno
a následně sledováno po dobu 3,5 roku 8 246 nemocných,
kteří dostali buď ertugliflozin, nebo placebo. Ve skupině
s ertugliflozinem se MACE vyskytly u 653 z 5 493
nemocných (11,9 %) a v placebové skupině u 327
z 2 745 nemocných (11,9 %) – HR 0,97; 95,6% CI 0,85‒1,11;
p < 0,001 pro non inferioritu.
Kardiovaskulární úmrtí nebo hospitalizace pro srdeční selhání
se vyskytly u 444 z 5 499 pacientů (8,1 %)
ve skupině s ertugliflozinem a u 250
z 2 747 pacientů (9,1 %) v placebové skupině
(HR 0,88; 95,8% CI 0,75–1,03; p = 0,11 pro
superioritu), graf 1A–C. Poměr rizik pro úmrtí
z kardiovaskulárních příčin činil 0,92 (95,8% CI
0,77–1,11). Amputace byla nutná u 54 pacientů (2,0 %) při
dávce 5 mg ertugliflozinu, u 57 pacientů (2,1 %) při
dávce 15 mg ve srovnání s placebem, kde byla provedena
u 45 nemocných (1,6 %) [3].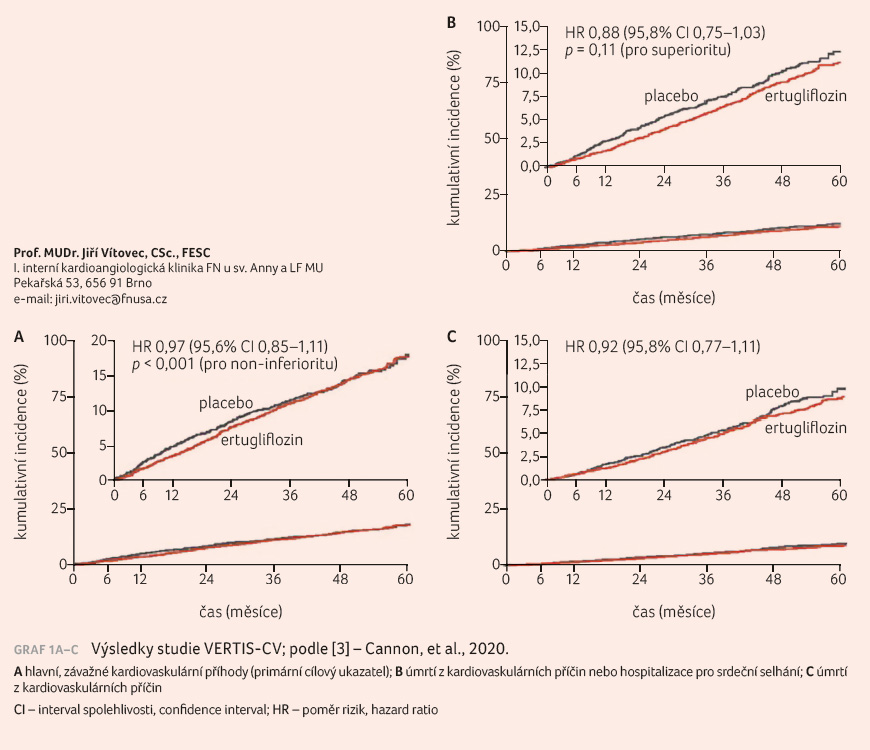
Závěr
Ve studii VERTIS CV zahrnující nemocné s DM2 a aterosklerotickým postižením kardiovaskulárního systému byl ertugliflozin non inferiorní s placebem v hlavním složeném cílovém ukazateli – úmrtí z kardiovaskulárních příčin, nefatálním infarktu myokardu či nefatální mozkové cévní příhodě.
Seznam použité literatury
- [1] Račická E. Ertugliflozin – inhibitor SGLT2. Interní Med 2019; 21: 239–247.
- [2] Špinar J, Vítovec J, Špinarová L. Inhibitory SGLT2 – glifloziny ‒ v léčbě kardiovaskulárních onemocnění. Remedia 2020; 30: 119‒124.
- [3] Cannon CP, Pratley R, Dagogo‑Jack S, et al. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med 2020; 383: 1425‒1435.