Účinek agonistů receptoru pro GLP‑1 na zlepšení kompenzace diabetu a snížení hmotnosti: co říkají výsledky přímých srovnávacích studií a síťové metaan
Souhrn:
Haluzík M. Účinek agonistů receptoru pro GLP‑1 na zlepšení kompenzace diabetu a snížení hmotnosti: co říkají výsledky přímých srovnávacích studií a síťové metaanalýzy? Remedia 2022; 32: 156–161.
Agonisté receptoru pro GLP‑1 (GLP‑1R) jsou kromě inzulinu nejúčinnějšími antidiabetiky, která vedle zlepšení kompenzace diabetu významně snižují tělesnou hmotnost a krevní tlak a zlepšují lipidogram. V rámci skupiny agonistů GLP‑1R můžeme použít řadu přípravků, mezi nimiž jsou určité odlišnosti. Cílem tohoto článku je shrnout rozdíly v účinnosti agonistů GLP‑1R na zlepšení kompenzace diabetu a na snížení hmotnosti. Primárně se zaměřujeme na porovnání prvního perorálního zástupce skupiny – semaglutidu – a dalších injekčních přípravků. Výsledky randomizovaných studií i nedávno publikované síťové metaanalýzy dokládají srovnatelnou nebo lepší účinnost perorálního semaglutidu na zlepšení kompenzace diabetu či na snížení hmotnosti ve srovnání s většinou dalších agonistů GLP‑1R s výjimkou injekční formy semaglutidu.
Summary:
Haluzik M. The effect of GLP‑1 receptor agonists on improving glucose control and decreasing body weight: results of direct comparative trials and network meta‑analysis. Remedia 2022; 32: 156–161.
Apart from insulin, GLP‑1 receptor agonists are the most effective antidiabetics, which decrease body weight and blood pressure and improve blood lipids, in addition to amelioration of glucose control. Numerous options are available within the GLP‑1 receptor agonist class that differ to a certain degree. The aim of this paper is to compare the differences in the efficacy of various GLP‑1 receptor agonists in improving glucose control and reducing body weight. Primarily, we focus on comparing the first oral GLP‑1 receptor agonist – semaglutide – and injectable GLP‑1 receptor agonists. The results of randomized trials and recently published network meta‑analysis show comparable or better efficacy of oral semaglutide in improving glucose control or reducing body weight in contrast with most injectable GLP‑1 receptor agonists, except for injectable semaglutide.
Key words: diabetes mellitus, obesity, GLP‑1 receptor agonists, efficacy, oral administration.
Úvod
Jedním z nejzásadnějších globálních problémů zdravotnictví je celosvětově rostoucí prevalence obezity a diabetes mellitus (DM) 2. typu, která se ve vyspělých zemích velmi pravděpodobně ještě více prohloubí negativní změnou životního stylu během pandemie COVID 19 [1]. K tomuto stavu nepochybně kromě genetické zátěže přispívá nadměrný příjem energeticky bohaté stravy, snižující se fyzická aktivita, stres spojený s nedostatkem spánku často kompenzovaný zvýšením příjmu potravy.
Obezita je nejdůležitějším rizikovým faktorem pro vznik inzulinové rezistence, která u predisponovaných jedinců vede až k rozvoji DM 2. typu [2]. Zároveň se přítomnost obezity významně podílí na rozvoji poruchy metabolismu lipidů, arteriální hypertenze, prozánětlivého stavu a celé řady dalších odchylek, jejichž kombinace je označována jako metabolický syndrom či syndrom inzulinové rezistence [3]. Pacienti se syndromem inzulinové rezistence mají několikanásobně zvýšené riziko kardiovaskulární morbidity a mortality, které dále stoupá u diabetiků 2. typu s neuspokojivou kompenzací [4].
Základním léčebným přístupem u diabetiků 2. typu je farmakoterapie spolu s intervencí životního stylu (zvýšení fyzické aktivity a redukční dieta s omezením příjmu nasycených tuků a jednoduchých sacharidů). Spíše u malého počtu pacientů obvykle s výraznějším stupněm obezity je využíváno postupů bariatrické chirurgie, která je v současné době vůbec nejúčinnější možností léčby jak DM 2. typu, tak i obezity [5]. I přes vysokou účinnost je však stále využívána pouze u zlomku pacientů.
Dostupná léčba DM 2. typu je u řady pacientů mininálně přechodně dobře účinná, postupně je však nutná její intenzifikace s ohledem na fakt, že DM 2. typu je progresivní onemocnění vyznačující se postupným poklesem počtu beta buněk pankreatu. Klasická antidiabetika (inzulin, deriváty sulfonylurey, glinidy, pioglitazon) mají častější nežádoucí účinky než novější skupiny antidiabetik zavedené v posledním desetiletí (gliptiny, agonisté receptoru pro glukagonu podobný peptid 1 [GLP 1R], glifloziny). Tyto nežádoucí účinky zahrnují především zvyšování tělesné hmotnosti, zvýšené riziko hypoglykemie a v některých případech také postupné zhoršování funkce beta buněk [6,7].
Zavedení gliflozinů a agonistů GLP 1R do léčby DM 2. typu zcela zásadně změnilo naše terapeutické možnosti a ovlivnění dlouhodobé prognózy nemocných s DM 2. typu. Obě tyto lékové skupiny totiž nejen významně zlepšují kompenzaci diabetu, ale také snižují hmotnost, výskyt kardiovaskulárních a renálních komplikací a v případě gliflozinů i výskyt srdečního selhání. Vzhledem k dostupnosti celé řady přípravků je mimo jiné důležité diskutovat rozdíly mezi jednotlivými zástupci těchto tříd léků, abychom tak byli schopni vybrat nejen optimální lékovou skupinu, ale také konkrétní přípravek s nejvyšší účinností. V tomto článku se zabýváme účinností agonistů GLP 1R při zlepšení kompenzace diabetu a snížení hmotnosti. Konkrétně diskutujeme především srovnání účinnosti prvního perorálního agonisty GLP 1R semaglutidu s dalšími injekčními přípravky této lékové skupiny. Kromě výsledků přímých srovnání v randomizovaných studiích vycházíme také ze závěrů nedávno publikované síťové metaanalýzy zaměřené na tuto problematiku [8].
Dynamický vývoj od podávání
2× denně s.c. až po perorální formu
Skupina agonistů GLP 1R byla od počátku spojována s velkými nadějemi, pokud jde o výbornou účinnost při zlepšení kompenzace diabetu i na snížení hmotnosti. Nutno říci, že tyto naděje byly zejména nejnovějšími zástupci skupiny plně naplněny. Vůbec prvním zástupcem této skupiny uvedeným na trh byl exenatid podávaný 2× denně, jehož struktura vycházela z exendinu, látky identifikované ve slinných žlázách ještěra korovce jedovatého [9]. Následoval lixisenatid [10] (strukturálně vycházející rovněž z exendinu) a zejména liraglutid s vysokou homologií s lidským GLP 1 a především s významně vyšší účinností než oba dříve jmenované přípravky [11]. Prvním zástupcem agonistů GLP 1R s podáváním 1× týdně byl exenatid s prodlouženým uvolňováním [12], dalšími pak dulaglutid a semaglutid rovněž s podáváním 1× týdně [13,14]. Prvním agonistou GLP 1R s možností perorálního podávání je orální forma semaglutidu, jehož vstřebávání v žaludku je umožněno díky přítomnosti pomocné látky SNAC (salkaprozát sodný) [15]. Při velmi dobrém výběru v rámci skupiny agonistů GLP 1R je zřejmé, že z hlediska preferencí pacientů i lékařů jsou nejvíce upřednostňovány přípravky podávané injekčně 1× týdně (především dulaglutid a semaglutid), stále častěji je však používána i perorální forma semaglutidu, a to nejen u pacientů, kteří se obávají injekční aplikace.
Spektrum agonistů GLP 1R
na českém trhu a efekty nad rámec zlepšení
kompenzace diabetu
V současné době jsou agonisté GLP 1R v České republice k dispozici buď k samostatnému podávání v injekční nebo perorální formě, nebo ve fixní kombinaci s inzulinem: fixní kombinace glargin 100 j./ml/lixisenatid nebo degludek 100 j./ml/liraglutid. Z agonistů GLP 1R k samostatnému podávání je možné použít liraglutid (1× denně v dávce 1,2–1,8 mg s.c.), exenatid (podávaný s.c. buď 2× denně v dávce 20 µg, nebo 1× týdně v dávce 2 mg), lixisenatid (1× denně 20 µg s.c.), dulaglutid (1× týdně 1,5 mg s.c.) a semaglutid (1× týdně 0,5–1 mg s.c. nebo 7–14 mg p.o. 1× denně).
Kromě účinného zlepšení kompenzace diabetu mají agonisté GLP 1R pozitivní vliv na sérové koncentrace lipidů (snížení hyperlipidemie nalačno i postprandiálně) a hodnoty krevního tlaku. Nevýhodou mohou být někdy častější nežádoucí gastrointestinální účinky [16], jimž může pacient předejít zmenšením jídelních porcí. Výskyt nežádoucích účinků navíc s delším podáváním klesá [17].
Z agonistů GLP 1R, které máme k dispozici v České republice, jsou pro liraglutid důkazy o snížení výskytu kardiovaskulárních komplikací i kardiovaskulární a celkové mortality [18]. Subkutánně podávaný semaglutid i dulaglutid vedly v prospektivních studiích ke snížení výskytu kardiovaskulárních komplikací (složených ukazatelů zahrnujících smrt z kardiovaskulárních příčin, nefatální cévní mozkové příhody a nefatální infarkt myokardu) [19,20]. Liraglutid, dulaglutid i semaglutid v kardiovaskulárních studiích také zpomalily progresi diabetického onemocnění ledvin.
Účinnost agonistů GLP 1R
a rozdíly mezi jednotlivými přípravky
Agonisté GLP 1R jsou v současné době kromě inzulinu jednoznačně nejúčinnějšími antidiabetiky. Vedle výrazného zlepšení kompenzace diabetu vedou ke snížení hmotnosti v průměru o 2–8 kg, u některých pacientů i více [21]. Tento efekt je dán relativně vysokými koncentracemi účinné látky, která snižuje příjem potravy kombinací centrálního působení a zpomalení vyprazdňování žaludku. V současné době už můžeme pracovat s výsledky řady přímých srovnání účinnosti dostupných agonistů GLP 1R jak pokud jde o zlepšení kompenzace diabetu, tak i z hlediska snížení hmotnosti.
V rámci studie SUSTAIN 10 bylo u japonských pacientů s DM 2. typu léčených perorálními antidiabetiky provedeno přímé srovnání semaglutidu 1 mg 1× týdně a liraglutidu 1,2 mg 1× denně [22]. Semaglutid snížil hodnotu glykovaného hemoglobinu (HbA1c) o 1,7 % ve srovnání s poklesem o 1 % při podávání liraglutidu, pokles hmotnosti činil 5,8 kg při podávání semaglutidu vs. 1,9 kg při podávání liraglutidu. Ve studii AWARD 6 v přímém srovnání dulaglutidu v dávce 1,5 mg 1× týdně a liraglutidu v dávce 1,8 mg 1× denně byla účinnost na snížení hodnot HbA1c srovnatelná (snížení o 1,42 % vs. 1,36 %); hmotnost více poklesla při podávání liraglutidu (o 3,6 kg vs. o 2,9 kg) [23]. Studie SUSTAIN 7 přímo porovnávala injekční semaglutid v dávkách 0,5 mg nebo 1 mg 1× týdně vs. dulaglutid 0,75 mg nebo 1,5 mg 1× týdně [24]. Pokles hodnoty HbA1c byl vyšší při podávání semaglutidu (snížení o 1,8 % při podávání semaglutidu 1 mg 1× týdně vs. o 1,4 % při podávání dulaglutidu v dávce 1,5 mg 1× týdně). Rovněž hmotnost poklesla významně více při podávání semaglutidu než dulaglutidu (o 6,5 kg vs. o 3 kg při podávání v dávkách 1 mg, resp. 1,5 mg 1× týdně).
Ve studii PIONEER 4 byl perorální semaglutid v dávce 14 mg 1× denně podobně účinný při zlepšení hodnot HbA1c jako liraglutid v dávce 1,8 mg 1× denně (pokles o 1,2 %, resp. o 1,1 %) a tělesná hmotnost se snížila při jeho podávání významně více (o 4,4 kg vs. o 3,1 kg) [25].
Další zajímavé poznatky, pokud jde o nepřímé srovnání účinnosti agonistů GLP 1R (v případě, že přímé srovnání není k dispozici), přináší nedávno publikovaná síťová metaanalýza (network metaanalysis) [8]. Jde v poslední době o velmi populární statistický přístup, kdy jsou vybrány srovnatelné studie s různými léky z dané skupiny a jejich komparátory a zvolené param
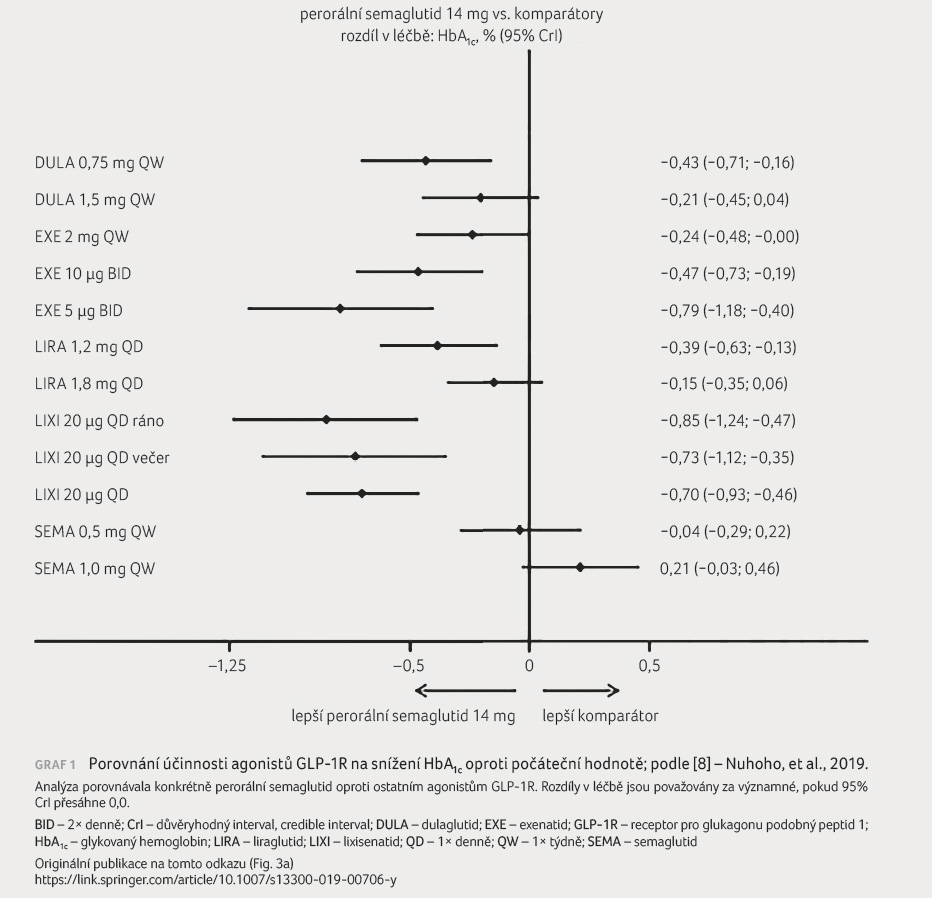
etry jsou pak porovnávány síťově – tedy i mezi rameny, která nebyla v rámci zařazených studií porovnávána přímo. Z této síťové metaanalýzy vyplývá, že účinnost perorálního semaglutidu, dulaglutidu a liraglutidu na zlepšení kompenzace diabetu je srovnatelná, tělesná hmotnost klesá významně více při podávání perorálního semaglutidu. Agonistou GLP 1R, který se při zlepšení kompenzace diabetu i snížení hmotnosti prokázal jako nejúčinnější, byl v této analýze injekční semaglutid podávaný v dávce 1 mg 1× týdně (graf 1).
Celkově tak lze konstatovat, že nejúčinnějším v současné době dostupným agonistou GLP 1R je injekční semaglutid v dávce 1 mg 1× denně, který také nejvíce snižuje tělesnou hmotnost. Antidiabetická účinnost dulaglutidu, liraglutidu a perorálního semaglutidu se zdá být srovnatelná, přičemž snížení tělesné hmotnosti je nejvýraznější při podávání perorálního semaglutidu, mírně nižší při podávání liraglutidu a relativně nejnižší u dulaglutidu. Všechny výsledky je však třeba interpretovat s vědomím, že jde o kombinaci přímých a nepřímých srovnání a že se mohou u různých populací pacientů lišit.
Závěr a další perspektivy
Agonisté GLP 1R jsou v současné době po inzulinu nejúčinnějšími antidiabetiky, která vedle zlepšení kompenzace diabetu významně snižují hmotnost, krevní tlak a sérové koncentrace lipidů. V prospektivních kardiovaskulárních studiích bylo pro některé zástupce této skupiny prokázáno snížení výskytu kardiovaskulárních komplikací (liraglutid, dulaglutid, injekční semaglutid), pokles kardiovaskulární i celkové mortality (liraglutid) a řada dalších studií aktuálně probíhá. Pro liraglutid, dulaglutid a injekční semaglutid bylo prokázáno také zpomalení progrese diabetického onemocnění ledvin.
Při srovnání účinnosti jednotlivých přípravků má nejvýznamnější vliv na zlepšení kompenzace diabetu i na snížení tělesné hmotnosti injekční semaglutid v dávce 1 mg 1× týdně. Antidiabetická účinnost dulaglutidu, perorálního semaglutidu a liraglutidu je srovnatelná, přičemž efekt na snížení hmotnosti je nejvýraznější při podávání perorálního semaglutidu. Semaglutid podávaný per os tak lze označit jako nejúčinnější perorální antidiabetikum, které se svou účinností vyrovná všem ostatním injekčním agonistům GLP 1R s výjimkou injekční formy semaglutidu.
Perspektivně bude velmi zajímavé využití agonistů GLP 1R v léčbě obezity bez diabetu. V této indikaci je již k dispozici liraglutid v dávkování až do 3 mg 1× denně a uvedení na trh se blíží semaglutid s dávkováním 2,4 mg 1× týdně. S perorálním semaglutidem v uvedené dávce navíc nyní probíhá kardiovaskulární studie SELECT [26], jejímž cílem je prokázat vliv podávání semaglutidu ve srovnání s placebem u pacientů s obezitou, bez diabetu a s vysokým kardiovaskulárním rizikem. Na český trh bude brzy uveden dulaglutid s vyšším dávkováním, který by měl mít výraznější efekt jak na kompenzaci diabetu, tak i na snížení hmotnosti. Zároveň probíhají i studie s vyššími dávkami perorálního semaglutidu a s duálními agonisty receptorů pro GLP 1 a GIP (tirzepatid) [27]. Velmi nadějně se jeví výsledky injekčního semaglutidu a tirzepatidu při léčbě nealkoholické steatohepatitidy. Již nyní je však zjevné, že agonisté GLP 1R budou i nadále jednou z nejlepších možností léčby obezity i DM 2. typu, přičemž dostupnost a zachovaná účinnost v perorální formě mohou usnadnit jejich podávání většímu počtu pacientů než ve formě injekční.
Seznam použité literatury
- [1] O’Rahilly S. Science, medicine, and the future. Non‑insulin dependent diabetes mellitus: the gathering storm. BMJ 1997; 314: 955–959.
- [2] Bluher M. Adipose tissue dysfunction contributes to obesity related metabolic diseases. Best Pract Res Clin Endocrinol Metab 2013; 27: 163–177.
- [3] Reaven G, Abbasi F, McLaughlin T. Obesity, insulin resistance, and cardiovascular disease. Recent Prog Horm Res 2004; 59: 207–223.
- [4] Haffner SM, Lehto S, Ronnemaa T, et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998; 339: 229–234.
- [5] Albaugh VL, Flynn CR, Tamboli RA, Abumrad NN. Recent advances in metabolic and bariatric surgery. F1000Res 2016; 5: F1000 Faculty Rev–978.
- [6] Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet 2017; 389: 2239–2251.
- [7] Johnston SS, Conner C, Aagren M, et al. Evidence linking hypoglycemic events to an increased risk of acute cardiovascular events in patients with type 2 diabetes. Diabetes Care 2011; 34: 1164–1170.
- [8] Nuhoho S, Gupta J, Hansen BB, et al. Orally Administered Semaglutide Versus GLP‑1 RAs in Patients with Type 2 Diabetes Previously Receiving 1‑2 Oral Antidiabetics: Systematic Review and Network Meta‑Analysis. Diabetes Ther 2019; 10: 2183–2199.
- [9] Buse JB, Klonoff DC, Nielsen LL, et al. Metabolic effects of two years of exenatide treatment on diabetes, obesity, and hepatic biomarkers in patients with type 2 diabetes: an interim analysis of data from the open‑label, uncontrolled extension of three double‑blind, placebo‑controlled trials. Clin Ther 2007; 29: 139–153.
- [10] Christensen M, Knop FK, Vilsboll T, Holst JJ. Lixisenatide for type 2 diabetes mellitus. Expert Opin Investig Drugs 2011; 20: 549–557.
- [11] Montanya E, Sesti G. A review of efficacy and safety data regarding the use of liraglutide, a once‑daily human glucagon‑like peptide 1 analogue, in the treatment of type 2 diabetes mellitus. Clin Ther 2009; 31: 2472–2488.
- [12] Holman RR, Bethel MA, Mentz RJ, et al. Effects of Once‑Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2017; 377: 1228–1239.
- [13] Scheen AJ. Dulaglutide for the treatment of type 2 diabetes. Expert Opin Biol Ther 2017; 17: 485–496.
- [14] Goldenberg RM, Steen O. Semaglutide: Review and Place in Therapy for Adults With Type 2 Diabetes. Can J Diabetes 2019; 43: 136–145.
- [15] Lavernia F, Blonde L. Clinical review of the efficacy and safety of oral semaglutide in patients with type 2 diabetes compared with other oral antihyperglycemic agents and placebo. Postgrad Med 2020: 132(sup 2): 15–25.
- [16] Deacon CF, Mannucci E, Ahren B. Glycaemic efficacy of glucagon‑like peptide‑1 receptor agonists and dipeptidyl peptidase‑4 inhibitors as add‑on therapy to metformin in subjects with type 2 diabetes‑a review and meta analysis. Diabetes Obes Metab 2012; 14: 762–767.
- [17] Madsbad S, Kielgast U, Asmar M, et al. An overview of once‑weekly glucagon‑like peptide‑1 receptor agonistsavailable efficacy and safety data and perspectives for the future. Diabetes Obes Metab 2011; 13: 394–407.
- [18] Marso SP, Daniels GH, Brown‑Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375: 311–322.
- [19] Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double‑blind, randomised placebo‑controlled trial. Lancet 2019; 394: 121–130.
- [20] Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016; 375: 1834–1844.
- [21] Htike ZZ, Zaccardi F, Papamargaritis D, et al. Efficacy and safety of glucagon‑like peptide‑1 receptor agonists in type 2 diabetes: A systematic review and mixed‑treatment comparison analysis. Diabetes Obes Metab 2017; 19: 524–536.
- [22] Capehorn MS, Catarig AM, Furberg JK, et al. Efficacy and safety of once‑weekly semaglutide 1.0mg vs once‑daily liraglutide 1.2mg as add‑on to 1‑3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10). Diabetes Metab 2020; 46: 100–109.
- [23] Dungan KM, Povedano ST, Forst T, et al. Once‑weekly dulaglutide versus once‑daily liraglutide in metformin‑treated patients with type 2 diabetes (AWARD‑6): a randomised, open‑label, phase 3, non‑inferiority trial. Lancet 2014; 384: 1349–1357.
- [24] Pratley RE, Aroda VR, Lingvay I, et al. Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open‑label, phase 3b trial. Lancet Diabetes Endocrinol 2018; 6: 275–286.
- [25] Pratley R, Amod A, Hoff ST, et al. Oral semaglutide versus subcutaneous liraglutide and placebo in type 2 diabetes (PIONEER 4): a randomised, double‑blind, phase 3a trial. Lancet 2019; 394: 39–50.
- [26] Ryan DH, Lingvay I, Colhoun HM, et al. Semaglutide Effects on Cardiovascular Outcomes in People With Overweight or Obesity (SELECT) rationale and design. Am Heart J 2020; 229: 61–69.
- [27] Bailey CJ. Tirzepatide: a new low for bodyweight and blood glucose. Lancet Diabetes Endocrinol 2021; 9: 646–648.