Volba terapie – podobné sloučeniny, stejný účinek?
Již 38. kongres ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis), největší světové profesní organizace, která se věnuje porozumění roztroušené skleróze a její léčbě, se konal letos na konci října v Amsterodamu, Nizozemsko. Odbornému programu dominovala řada zajímavých přednášek. Následující řádky vám prezentují aktuálně řešené téma jedné z nich.
Pro léčbu roztroušené sklerózy (RS) je registrováno stále více přípravků. Roste počet léčiv, která působí podobným způsobem, např. zásahem do stejného receptoru. O tom, jak si vybrat z této rozšiřující se palety, vědět, kdy má změna léčby smysl a kdy ne a které rozdíly a podobnosti jsou důležité pro klinickou praxi, diskutovali s přítomnými v rámci sekce Setkání s odborníkem zkušení neurologové profesor Stephen Hauser (Department of Neurology at the University of California, San Francisco, Spojené státy americké) a profesor Ludwig Kappos (Klinik für Neurologie, Universitätsspital Basilej, Švýcarsko).
Ve společné prezentaci se věnovali terapeutickému rozhodování u relabující RS. Na jednoduchém schématu demonstrovali, že pro léčbu je hledáno léčivo primárně účinné a bezpečné. Léčiva, která jsou v praxi již třicet let a představovala dosud terapii první linie, glatiramer acetát a interferony, jsou velmi bezpečná. Jsou rovněž účinná, nicméně jejich efekt není velkolepý. Krátce po roce 2020 začala vstupovat do léčby RS další léčiva, s vyšší účinností, z hlediska bezpečnosti však rizikovější. Strategie léčby se v té době řídila posloupností od léčiv zavedených, bezpečnějších k léčivům účinnějším, rizikovějším při potřebě eskalace léčby (obr. 1).
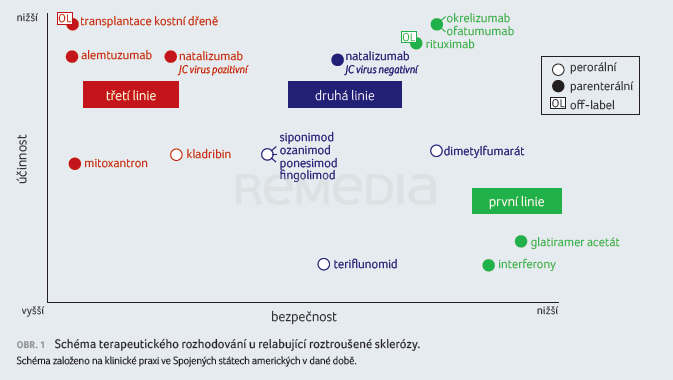
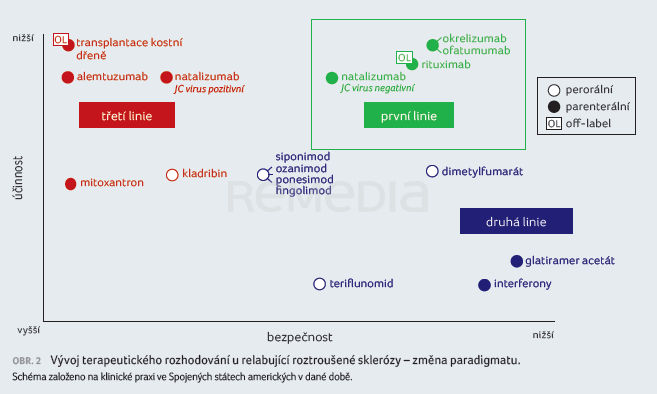
Paleta léčiv se postupně rozšířila a vedla ke změně paradigmatu. V první linii léčby jsou nyní u většiny nově diagnostikovaných pacientů voleny vysoce účinné přípravky, přijatelné z hlediska bezpečnosti (obr. 2). Profesor Hauser také poznamenal, že výsledky dlouhodobých sledování jsou u některých novějších léčiv již dostupné a přinášejí zajímavá zjištění, která možná povedou k přehodnocení rizikovosti těchto přípravků.
Profesor Kappos přiblížil probíhající revizi tzv. následných (follow‑on) terapií modifikujících onemocnění (disease modifying therapy, DMT), které vstupují na trh s léčivy po vypršení platnosti patentu originálních léčiv. Ceny léčivých přípravků jsou tím, co zejména přispívá k vysokým nákladům na péči o pacienty trpící RS. Ve Spojených státech amerických, Evropě a Latinské Americe již byly schváleny tři generické přípravky glatiramer acetátu a další DMT indikované pro léčbu relabující RS čeká vypršení platnosti patentů. Generika nebo biosimilars potenciálně poskytují plátcům a pacientům nižší ceny a úspory nákladů. Ve složitosti vývoje, regulačním schvalování a marketingu jsou však mezi těmito a novými léky důležité rozdíly.
Moss a Cohen ve své práci nastiňují pozadí a poskytují informace o vývoji této problematiky [1]. Není požadováno, aby následný produkt byl identický, ale pouze „srovnatelný“ nebo „vysoce podobný“ bez klinicky významných rozdílů v potenci, bezpečnosti a čistotě. Obecné limity ekvivalence jsou stanoveny na 80–125 %. Profesor Kappos uvedl, že postoj je na zvážení každého lékaře, nicméně regulační úřady se snaží nastavit pevná pravidla. Vývoj těchto přípravků představuje kompromis; příliš uvolněné požadavky mohou ohrozit účinnost nebo bezpečnost, příliš striktní požadavky jsou demotivací pro farmaceutické společnosti. Zaměnitelnost představuje vyšší standard než ekvivalence. Očekává se, že přípravek vyvolá stejný klinický efekt u jakéhokoliv pacienta, kterému je podán (sledována je například aktivita na magnetické rezonanci). Práce uvádí, že při opakovaném podání nejsou rizika z hlediska bezpečnosti a snížené účinnosti v rámci přechodu (switch) větší než při pokračujícím používání referenčního přípravku [1]. Daný zaměnitelný přípravek může být nahrazen originálním lékem bez schválení zdravotníka.
Na základě dosavadních důkazů probíhá hledání konsenzu, který by usnadnil rozhodování o léčbě. Konsenzuální doporučení zaměřené na Evropu publikované v letošním roce podporuje použití „následných“ DMT u pacientů s RS [2]. Jeho závěry podpořilo více než 80 % účastníků panelu. Follow‑on DMT schválené ve vysoce regulovaných oblastech lze považovat za účinné a bezpečné jako jejich referenční produkty a publikovaná data podporují jejich použití u pacientů s RS. Profesor Kappos uvedl, že by se jejich použití nebál, jde o důvěru v regulační autority, které se snaží zajistit kvalitní léčbu. Přípravky mohou být hodnoceny případ od případu, ne vždy je u nich vyžadováno klinické hodnocení fáze III. Je nutná dlouhodobá farmakovigilance a transparentnost, zatím chybějí důkazy pro vícenásobnou změnu léčby.
Při volbě terapie je třeba zvážit vždy řadu hledisek. Přednášející se zaměřili na anti‑CD20 léčbu. K zamyšlení připomněli, že dlouhá léta používaný rituximab je podáván v dávce, která byla stanovena pro jiná onemocnění, neproběhly u něho studie hledající optimální dávku pro léčbu RS. Stejně je třeba vzít v potaz rozdíly v imunogenicitě, rituximab má povahu chimérické myší/lidské protilátky a reakce na podání léčiva jsou u této léčby proto výraznější. Vedle účinnosti a snášenlivosti terapie je v rámci lékové skupiny třeba zvážit cestu podání (infuzní léčba versus možnost domácí aplikace léčby), frekvenci podání a s nimi související compliance pacienta a náklady na péči o pacienta (ve Spojených státech cena infuze mnohonásobně převyšuje cenu léčiva). Tyto faktory nabyly obzvláště na významu v době covidu. Vždy je třeba je s pacientem prodiskutovat. Dotazy z auditoria se týkaly i načasování gravidity, dle přednášejících se směruje do období před podáním další dávky léčiva, někteří kolegové volí odsun následné dávky. Stejně tak je tomu u vakcinace – lékaři časují aplikaci vakcíny na dobu 2–4 týdny před dalším podáním léku nebo adekvátně prodlužují dávkový interval s cílem maximalizovat šance na vytvoření imunitní odpovědi. Profesor Hauser vyzdvihl dobrou T buněčnou odpověď na anti‑covid vakcinaci a jednoznačný přínos očkování u pacientů s RS z hlediska jejich rizikovosti. Dále uvedl, že anti‑CD20 terapie je provázena mírným setrvalým vzestupem výskytu infekcí, který však v uskutečněných sledováních nedosáhl statistické významnosti, a zdůraznil, že vždy je hlavní probrat s pacientem jeho historii před zahájením léčby a individuální charakteristiky.
Diskutována byla úprava B depleční terapie na základě hodnot B lymfocytů v krvi, otázka, zda je možné hodnoty použít pro monitoraci efektu léčby a při nízké hladině případně odložit následující dávku léku. Profesor Hauser připomněl, že je známo, že hodnoty B lymfocytů souvisejí s tělesnou hmotností. Na druhou stranu u všech těchto léčiv podáváme všem nemocným s RS stejnou dávku. Doporučuje přesto držet se navrženého schématu léčby s cílem zabránit progresi onemocnění bez ohledu na hodnoty B lymfocytů.
Přednášející se v závěru zaměřili na skupinu modulátorů sfingosin‑1‑fosfátových (S1P) receptorů, které tvoří další skupinu léčiv, jež jsou indikována u pacientů s RS a u nichž je doložen efekt na aktivitu nemoci a zpomalení atrofie mozku. Paleta S1P modulátorů se od doby registrace fingolimodu, prvního léčiva z této skupiny, rozšířila o ponesimod, siponimod a ozanimod. Nová léčiva se liší selektivitou vůči S1P receptorům i snášenlivostí, sledovanou zejména s ohledem na výskyt bradykardie. Odlišnosti je možné zaznamenat ve farmakokinetice léčiv a s tím související rychlosti obnovy hodnot T lymfocytů po přerušení léčby. Od ní se odvíjí termín, kdy už je možné zahájit novou léčbu a předejít relapsu nemoci. Otázky z auditoria se týkaly právě změny terapie a doporučovaného odstupu. Navzdory riziku reaktivace nemoci profesor Kappos nedoporučuje nedodržení doporučovaného nebo tzv. přemostění (bridging therapy) pomocí kortikosteroidů pro překlenutí období do zahájení nové léčby. Důvodem je i imunosupresivní efekt kortikoterapie.
Literatura
[1] Moss BP, Cohen JA. The emergence of follow‑on disease‑modifying therapies for multiple sclerosis. Mult Scler 2019; 25: 1560–1565.
[2] Brownlee WJ, Wolf C, Hartung HP, et al. Use of follow‑on disease‑modifying treatments for multiple sclerosis: Consensus recommendations. Mult Scler 2022; 28: 2177–2189.