Výsledky studie VERTIS CV
Souhrn:
Edelsberger T. Výsledky studie VERTIS CV. Remedia 2020; 30: 565–570.
VERTIS CV je recentní kardiovaskulární bezpečnostní studie s ertugliflozinem. Článek přináší souhrn primárních a sekundárních výsledků studie se zaměřením na účinky ertugliflozinu na výskyt kardiovaskulárních příhod, progresi srdečního selhání a chronického renálního onemocnění u vysoce rizikové skupiny pacientů s diabetem a manifestním aterosklerotickým postižením.
Summary:
Edelsberger T. Results of the VERTIS CV study. Remedia 2020; 30: 565–570.
VERTIS CV is a recent cardiovascular safety study with ertugliflozin. The article brings a summary of primary and secondary results of the study with a focus on ertuglifozin effects on the occurrence of cardiovascular events and heart failure and chronic renal disease progression in a high‑risk group of patients with diabetes and manifest atherosclerotic impairment.
Key words: ertugliflozin, SG-2 inhibitors, gliflozins, oral antidiabetics, type 2 diabetes mellitus, cardiovascular safety, heart failure
VERTIS CV (eValuation of ERTugliflozin
effIcacy and Safety CardioVascular outcomes trial) je recentní
kardiovaskulární (KV) bezpečnostní studie s ertugliflozinem,
která byla poprvé prezentována v letošním roce na kongresu
ADA (American Diabetes Association) [1]. Primárním cílem studie
bylo prokázat non inferioritu ertugliflozinu vůči placebu
s ohledem na výskyt závažných KV příhod (úmrtí,
nefatální infarkt myokardu nebo nefatální mozková příhoda).
Sekundárním cílem pak bylo potvrdit superioritu ertugliflozinu nad
placebem z hlediska vlivu na četnost KV úmrtí,
hospitalizací pro srdeční selhání nebo progresi diabetického
onemocnění ledvin.
Účinnost a bezpečnost nového zástupce skupiny inhibitorů společného transportu pro glukózu a sodík (sodium glucose co transporter 2, SGLT-2) ertugliflozinu komplexně zkoumá klinický program VERTIS. Jedná se o multicentrické, randomizované, dvojitě zaslepené, placebem nebo aktivním komparátorem kontrolované klinické studie fáze III, kterých se účastnilo celkem 4 863 pacientů s diabetem 2. typu. Ertugliflozin byl hodnocen v monoterapii a v kombinaci s metforminem a/nebo s inhibitorem dipeptidylpeptidázy 4 (DPP 4) sitagliptinem. Ertugliflozin byl rovněž hodnocen u pacientů s diabetem 2. typu se středně závažnou poruchou funkce ledvin v kombinaci se současnými způsoby léčby diabetu, včetně inzulinu a glimepiridu [2–13].
Uspořádání studie VERTIS CV
Do studie VERTIS CV bylo zařazeno
celkem 8 246 pacientů. Průměrný věk zařazených osob byl 64,4
roku, průměrná délka trvání diabetu 12,9 roku a hodnota
glykovaného hemoglobinu (HbA1c) při vstupu do studie
činila 8,3 % (DCCT). Při vstupu bylo aterosklerotické postižení
srdce, cerebrovaskulární onemocnění a periferní arteriální
onemocnění přítomno u 76,3 %, 23,1 %, resp. 18,8 %
pacientů. Manifestní srdeční selhání bylo dokumentováno
u 23,1 % a chronické onemocnění ledvin 3. stupně
u 21,6 % pacientů.
Pacienti byli randomizováni v poměru
1 : 1 : 1 k užívání ertugliflozinu v dávce
5 mg (n = 2 752), 15 mg (n = 2 747), nebo
k podávání placeba (n = 2 747) [14]. Výchozí
charakteristiky byly mezi jednotlivými skupinami dobře vyvážené,
pacienti byli ve vysoké míře léčeni antihypertenzivy,
statiny a dalšími léky sloužícími k sekundární
prevenci KV příhod (obr. 1, 2).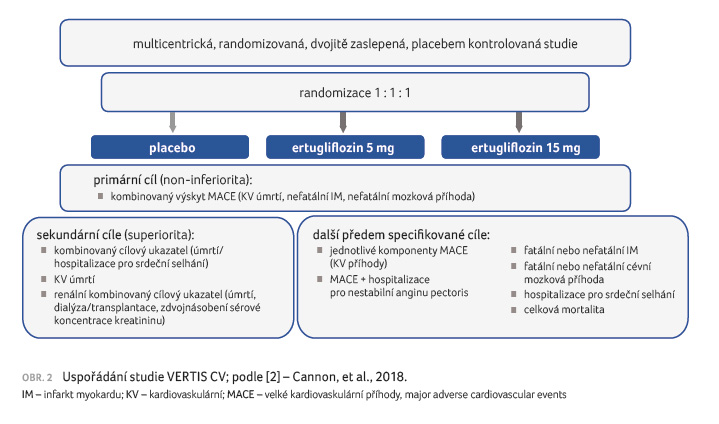
Populace pacientů zařazených do studie VERTIS CV byla většinově mužská, obézní a bělošská, s průměrnou vstupní hodnotou HbA1c 8,2 % a s trváním diabetu 13 let. Srdeční selhání bylo přítomno u 23,7 % studijní populace, což bylo až dvojnásobně více než v jiných studiích.
Výsledky studie VERTIS CV
Celkem 8 246 randomizovaných
pacientů bylo sledováno průměrně 3,5 roku. Z 8 238
pacientů, kteří dostali alespoň jednu dávku ertugliflozinu nebo
placeba, došlo k závažné KV příhodě u 653
z 5 493 pacientů (11,9 %) ve skupině
s ertugliflozinem a u 327 z 2 745 pacientů
(11,9 %) v placebové větvi (poměr rizik [hazard ratio, HR]
0,97; interval spolehlivosti [confidence interval, CI] 0,85–1,11;
p < 0,001 pro non inferioritu), graf 1.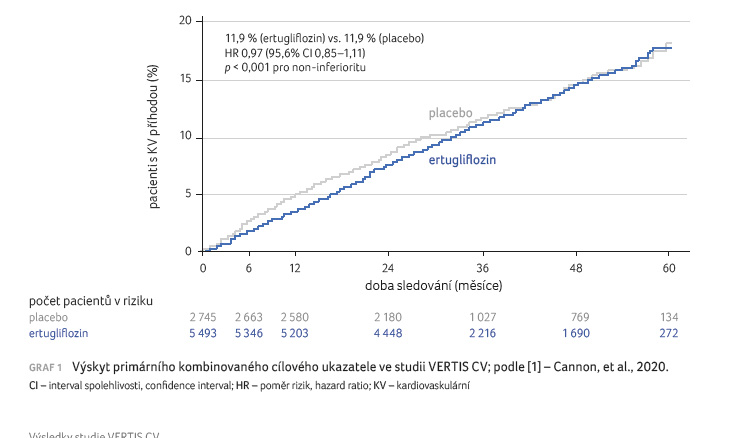
Smrt z KV příčin nebo
hospitalizace pro srdeční selhání se vyskytla u 444 z 5 499
pacientů (8,1 %) ve skupině s ertugliflozinem
a u 250 z 2 747 pacientů (9,1 %) ve skupině
s placebem (HR 0,88; 95,8% CI 0,75–1,03; p = 0,11
pro superioritu), graf 2A, B. Poměr rizik pro výskyt KV
úmrtí činil 0,92 (95,8% CI 0,77–1,11) a pro výskyt
renálního kombinovaného cílového ukazatele (úmrtí z renálních
příčin, dialýza nebo zdvojnásobení sérové koncentrace
kreatininu) 0,81 (95,8% CI 0,63–1,04). Amputace dolních končetin
byly provedeny u 54 pacientů (2,0 %) ze skupiny
léčené ertugliflozinem v dávce 5 mg a u 57 pacientů
(2,1 %) ze skupiny s léčbou ertugliflozinem v dávce
15 mg versus u 45 pacientů (1,6 %) ze skupiny placeba
[15].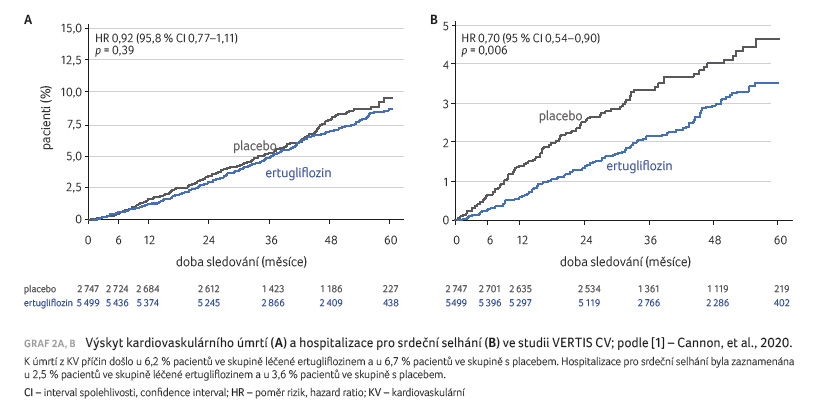
Ertugliflozin ve srovnání
s placebem očekávaně snížil během celé doby trvání
studie hodnoty HbA1c, tělesnou hmotnost a systolický
krevní tlak. Hodnota HbA1c po 18 týdnech léčby
byla ve skupině užívající ertugliflozin v dávce 5 mg
i 15 mg o 0,5 % nižší oproti placebu (p < 0,0001),
graf 3. Průměrný rozdíl ve snížení tělesné
hmotnosti při léčbě ertugliflozinem oproti placebu činil 2,4 kg
při podávání dávky 5 mg a 2,8 kg při podávání dávky
15 mg.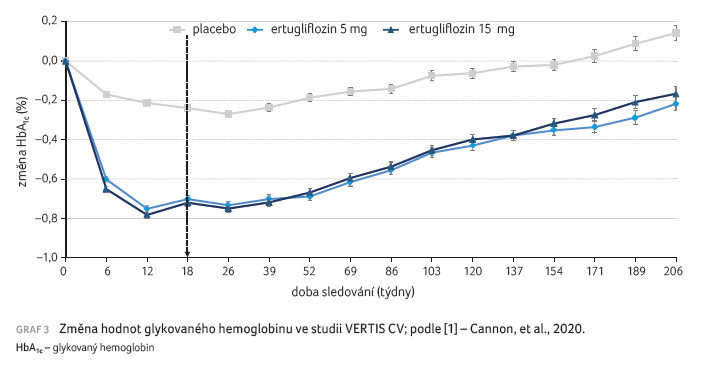
K hospitalizaci pro srdeční selhání došlo u 2,5 % pacientů léčených ertugliflozinem ve srovnání s 3,6 % ze skupiny placeba (p = 0,006). Doba do první hospitalizace pro srdeční selhání byla 0,73 vs. 1,05 příhody/100 pacientoroků při podávání ertugliflozinu, resp. placeba (HR 0,70; 95% CI 0,54–0,90; p = 0,006). Přínos léčby ertugliflozinem byl konzistentní bez ohledu na jeho dávku. Při analýze podskupin byly účinky výraznější u pacientů s odhadovanou glomerulární filtrací (estimated glomerular filtration rate, eGFR) < 60 ml/min (p = 0,04) a za přítomnosti makro nebo mikroalbuminurie (p = 0,04) a u pacientů užívajících diuretika (p = 0,02).
Překvapivě nízký efekt mělo ve srovnání s dalšími glifloziny podávání ertugliflozinu na progresi renálního onemocnění. Jako možnou příčinu uvádějí autoři publikovaných výsledků rozdíly v definici tzv. kombinovaného renálního cílového ukazatele v jednotlivých studiích. Zajímavé je, že nižší dávka, tedy 5 mg ertugliflozinu, vykazovala výraznější renoprotektivní efekt.
Nežádoucí účinky ertugliflozinu
Předcházející klinické studie programu VERTIS prokázaly, že bezpečnostní profil ertugliflozinu je podobný jako u ostatních molekul ze skupiny gliflozinů, tedy léčbu provází zvýšený výskyt genitálních mykotických infekcí, infekcí močových cest, hypotenze při poškození ledvin a euglykemická ketoacidóza. Obecně platí, že pacienti s diabetem mají významně větší riziko močových a genitálních infekcí ve srovnání s nediabetickými pacienty. Mezi diabetické pacienty s obzvláště vysokým rizikem patří pacienti se špatnou glykemickou kontrolou (HbA1c > 8,5 %), pacienti ve vyšším věku, ženy a osoby s anamnézou infekce močových cest v předchozích dvou letech.
Léčba ertugliflozinem byla ve studii
VERTIS CV bezpečná a byla dobře snášena s bezpečnostním
profilem, který odpovídá známým rizikům třídy inhibitorů
SGLT-2. Zaznamenané nežádoucí účinky blíže uvádí tabulka 1. Infekce močových cest a genitální mykotické infekce
byly významně četnější ve skupinách s ertugliflozinem
oproti placebu, zatímco frekvence výskytu akutního
selhání ledvin se ve skupině ertugliflozinu
oproti skupině placeba nelišila. Rovněž výskyt diabetické
ketoacidózy či amputací dolních končetin se nelišil ve skupině
léčené ertugliflozinem nebo placebem.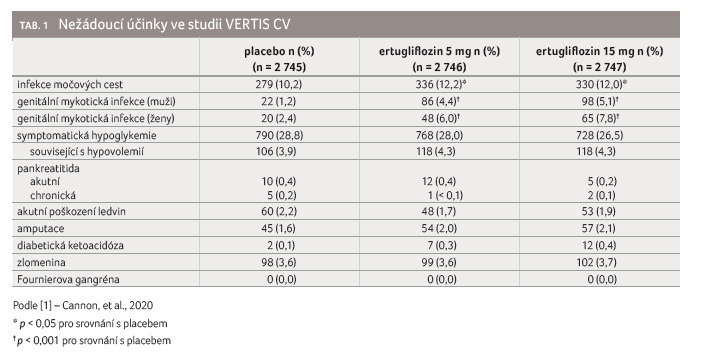
Srdeční selhání a inhibitory
SGLT-2 (class effect)
Přestože inhibitory SGLT-2 byly primárně vyvinuty k léčbě diabetu, poněkud překvapivé výsledky ukončených klinických studií podnítily odbornou veřejnost i farmaceutické firmy zaměřit se na intenzivnější sledování léčivého účinku inhibitorů SGLT-2 na srdeční selhání. V reakci na to tvůrci studie VERTIS CV v roce 2016 zdvojnásobili velikost studované populace na 8 246 pacientů a do hodnocení připojili sekundární cíle sledující superioritu ertugliflozinu z hlediska výskytu KV příhod a progrese diabetické nefropatie.
Výsledek hodnocení empagliflozinu ve studii EMPA REG OUTCOME také přiměl modifikovat protokol studie DECLARE TIMI 58; studie se v tomto případě zaměřila i na kombinovaný parametr složený z KV mortality a hospitalizace pro srdeční selhání. I díky tomu splnil dapagliflozin tento sekundární cíl, zejména snížením rizika progrese srdečního selhání o 27 % [16].
V loňském roce publikované výsledky studie DAPA HF (Study to Evaluate the Effect of Dapagliflozin on the Incidence of Worsening Heart Failure or Cardiovascular Death in Patients With Chronic Heart Failure) s dapagliflozinem dokumentují 26% snížení počtu KV úmrtí nebo progrese srdečního selhání u pacientů se srdečním selháním se sníženou ejekční frakcí levé komory, aniž by byla zohledněna přítomnost diabetu (HR 0,74; 95% CI 0,65–0,85; p < 0,001) [17].
A nejčerstvější data o působení inhibitorů SGLT-2 na chronické srdeční selhání přinesla studie EMPEROR Reduced (Empagliflozin Outcome Trial in Patients With Chronic Heart Failure with Reduced Ejection Fraction), ve které vedlo užívání empagliflozinu rovněž u pacientů se srdečním selháním se sníženou ejekční frakcí a bez ohledu na diabetes mellitus k redukci počtu KV úmrtí nebo hospitalizací pro srdeční selhání o 25 % (HR 0,75; 95% CI 0,65–0,86, p < 0,001) [18].
Výsledky těchto studií výrazně podporují druhou samostatnou indikaci pro využití gliflozinů, kterou je léčba srdečního selhání bez ohledu na přítomnost či absenci diabetu. Vzhledem k průkaznému snížení počtu hospitalizací pro srdeční selhání ve všech studiích s inhibitory SGLT-2 lze v tomto případě mluvit téměř s jistotou o tzv. class effect celé třídy antidiabetik.
Srovnání studie VERTIS CV
s dalšími KV studiemi inhibitorů SGLT-2
Kardiovaskulární a renální bezpečnost inhibitorů SGLT-2 se zkoumala nebo se stále ještě zkoumá v několika velkých studiích. Ve čtyřech z nich byl primární cílový ukazatel tvořen tzv. 3P MACE (KV mortalita, nefatální infarkt myokardu, nefatální cévní mozková příhoda), ve dvou případech byl zaměřen na zhoršení renálních parametrů a v dalších studiích představuje primární cílový ukazatel kombinaci progrese srdečního selhání a KV mortality u osob s chronickým srdečním selháním.
Prvním inhibitorem SGLT-2, který prokázal v randomizované studii fáze III příznivý účinek na redukci počtu KV příhod, byl empagliflozin ve studii EMPA REG OUTCOME, publikované v roce 2015. Riziko vzniku KV příhod bylo při léčbě empagliflozinem sníženo o 14 % ve srovnání s placebem (HR 0,86; 95% CI 0,74–0,99, p = 0,038). Empagliflozin také významně snížil riziko hospitalizace pro srdeční selhání o 35 % (HR 0,65; 95% CI 0,50–0,85) a celkovou mortalitu o 32 % (HR 0,68; 95% CI 0,57–0,82).
Data o KV bezpečnosti kanagliflozinu pocházejí především ze dvou samostatných studií CANVAS a CANVAS R. Ve srovnání s placebem vedlo podávání kanagliflozinu k redukci výskytu KV příhod o 14 % (HR 0,86; 95% CI 0,75–0,97, p = 0,02), čímž bylo splněno kritérium pro non inferioritu.
Do studie DECLARE TIMI 58 s dapagliflozinem bylo zařazeno úctyhodných 17 160 pacientů, z toho 10 186 bez aterosklerotických KV onemocnění, s mediánem doby sledování 4,2 roku. Dapagliflozin vedl k nižší míře výskytu KV příhod (8,8 % ve skupině s dapagliflozinem a 9,4 % ve skupině s placebem; HR 0,93; 95% CI 0,84–1,03).
Vzhledem k tomu, že ertugliflozin je již čtvrtým zástupcem ze skupiny inhibitorů SGLT-2, byla součástí prezentace výsledků studie VERTIS CV na kongresu ADA 2020 i metaanalýza, resp. srovnání ostatních velkých KV studií s glifloziny.
Kumulované výsledky výše zmíněných
studií a studie VERTIS CV (tab. 2) [19] potvrzují, že
účinky inhibitorů SGLT-2 na KV a renální výsledky
vykazují podobný trend, přestože je nutné brát v potaz
rozdíly v uspořádání jednotlivých studií
i v charakteristikách jednotlivých studovaných populací.
Největší přínos z pohledu KV onemocnění je patrný pro
snížení rizika progrese srdečního selhání a progrese
chronického onemocnění ledvin.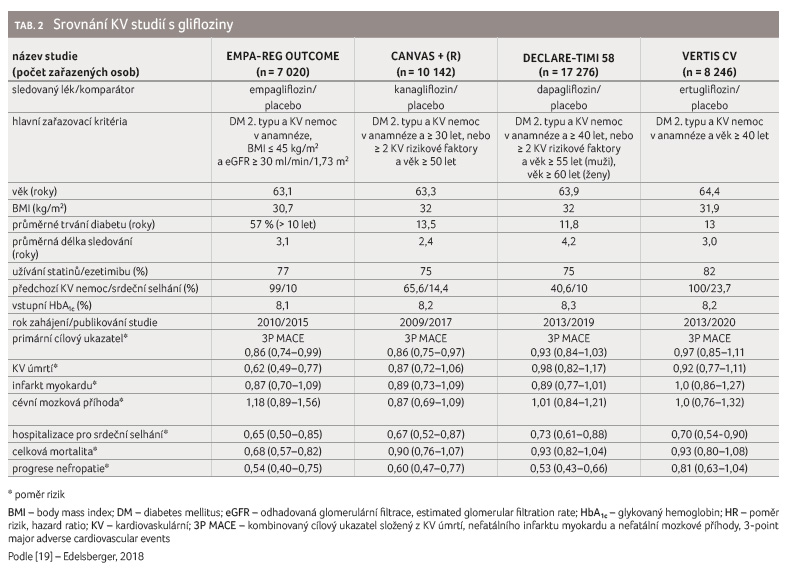
Metaanalýzy studií s glifloziny tak podporují současná doporučení odborných společností upřednostnit použití inhibitorů SGLT-2 u pacientů s diabetem 2. typu s vysokým KV a renálním rizikem [1,20–22].
Závěr
Ertugliflozin představuje účinný a bezpečný inhibitor SGLT-2. Stejně jako ostatní glifloziny má prokazatelný efekt při snižování hodnot glykovaného hemoglobinu, krevního tlaku a tělesné hmotnosti, a to jak v monoterapii, tak v kombinaci s dalšími antidiabetiky [13].
Jedná se o čtvrtý lék ze skupiny inhibitorů SGLT-2, který potvrdil svou KV bezpečnost. Je zřejmé, že existuje konzistentní „class effect“, pokud jde o snížení počtu hospitalizací pro srdeční selhání, ale statisticky významné snížení výskytu KV příhod bylo prokázáno pouze u kanagliflozinu a empagliflozinu. Na rozdíl od kanagliflozinu nebyly v případě ertugliflozinu zaznamenány žádné varovné signály týkající se amputací. Je otázkou, zda jsou příznivé účinky ertugliflozinu ve srovnání s kanagliflozinem a empagliflozinem vyplývající z výsledků studie VERTIS CV důsledkem rozdílů v populaci pacientů napříč studiemi (zejména podíl pacientů v primární a sekundární KV prevenci, doprovodná léčby statiny atd.), nebo zda jde o skutečný biologický rozdíl v účinnosti jednotlivých molekul.
Studie VERTIS CV dosáhla svého primárního cíle, tedy průkazu non inferiority ertugliflozinu z hlediska výskytu KV příhod (MACE) ve srovnání s placebem u vysoce rizikové skupiny pacientů s diabetem 2. typu a přítomným aterosklerotickým postižením. Rovněž poskytla další silné důkazy o KV bezpečnosti inhibitorů SGLT-2 a o jejich přidaném efektu na chronické srdeční selhání.
Seznam použité literatury
- [1] Cannon CP, McGuire DK, Cherney D, et al. Results of the eValuation of ERTugliflozin EffIcacy and Safety CardioVascular Outcomes Trial (VERTIS CV). Presented at: 80th American Diabetes Association Scientific Sessions; June 16, 2020. Symposium.
- [2] Terra SG, Focht K, Davies M, et al. Phase III, efficacy and safety study of ertugliflozin monotherapy in people with type 2 diabetes mellitus inadequately controlled with diet and exercise alone. Diabetes Obes Metab 2017; 19: 721–728.
- [3] Aronson R, Frias J, Goldman A, et al. Long‑term efficacy and safety of ertugliflozin monotherapy in patients with inadequately controlled T2DM despite diet and exercise: VERTIS MONO extension study. Diabetes Obes Metab 2018: 20: 1–8.
- [4] Rosenstock J, Frias J, Páll D, et al. Effect of ertugliflozin on glucose control, body weight, blood pressure and bone density in type 2 diabetes mellitus inadequately controlled on metformin monotherapy (VERTIS MET) Diabetes Obes Metab 2018; 20: 520–529.
- [5] Gallo, S, Charbonnel, B, Goldman, A, et al. Long‐term efficacy and safety of ertugliflozin in patients with type 2 diabetes mellitus inadequately controlled with metformin monotherapy: 104‐week VERTIS MET trial. Diabetes Obes Metab 2019; 21: 1027–1036.
- [6] Pratley R, Eldor R, Golm G, et al. Safety and efficacy of ertugliflozin plus sitagliptin versus either treatment alone in subjects with type 2 diabetes inadequately controlled with metformin: the VERTIS FACTORIAL trial. Poster presented at: EASD 2016 52nd European Association for the Study of Diabetes; September 15 2016; Munich, Germany.
- [7] Pratley R, Raji A, Eldor R, et al. Safety and efficacy of ertugliflozin plus sitagliptin vs. either treatment alone after 52 weeks in subjects with T2DM inadequately controlled on metformin: VERTIS FACTORIAL trial extension. Oral presentation at: ADA 2017; June 9 2017; San Diego, CA.
- [8] Lauring B, Miller SS, Krumins T, et al. Safety and efficacy of ertugliflozin in combination with sitagliptin in subjects with T2DM inadequately controlled on diet and exercise: the VERTIS SITA Trial. Poster presented at: ADA 2017; June 8 2017; San Diego, CA.
- [9] Lauring B, Eldor R, Liu J, et al. Efficacy and safety of ertugliflozin in subjects with type 2 diabetes mellitus inadequately controlled on the dual combination of metformin and sitagliptin: the VERTIS SITA2 trial. Poster presented at: EASD 2016 52nd European Association for the Study of Diabetes; September 15 2016; Munich, Germany.
- [10] Liu J, Eldor R, Dagogo‑Jack S, et al. Safety and efficacy of ertugliflozin after 52 weeks in subjects with T2DM inadequately controlled on metformin and sitagliptin: results from the extension phase of the VERTIS SITA2 Trial. Oral presentation at: ADA 2017; June 9 2017; San Diego, CA.
- [11] Hollander P, Liu J, Hill J, et al. Safety and efficacy of ertugliflozin compared to glimepiride in patients with type 2 diabetes inadequately controlled on metformin: the VERTIS SU trial. Poster presentation at: EASD 2017; Lisbon, Portugal.
- [12] Grunberger G, Camp S, Johnson J, et al. Ertugliflozin in Patients with Stage 3 Chronic Kidney Disease and Type 2 Diabetes Mellitus: The VERTIS RENAL Randomized Study. Diabetes Ther 2018; 9: 49–66.
- [13] Edelsberger T. Ertugliflozin. Remedia 2020; 30: 82–85.
- [14] Cannon CP, McGuire DK, Pratley R, et al. Design and baseline characteristics of the eValuation of ERTugliflozin effIcacy and Safety CardioVascular outcomes trial (VERTIS‑CV), Am Heart J 2018; 206: 11–23.
- [15] Cannon CP, Pratley R, Dagogo‑Jack S, et al. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med 2020; doi.org/10.1056/NEJMoa2004967.
- [16] Wiviott SD, Raz I, Bonaca MP, et al., on behalf of the DECLARE–TIMI 58 Investigators. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2019; 380: 347–357.
- [17] McMurray JJV, Solomon SD, Inzucchi ZE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019; 381: 1995–2008.
- [18] Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020; doi: 10.1056/NEJMoa2022190.
- [19] Edelsberger, T. Kardiovaskulární bezpečnost antidiabetik v roce 2018. Remedia 2018; 28: 433–440.
- [20] Zelniker TA, Wiviott SD, Raz I, et al. SGLT-2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta‑analysis of cardiovascular outcome trials. Lancet 2019; 393: 31–39 (Erratum in: Lancet 2019; 393: 30).
- [21] Zelniker TA, Wiviott SD, Raz I, et al. Comparison of the Effects of Glucagon‑Like Peptide Receptor Agonists and Sodium‑Glucose Cotransporter 2 Inhibitors for Prevention of Major Adverse Cardiovascular and Renal Outcomes in Type 2 Diabetes Mellitus. Circulation 2019; 139: 2022–2031.
- [22] Arnott C, Li Q, Kang A, et al. Sodium‑Glucose Cotransporter 2 Inhibition for the Prevention of Cardiovascular Events in Patients With Type 2 Diabetes Mellitus: A Systematic Review and Meta‑Analysis. J Am Heart Assoc 2020; 9: e014908.