Zacíleno na farmakologický efekt fingolimodu
Roztroušená skleróza (RS) představuje zánětlivé demyelinizační onemocnění centrální nervové soustavy. Imunopatogenetických pochodů se účastní T a B lymfocyty a pravděpodobně také autoprotilátky. Dostupná léčba modifikující průběh onemocnění (disease‑modifying therapy, DMT) se snaží různými způsoby ovlivnit nebo potlačit patologickou aktivitu imunitního systému. Imunomodulační efekt, který ovlivňuje distribuci a počet imunitních buněk, může mít vedle pozitivních účinků na aktivitu onemocnění i negativní efekt na obranyschopnost organismu, může představovat potenciální riziko z hlediska nežádoucích účinků (infekce) nebo ovlivňovat odpověď na vakcinaci a možnost imunizace.
Fingolimod, první schválená perorální DMT v léčbě RS, působí modulačně na sfingosin 1 fosfátové (S1P) receptory, které jsou potřebné pro vycestování lymfocytů z lymfatických uzlin. V důsledku modulace dochází k jejich internalizaci, degradaci a následně k signifikantnímu snížení počtu lymfocytů v periferní cirkulaci. Vedle gradientu S1P regulují výstup lymfocytů ze sekundárních lymfatických orgánů také vybrané chemokiny, které využívají chemokinový receptor CCR7. Jako zástupný znak se však namísto průkazu CCR7 stanovuje membránová molekula CD62L.
Hjorth a kolektiv [1] se ve své studii snažili detailně zmapovat změny počtu a zastoupení relevantních buněčných subpopulací a případný vztah k aktivitě nemoci u pacientů s RS léčených fingolimodem po dobu jednoho roku.
Metodika
Ke sledování bylo zavzato 19 nemocných s relabující remitující RS, u nichž bylo indikováno podávání fingolimodu, a 18 zdravých dobrovolníků, jejichž krevní vzorky byly použity pro srovnání výchozích hodnot populací lymfocytů. Vstupní charakteristiku obou skupin uvádí tabulka 1. Krevní vzorky hodnocených pacientů byly vyšetřeny před zahájením léčby a po roce (11−15 měsíců, medián 13 měsíců) podávání fingolimodu v dávce 0,5 mg denně. Průtokovou cytometrií byly analyzovány absolutní počty a relativní podíly subpopulací T, B lymfocytů a NK buněk.
Po roce podávání fingolimodu
byl u pacientů s RS hodnocen také klinický
a radiologický výstup (aktivita nemoci) s cílem zjistit,
jaký význam zde mají změny v počtech subpopulací
lymfocytů.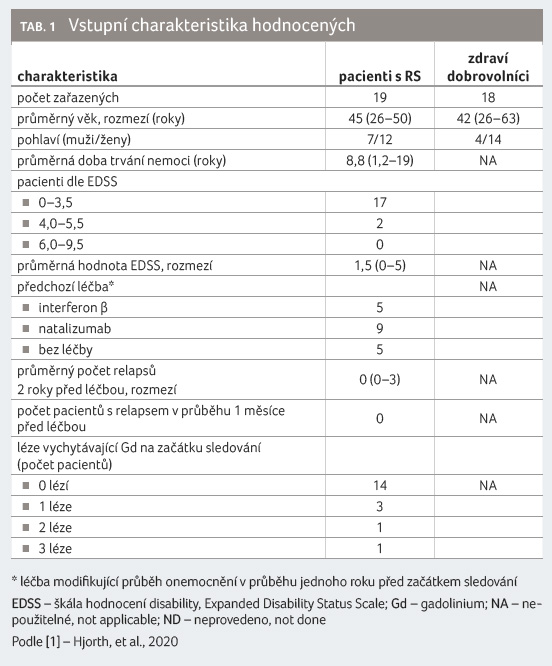
Výsledky
Změny v počtu buněčných linií
Výchozí počty
všech hlavních subpopulací lymfocytů byly u pacientů s RS
a u zdravých kontrol srovnatelné. Roční léčba
fingolimodem výrazně snížila celkový počet lymfocytů
v periferní krvi u všech pacientů. Nejvýraznější
redukce byla zaznamenána u populace pomocných
T (Th) lymfocytů a B lymfocytů
(p < 0,001).
Ke snížení počtu došlo i u cytotoxických T
lymfocytů, zatímco počet NK buněk byl ovlivněn pouze mírně;
jejich relativní zastoupení v krvi se oproti ostatním
lymfocytům zvýšilo, graf 1.
Tato zjištění jsou v souladu s předchozími klinickými
hodnoceními, demonstrují definovaný terapeutický účinek
fingolimodu.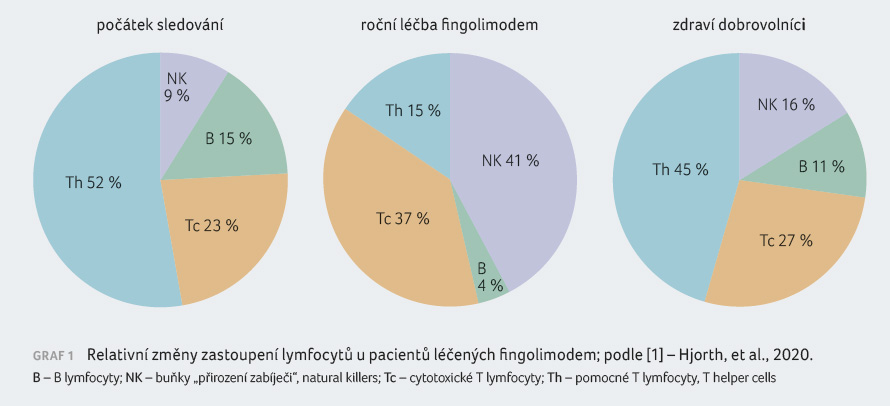
Podrobné vyšetření lymfocytárních subpopulací v periferní krvi (fenotypizace a stanovení počtu jednotlivých subpopulací pomocí průtokové cytometrie) přineslo nová zjištění. Ukazuje na odlišnosti v ovlivnění populace naivních a paměťových buněčných populací regulačních T (Treg) lymfocytů.
Snížen byl převážně počet naivních a centrálních paměťových (central memory, CM) Th lymfocytů a cytotoxických T lymfocytů (p < 0,001), což v souladu s předchozími zjištěními ukazuje, že buňky exprimující receptor CCR7 jsou ovlivněny nejvíce [2]. Méně výrazné snížení bylo pozorováno v subpopulaci efektorových paměťových (effector memory, EM) buněk (p < 0,001); tyto buňky zůstávají v oběhu, protože na svém povrchu neexprimují CCR7/CD62L. Stejně tak byly ve srovnání s celkovou populací Th lymfocytů relativně málo ovlivněny počty Treg lymfocytů (p < 0,001), které ve většině případů na svém povrchu také nemají CCR7 a CD62L.
Zaznamenáno bylo relativní zvýšení počtu paměťových Treg lymfocytů během léčby fingolimodem. Tyto buňky jsou považovány za klíčové imunomodulátory se supresivní schopností v autoimunitní odpovědi; již dříve se ukázalo [3], že fingolimod může v důsledku redukce počtu Th lymfocytů exprimujících CCR7 nepřímo zvrátit dysfunkci Treg u pacientů s RS (relativní zvýšení jejich počtu).
Absolutní počet NK buněk byl ovlivněn pouze mírně, jejich relativní zastoupení v porovnání s ostatními lymfocyty tedy vzrostlo. Většina NK buněk neexprimuje CCR7 a CD62L [4].
Hodnocení aktivity nemoci
Záměrem sledování bylo rovněž vyhodnotit, jestli se změny v počtu subpopulací lymfocytů v průběhu léčby fingolimodem odrážejí na klinickém a radiologickém výstupu. Po roce léčby byli pacienti rozděleni do dvou skupin podle aktivity nemoci. Devět pacientů vykazovalo stav NEDA (No Evidence of Disease Activity), tedy bez doložených relapsů, bez aktivity na magnetické rezonanci a bez progrese disability hodnocené na škále EDSS (Expanded Disability Status Scale), koncept NEDA 3. U deseti pacientů byla doložena aktivita nemoci, a to buď v podobě relapsu (n = 3), nové aktivity na magnetické rezonanci (n = 5), nebo jako progrese disability (n = 4).
Na první pohled se zhruba poloviční počet pacientů nedosahujících stavu NEDA jeví jako vysoký, nicméně pohledem na jednotlivé parametry – roční počet relapsů ve sledované kohortě byl 0,15, bez aktivity na magnetické rezonanci bylo 14 z 19 pacientů (74 %) a k progresi během roční léčby došlo u 4 pacientů (21 %) – data odpovídají dříve prezentovaným zjištěním z reálného prostředí [5].
Sledování rozdílů ve změnách počtu jednotlivých subpopulací buněk během léčby přineslo několik zjištění. U populace CM Th lymfocytů byla dříve prezentována asociace s výskytem relapsu během léčby [6]; v této práci nebyl rozdíl v CM populaci ve vztahu k aktivitě nemoci zaznamenán. U jedinců bez aktivity nemoci byl však pozorován vyšší počet TEMRA (terminálně diferencovaných efektorových paměťových) Th lymfocytů, a to jak na začátku sledování, tak po roce léčby. Vzhledem k nízkému počtu zařazených pacientů nelze z tohoto pozorování vyvodit pevné závěry, ale tento fakt by mohl být zajímavý z pohledu možné predikce odpovědi na léčbu fingolimodem na základě výchozího profilu lymfocytů u pacienta před léčbou.
Hlavní limitací této studie je relativně nízký počet sledovaných pacientů a předchozí léčba (nejednalo se o tzv. naivní pacienty, ačkoliv část nebyla poslední rok léčena). Se záměrem eliminovat možný vliv předešlé léčby na počty buněčných populací a zajistit relevantnost výsledků byli pacienti posuzováni i ve vztahu k normálním krevním hodnotám (u zdravých kontrol). Na druhou stranu je v reálném prostředí změna terapie (switch) na jinou DMT často potřebná a hodnocení tak více odpovídá dané klinické situaci.
Shrnutí
Léčba fingolimodem je v důsledku efektu blokování výstupu lymfocytů z lymfatických uzlin provázena poklesem počtu lymfocytů v periferní krvi. Nicméně jedná se o relativní redistribuci subpopulací lymfocytů, která nepředstavuje lymfopenii, ale specifickou alteraci distribuce imunoregulačních lymfocytů. Analýza buněčných podskupin doložila, že nejvíce byly zasaženy populace naivních a CM Th lymfocytů naproti tomu populace paměťových Treg lymfocytů byla relativně zachována.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Komentář: Zacíleno na farmakologický efekt fingolimodu
Prof. RNDr. Jan Krejsek, CSc.
Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové
Dovoluji si komentovat článek Zacíleno na farmakologický efekt fingolimodu, který se opírá o publikaci vydanou v časopise PLoS One, protože se v něm pracuje s informacemi, které mohou být pro neurology méně srozumitelné. Článek vychází z výsledků klinického výzkumu, který sledoval u relativně malé skupiny nemocných s roztroušenou sklerózou (RS) vliv léčby fingolimodem na klinický průběh onemocnění. Hledal k nim korelát stanovením dynamiky vybraných parametrů buňkami zprostředkované imunity měřených v periferní krvi za použití vícebarevné průtokové cytometrie. Jedním z cílů studie bylo hledání biomarkerů, které by měly výpovědní hodnotu jak pro hodnocení účinnosti léčby, tak pro sledování případných dopadů léčby na imunitní systém pacienta. Studie tohoto typu jsou postupně realizovány pro všechna nová léčiva, která jsou zaváděna s cílem tlumit poškozující zánět u nemocných s RS. Jsou to jednak malé molekuly, např. již zmíněný fingolimod, dimetylfumarát a kladribin, jednak biologika, zejména alemtuzumab, okrelizumab. Všechny tyto látky mají dopad na parametry především buňkami zprostředkované imunity měřitelné v periferní krvi. Studie jsou zaměřeny na dynamiku populací T a B lymfocytů, jejich funkčních subsetů, včetně paměťových buněk. Z přirozené imunity jsou studovány NK (natural killers, tzv. přirození zabíječi) buňky jako součást buněk ILC (innate lymphoid cells, vrozené imunitní buňky lymfoidní linie) a výjimečně také populace monocyto makrofágových buněk, subsety dendritických buněk.
Studie jsou prováděny, s ohledem na jejich náročnost, u poměrně omezeného počtu pacientů. Studovány jsou parametry, které jsou vybrány výzkumníky na základě jejich rozhodnutí z obrovského množství kombinací stanovení membránových (CD znaky) a nitrobuněčných molekul vícebarevnou (rutinně 8 barev, tj. současné stanovení 8 znaků) průtokovou cytometrií. To vše je příčinou toho, že se dosud nepodařilo nalézt dostatečně silné biomarkery, které by měly prediktivní váhu jak pro odhad účinnosti léčebných zásahů, tak pro zhodnocení negativního dopadu dané léčebné modality na protektivní imunitu.
V článcích, které jsou publikovány v časopisech specializovaných pro neurology, jsou prezentovány parametry buněčné imunity, které jsou málo srozumitelné dokonce pro klinické imunology. Jsou totiž odvozeny od výsledků studií, které byly realizovány především na zvířecích (myších) modelech. Nejedná se pouze o myší model EAE (experimentální autoimunitní encefalomyelitida), který slouží jako model pro studium RS. Jsou využívány práce publikované na základě výsledků výzkumu obecných základních mechanismů fungování imunitní soustavy jako významné součásti obranného i poškozujícího zánětu. Je třeba připustit, že v publikovaných klinických studiích jsou diskutována data, která byla získána právě ve studiích se zvířecími modely, jejichž výsledky byly volně extrapolovány na člověka. To je do určité míry možné, ale může to vést k vyvozování závěrů, které nejsou u lidí dostatečně podloženy. Vytrácí se schopnost interpretovat především imunofenotypizační nálezy získané v těchto klinických studiích.
V komentovaném článku jsou na základě membránových znaků odlišeny např. v populaci T lymfocytů „naivní T lymfocyty“, tj. T lymfocyty, které dosud nebyly stimulovány antigenem od několika funkčních subsetů, do kterých T lymfocyty vyzrávají po antigenní stimulaci. Autoři v článku využívají k jejich odlišení stanovení exprese CD45RA a CD62L. Naivní T lymfocyty jsou CD45RA+/CD62L+, tzv. centrální paměťové T lymfocyty (TCM) jsou CD45RA /CD62L+, efektorové paměťové T lymfocyty (TEM) jsou CD45RA /CD62L a terminálně diferencované efektorové paměťové T lymfocyty (TEMRA) jsou CD45RA+/CD62L . Autoři neměřili expresi receptoru CCR7 (CD197), který je obvykle využíván k definování těchto subsetů. Vycházejí přitom z dobře doloženého faktu, že dynamika exprese CCR7 odpovídá zhruba dynamice exprese CD62L. I z našich vlastních zkušeností (ústní sdělení dr. O. Součka) víme, že exprese CCR7 je více citlivá na preanalytické podmínky než exprese CD62L. Z uvedeného je zřejmé, že zde nastává i řada obtíží v laboratorní analytické fázi realizace takových studií. Prakticky nic se z práce nedozvídáme o konkrétní funkci výše uvedených subsetů T lymfocytů u člověka ani o klinických konsekvencích změn v těchto subsetech, které jsou indukovány léčbou fingolimodem. Upřímně řečeno, takové závěry nelze podle mého názoru v současnosti pro lidský systém vyvodit. O to více to bude platit pro individuální hodnocení konkrétního pacienta.
Závěrem lze konstatovat, že je velmi žádoucí, aby studie podobné projektu, jehož výsledky komentuji, byly realizovány s co největšími dobře definovanými soubory pacientů s RS a byly dlouhodobé. Potřebné budou zvláště u léčiv, u kterých se předpokládá „rekonstituce“ imunitního systému a očekává se dlouhodobý pozitivní léčebný účinek. U nich je třeba co nejlépe predikovat dopady nejen na protektivní zánět, ale především vyhodnotit rizika „indukce“ jiných imunopatologických (autoimunitních) onemocnění.
Seznam použité literatury
- [1] Hjorth M, Dandu N, Mellergård J. Treatment effects of fingolimod in multiple sclerosis: Selective changes in peripheral blood lymphocyte subsets. PLoS ONE 2020; 15: e0228380.
- [2] Mehling M, Brinkmann V, Antel J, et al. FTY720 therapy exerts differential effects on T cell subsets in multiple sclerosis. Neurology 2008; 71: 1261–1267.
- [3] Haas J, Schwarz A, Korporal‑Kunke M, et al. Fingolimod does not impair T‑cell release from the thymus and beneficially affects Treg function in patients with multiple sclerosis. Mult Scler 2015; 21: 1521–1532.
- [4] Berahovich RD, Lai NL, Wei Z, et al. Evidence for NK cell subsets based on chemokine receptor expression. J Immunol 2006; 177: 7833–7840.
- [5] Izquierdo G, Damas F, Paramo MD, et al. The real‑world effectiveness and safety of fingolimod in relapsing‑remitting multiple sclerosis patients: An observational study. PLoS One 2017; 12: e0176174.
- [6] Song ZY, Yamasaki R, Kawano Y, et al. Peripheral blood T cell dynamics predict relapse in multiple sclerosis patients on fingolimod. PLoS One 2014; 10: e0124923.