Arteriální hypertenze a fibrilace síní – zločinné spolčení
Souhrn
Kautzner J. Arteriální hypertenze a fibrilace síní – zločinné spolčení. Remedia 2024; 34: 82–88.
Arteriální hypertenze je jedním z nejčastějších rizikových faktorů pro vznik fibrilace síní. Vzhledem k tomu, že fibrilace síní není benigní arytmií a udržování sinusového rytmu přináší zlepšení prognózy (i u asymptomatických pacientů), je nezbytné u nemocných léčených pro hypertenzi aktivně pátrat po fibrilaci síní. Existuje celá řada možností od pouhé palpace pulzu při jakémkoliv kontaktu s pacientem až po různé formy nositelné elektroniky. V případě průkazu by měla být kromě antikoagulační léčby zvážena léčba směřující k udržení sinusového rytmu. V ní hraje stále větší roli katetrizační ablace, zejména v poslední době, kdy se používá pulzní pole. Důležité je i to, že vhodná léčba hypertenze může oddálit vznik fibrilace síní. Hlavní roli hrají inhibitory renin–angiotenzin–aldosteronového systému a diuretika.
Klíčová slova: arteriální hypertenze – fibrilace síní – screening – telemonitoring – katetrizační ablace.
Summary
Kautzner J. Arterial hypertension and atrial fibrillation – a criminal conspiracy. Remedia 2024; 34: 82–88.
Arterial hypertension is one of the most common risk factors of atrial fibrillation. Given the fact that atrial fibrillation is not a benign arrythmia and that sinus rhythm maintenance is associated with better prognosis (even in asymptomatic patients), active search for possible atrial fibrillation in patients treated for hypertension is necessary. Various possibilities are available – from simple pulse palpation during any contact with the patient to the use of a wide range of wearable electronic equipment. Once made, the diagnosis of atrial fibrillation should not only prompt anticoagulation therapy; attempts to restore and maintain the sinus rhythm should also follow. Catheter ablation has been used more and more often for this purpose lately, especially since the pulse field technique was introduced. One should keep in mind that an appropriate management of arterial hypertension may postpone the development of atrial fibrillation. Renin – angiotensin – aldosterone system inhibitors and diuretics play a crucial role here.
Key words: arterial hypertension – atrial fibrillation – screening – telemonitoring – catheter ablation.
Úvod
Arteriální hypertenze je nejčastějším kardiovaskulárním onemocněním s odhadovanou prevalencí okolo 30–45 % [1,2]. Zajímavé je, že prevalence se příliš neliší podle stavu ekonomiky v jednotlivých vyspělých zemích. Nicméně výrazně narůstá s věkem. Ve věku nad 60 let činí prevalence hypertenze již 60 %. Data ze Spojených států amerických ukazují, že okolo 17 % dospělých o své hypertenzi neví a že 10 % léčených pacientů nedosahuje cílových hodnot krevního tlaku navzdory podávání čtyř a více antihypertenziv [3].
Arteriální hypertenze poškozuje životně důležité orgány jako mozek, srdce a ledviny a je spojena s rizikem vzniku koronárních příhod. Toto riziko se liší podle věku a přítomnosti dalších rizikových faktorů (SCORE systém) [1]. Doporučené postupy týkající se diagnostiky a léčby hypertenze se zabývají detailně poškozením orgánů způsobeným hypertenzí [2]. Příčinou je především strukturní a funkční alterace arteriálního cévního řečiště. Překvapující je, že o fibrilaci síní (FS) a vztahu k arteriální hypertenzi se tato doporučení prakticky nezmiňují. Jediný krátký odstavec je věnován především metodice měření krevního tlaku při FS.
Přitom FS je nejčastější setrvalou arytmií u člověka a nejčastějším onemocněním spojeným s FS je právě arteriální hypertenze. Bohužel, mnoho lékařů nepovažuje FS za důležitou a nechápe řadu souvislostí spojených s jejím výskytem. Z toho vyplývá i často velmi laxní přístup k její léčbě. Cílem tohoto sdělení je proto zvýšit povědomí o vztahu arteriální hypertenze s FS a o nutnosti léčby obou klinických jednotek.
Je fibrilace síní benigní arytmií?
Studie porovnávající v minulosti dvě strategie léčby FS (kontrolu rytmu versus kontrolu frekvence) naznačily, že udržování sinusového rytmu nezlepšuje prognózu nemocných [4]. Podle předběžných dat z Ústavu zdravotnických informací a statistiky (ÚZIS) ČR postihuje u nás FS zhruba 4 % obyvatel a prevalence každým rokem narůstá o 7–8 %. Nejde přitom o benigní arytmii [5]. Fibrilace síní zvyšuje celkovou mortalitu 1,5–3,5násobně, a to u mužů i u žen. Zodpovídá za 20–30 % všech mozkových příhod a zhruba za 10 % tzv. kryptogenních příhod. Fibrilace síní vede často k srdečnímu selhání, a to jak se sníženou funkcí levé komory, tak především k selhání se zachovalou funkcí. Řada nemocných s tímto typem selhání má FS a její odstranění katetrizační ablací zlepšuje výrazně kvalitu života [6]. Fibrilace síní zvyšuje i riziko oběhové zástavy mimo nemocnici [7], zhoršuje kvalitu života nemocných a je příčinou řady hospitalizací. V neposlední řadě je asociována se zvýšeným výskytem demence [7]. Ta má zřejmě multifaktoriální příčinu – kromě embolizací a mikroembolizací snižuje FS perfuzi mozku a způsobuje zánětlivé změny.
Důležité je, že FS lze považovat za určitý indikátor nebo barometr stavu kardiovaskulárního systému [8]. Celá řada rizikových faktorů může působit nejprve na subklinické úrovni, což v konečném důsledku vede k rozvoji substrátu ve svalovině síní. Substrát má různou povahu, ale jde v podstatě o přestavbu síňové svaloviny, zvýšení množství tuku a fibrózy, přítomnost zánětlivých infiltrátů, ukládání amyloidu atd. Narušená hemodynamika se zvýšeným tlakem v levé síni a zvýšeným napětím ve stěně síní podněcuje vytváření ložiskových vzruchů (nejčastěji v plicních žílách) [9,10]. Tento mechanismus se uplatňuje právě u arteriální hypertenze. Substrát ve svalovině narušuje normální vedení vzruchu a způsobuje prodlužování epizod FS až do perzistující formy. Jindy může FS jako perzistující začít – obvykle již vlivem přítomnosti substrátu ve svalovině. Na druhou stranu narušuje přítomnost substrátu v síňové svalovině i funkci endokardu a uvolňování různých působků. To spolu s narušenou hemodynamikou při arytmii zvyšuje výrazně riziko rozvoje tromboembolismu. To je mimochodem jeden z důvodů, proč riziko tromboembolismu trvá i při sinusovém rytmu. Proto by pacienti s vyšším rizikem (např. podle CHA2DS2 VASc skóre) měli být léčeni antikoagulační léčbou trvale.
První manifestace FS by měla být vždy důvodem k podrobnému vyšetření a pátrání po rizikových faktorech, jako jsou hypertenze, diabetes mellitus, spánková apnoe atd. [5]. Vzhledem k tomu, že nejčastěji se u pacientů s FS vyskytuje hypertenze, je pátrání po ní na prvním místě. Může přitom jít jen o hraniční hodnoty vysokého tlaku. To dokumentuje anglická studie, která ukázala, že vzestup systolického tlaku o 20 mm Hg je provázen u mladších pacientů dvojnásobným rizikem rozvoje FS [11]. Nabízí se řada vysvětlení. Hypertenze je totiž provázena řadou hemodynamických změn, které vedou ke změnám arteriální tuhosti, k remodelaci síňové svaloviny, poruše autonomní regulace a aktivaci renin–angiotenzin–aldosteronového systému (RAAS). To vše může přispívat k rozvoji FS. Samozřejmě pacienti s genetickou predispozicí jsou ohroženi více.
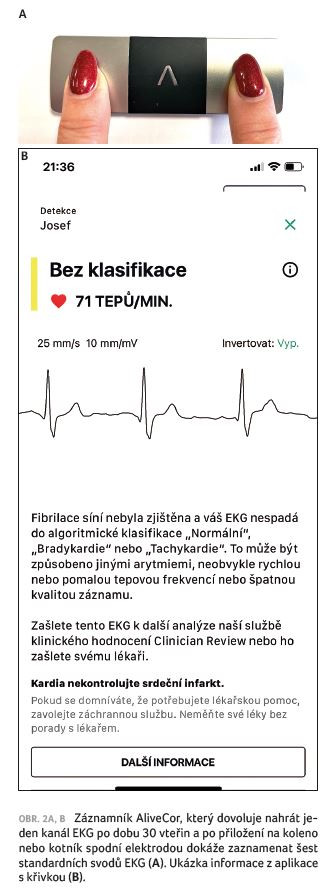
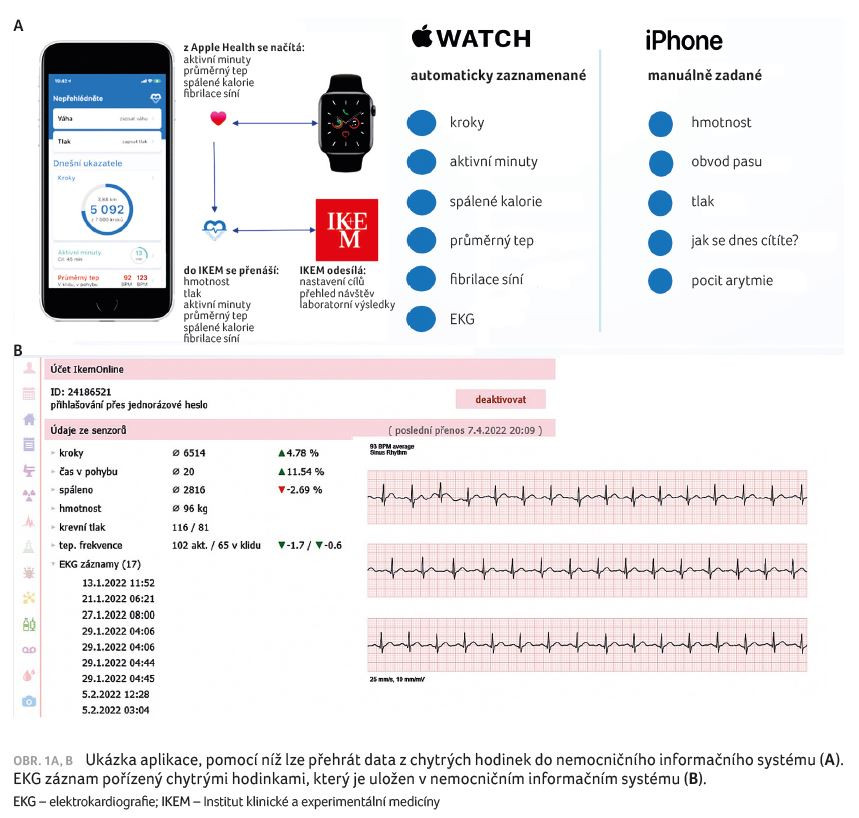 Je také prokázáno, že pacienti s FS a preexistující hypertenzí mají signifikantně více kardiovaskulárních událostí, jako jsou mozkové příhody nebo infarkt myokardu. Mají také vyšší mortalitu, počet revaskularizačních intervencí, větší výskyt tromboembolické choroby atd. [12]. Čím vyšší hodnoty krevního tlaku, tím je těchto událostí signifikantně více. Další práce se zabývaly vztahem mezi výskytem FS a typem arteriální hypertenze [13]. Ukázalo se, že nejvyšší výskyt FS má maskovaná hypertenze (dvojnásobné riziko vzniku arytmie proti normotenzním jedincům). Toto riziko bylo podobné u neléčené hypertenze. Naproti tomu tzv. hypertenze bílého pláště (tj. detekovaná pouze v ordinaci) měla riziko vzniku FS podobné jako normotenzní populace. Z těchto důvodů je doporučeno provádět u pacientů léčených pro arteriální hypertenzi screening zaměřený na detekci FS [14,15]. Intenzita screeningu by měla být odstupňovaná podle očekávané míry rizika detekce arytmie. U nemocných bez anamnézy mozkové příhody a mladších 65 let stačí oportunistický screening – tj. vyšetření pulzu při každém kontaktu s lékařem (např. při předpisu léků). U starších by měl být prováděn screening systematicky. Podobně u nemocných s anamnézou mozkové příhody. Prostředků pro systematický screening je dnes celá řada. Lze využít přístroje na měření tlaku s možností detekce arytmie, dále fotopletysmografické monitory (kam patří chytré hodinky), jednoduché ruční záznamníky, nalepovací monitory, různé varianty holterovské monitorace atd. Příkladem možného využití chytrých hodinek k monitoraci FS je projekt, který probíhá v Institutu klinické a experimentální medicíny (IKEM). Byl vyvinut ve spolupráci se společností Apple a dovoluje sledování pacientů a jejich EKG přenosem dat z hodinek přes aplikaci IKEM přímo do nemocničního informačního systému (obr. 1A, B). Kromě toho lze sledovat i další parametry jako pohybovou aktivitu nebo tělesnou hmotnost a krevní tlak. Máme také jako první na světě možnost přenášet přes mobilní aplikaci data z malého přenosného monitoru EKG s názvem AliveCor. Přiložením dvou prstů lze získat kvalitní záznam EKG a posoudit přítomnost arytmie (obr. 2A, B).
Je také prokázáno, že pacienti s FS a preexistující hypertenzí mají signifikantně více kardiovaskulárních událostí, jako jsou mozkové příhody nebo infarkt myokardu. Mají také vyšší mortalitu, počet revaskularizačních intervencí, větší výskyt tromboembolické choroby atd. [12]. Čím vyšší hodnoty krevního tlaku, tím je těchto událostí signifikantně více. Další práce se zabývaly vztahem mezi výskytem FS a typem arteriální hypertenze [13]. Ukázalo se, že nejvyšší výskyt FS má maskovaná hypertenze (dvojnásobné riziko vzniku arytmie proti normotenzním jedincům). Toto riziko bylo podobné u neléčené hypertenze. Naproti tomu tzv. hypertenze bílého pláště (tj. detekovaná pouze v ordinaci) měla riziko vzniku FS podobné jako normotenzní populace. Z těchto důvodů je doporučeno provádět u pacientů léčených pro arteriální hypertenzi screening zaměřený na detekci FS [14,15]. Intenzita screeningu by měla být odstupňovaná podle očekávané míry rizika detekce arytmie. U nemocných bez anamnézy mozkové příhody a mladších 65 let stačí oportunistický screening – tj. vyšetření pulzu při každém kontaktu s lékařem (např. při předpisu léků). U starších by měl být prováděn screening systematicky. Podobně u nemocných s anamnézou mozkové příhody. Prostředků pro systematický screening je dnes celá řada. Lze využít přístroje na měření tlaku s možností detekce arytmie, dále fotopletysmografické monitory (kam patří chytré hodinky), jednoduché ruční záznamníky, nalepovací monitory, různé varianty holterovské monitorace atd. Příkladem možného využití chytrých hodinek k monitoraci FS je projekt, který probíhá v Institutu klinické a experimentální medicíny (IKEM). Byl vyvinut ve spolupráci se společností Apple a dovoluje sledování pacientů a jejich EKG přenosem dat z hodinek přes aplikaci IKEM přímo do nemocničního informačního systému (obr. 1A, B). Kromě toho lze sledovat i další parametry jako pohybovou aktivitu nebo tělesnou hmotnost a krevní tlak. Máme také jako první na světě možnost přenášet přes mobilní aplikaci data z malého přenosného monitoru EKG s názvem AliveCor. Přiložením dvou prstů lze získat kvalitní záznam EKG a posoudit přítomnost arytmie (obr. 2A, B).
 Ke sjednocení vyšetřovacího postupu, byla připravena evropská doporučení pro diagnostiku FS u nemocných s hypertenzí [16]. Navrhují postup diagnostiky a zejména léčby (obr. 3).
Ke sjednocení vyšetřovacího postupu, byla připravena evropská doporučení pro diagnostiku FS u nemocných s hypertenzí [16]. Navrhují postup diagnostiky a zejména léčby (obr. 3).
Vyplatí se léčit fibrilaci síní?
![OBR. 3 Návrh na standardizovaný postup při vyšetření pacienta s hypertenzí a s podezřením na arytmii; podle [16] – Lip, et al., 2017. OBR. 3 Návrh na standardizovaný postup při vyšetření pacienta s hypertenzí a s podezřením na arytmii; podle [16] – Lip, et al., 2017.](https://www.remedia.cz/photo-pg-1328---.jpg) Řada dřívějších menších randomizovaných studií nedokumentovala rozdíl v mortalitě mezi strategií kontroly rytmu a kontroly frekvence při FS. Největší z nich byla studie AFFIRM, která randomizovala 4 060 pacientů po dobu čtyř let [17]. Její následná analýza ukázala, že studie měla řadu nedostatků. Jednak byli zařazováni pacienti, kteří arytmii tolerovali, a mohli být tedy randomizováni do jednoho ze dvou ramen. Jednak ve studii došlo k řadě zkřížení (tzv. cross‑over) u obou ramen. Antikoagulační léčbu měli všichni pacienti, nicméně v rameni kontroly rytmu bylo dovoleno při opakovaném průkazu sinusového rytmu po dobu čtyř (optimálně 12 týdnů) vysadit antikoagulancia. Analýza 2 796 pacientů tak, jak byli skutečně léčeni (on treatment), ukázala, že skutečná přítomnost sinusového rytmu byla spojena s významným poklesem mortality [18]. Na druhou stranu léčba antiarytmiky byla spojena se zvýšením mortality, avšak pouze po úpravě kvůli přítomnosti sinusového rytmu. Dalším lékem, který byl asociován s vyšší mortalitou, byl digoxin podávaný v rámci kontroly frekvence. Z retrospektivních dat nelze samozřejmě zjistit příčinnou souvislost. Další terapie spojená s poklesem mortality byla léčba warfarinem.
Řada dřívějších menších randomizovaných studií nedokumentovala rozdíl v mortalitě mezi strategií kontroly rytmu a kontroly frekvence při FS. Největší z nich byla studie AFFIRM, která randomizovala 4 060 pacientů po dobu čtyř let [17]. Její následná analýza ukázala, že studie měla řadu nedostatků. Jednak byli zařazováni pacienti, kteří arytmii tolerovali, a mohli být tedy randomizováni do jednoho ze dvou ramen. Jednak ve studii došlo k řadě zkřížení (tzv. cross‑over) u obou ramen. Antikoagulační léčbu měli všichni pacienti, nicméně v rameni kontroly rytmu bylo dovoleno při opakovaném průkazu sinusového rytmu po dobu čtyř (optimálně 12 týdnů) vysadit antikoagulancia. Analýza 2 796 pacientů tak, jak byli skutečně léčeni (on treatment), ukázala, že skutečná přítomnost sinusového rytmu byla spojena s významným poklesem mortality [18]. Na druhou stranu léčba antiarytmiky byla spojena se zvýšením mortality, avšak pouze po úpravě kvůli přítomnosti sinusového rytmu. Dalším lékem, který byl asociován s vyšší mortalitou, byl digoxin podávaný v rámci kontroly frekvence. Z retrospektivních dat nelze samozřejmě zjistit příčinnou souvislost. Další terapie spojená s poklesem mortality byla léčba warfarinem.
V mezidobí proběhly další studie týkající se léčby FS. Za zmínku stojí studie ATHENA, která jako jediná prokázala, že léčba paroxysmální FS antiarytmikem dronedaronem snížila mortalitu a výskyt dalších komponent společného cílového ukazatele [19]. Nicméně další studie PALLAS se stejným lékem u perzistující FS byla předčasně ukončena pro zcela opačný trend [20]. Aktuálně máme k dispozici data z velké evropské randomizované studie EAST‑AFNET 4 [21]. Ta randomizovala 2 789 pacientů s recentně vzniklou FS a rizikem tromboembolismu (CHA2DS2 VASc skóre 2 a více) do ramene časné léčby a ramene obvyklé léčby – tj. většinou kontroly tepové frekvence. Po mnohaletém sledování bylo zjištěno, že časná léčba směřující k udržení sinusového rytmu přinesla zlepšení prognózy. Ze čtyř komponent primárního cílového ukazatele studie byly statisticky významné dvě, a to kardiovaskulární mortalita a výskyt mozkových příhod (přestože byli pacienti v obou ramenech léčeni antikoagulační léčbou). Lze předpokládat, že kdyby bylo více nemocných v aktivní větvi léčeno katetrizační ablací FS, byl by výsledek ještě výraznější (v dané populaci podstoupilo jen 19,4 % pacientů ablaci arytmie v průběhu dvou let). Důležité je, že výsledky byly stejné i u pacientů, kteří byli při FS asymptomatičtí [22]. Z toho vyplývá, že FS je nutné léčit i v případech, kdy se u pacienta neobjevují žádné symptomy.
Role katetrizační ablace v léčbě fibrilace síní
Katetrizační ablace FS prodělala za poslední dvě dekády značný rozvoj. Stala se rutinní metodou léčby, především u symptomatických a mladších pacientů. Evropský registr EORP (EURObservational Research Programme) ukázal, že ablací lze dosáhnout udržení sinusového rytmu zhruba v 70 % případů [23]. Studie CABANA ukázala, že ablace přináší oproti podávání antiarytmik snížení rizika recidivy FS o 47 % [24]. Studie CASTLE‑AF u nemocných se srdečním selháním, implantovaným přístrojem a FS dokumentovala, že ablace přináší zlepšení prognózy a pokles počtu hospitalizací pro srdeční selhání [25]. Studie CASTLE‑HTx přinesla podobné výsledky i u nemocných s FS, kteří byli kandidáty na transplantaci srdce [26].
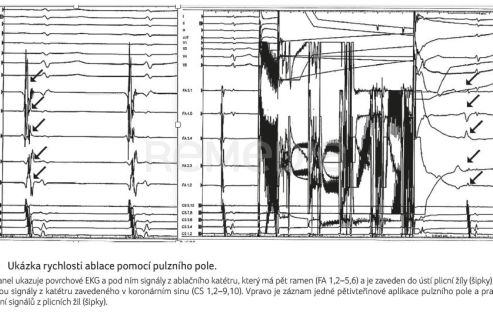 Podobně i u pacientů s hypertenzí a FS by měla být ablace FS indikována v případě rekurencí arytmie při antiarytmické léčbě [16]. Ablace může být terapií první volby u vybraných pacientů místo antiarytmik, a to v závislosti na volbě nemocného, zvažovaném přínosu a riziku. V této souvislosti je nezbytné zmínit skutečnost, že jsme v současné době svědky revoluce v oblasti katetrizační léčby FS. Začala se používat technologie pulzního pole, která dovoluje selektivní zničení myocytů s minimálním rizikem poškození okolních tkání. Výkon je velmi rychlý a bezpečný (obr. 4), neboť pulzní pole působí selektivně na myocyty a riziko poškození okolních tkání je zcela minimální. Navíc se ukazuje, že účinnost je alespoň tak dobrá jako u dříve používané radiofrekvenční ablace nebo kryoablace na nejlepších pracovištích. V České republice je v současnosti nejvyšší počet pacientů v přepočtu na jeden milion obyvatel, kteří jsou léčeni ablací pomocí pulzního pole. Je to z velké části důsledek toho, že vývoje jedné platformy se aktivně účastnilo centrum v Nemocnici Na Homolce [27]. Druhá platforma byla rozvíjena také v IKEM [28,29]. Obě pracoviště zahájila časně rutinní používání tohoto způsobu ablace a díky dosažení úhrady se léčba rozšířila na další centra. Centra se podílejí na sbírání dat v registru MANIFEST-PF [30,31]. Hlavní výhodou je rychlost provedení výkonu (lze provést do jedné hodiny), bezpečnost a podle dosavadních dat zřejmě i větší úspěšnost.
Podobně i u pacientů s hypertenzí a FS by měla být ablace FS indikována v případě rekurencí arytmie při antiarytmické léčbě [16]. Ablace může být terapií první volby u vybraných pacientů místo antiarytmik, a to v závislosti na volbě nemocného, zvažovaném přínosu a riziku. V této souvislosti je nezbytné zmínit skutečnost, že jsme v současné době svědky revoluce v oblasti katetrizační léčby FS. Začala se používat technologie pulzního pole, která dovoluje selektivní zničení myocytů s minimálním rizikem poškození okolních tkání. Výkon je velmi rychlý a bezpečný (obr. 4), neboť pulzní pole působí selektivně na myocyty a riziko poškození okolních tkání je zcela minimální. Navíc se ukazuje, že účinnost je alespoň tak dobrá jako u dříve používané radiofrekvenční ablace nebo kryoablace na nejlepších pracovištích. V České republice je v současnosti nejvyšší počet pacientů v přepočtu na jeden milion obyvatel, kteří jsou léčeni ablací pomocí pulzního pole. Je to z velké části důsledek toho, že vývoje jedné platformy se aktivně účastnilo centrum v Nemocnici Na Homolce [27]. Druhá platforma byla rozvíjena také v IKEM [28,29]. Obě pracoviště zahájila časně rutinní používání tohoto způsobu ablace a díky dosažení úhrady se léčba rozšířila na další centra. Centra se podílejí na sbírání dat v registru MANIFEST-PF [30,31]. Hlavní výhodou je rychlost provedení výkonu (lze provést do jedné hodiny), bezpečnost a podle dosavadních dat zřejmě i větší úspěšnost.
Je možné snížit pravděpodobnost rozvoje fibrilace síní léčbou arteriální hypertenze?
Existují data z řady studií, která ukazují, že léčba hypertenze (včetně hraniční hypertenze) a úprava dalších rizikových faktorů (např. diabetes mellitus, hypercholesterolemie, obezity) snižuje pravděpodobnost rozvoje FS. Například studie u pacientů s výší systolického tlaku mezi 130–139 mm Hg ukázala, že podávání ramiprilu snižuje výrazně riziko vzniku FS [32]. Studie RACE 3 zařadila symptomatické pacienty s FS a recentním vznikem srdečního selhání [33]. V aktivní větvi byla zahájena léčba antagonisty mineralokortikoidního receptoru, statiny, inhibitory angiotenzin konvertujícího enzymu (ACE) a pacienti podstoupili program kardiorehabilitace. Druhá větev byla léčena obvyklou léčbou. Po třech měsících podstoupili pacienti kardioverzi a byli sledováni. Po jednom roce byl zjištěn výrazně nižší výskyt FS v aktivní větvi. Podobná data ukazují studie zabývající se úpravou životního stylu a léčbou hypertenze, diabetes mellitus a dalších rizikových faktorů po katetrizační ablaci [34].
Co se týče vlastní léčby hypertenze, i zde existují rozdíly v dopadu určitého typu léčby na výskyt FS. Nejlepší data existují pro léky inhibující RAAS [35]. Metaanalýzy ukazují téměř 30% relativní redukci rizika rozvoje arytmie. V porovnání s podáváním kalciových blokátorů je léčba blokátory angiotenzinového receptoru v prevenci vzniku FS účinnější téměř o 30 % [36]. Dalším vhodným lékem, který prokazatelně snižuje rozvoj hypertrofie levé komory bez negativních dopadů na lipidový metabolismus, je indapamid [37]. Jeho účinek byl potvrzen v metaanalýze studií [38]. Podobně vede k regresi hypertrofie telmisartan [39]. Regrese hypertrofie levé komory je spojena s nižším výskytem FS [40]. V porovnání s inhibitory RAAS byl efekt diuretik na regresi hypertrofie levé komory vyšší [41]. Fixní kombinace inhibitoru ACE a indapamidu snižovala prokazatelně výskyt FS u diabetiků s hypertenzí ve studii ADVANCE [42]. K dispozici je rovněž fixní kombinace telmisartanu a indapamidu.
Závěry
Arteriální hypertenze je jedním z nejčastějších rizikových faktorů pro vznik fibrilace síní. Vzhledem k tomu, že fibrilace síní není benigní arytmií a udržování sinusového rytmu přináší zlepšení prognózy (i u asymptomatických pacientů), je nezbytné u nemocných léčených pro hypertenzi aktivně pátrat po fibrilaci síní. V případě průkazu by měla být kromě antikoagulační léčby zvážena léčba směřující k udržení sinusového rytmu. V ní hraje stále větší roli katetrizační ablace, zejména v poslední době, kdy se používá pulzní pole. Důležité je i to, že vhodná léčba hypertenze může oddálit vznik fibrilace síní. Hlavní roli hrají inhibitory renin–angiotenzin–aldosteronového systému a diuretika.
Podporováno výzkumným záměrem Ministerstva zdravotnictví České republiky pro rozvoj výzkumné organizace 00023001 (IKEM, Praha, ČR) – institucionální podpora – a dále projektem Národního institutu pro výzkum metabolických a kardiovaskulárních onemocnění – EXCELES, No LX22NPO5104 – podporováno EU.
Prof. MUDr. Josef Kautzner, CSc., FESC
Klinika kardiologie IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: joka@ikem.cz
Literatura
[1] Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens 2018; 36: 1953–2041.
[2] Unger T, Borghi C, Charchar F, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension 2020; 75: 1334–1357.
[3] Mozaffarian D, Benjamin EJ, Go AS, et al. Heart disease and stroke statistics‑2016 update: A Report from the American Heart Association. Circulation 2016; 133: e38–360.
[4] Caldeira D, David C, Sampaio C. Rate versus rhythm control in atrial fibrillation and clinical outcomes: updated systematic review and meta‑analysis of randomized controlled trials. Arch Cardiovasc Dis 2012; 105: 226–238.
[5] Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio‑Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42: 373–498.
[6] Sramko M, Wichterle D, Melenovsky V, et al. J Resting and exercise‑induced left atrial hypertension in patients with atrial fibrillation: The causes and implications for catheter ablation. JACC Clin Electrophysiol 2017; 5: 461–469.
[7] Rivard L, Friberg L, Conen D. Atrial fibrillation and dementia: A report from the AF‑SCREEN International Collaboration. Circulation 2022; 145: 392–409.
[8] Wyse DG, van Gelder IC, Ellinor PT, et al. Lone atrial fibrillation: does it exist? J Am Coll Cardiol 2014; 63: 1715–1723.
[9] Casaclang‑Verzosa G, Gersh BJ, Tsang TS. Structural and functional remodeling of the left atrium: clinical and therapeutic implications for atrial fibrillation. J Am Coll Cardiol 2008; 51: 1–11.
[10] Wyse DG, Gersh BJ. Atrial fibrillation: a perspective: thinking inside and outside the box. Circulation 2004; 109: 3089–3095.
[11] Emdin CS, Anderson SG, Salimi‑Khorshidi S, et al. Usual blood pressure, atrial fibrillation and vascular risk: evidence from 4.3 million adults. Int J Epidemiol 2017; 46: 162–172.
[12] Kario K, Abe T, Kanegae HJ. Impact of pre‑existing hypertension and control status before atrial fibrillationonset on cardiovascular prognosis in patients with non‑valvular atrialfibrillation: A real‑world database analysis in Japan. Clin Hypertens (Greenwich) 2020; 22: 431–437.
[13] Coccina F, Pierdomenico AM, De Rosa M, et al. Risk of Atrial Fibrillation in Masked and White Coat Uncontrolled Hypertension. Am J Hypertens 2021; 34: 504–510.
[14] Gawałko M, Linz D. Atrial Fibrillation Detection and Management in Hypertension. Hypertension 2023; 80: 523–533.
[15] Dzeshka MS, Shahid F, Shantsila A, Lip GYH. Hypertension and Atrial Fibrillation: An Intimate Association of Epidemiology, Pathophysiology, and Outcomes. Am J Hypertens 2017; 30: 733–755.
[16] Lip GYH, Coca A, Kahan T, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia‑Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulación Cardíaca y Electrofisiología (SOLEACE). Europace 2017; 19: 891–911.
[17] Wyse DG, Waldo AL, DiMarco JP, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825–1833.
[18] Corley SD, Epstein AE, DiMarco JP, et al. Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow‑Up Investigation of Rhythm Management (AFFIRM) Study. Circulation 2004; 109: 1509–1513.
[19] Hohnloser SH, Crijns HJGM, van Eickels M, et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360: 668–678.
[20] Connolly SJ, Camm AJ, Halperin JL, et al. Dronedarone in high‑risk permanent atrial fibrillation. N Engl J Med 2011; 365: 2268–2276.
[21] Kirchhof P, Camm AJ, Goette A. Early Rhythm‑Control Therapy in Patients with Atrial Fibrillation. N Engl J Med 2020; 383: 1305–1316.
[22] Willems S, Borof K, Brandes A, et al. Systematic, early rhythm control strategy for atrial fibrillation in patients with or without symptoms: the EAST‑AFNET 4 trial. Eur Heart J 2022; 43: 1219–1230.
[23] Arbelo E, Brugada J, Hindricks G, et al. ESC‑EURObservational Research Programme: the Atrial Fibrillation Ablation Pilot Study, conducted by the European Heart Rhythm Association. Europace 2012; 14: 1094–1103.
[24] Packer DL, Mark DB, Robb RA, et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation. The CABANA Randomized Clinical Trial. JAMA 2019; 321: 1261–1274.
[25] Marrouche NF, Brachmann J, Andresen D, et al. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med 2018; 378: 417–427.
[26] Sohns C, Fox H, Marrouche NF, Crijns HJGM. Catheter Ablation in End‑Stage Heart Failure with Atrial Fibrillation. N Engl J Med 2023; 389: 1380–1389.
[27] Reddy VY, Koruth J, Jais P. Ablation of Atrial Fibrillation With Pulsed Electric Fields: An Ultra‑Rapid, Tissue‑Selective Modality for Cardiac Ablation. JACC Clin Electrophysiol 2018; 4: 987–995.
[28] Reddy VY, Anter E, Rackauskas G, et al. Lattice‑Tip Focal Ablation Catheter That Toggles Between Radiofrequency and Pulsed Field Energy to Treat Atrial Fibrillation: A First‑in‑Human Trial. Circ Arrhythm Electrophysiol 2020; 13: e008718.
[29] Reddy VY, Peichl P, Anter E, et al. A Focal Ablation Catheter Toggling Between Radiofrequency and Pulsed Field Energy to Treat Atrial Fibrillation. JACC Clin Electrophysiol 2023; 9(8 Pt 3): 1786–1801.
[30] Ekanem E, Reddy VY, Schmidt B. Multi‑national survey on the methods, efficacy, and safety on the post‑approval clinical use of pulsed field ablation (MANIFEST‑PF). Europace 2022; 24: 1256–1266.
[31] Turagam MK, Neuzil P, Schmidt B. Safety and Effectiveness of Pulsed Field Ablation to Treat Atrial Fibrillation: One‑Year Outcomes From the MANIFEST‑PF Registry. Circulation 2023; 148: 35–46.
[32] Belluzzi F, Sernesi L, Preti P, et al. Prevention of recurrent lone atrial fibrillation by the angiotensin‑II converting enzyme inhibitor ramipril in normotensive patients. J Am Coll Cardiol 2009; 53: 24–29.
[33] Rienstra M, Hobbelt AH, Alings M, et al. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J 2018; 39: 2987–2996.
[34] Pathak RK, Middeldorp ME, Lau DH, et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST‑AF cohort study. J Am Coll Cardiol 2014; 64: 2222–2231.
[35] Chaugai S, Meng WY, Ali Sepehry A. Effects of RAAS Blockers on Atrial Fibrillation Prophylaxis: An Updated Systematic Review and Meta‑Analysis of Randomized Controlled Trials. J Cardiovasc Pharmacol Ther 2016; 21: 388–404.
[36] Ma H, Jiang H, Feng J, Gan Y. Angiotensin Receptor Blocker and Calcium Channel Blocker Preventing Atrial Fibrillation Recurrence in Patients with Hypertension and Atrial Fibrillation: A Meta‑analysis. Cardiovasc Ther 2021; 2021: 6628469.
[37] Senior R, Imbs JL, Bory M. Indapamide reduces hypertensive left ventricular hypertrophy: an international multicenter study. J Cardiovasc Pharmacol 1993; 22(Suppl 6): S106–110.
[38] Carey PA, Sheridan DJ, de Cordoue A, Guez D. Effect of indapamide on left ventricular hypertrophy in hypertension: a meta‑analysis. Am J Cardiol 1996; 77: 17b–19b.
[39] Mattioli AV, ZEnnaro M, Bonatti S, et al. Regression of left ventricular hypertrophy and improvement of diastolic function in hypertensive patients treated with telmisartan. Int J Cardiol 2004; 97: 383–388.
[40] Pan G, Zhou X, Zhao J. Effect of telmisartan on atrial fibrillation recurrences in patients with hypertension: a systematic review and meta‑analysis. Cardiovasc Ther 2014; 32: 184–188.
[41] Roush GC, Abdelfattah R, Song S. Hydrochlorothiazide and alternative diuretics versus renin‑angiotensin system inhibitors for the regression of left ventricular hypertrophy: a head‑to‑head meta‑analysis. J Hypertens 2018; 36: 1247–1255.
[42] Du X, Ninomiya T, de Galan B. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009; 30: 1128–1135.