Adalimumab v indikaci revmatologických diagnóz
Key words: adalimumab, TNFα, biologics, rheumatoid arthritis ankylosing spondyliti, seronegative spondylarthrosis, psoriatic arthritis, Behçet's disease.
Úvod
Terapie chronických zánětlivých revmatických chorob má několik významných milníků, které výrazně ovlivnily morbiditu a mortalitu pacientů. Pokroky ve výzkumu patogeneze těchto chorob spojené zároveň s pokroky molekulární biologie přinesly biologickou léčbu – biologická léčiva modifikující chorobu (biological disease modifying antirheumatic drugs, bDMARD). Jedním z prvních prozánětlivých cytokinů, který se stal cílem pro monoklonální terapeutické protilátky, byl tumor nekrotizující faktor alfa (TNFα). V poslední dekádě minulého století byly do terapie revmatoidní artritidy (RA) zavedeny inhibitory TNFα, další indikace této skupiny bDMARD rychle následovaly [1].
Z revmatických onemocnění to byly séronegativní spondylartritidy (radiografická a neradiografická axiální spondylartritida), psoriatická artritida, juvenilní idiopatická artritida. Využití inhibice TNFα se rozšířilo i na další autoimunitní nozologické jednotky v gastroenterologii, kožním a očním lékařství [2].
Tumor nekrotizující faktor alfa je molekula proteinové povahy složená ze tří identických podjednotek, která je in vivo přítomna ve dvou formách, solubilní a transmembránové. Vazbou na specifické receptory, jejichž prostřednictvím pak aktivuje celou řadu intracelulárních signálních drah, se TNFα podílí na regulaci celé řady imunitních pochodů v organismu. Působí i na neimunitní děje v organismu (inzulinovou rezistenci, metabolismus mastných kyselin, endoteliální funkce a další). Tumor nekrotizující faktor alfa ovlivňuje mnoho buněčných populací (T lymfocyty, makrofágy, granulocyty, keratinocyty, endoteliální buňky, neurony a další). Porucha regulace TNFα vede mimo jiné i k akceleraci zánětlivé odpovědi a v případě revmatických chorob pak facilituje tkáňové poškození. Inhibice TNFα se ukázala jako efektivní možnost k ovlivnění celé řady revmatických autoimunitních onemocnění a stala se nedílnou součástí léčby nemocných. Nyní je v revmatologii k dispozici celá řada inhibitorů TNFα – monoklonální protilátky adalimumab, infliximab, golimumab, certolizumab pegol (Fab fragment) a fúzní protein etanercept [1–3].
Adalimumab patří do skupiny inhibitorů TNFα a je s úspěchem využíván v terapii řady revmatických i nerevmatických onemocnění. V současnosti probíhá mnoho klinických hodnocení, která si kladou za cíl rozšíření indikací pro využití adalimumabu. Toto sdělení se zabývá rolí adalimumabu v terapii revmatických onemocnění u dospělé populace pacientů.
Mechanismus účinku a farmakologické vlastnosti adalimumabu
Adalimumab je plně humánní monoklonální protilátka třídy IgG1 se schopností specifické vazby na TNFα, kterou neutralizuje zamezením jeho vazby na povrchové buněčné receptory (p55 a p75). Adalimumab se váže na solubilní i transmembránový TNFα s vysokou afinitou a specificitou, je proto vhodný k dlouhodobému podávání vzhledem ke své nízké imunogenicitě. Nebyla prokázána vazba na receptor TNFβ. Adalimumab má schopnost ovlivnění celé řady biologických pochodů, které jsou spjaty s působením TNFα v organismu, mezi jinými i buněk endotelu a jejich prostřednictvím i koncentrací adhezních molekul, jež se podílejí na migraci leukocytů.
Podání adalimumabu vede k rychlému poklesu hodnot reaktantů akutní fáze (C reaktivního proteinu) a interleukinů (IL 6, IL 1 a dalších). Rovněž byl dokumentován pokles hodnot metaloproteináz 1 a 3 zodpovědných za remodelační děje, které vedou k destrukci chrupavek v průběhu zánětlivého kloubního onemocnění.
Farmakologické analýzy prokázaly po jednorázovém podání 40 mg adalimumabu subkutánně vrcholovou sérovou koncentraci za pět dnů. Současné podávání metotrexátu (MTX) vede ke zpomalování clearance adalimumabu o 29–49 %, jeho biologická dostupnost je 64 % [2,4].
Dávkování a indikace adalimumabu v revmatologii
Adalimumab se podává subkutánně v intervalu 14 dnů. Kombinace s MTX prodlužuje biologický poločas eliminace a zvyšuje jeho účinnost u nemocných s RA. Postupem let došlo k rozšíření indikací podávání adalimumabu (RA, psoriatická artritida, ankylozující spondylitida i neradiografická axiální spondylartritida, juvenilní idiopatická artritida, Crohnova choroba, ulcerózní kolitida, neinfekční intermediální a zadní uveitida a panuveitida, hidradenitis suppurativa). Nyní probíhá řada klinických hodnocení u dalších indikací čekajících na schválení terapie [1,2].
Biosimilární adalimumab má obdobné dávkování, nicméně indikace k jeho použití se liší. V běžné klinické praxi v České republice dosud není k dispozici.
Revmatoidní artritida
Revmatoidní artritida je chronické
autoimunitní onemocnění predilekčně postihující struktury
pohybového aparátu. U obzvlášť klinicky závažných forem
tohoto onemocnění se mohou objevit i mimokloubní projevy
s postižením dalších orgánových soustav (kardiovaskulární,
plicní, kožní, neurologické projevy a další). Tradiční
chorobu modifikující léky (conventional synthetic , csDMARD)
postupem času doplnila cílená terapie zaměřená na vybrané
prozánětlivé molekuly hrající roli v patogenezi RA. Tumor
nekrotizující faktor alfa je významným prozánětlivým
cytokinem podílejícím se na patogenezi RA [3]. Adalimumab se
s úspěchem etabloval v terapii RA, jeho účinnost byla
prokázána celou řadou klinických studií (tab. 1). Efekt terapie byl následně podpořen daty z mnoha
národních registrů.
, csDMARD)
postupem času doplnila cílená terapie zaměřená na vybrané
prozánětlivé molekuly hrající roli v patogenezi RA. Tumor
nekrotizující faktor alfa je významným prozánětlivým
cytokinem podílejícím se na patogenezi RA [3]. Adalimumab se
s úspěchem etabloval v terapii RA, jeho účinnost byla
prokázána celou řadou klinických studií (tab. 1). Efekt terapie byl následně podpořen daty z mnoha
národních registrů.
Adalimumab u časné RA
Klinické studie zaměřené na populaci pacientů s časnou RA vycházely z předpokladu, že agresivní terapeutický přístup v počátcích onemocnění vede k rychlému navození remise a k jejímu dlouhodobému udržení včetně zpomalení radiografické progrese choroby. PREMIER byla dvojitě zaslepená studie kontrolovaná placebem zaměřená na populaci pacientů s časnou RA bez předchozí terapie MTX. Pacienti byli rozděleni do tří skupin podle podávané terapie (monoterapie adalimumabem, monoterapie MTX a kombinovaná terapie adalimumabem a MTX). V této studii bylo dosaženo primárního cíle (terapeutická odpověď hodnocená jako ACR 50 – podíl pacientů s 50% zlepšením dle kritérií American College of Rheumatology) a zároveň byla výrazně zpomalena rentgenová progrese u pacientů užívajících kombinovanou terapii. Z hlediska rychlé progrese choroby vedoucí ke strukturálnímu poškození byla rizikovou skupina nedosahující terapeutické odpovědi na léčbu ve všech sledovaných skupinách. Takzvaní MTX naivní pacienti měli prospěch z kombinované terapie MTX a adalimumabem a vykazovali nižší radiografickou progresi proti pacientům dostávajícím MTX v monoterapii, a to již v prvních měsících léčby. Obdobné výsledky byly dokumentovány i u jiných inhibitorů TNFα [5,6].
Adalimumab v monoterapii RA
Intolerance či kontraindikace DMARD představuje u pacientů s RA podstatný problém. Kombinovaná terapie csDMARD a bDMARD, obzvláště cílená na TNFα, je považována za kotvící léčbu. Studie DE011 trvala 26 týdnů a sledovala bezpečnost monoterapie adalimumabem u pacientů s aktivní RA, u kterých selhala předchozí terapie csDMARD. Adalimumab byl účinnější než placebo, nicméně data dalších klinických studií týkající se účinnosti prokazují lepší efekt kombinované terapie adalimumabem a csDMARD [7].
Adalimumab v kombinované terapii csDMARD
Bezpečnost a účinnost adalimumabu v kombinované terapii byla prokázána v celé řadě klinických studií, a to nejen v kombinaci s MTX, ale i s dalšími csDMARD. Selhání csDMARD bylo jedním ze zařazovacích kritérií do studie STAR. Pacienti s aktivní RA dostávali svou bazální léčbu csDMARD, ke které byla přidána studijní medikace (placebo proti adalimumabu). Efekt léčby pomocí kombinace csDMARD a adalimumabu byl statisticky signifikantně vyšší proti terapii pouze csDMARD. Jistou obavu představovala bezpečnost kombinované léčby, ale nebyl zaznamenán statisticky signifikantní rozdíl oproti placebové skupině, a to jak ve výskytu závažných nežádoucích příhod, tak infekcí [8].
Studie ARMADA byla zaměřena jen na kombinovanou terapii MTX a adalimumabem, rovněž zde pacienti dostávající tuto léčbu dosahovali ve srovnání s monoterapií MTX rychleji remise s ústupem příznaků RA, včetně zpomalení radiografické progrese [9].
Otevřená studie ReAct sledovala velkou kohortu pacientů s RA, u kterých došlo k selhání předchozí terapie csDMARD (n = 6 610). Jednalo se o různorodou kohortu nemocných s různou terapií csDMARD a u malého počtu i s předchozí léčbou bDMARD. Bazální terapie csDMARD byla ponechána a byl přidán adalimumab. Více než polovina nemocných vykazovala terapeutickou odpověď hodnocenou indexy sledujícími aktivitu RA včetně parametrů hodnocených pacientem v týdnu 12. Kombinovaná terapie se ukázala jako relativně bezpečná a účinná. Zajímavé bylo zjištění, že nejlepší terapeutické odpovědi bylo dosaženo u tzv. bDMARD naivních pacientů [10–12].
Adalimumab versus další bDMARD a malé molekuly
Účinnost, bezpečnost a možná zaměnitelnost mezi jednotlivými bDMARD byla sledována a porovnávána u adalimumabu a certolizumab pegolu. Oba inhibitory TNFα byly podávány v kombinaci s MTX ve studii EXXELERATE. Skupiny pacientů byly rozděleny podle léčby a v týdnu 12 došlo u non respondérů k záměně bDMARD. Byla prokázána srovnatelná účinnost obou dvou bDMARD a rovněž dobrá odpověď po záměně přípravku u non respondérů v prvních 12 týdnech studie [13].
Účinnost a bezpečnost dvou bDMARD s odlišným mechanismem účinku porovnávala studie ADACTA. Jednalo se o nemocné s RA, u kterých selhala předchozí terapie MTX. Monoterapie tocilizumabem vykazovala vyšší účinnost proti monoterapii adalimumabem. Autoři předpokládali vliv rozdílného mechanismu účinku na terapeutickou odpověď v monoterapii [14].
Studie RA BEAM porovnávala účinnost baricitinibu proti adalimumabu. Obě léčiva prokázala dobrou účinnost a bezpečnost v 52týdenním sledování, léčebné odpovědi byly ekvivalentní, nicméně rozdíly byly pozorovány v týdnu 12 u baricitinibu. Adalimumab naopak prokázal lepší ovlivnění radiologické progrese [15].
Ankylozující spondylitida
Ankylozující spondylitida (AS) je chronické zánětlivé onemocnění primárně postihující osový skelet (sakroiliakální skloubení, páteř a velké klouby), může se ale vyskytovat i periferní kloubní postižení. Účinnost terapie bDMARD inhibující TNFα byla založena na předpokladu zvýšené exprese tohoto cytokinu v místě zánětu. Adalimumab prokázal svůj efekt v celé řadě klinických studií u AS, stejně jako u pacientů s neradiografickou axiální spondylartritidou (nr axSpA), tabulka 2.
Adalimumab u nr axSpA
Nemocní, u kterých nedošlo k rozvoji radiografických změn a selhala u nich předchozí léčba nejméně dvěma léčivy ze skupiny nesteroidních antiflogistik (NSA), představovali terapeutickou výzvu k ovlivnění radiografické progrese a symptomů choroby. Populace pacientů s nr axSpA byla sledována ve dvou studiích – v menší D2E7 Early AS a ve větší ABILITY 1. Nemocní dostávající adalimumab vykazovali výrazně vyšší terapeutickou odpověď hodnocenou indexy aktivity ASDAS (Ankylosing Spondylitis Disease Activity Score) a ASAS 40 (40% zlepšení dle kritérií SpondyloArthritis International Society). Dále i zpomalení radiografické progrese [16,17].
Adalimumab u AS
Ovlivnění symptomů a radiografické progrese u pacientů s AS bylo jedním z hlavních cílů studie ATLAS. Populace pacientů byla vybrána na základě selhání předchozí terapie a vysoké aktivity onemocnění. Byly sledovány nejen indexy hodnotící aktivitu onemocnění, ale i laboratorní parametry. Adalimumab prokázal dobrou účinnost spojenou s relativně uspokojivým bezpečnostním profilem. V průběhu léčby došlo k výraznému poklesu hodnot zánětlivých parametrů, ke snížení indexů aktivity nemoci a parametrů hodnocených pacientem [18].
Psoriatická artritida
Psoriatická artritida (PsA) je
chronické zánětlivé kloubní onemocnění ve většině
případů asociované s psoriázou. Nadprodukce TNFα je
považována za jeden z klíčových mechanismů
spojujících kloubní a kožní postižení u PsA.
Adalimumab prokázal svou účinnost u RA a u AS
a bylo přepokládáno, že jeho terapeutická odpověď bude
obdobná i u nemocných s PsA, což bylo potvrzeno
celou řadou klinických sledování jak v dermatologické, tak
v revmatologické indikaci. Klinická studie ADEPT u PsA se
nezabývala jen hodnocením aktivity zaměřené na pohybový
aparát či na radiografickou progresi, ale sledovala také
změny v kožním postižení (tab. 3).
Cílovou skupinou nemocných byli pacienti s PsA, u nichž
selhala předchozí terapie NSA. Adalimumab byl podáván
v kombinované terapii s MTX či v monoterapii. Studie
prokázala dobrý efekt adalimumabu na pohybový aparát
a zároveň došlo k pozitivnímu ovlivnění kožních
projevů PsA oproti monoterapii MTX. Rovněž byla zaznamenána menší
radiografická progrese u skupiny dostávající adalimumab.
Kvalita života a další domény hodnocené pacienty byly
signifikantně lepší u skupiny s adalimumabem [19].
kožním postižení (tab. 3).
Cílovou skupinou nemocných byli pacienti s PsA, u nichž
selhala předchozí terapie NSA. Adalimumab byl podáván
v kombinované terapii s MTX či v monoterapii. Studie
prokázala dobrý efekt adalimumabu na pohybový aparát
a zároveň došlo k pozitivnímu ovlivnění kožních
projevů PsA oproti monoterapii MTX. Rovněž byla zaznamenána menší
radiografická progrese u skupiny dostávající adalimumab.
Kvalita života a další domény hodnocené pacienty byly
signifikantně lepší u skupiny s adalimumabem [19].
Adalimumab v terapii dalších revmatických onemocnění
Behçetova nemoc
Behçetova nemoc (BN) je chronické autoimunitní zánětlivé onemocnění charakterizované recidivujícími ulceracemi v dutině ústní spojenými s celou řadou systémových projevů (ulcerace genitálu, kožní, kardiovaskulární a oční manifestace, artritidy, gastrointestinální a neurologické projevy). Behçetova nemoc patří mezi systémové vaskulitidy a je pro ni typické postižení cév všech velikostí, jak arterií, tak žil. Terapie BN se liší v závislosti na tíži projevů onemocnění – od topické léčby v kombinaci s kolchicinem po podávání systémových glukokortikoidů a další imunosupresivní terapii. Terapie bDMARD je zatím předmětem klinických sledování. Terapie adalimumabem se ukázala být efektivní v léčbě kožních a slizničních projevů BN. Adalimumab v indikaci BN není dosud v České republice schválen [20].
Kazuistika
57letý muž přichází
do revmatologické ambulance s anamnézou recidivujících
předních uveitid k vyloučení zánětlivého revmatického
onemocnění. Nemocný je sledován od roku 1992 pro ulcerózní
kolitidu, při vstupním vyšetření je nespecifický střevní
zánět v dlouhodobé remisi při terapii mesalazinem. Nemocný
udává intermitentní bolesti dolních zad bez vazby na změnu
pohybu, k akcentaci obtíží dochází v klidu. Při
vstupním vyšetření na revmatologii je bez výraznějších
bolestí zad. V klinickém vyšetření byla zjištěna omezená
hybnost páteře, dechové exkurze exspirum/inspirum 3,5 cm,
Thoma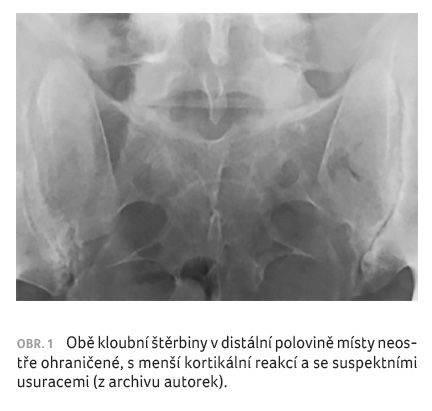 yerova distance 45 cm a Schoberova distance 4,5 cm.
Pacient měl provedeno laboratorní vyšetření, antigen HLA B27
byl pozitivní, nicméně reaktanty zánětu byly v normě.
Další laboratorní vyšetření bylo bez abnormalit (krevní obraz,
jaterní a ledvinné testy, imunologické vyšetření), kromě
nízké sérové koncentrace vitaminu D. Cílené rentgenové
vyšetření páteře neprokázalo změny typické pro AS
a u sakroiliakálních (SI) kloubů popsalo suspektní
nález neostře ohraničené kloubní štěrbiny s kortikální
reakcí a možnými usuracemi (obr. 1). Dále byla provedena magnetická rezonance SI
skloubení, kde byly popsány diskrétní změny při sakroiliitidě
(obr. 2).
yerova distance 45 cm a Schoberova distance 4,5 cm.
Pacient měl provedeno laboratorní vyšetření, antigen HLA B27
byl pozitivní, nicméně reaktanty zánětu byly v normě.
Další laboratorní vyšetření bylo bez abnormalit (krevní obraz,
jaterní a ledvinné testy, imunologické vyšetření), kromě
nízké sérové koncentrace vitaminu D. Cílené rentgenové
vyšetření páteře neprokázalo změny typické pro AS
a u sakroiliakálních (SI) kloubů popsalo suspektní
nález neostře ohraničené kloubní štěrbiny s kortikální
reakcí a možnými usuracemi (obr. 1). Dále byla provedena magnetická rezonance SI
skloubení, kde byly popsány diskrétní změny při sakroiliitidě
(obr. 2).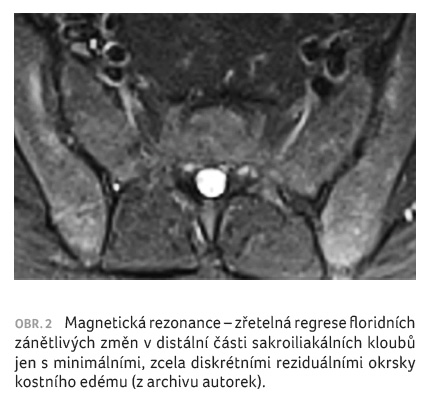
Otázkou byla další terapie nemocného, v klinickém obraze dominovalo oční postižení s recidivujícími předními uveitidami. V průběhu následujícího roku dochází k opakované exacerbaci přední uveitidy, došlo také k mírné exacerbaci střevního zánětu a ke zhoršení zánětlivé bolesti zad. Terapeuticky tento nemocný představoval určitou výzvu k účelnému navržení optimální terapie, která by pokryla všechny projevy tohoto multifaktoriálního onemocnění. Po vzájemné domluvě s gastroenterologem byla navržena a zavedena terapie adalimumabem s postupným navozením remise jak gastroenterologické, tak oční problematiky včetně ústupu zánětlivé bolesti zad. Pacient je dlouhodobě stabilizovaný v remisi při léčbě adalimumabem.
Tento nemocný představuje menší, ale o to složitější část pacientů s projevy SpA vyžadujících multidisciplinární přístup v řešení jejich zdravotního stavu.
Závěr
Adalimumab se stal součástí terapie celé řady autoimunitních revmatických onemocnění a každým rokem se indikace k jeho podávání rozšiřují o nové diagnózy. Jeho první indikací byla léčba RA, následně i AS a PsA. Data o bezpečnosti a účinnosti adalimumabu jsou podpořena výsledky celé řady klinických studií a také údaji získanými z mnoha národních registrů. Adalimumab zlepšuje prognózu nemocných se zánětlivými kloubními onemocněními v kombinaci s MTX či s jinými DMARD u RA či v monoterapii u AS. Nejnovější indikace, ke které byl adalimumab schválen, jsou zrak ohrožující neinfekční uveitidy na podkladě dat získaných z klinických sledování VISUAL (I a II) [21].
Biosimilární adalimumab vyvíjený řadou farmaceutických společností je nyní předmětem klinických sledování a lze očekávat jeho brzké uvedení do praxe v několika indikacích.
Kazuistika demonstrovala nutnost multidisciplinárního přístupu k nemocnému s celou řadou manifestací s nutností pečlivého zvážení terapeutického postupu. Adalimumab má své pevné místo jak v gastroenterologii, tak revmatologii a u řady pacientů se jeho indikace často překrývá. Úzká spolupráce celé řady odborníků je nezbytností ke zvládnutí všech obtíží nemocných.
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Seznam použité literatury
- [1] Scott DL. Biologics‑based therapy for the treatment of rheumatoid arthritis. Clin Pharmacol Ther 2012; 91: 30–43.
- [2] http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/000481/WC500050870.pdf
- [3] Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis. Lancet 2010; 376: 1094–1108.
- [4] Lee SJ, Kavanaugh A. Adalimumab for the treatment of rheumatoid arthritis. Therapy 2005; 2: 13–21.
- [5] Breedveld FC, Weisman MH, Kavanaugh AF, et al. The efficacy and safety of adalimumab (Humira®) plus methotrexate vs. adalimumab alone or methotrexate alone in the early treatment of rheumatoid arthritis: 1‑ and 2‑year results of the PREMIER study [abstract]. Ann Rheum Dis 2005; 64: 60.
- [6] Breedveld FC, Weisman MH, Kavanaugh AF, et al. for the PREMIER investigators The PREMIER Study: combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in methotrexate‑naïve patients with early, aggressive rheumatoid arthritis. Arthritis Rheum 2006; 54: 26–37.
- [7] van de Putte LB, Atkins C, Malaise M, et al. Efficacy and safety of adalimumab as monotherapy in patients with rheumatoid arthritis for whom previous disease modifying antirheumatic drug treatment has failed. Ann Rheum Dis 2004; 63: 508–516.
- [8] Furst DE, Schiff MH, Fleischmann RM, et al. Efficacy and safety of the fully human anti‑tumour necrosis factor‑monoclonal antibody, and concomitant standard antirheumatic therapy for the treatment of rheumatoid arthritis: results of STAR (Safety Trial of Adalimumab in Rheumatoid Arthritis). J Rheumatol 2003; 30: 2563–2571.
- [9] Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti‑tumor necrosis factor alpha monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. Arthritis Rheum 2003; 48: 35–45.
- [10] Burmester GR, Mariette X, Montecucco C, et al. Adalimumab alone and in combination with disease‑modifying antirheumatic drugs for the treatment of rheumatoid arthritis in clinical practice: the Research in Active Rheumatoid Arthritis (ReAct) trial. Ann Rheum Dis 2007; 66: 732–739.
- [11] Burmester GR, Saez IM, Malaise M, et al. Efficacy and safety of adalimumab in European clinical practice: the ReAct Trial [abstract]. Ann Rheum Dis 2004; 63(Suppl 1): 90.
- [12] Burmester GR, Monteagudo Sáez I, Malaise MG, et al. Adalimumab (Humira®) is effective and safe in treating rheumatoid arthritis (RA) in real‑life clinical practice: 1‑year‑results of the ReAct study [abstract]. Arthritis Rheum 2005; 52(Suppl): S541–S542.
- [13] Smolen JS, Burmester GR, Combe B, et al. Head‑to‑head comparison of certolizumab pegol versus adalimumab in rheumatoid arthritis: 2‑year efficacy and safety results from the randomised EXXELERATE study. Lancet 2016; 388: 2763–2774.
- [14] Gabay C, Emery P, van Vollenhoven R, et al. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double‑blind, controlled phase 4 trial. Lancet 2013; 381: 1541–1550.
- [15] Taylor PC, Keystone EC1, van der Heijde D, et al. Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N Engl J Med 2017; 376: 652–662.