Adjuvantní hormonální léčba karcinomu prsu u postmenopauzálních žen
Hormonální léčba by měla být nabídnuta pacientkám s ER- či PR-pozitivním karcinomem prsu bez ohledu na věk, menopauzální status, amplifikaci genu HER-2/neu, stav axilárních uzlin i aplikaci cytostatické terapie. V léčbě postmenopauzálních pacientek využíváme jak tamoxifen, tak selektivní inhibitory aromatáz. Rozdíly v designu a v populaci žen zařazených do jednotlivých klinických studií neumožňují přímé srovnání výsledků. Není proto zcela jasné, jaká je optimální strategie adjuvantní hormonální léčby. Stejně tak není známa optimální doba léčby inhibitory aromatázy. Ve srovnání s tamoxifenem samotným snižují inhibitory aromatázy 3. generace u postmenopauzálních žen s pozitivními hormonálními receptory riziko rekurence (ipsilaterální recidivy, kontralaterálního nádoru prsu i distančních metastáz), pokud jsou užity jako iniciální adjuvantní terapie, sekvenčně či jako prodloužená léčba. Prodloužení celkového přežití však prokázaly jen některé studie. Změna terapie z tamoxifenu na inhibitory aromatázy snižuje riziko toxicity a bude pravděpodobně nejlepší alternativou hormonální léčby ve vztahu k účinnosti a toxicitě.
Neshody v pohledu na optimální způsob endokrinní léčby postmenopauzálních žen se objevily při hlasování panelu St. Gallen Concensus Conference v roce 2011, jehož členové nebyli jednotní v názoru, zda by všechny postmenopauzální pacientky v určitém období hormonální léčby měly dostávat inhibitor aromatázy. Léčebný režim je třeba volit s ohledem na pokročilost onemocnění a komorbidity tak, aby poměr mezi prospěchem a riziky byl pro nemocnou co nejlepší.
Úvod
Historie hormonální léčby karcinomu prsu sahá až do 19. století. Již v roce 1836 sir Astley Cooper pozoroval změny růstu pokročilého nádoru prsu v průběhu menstruačního cyklu [1]; první ovarektomii u pacientky s karcinomem prsu provedl George Beatson v roce 1896 a až v roce 1962 byly objeveny estrogenní receptory [2].
Hormonální léčba představuje první cílenou léčbu – předpokladem její účinnosti je exprese hormonálních, tedy estrogenových a progesteronových receptorů. Výsledkem hormonální léčby je snížení hladiny hormonů stimulujících nádorový růst nebo blokace vazby hormonu na jeho receptor v nádorové buňce. V důsledku hormonálních manipulací dochází k inhibici buněčné proliferace a k indukci programované buněčné smrti (apoptózy).
Přibližně tři čtvrtiny všech karcinomů prsu jsou diagnostikovány u žen v postmenopauze a přibližně ve třech čtvrtinách těchto případů se jedná o hormonálně dependentní nádor. U postmenopauzálních žen s hormonálně dependentním karcinomem prsu můžeme v adjuvanci využít řady hormonálních přípravků. Nejdéle používaným je tamoxifen (TMX), který patří do skupiny tzv. SERM (selective estrogen receptor modulators). Dalšími léčivy jsou selektivní inhibitory aromatáz – nesteroidní (anastrozol, letrozol) či steroidní (exemestan).
Tamoxifen
V klinické praxi je nejlépe ověřeným hormonálním preparátem tamoxifen, antagonista steroidních hormonů, který blokuje jejich účinek tím, že se naváže na estrogenní receptory (ER). Tato vazba brání účinku endogenních estrogenů. TMX blokuje efekt estrogenů neúplně, má svou parciální agonistickou aktivitu, což vysvětluje jeho protektivní efekt vůči osteoporóze a nežádoucí stimulační efekt na endometrium.
TMX lze užít v adjuvanci jak u premenopauzálních, tak i postmenopauzálních žen. Snižuje pravděpodobnost rekurence o 39 % a pravděpodobnost úmrtí o 31 % bez ohledu na věk pacientek, uzlinové postižení, menopauzální status a užití chemoterapie [3]. Prospektivní randomizované studie ukazují, že optimální doba léčby TMX je 5 let. Pokud je současně indikována chemoterapie, pak hormonální léčbu TMX zahajujeme až po ukončení léčby cytostatiky.
V roce 2011 byly v časopise Lancet publikovány výsledky metaanalýzy randomizovaných klinických studií, v nichž byl TMX podáván po dobu 5 let u nemocných v období premenopauzy i u pacientek postmenopauzálních, se zaměřením na význam hormonálních receptorů a dalších faktorů ovlivňujících účinnost adjuvantně podaného TMX [4].
Pacientky s ER-pozitivním nádorem prsu (n = 10 645), které užívaly TMX po dobu 5 let, měly ve srovnání s pacientkami, jimž bylo podáváno placebo, během prvních 10 let snížený počet rekurencí. V období do 4 let byl počet rekurencí snížen přibližně na polovinu, v průběhu let 5–9 přibližně o třetinu. Po 10 letech bylo zaznamenáno již jen minimální zlepšení. Celkové snížení počtu recidiv činilo v průběhu prvních 15 let po randomizaci v průměru 39 %. Snížení rizika recidivy bylo výraznější ve vyšších věkových skupinách ve srovnání se ženami před menopauzou, tento rozdíl však nebyl signifikantní. Uvedená metaanalýza ukázala významný protektivní efekt TMX dokonce i u nemocných s marginálně pozitivními ER (10–19 fmol/mg). Dále prokázala, že užívání TMX po dobu 5 let redukuje u všech žen s ER-pozitivním karcinomem prsu během prvních 15 let po zahájení léčby mortalitu na karcinom prsu nejméně o třetinu ve srovnání s žádnou adjuvantní hormonální léčbou (risk ratio, RR 0,71; standard error, SE 0,05). Mortalita z jiných příčin, než je karcinom prsu, byla jen málo ovlivněna i přes malý absolutní vzestup počtu úmrtí na tromboembolie a karcinom dělohy.
Selektivní inhibitory aromatázy
U postmenopauzálních žen může syntéza estrogenů probíhat v nadledvinách, ale také v tukové tkáni, svalech a i ve vlastním tumoru [5]. Na tvorbě estrogenů se podílejí aromatázy, které řídí přeměnu androgenů na estrogeny. K jejich blokaci lze využít inhibitory, ať již steroidní, které ireverzibilně blokují aromatázu (exemestan), nebo nesteroidní, které snižují hladiny estrogenů bez ovlivnění syntézy jiných steroidních hormonů (anastrozol, letrozol).
Možnosti využití inhibitorů aromatázy
Klinické studie s využitím inhibitorů aromatázy (IA) zkoumaly efekt těchto léčiv u postmenopauzálních žen v adjuvanci jako léčbu iniciální či sekvenční – následující po 2–3 letech užívání TMX, nebo tzv. prodlouženou adjuvanci – po 4,5–6 letech užívání TMX (tab. 1). 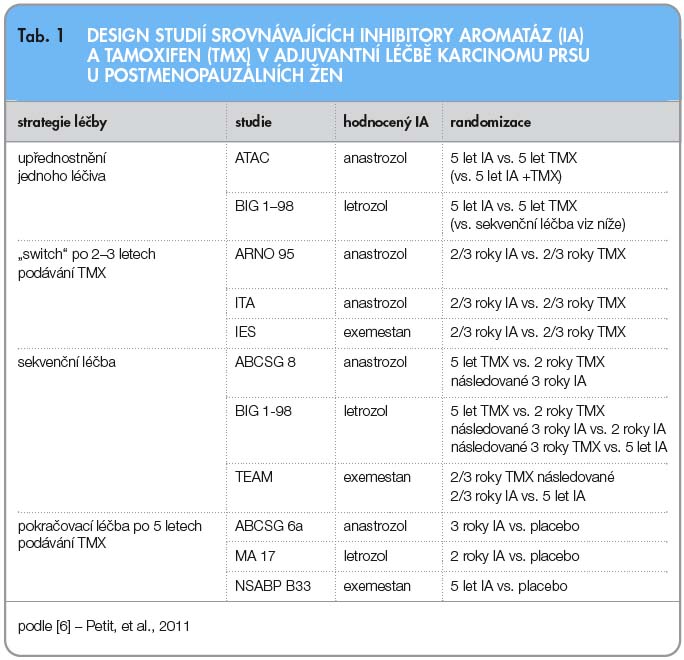
Výsledky dvou prospektivních randomizovaných klinických studií (ARNO 95, IES) poskytly při vyřazení pacientek s ER-negativními nádory prsu data o zlepšení celkového přežití pacientek s časným karcinomem prsu, které užívaly TMX a následně sekvenčně anastrozol nebo exemestan, ve srovnání s užitím samotného TMX [7, 8].
Studie NCIC CTG (National Cancer Institute Canada Clinical Trials Group) MA-17 ukázala lepší přežití při prodloužené léčbě letrozolem po podávání TMX ve srovnání s placebem u pacientek s ER-pozitivním nádorem prsu, pokud měly pozitivní axilární uzliny [9].
Rozdíly v celkovém přežití nebyly v dalších studiích zaznamenány u pacientek, které dostávaly v adjuvanci IA iniciálně, ve srovnání se samotným TMX. Byl však zjištěn přínos IA v některých hodnocených parametrech (ATAC, BIG 1-98) [10, 11].
Iniciální léčba
Dvě studie (ATAC, BIG 1-98) hodnotily iniciální adjuvantní hormonální léčbu s TMX nebo IA.
Studie ATAC
Pacientky léčené anastrozolem vykazovaly oproti pacientkám léčeným TMX významně delší přežití bez známek onemocnění (hazard ratio, HR 0,85; p = 0,003), nižší četnost rekurencí lokálních i vzdálených [10] a významné snížení výskytu druhostranného karcinomu prsu (HR 0,56; p = 0,01) [12]. Podávání anastrozolu bylo spojeno s významně nižším výskytem závažných nežádoucích příhod včetně nižší četnosti karcinomu endometria, docházelo však častěji ke vzniku zlomenin [13].
V roce 2010 byla publikována v Lancetu analýza, ve které byly údaje studie ATAC aktualizovány během sledování po dobu 120 měsíců. Výsledky, jichž bylo dosaženo v podskupině s hormonálně dependentním onemocněním, svědčily ve prospěch skupiny léčené anastrozolem, pokud jde o přežití bez známek onemocnění (HR 0,86; 95%, confidence interval CI: 0,78–0,95; p = 0,003), dobu do rekurence (HR 0,79; CI: 0,70–0,89; p = 0,0002) i dobu do vzdálené rekurence (HR 0,85; CI: 0,73–0,98; p = 0,02). U pacientek s pozitivitou hormonálních receptorů byl zaznamenán pokles výskytu rekurencí o 2,7 % během 5 let a o 4,3 % během 10 let při užívání anastrozolu oproti užívání TMX. Četnost rekurencí po ukončení terapie zůstávala ve skupině léčené anastrozolem významně nižší než ve skupině léčené TMX (HR 0,81; 95% CI: 0,67–0,98; p = 0,03). V této skupině pacientek byl zaznamenán i trend ke snížení četnosti úmrtí po rekurenci při léčbě anastrozolem oproti léčbě TMX (HR 0,87; 95% CI: 0,74–1,02; p = 0,09), avšak bez významného rozdílu v celkové úmrtnosti (HR 0,95; 95% CI: 0,84–1,06; p = 0,4) [14].
BIG 1-98
BIG1-98 (Breast International Group) je randomizovaná klinická studie testující užívání samotného TMX po dobu 5 let, letrozolu po dobu 5 let či TMX po dobu 2 let, po němž následuje podávání letrozolu po dobu 3 let nebo letrozolu po dobu 2 let a poté sekvenční léčba TMX trvající 3 roky. Do analýzy, ve které byl srovnáván TMX proti samotnému letrozolu (včetně pacientek se sekvenčním ramenem při zahájení hormonální léčby letrozolem po dobu 2 let), bylo zařazeno 8010 žen. V rameni s letrozolem bylo zaznamenáno zlepšení disease free survival (DFS); (HR 0,81; 95% CI: 0,70–0,39; log-rank p = 0,003) bez rozdílu v celkovém přežití. Srovnání kardiovaskulárních nežádoucích účinků v rameni s TMX a letrozolem ukázalo podobnou incidenci (letrozol – 4,8 %, TMX – 4,7 %), nicméně stupeň agresivity/míra toxicity uváděné jako grade 3–5 byly signifikantně vyšší v rameni s letrozolem a incidence grade 3–5 tromboembolických příhod byla signifikantně vyšší v rameni s TMX. V rameni s letrozolem byla také popsána vyšší incidence kostních zlomenin proti TMX (9,5 % vs. 6,5 %) [11].
Sekvenční léčba
Čtyři studie sledovaly užívání TMX po 2–3 roky, následované sekvenčním podáváním IA 3. generace ve srovnání s pokračováním v léčbě TMX.
Italian Tamoxifen Anastrozol (ITA) je název studie, která randomizovala 426 postmenopauzálních žen s ukončenou 2–3letou léčbou TMX do větve pokračující v terapii TMX nebo do větve pacientek užívajících anastrozol (k dokončení 5leté hormonální léčby). Míra rizika relapsu upřednostnila sekvenční léčbu s anastrozolem (HR 0,35; 95% CI: 0,18–0,68; p = 0,001) [15].
Intergroup Exemestane Study (IES) randomizovala 4742 postmenopauzálních žen s karcinomem prsu, které ukončily 2–3letou léčbu TMX a dále buď pokračovaly ve stejné léčbě, nebo byly převedeny na podávání exemestanu do celkové doby léčby 5 let. Při mediánu follow-up 55,7 měsíce byla v DFS prokázána superiorita sekvenčně podávaného exemestanu (HR 0,76; 95% CI: 0,66–0,88; p = 0,0001) se signifikantním rozdílem v celkovém přežití pouze u pacientek s ER-pozitivním karcinomem prsu (HR 0,83; 95% CI: 0,69–1,00; log-rank p = 0,005) [8].
ARNO 95, ABCSG 8
V prospektivní kombinované analýze 3224 pacientek zařazených do studie ABCSG 8 (Austrian Breast and Colorectal Cancer Study Group) a ARNO 95 (Arimidex-Nolvadex) byly pacientky randomizovány po dvouleté léčbě TMX k dokončení 5leté adjuvantní léčby TMX nebo k 3leté léčbě anastrozolem [16]. Přežití bez události (event free survival) bylo častější v rameni, kde byly pacientky převedeny na terapii anastrozolem (HR 0,60; 95% CI: 0,44–0,81; p = 0,0009), bez zlepšení celkového přežití při mediánu follow-up 28 měsíců.
Analýza samotné studie ARNO 95 po 58 měsících follow-up prokázala signifikantní zlepšení jak v přežití bez známek choroby (HR 0,66; 95% CI: 0,44–1,00; p = 0,049), tak i v celkovém přežití (HR 0,53; 95% CI: 0,28–0,99; p = 0,045) pro rameno se změnou léčby na anastrozol [7].
Metaanalýza ABCSG 8, ARNO 95 a studie ITA potvrdily signifikantní zlepšení v celkovém přežití (HR 0,71; 95% CI: 0,52–0,98; p = 0,04) v rameni s anastrozolem [17].
Prodloužená adjuvance
Výsledky studie MA-17, do níž bylo zařazeno 5187 žen, ukázaly, že prodloužená adjuvantní léčba letrozolem je přínosem pro postmenopauzální ženy s pozitivními hormonálními receptory. Při mediánu sledování 2,5 roku bylo méně rekurencí nebo nových kontralaterálních nádorů zaznamenáno v rameni s prodlouženou léčbou letrozolem (HR 0,58; 95% CI: 0,45–0,76; p < 0,001), bez rozdílu v celkovém přežití (HR 0,82; 95% CI: 0,57–1,19; p = 0,3), nicméně bylo potvrzeno zlepšení celkového přežití v podskupině pacientek s postiženými axilárními lymfatickými uzlinami (HR 0,61; 95% CI: 0,38–0,98; p = 0,004) [9].
Metaanalýza studií s využitím IA
V roce 2010 publikoval Dowset v Journal of Clinical Oncology metaanalýzu randomizovaných klinických studií, která sledovala výsledky užití IA u postmenopauzálních žen s hormonálně dependentními karcinomy prsu [18]. Pacientky byly rozděleny do dvou kohort, jež byly analyzovány odděleně. Do první kohorty byly zařazeny studie srovnávající 5leté užívání IA v porovnání s TMX podávaným při zahájení hormonální léčby ihned po operačním výkonu. Druhá kohorta zahrnula klinické studie, ve kterých byla hormonální léčba TMX po 2–3 letech přesmyknuta na 2–3letou léčbu IA nebo bylo pokračováno v užívání TMX (celková doba léčby 5 let).
V kohortě 1 bylo vyhodnoceno celkem 9856 žen s průměrnou dobou sledování 5,8 roku. V 5letém sledování byla léčba IA spojena s absolutním snížením rekurence o 3,0 % (SE = 0,7 %) – 9,6 % pro IA vs. 12,6 % pro TMX (2 p < 0,0001) a s nesignifikantním absolutním snížením mortality na karcinom prsu o 1,1 % (SE = 0,5) – 4,8 % pro IA vs. 5,9 % pro TMX (2 p = 0,1). Po 8 letech od zahájení hormonální léčby byl absolutní rozdíl rizika rekurence 3,9 % (SE = 1,0 %) – 15,3 % pro IA vs. 19,2 % pro TMX, viz graf 1. ![Graf 1 Metaanalýza – inhibitory aromatáz vs. tamoxifen, 1. kohorta; podle [18] – Dowset, et al., 2010.](https://www.remedia.cz/photo-a-28706---.jpg)
Do kohorty 2 bylo zařazeno 9015 pacientek s průměrnou dobou sledování 3,9 roku. Po 3 letech od rozdělení nemocných do ramene s IA či s TMX (přibližně 5 let po zahájení hormonální léčby) byla léčba IA spojena s absolutním snížením rekurence o 3,1 % (SE = 0,6 %) – 5,0 % pro IA vs. 8,1 % pro TMX v tomto období (2 p < 0,0001) a s absolutním snížením nádorové mortality o 0,7 % (SE = 0,3 %) – 1,7 % pro IA vs. 2,4 % pro TMX v tomto období (2 p = 0,02), viz graf 2.
![Graf 2 Metaanalýza – inhibitory aromatáz vs. tamoxifen, 2. kohorta; podle [18] – Dowset, et al., 2010.](https://www.remedia.cz/photo-a-28707---.jpg) Ani v jedné kohortě nebyly zaznamenány rozdíly ve snížení rekurence v podskupinách pacientek s ohledem na věk, stav uzlin, stupeň diferenciace nádoru nebo stav progesteronových receptorů, ani zvýšení mortality z jiné příčiny, než je karcinom prsu při léčbě IA.
Ani v jedné kohortě nebyly zaznamenány rozdíly ve snížení rekurence v podskupinách pacientek s ohledem na věk, stav uzlin, stupeň diferenciace nádoru nebo stav progesteronových receptorů, ani zvýšení mortality z jiné příčiny, než je karcinom prsu při léčbě IA.
Nežádoucí účinky hormonální léčby
IA a TMX mají rozdílné spektrum nežádoucích účinků. Oba druhy léčby mohou způsobit návaly, noční pocení či suchost vaginální sliznice. IA častěji vedou k muskuloskeletálním symptomům, osteoporóze a k vyššímu počtu kostních fraktur, zatímco TMX je spojován se zvýšeným rizikem vzniku nádorů děložního těla a hluboké žilní trombózy [19].
Profil kardiovaskulární toxicity IA je v jednotlivých studiích rozdílný. Ve studii ATAC nebyl shledán žádný rozdíl mezi anastrozolem a TMX [13], zatímco ve studii BIG 1-98 byl dokumentován trend ke zvýšení incidence infarktu myokardu při léčbě letrozolem [20].
![Graf 3 Srovnání toxicity inhibitorů aromatázy a tamoxifenu – míra relativního rizika pro vybrané nežádoucí účinky; podle [21] – Amir, et al., 2011. IA – inhibitory aromatázy, TMX – tamoxifen, OR – odds ratio, CI – confidence interval](https://www.remedia.cz/photo-a-28708---.jpg) V letošním roce byla publikována metaanalýza toxicity adjuvantní endokrinní terapie u postmenopauzálních žen. Do této metaanalýzy bylo zařazeno celkem 30 023 pacientek ze 7 klinických studií. Delší doba užívání IA byla spojena se zvýšeným výskytem kardiovaskulárních onemocnění (odds ratio, OR = 1,26, 95% CI: 1,10–1,43, p < 0,001) a kostních fraktur (OR = 1,47, 95% CI: 1,34–1,61; p < 0,001) a naopak se snížením výskytu žilní trombózy (OR = 0,55, 95% CI: 0,46–0,64; p < 0,001) a vzniku karcinomu endometria (OR = 0,34, 95% CI: 0,22–0,53; p < 0,001). Pětileté užívání IA bylo spojeno se statisticky nevýznamným zvýšením rizika smrti bez průkazu recidivy základního onemocnění ve srovnání s 5letým podáváním TMX samostatně nebo podáváním TMX po dobu 2–3 let následovaným 2–3letou léčbou IA [21], viz graf 3.
V letošním roce byla publikována metaanalýza toxicity adjuvantní endokrinní terapie u postmenopauzálních žen. Do této metaanalýzy bylo zařazeno celkem 30 023 pacientek ze 7 klinických studií. Delší doba užívání IA byla spojena se zvýšeným výskytem kardiovaskulárních onemocnění (odds ratio, OR = 1,26, 95% CI: 1,10–1,43, p < 0,001) a kostních fraktur (OR = 1,47, 95% CI: 1,34–1,61; p < 0,001) a naopak se snížením výskytu žilní trombózy (OR = 0,55, 95% CI: 0,46–0,64; p < 0,001) a vzniku karcinomu endometria (OR = 0,34, 95% CI: 0,22–0,53; p < 0,001). Pětileté užívání IA bylo spojeno se statisticky nevýznamným zvýšením rizika smrti bez průkazu recidivy základního onemocnění ve srovnání s 5letým podáváním TMX samostatně nebo podáváním TMX po dobu 2–3 let následovaným 2–3letou léčbou IA [21], viz graf 3.
![Obr. 1 Doporučený algoritmus péče o pacientky s karcinomem prsu léčené inhibitory aromatázy – volně podle [22] – Hadji, et al., 2011; IA – inhibitory aromatázy. *Při ročním poklesu kostní denzity ≥ 10 % (při použití stejné techniky měření) by měly být zhodnoceny sekundární příčiny kostních ztrát (jako je nedostatek vitaminu D) a měla by být zahájena antiresorpční léčba. **Pro některé pacientky může být účinnou možností léčby denosumab. ***Ačkoli je osteonekróza čelisti vzácnou příhodou, která je zřídka pozorována v prvních letech léčby kyselinou zoledronovou na pozadí kostní ztráty asociované s IA, jsou těmto pacientkám doporučovány pravidelné dentální kontroly a péče.](https://www.remedia.cz/photo-a-28709---.jpg) Riziko snížení kostní denzity při léčbě IA vyžaduje aktivní přístup k prevenci a léčbě tohoto nežádoucícho účinku. Všechny pacientky léčené IA potřebují dostat doporučení týkající se prevence a léčby osteoporózy, především udržování dostatečné tělesné aktivity a suplementace kalciem a vitaminem D. Zároveň je vhodné vstupní zhodnocení denzity kostního minerálu (bone mineral density, BMD) a posouzení rizikových faktorů vzniku osteoporózy. Na základě těchto údajů je možné indikovat adekvátní terapii, včetně podávání bisfosfonátů. Existuje řada doporučení, jak riziko nemocných hodnotit, i několik terapeutických postupů. Jedna z alternativ je uvedena v obr. 1 [22].
Riziko snížení kostní denzity při léčbě IA vyžaduje aktivní přístup k prevenci a léčbě tohoto nežádoucícho účinku. Všechny pacientky léčené IA potřebují dostat doporučení týkající se prevence a léčby osteoporózy, především udržování dostatečné tělesné aktivity a suplementace kalciem a vitaminem D. Zároveň je vhodné vstupní zhodnocení denzity kostního minerálu (bone mineral density, BMD) a posouzení rizikových faktorů vzniku osteoporózy. Na základě těchto údajů je možné indikovat adekvátní terapii, včetně podávání bisfosfonátů. Existuje řada doporučení, jak riziko nemocných hodnotit, i několik terapeutických postupů. Jedna z alternativ je uvedena v obr. 1 [22].
Postavení adjuvantní hormonální léčby u postmenopauzálních pacientek
Srovnání výsledků jednotlivých studií je obtížné pro heterogenitu populací především s ohledem na postižení axilárních lymfatických uzlin a podávání adjuvantní chemoterapie. Hormonální léčba by však měla být nabídnuta pacientkám s ER- či PR-pozitivním karcinomem prsu bez ohledu na věk, menopauzální status, amplifikaci HER-2/neu, stav axilárních uzlin i aplikaci cytostatické terapie. Výjimku mohou tvořit nádory malé (o velikosti 0,5–1 cm), hormonálně dependentní, s negativními axilárními uzlinami, u kterých je prognóza vývoje onemocnění příznivá a přínos hormonální léčby nízký. Rozdíly v designu a v populaci žen zařazených do jednotlivých klinických studií neumožňují přímé srovnání výsledků. Z tohoto důvodu není zcela jasné, zda iniciální, sekvenční nebo prodloužená léčba IA je optimální strategií adjuvantní hormonální léčby. Stejně tak není známa optimální doba léčby IA. Dlouhodobé sledování (více než 5 let) bezpečnosti a účinnosti těchto preparátů dosud není vyhodnoceno. Všechny studie ovšem konzistentně potvrzují, že IA 3. generace u postmenopauzálních žen s pozitivními hormonálními receptory snižují riziko rekurence (ipsilaterální recidivy, kontralaterálního nádoru prsu i distančních metastáz) ve srovnání s TMX samotným, pokud jsou užity jako iniciální adjuvantní terapie, sekvenčně či jako prodloužená léčba.
Kumulativní toxicita spojená s podáváním IA v případě, že byly použity jako iniciální léčba, snad může vysvětlit absenci prodloužení celkového přežití i přes zlepšení přežití bez známek onemocnění. Z tohoto důvodu pak změna terapie („switch“) z TMX na IA, která snižuje riziko toxicity, bude pravděpodobně nejlepší alternativou hormonální léčby ve vztahu k účinnosti a toxicitě [21].
Přetrvávající nejistota ohledně optimální endokrinní léčby postmenopauzálních žen se projevila i v hlasování panelu St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer v roce 2011; diskutující se rozdělili na dvě skupiny v názoru na to, zda by všechny postmenopauzální pacientky v určitém období hormonální léčby měly dostávat léčbu IA, nebo ne [24]. Účastníci panelové diskuse se shodli na stanovisku, že část žen může být léčena pouze TMX, zatímco část pacientek, například s pozitivními axilárními uzlinami, by měla zahájit léčbu IA.
Závěr
Při rozhodování o správné volbě hormonální léčby pro konkrétní pacientku je nutné vzít v úvahu riziko recidivy, riziko toxicity a přidružená onemocnění. V současné době nejsou doloženy jednoznačné rozdíly v účinnosti nebo toxicitě mezi anastrozolem, letrozolem a exemestanem. U postmenopauzálních žen je dle National Comprehensive Cancer Network (NCCN) doporučení užívat samotný TMX po dobu 5 let omezeno pouze na pacientky, které odmítají podávání IA či mají k této léčbě kontraindikaci. U vybraných postmenopauzálních pacientek s nízkým rizikem, u pacientek s komorbiditami pohybového aparátu nebo s kardiovaskulárními rizikovými faktory, i s ohledem na malý prospěch užití IA v porovnání s TMX, je možné podávání samotného TMX.
Seznam použité literatury
- [1] Brock RC. The Life and Work of Astley Cooper. Edinburgh and London, Livingstone. 1952.
- [2] Beatson GT. On the treatment of inoperable cases of carcinoma of the mamma: suggestions for a new method of treatment with illustrative cases. Lancet 1896; 2: 104–107.
- [3] Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005; 365: 1687–1717.
- [4] Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet 2011; 378: 771–784.
- [5] Campos SM. Aromatase inhibitors for breast cancer in postmenopausal women. Oncologist 2004; 9: 126–136.
- [6] Petit T, Dufour P, Tannock I. A critical evaluation of the role of aromatase inhibitors as adjuvant therapy for postmenopausal women with breast cancer. Endocr Relat Cancer 2011; 18, doi: 10.1530/ERC-10-0162.
- [7] Kaufmann M, Jonat W, Hilfrich J. Improved Overall Survival in Postmenopausal Women With Early Breast Cancer After Anastrozole Initiated After Treatment With Tamoxifen Compared With Continued Tamoxifen: The ARNO 95 Study, JCO 2007; 25: 2664–2670.
- [8] Coombes RC, Kilburn LS, Snowdon CF, et al. Survival and safety of exemestane versus tamoxifen after 2-3 years' tamoxifen treatment (Intergroup Exemestane Study): a randomised controlled trial. Lancet 2007; 369: 559–570.
- [9] Goss PE, Ingle JN, Martino S. Randomized Trial of Letrozole Following Tamoxifen as Extended Adjuvant Therapy in Receptor-Positive Breast Cancer: Updated Findings from NCIC CTG MA.17. J Natl Cancer Inst 2005; 97: 1262–1271.
- [10] Arimidex, Tamoxifen, Alone or in Combination (ATAC) Trialists' Group, Forbes JF, Cuzick J, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 100-month analysis of the ATAC trial. Lancet Oncol 2008; 9: 45–53.
- [11] Breast International Group (BIG) 1-98 Collaborative Group, Thürlimann B, Keshaviah A. A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. N Engl J Med 2005; 353: 2747–2757.
- [12] Howell A, Cuzick J, Baum M, et al. Results of the ATAC (Arimidex Tamoxifen, Alone or in Combination) trial after completion of 5 years' adjuvant treatment for breast cancer. Lancet 2005; 365: 60–62.
- [13] Arimidex, Tamoxifen, Alone or in Combination (ATAC) Trialists' Group. Comprehensive side-effect profile of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: long-term safety analysis of the ATAC trial. Lancet Oncol 2006; 7: 633–643.
- [14] Cuzick J, Sestak I, Baum M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial. Lancet Oncol 2010; 11: 1135–1141.
- [15] Boccardo F, Rubagotti A, Guglielmini P, et al. Switching to anastrozole versus continued tamoxifen treatment of early breast cancer. Updated results of the Italian tamoxifen anastrozole (ITA) trial. Ann Oncol 2006; 17: 10–14.
- [16] Jakesz R, Jonat W, Gnant M, et al. Switching of postmenopausal women with endocrine-responsive early breast cancer to anastrozole after 2 years' adjuvant tamoxifen: combined results of ABCSG trial 8 and ARNO 95 trial. Lancet 2005; 366: 455–462.
- [17] Jonat W, Gnant M, Boccardo F, et al. Effectiveness of switching from adjuvant tamoxifen to anastrozole in postmenopausal women with hormone-sensitive early-stage breast cancer: a meta-analysis. Lancet Oncol 2006; 7: 991–996.
- [18] Dowsett M, Cuzick J, Ingle J, et al. Meta-analysis of breast cancer outcomes in adjuvant trials of aromatase inhibitors versus tamoxifen. J Clin Oncol 2010; 28: 509–518.
- [19] Colleoni M, Giobbie-Hurder A. Benefits and adverse effects of endocrine therapy. Ann Oncol 2010; 21: 107–111.
- [20] Coates AS, Keshaviah A, Thürlimann B, et al. Five years of letrozole compared with tamoxifen as initial adjuvant therapy for postmenopausal women with endocrine-responsive early breast cancer: update of study BIG 1-98. J Clin Oncol 2007; 25: 486–492.
- [21] Amir E, Seruga B, Niraula S, et al. Toxicity of Adjuvant Endocrine Therapy in Postmenopausal Breast Cancer Patients: A Systematic Review and Meta-analysis. JNCI J Natl Cancer Inst 2011; 103, doi: 10.1093/jnci/djr242.
- [22] Hadji P, Aapro MS, Body JJ, et al. Management of aromatase inhibitor-associated bone loss in postmenopausal women with breast cancer: practical guidance for prevention and treatment. Ann Oncol 2011; 22, doi:10.1093/annonc/ mdr017.
- [23] Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22: 1736–1747.