Aktuality v léčbě inhibitory dipeptidyl peptidázy 4
Posledních dvanáct měsíců přineslo řadu nových informací o působení inhibitorů dipeptidyl peptidázy 4 (DPP-4) především v oblasti bezpečnosti a následně i analýzy výsledků prvních studií hodnotících kardiovaskulární ukazatele. Dvě publikace vydané v první polovině roku 2013 obnovily kontroverze o potenciálu inkretinů stimulovat proliferaci nejen β-buněk, ale i jiných buněčných linií ve tkáni pankreatu. Závěry odvozené z výsledků těchto prací byly ovšem přijaty se značnými výhradami kvůli poměrně závažným technickým a metodologickým nedostatkům provedených výzkumů.
Na základě posouzení řady zdrojů vydaly FDA a EMA v únoru 2014 své stanovisko, že dohady o příčinné souvislosti mezi léčivy odvozenými od inkretinů a pankreatitidou či karcinomem pankreatu neodpovídají současným vědeckým datům. Do doby, než budou k dispozici další informace, považují tyto autority pankreatitidu jen za určité riziko, které může být spojeno s touto formou léčby.
První ze série studií s inhibitory DPP-4 specificky zaměřených na působení těchto léčiv na kardiovaskulární ukazatele (SAVOR, EXAMINE) naznačily neutrální vliv zkoumaného saxagliptinu a alogliptinu na kardiovaskulární systém.
Vysvětlení, proč se potenciální pozitivní účinky inhibitorů DPP-4 nepromítly do snížení četnosti kardiovaskulárních příhod, má jistě dvě roviny. První souvisí s krátkým časovým horizontem obou studií (řádově 2–3 roky), při němž nemůže dojít při použití léčiv ovlivňujících primárně glykovaný hemoglobin k zásadním strukturálním změnám na velkých cévách. Druhou rovinou jsou prozatím nepříliš známé účinky inhibice DPP-4 na funkce endotelu, další funkce cévní stěny či působení v různých tkáních myokardu. Výsledky další studie (VIVIDD) ukázaly, že o kardiálních účincích inhibitorů DPP-4 u osob se srdečním selháním víme v současné době jen velmi málo, aby bylo možné provést seriózní závěry. Bude tak nezbytné vyčkat na výsledky dalších kardiovaskulárních projektů.
Úvod
Posledních dvanáct měsíců přineslo řadu nových informací o působení inhibitorů dipeptidyl peptidázy 4 (DPP-4) nejen na úrovni klinické medicíny. V první polovině roku 2013 byla intenzivně diskutována problematika bezpečnosti léčiv odvozených od inkretinů a druhá polovina téhož roku přinesla výsledky prvních studií hodnotících kardiovaskulární ukazatele při léčbě inhibitory DPP-4. Analýzy obou zmíněných témat se objevovaly v řadě předních odborných diabetologických periodik. Některé zmíněné aspekty jsou v současné době již jasnější, ovšem klinický význam dalších získaných poznatků bude možné specifikovat až v budoucnu po vyhodnocení dalšího výzkumu.
Je léčba odvozená od GLP-1 bezpečná?
V březnu 2013 byla odborná veřejnost očekávající výsledky prvních studií s kardiovaskulárními endpointy poněkud zaskočena zprávou z naprosto odlišné oblasti, a to z oboru histopatologie. Butlerová a kolektiv publikovali práci s názvem Výrazná expanze exokrinního a endokrinního pankreatu v souvislosti s léčbou inkretiny u osob se zvýšenou dysplazií pankreatu a potenciál pro glukagon produkující neuroendokrinní tumory [1].
Tato práce navazovala na jisté kontroverze o potenciálu inkretinů ve smyslu regenerace β-buněk, ale i eventuální stimulace proliferace jiných buněčných linií ve tkáni pankreatu, které byly shrnuty v přehledovém článku Kritická analýza klinického užití terapie odvozené od inkretinů [2]. Předpokládaným mechanismem, který měl vysvětlovat tyto vedlejší účinky terapie odvozené od inkretinů, měla být exprese receptorů pro GLP-1 (glucagon-like peptide 1) nejen v buňkách ostrůvků pankreatu, ale i na epiteliích pankreatických duktů. Proliferace acinů a duktů pankreatu při podávání inkretinové léčby byla totiž pozorována v některých preklinických studiích [3–5] a GLP-1 měl taktéž stimulovat proliferační signální kaskádu v lidských epiteliálních buňkách pankreatu [6]. Autoři hypoteticky uváděli, že proliferace buněk duktů s následnou okluzí měla vysvětlovat případný vzestup intraduktálního tlaku jako důležitý spouštěcí faktor eventuální pankreatitidy.
Úvahy v podobném duchu podporovaly i signály generované databázovým systémem FDA (Food and Drug Administration) zaměřeným na odhalení potenciálních problémů bezpečnosti léčiv, které naznačovaly také „jistou spojitost“ 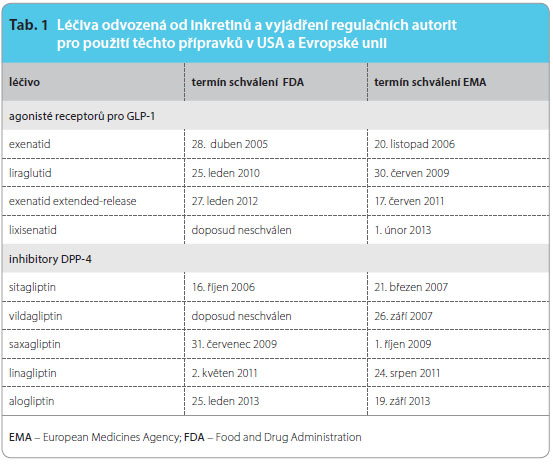 mezi široce užívanými léčivy odvozenými od inkretinů (tab. 1) a výskytem pankreatitid. Daleko závažnější zdravotní dopady by pochopitelně měla uváděná možná subklinická proliferace duktů, acinární či duktální metaplazie spojená s rizikem vzniku subklinické pankreatitidy, která by mohla postihovat jistě větší počet uživatelů léčiv odvozených od inkretinů.
mezi široce užívanými léčivy odvozenými od inkretinů (tab. 1) a výskytem pankreatitid. Daleko závažnější zdravotní dopady by pochopitelně měla uváděná možná subklinická proliferace duktů, acinární či duktální metaplazie spojená s rizikem vzniku subklinické pankreatitidy, která by mohla postihovat jistě větší počet uživatelů léčiv odvozených od inkretinů.
Lze usuzovat, že mírná forma asymptomatické chronické pankreatitidy spojené s proliferativními změnami postihuje nemalou skupinu osob středního věku, které jsou potenciálními uživateli těchto léčiv. Obava, že by se předpokládané negativní působení léčiv odvozených od inkretinů superponovalo v již predisponovaném terénu, vytvářela poměrně hrozivý scénář. Jeho základ byl odvozen z údajů o expresi receptoru pro GLP-1 na tzv. pankreatických intraepiteliálních lézích (považovaných za prekancerózu) a buňkách karcinomu pankreatu u lidí. Autoři dané analýzy přirovnávali situaci v lézích exokrinního pankreatu při léčbě přípravky odvozenými od inkretinů ke stavům, kdy při léčbě estrogeny lze u některých osob s maligními dysplastickými změnami v prsní žláze s expresí receptorů pro estrogeny urychlit růst a případně maligní konverzi [7].
Autoři tak postavili GLP-1 do role stimulátoru růstu v exokrinním pankreatu, který může navodit akceleraci u dysplastických lézí a přispět k rozvoji karcinomu pankreatu. V práci Butlerové byl navíc popsán výskyt hyperplazie α-buněk, glukagon exprimujících mikroadenomů a výskyt jednoho neuroendokrinního tumoru, což vedlo autory k vyslovení obavy o možném potenciálu vývoje neuroendokrinních tumorů. Tyto teze byly jistě „hozenou rukavicí“ pro regulační orgány, ale vyvolaly diskuse i v řadách klinických diabetologů. Závěry generované z výsledků výše uvedených výzkumů byly ovšem napadeny pro poměrně závažné technické a metodologické nedostatky. Řada odborníků se v periodikách vyjadřovala kriticky k širšímu zobecnění těchto výsledků a jejich výhrady k metodice výzkumu na úrovni exprese receptorů, buněčné proliferace endokrinního i exokrinního pankreatu shrnul v přehledném článku Drucker [8]. Metodologické nedostatky byly spatřovány především v použití nedostatečně citlivých reagencií, která měla lokalizovat expresi receptoru pro inkretiny; další značný potenciál chybné interpretace se týkal procesu izolace RNA pouze z buněk duktů, acinů či buněk Langerhansových ostrůvku. Při kontaminaci RNA z jiných buněčných typů mohou být závěry o genové expresi u „čistých“ buněčných linií zkresleny. V budoucnu bude možné přinést spolehlivější poznatky o přímých cílových strukturách účinku GLP-1 v buňkách pankreatu pomocí metod, které umožní studovat jednotlivou endokrinní či acinární buňku; k jejímu získání dopomohou izolátory využívající fluorescenci aktivovaných buněk a nebo metoda laserové mikrodisekce s následným použitím validovaných antisér a PCR (polymerase chain reaction) analýzy, v níž primery obsahují celou délku receptoru pro GLP-1, nejen jeho fragment.
Proliferace β-buněk
Výsledky řady preklinických studií prokazovaly proliferační a antiapoptotickou aktivitu GLP-1 vedoucí ke zvětšení množství a masy β-buněk a úvodní experimenty podporovaly představu, že agonisté receptoru pro GLP-1 stimulují neogenezi β-buněk aktivací právě tohoto receptoru na duktálních buňkách. Nicméně příspěvek neogeneze z duktálních prekurzorů ke vzniku nových β-buněk u dospělých myší byl zpochybněn výsledky studie [9].
Nová data z oblasti intracelulárních mechanismů řízení proliferace vysvětlují skutečnost, proč doposud nemáme klinické důkazy o nárůstu hmoty funkčních β-buněk u osob s diabetem léčených pomocí agonistů GLP-1 nebo inhibitorů DPP-4. Naprostá většina výzkumů s pozitivními dopady na proliferaci byla totiž realizována na mladých zvířatech, zatímco β-buňky starších hlodavců vykazují daleko nižší nebo zcela nulovou odezvu na různé regenerativní stimuly, agonisty receptoru pro GLP-1 nevyjímaje. Snížení schopnosti dělení je odvozeno od ztráty proteinů, které regulují buněčný cyklus např. Skp2, a naopak trvalé exprese p16Ink4a jak u starších hlodavců, tak i lidských β-buněk. Právě lidské β-buňky jsou výrazně méně citlivé na proliferační stimuly ve srovnání s β-buňkami hlodavců a jejich replikace je daleko nižší u starších osob [10].
Z tohoto důvodu bude v budoucnu nezbytné zjistit, zda i β-buňky starších nemocných s diabetem si zachovaly jistou schopnost proliferace a zda působení inkretinů v nich napomáhá udržet jejich funkční diferencovaný stav (β-buňky mají totiž schopnost za nepříznivých podmínek realizovat proces „dediferenciace“, která je samozřejmě spojena se zástavou produkce inzulinu). V práci Butlerové byla také uváděna hyperplazie α-buněk u osob léčených exenatidem nebo sitagliptinem s náznakem představy, že omezení sekrece glukagonu těmito přípravky může vést k nárůstu masy α-buněk. Analýza dostupných výsledků výzkumu v této oblasti ukazuje, že k rozvoji hyperplazie
α-buněk dochází pouze v případě úplné blokády produkce glukagonu [11], ale inhibitory DPP-4 nebo agonisté receptoru pro GLP-1 obecně snižují plazmatické koncentrace glukagonu o 20–50 % [12, 13]. Naopak řada výsledků na sobě nezávislých výzkumů je v rozporu se spekulativní dráhou propojující parciální pokles sekrece glukagonu a expanzi α-buněk, eventuálně i tvorbu neuroendokrinních tumorů.
Podobná situace nastala i při analýze výsledků studií vlivu GLP-1 na buňky exokrinního pankreatu (buňky acinů a duktů). Při nejistotě, zda vůbec buňky acinů a duktů exprimují funkční receptor GLP-1, nebylo kromě zmíněné studie (Butlerová) jinými studiemi spolehlivě potvrzeno, že trvalá stimulace receptoru pro GLP-1 vede k proliferaci buněk exokrinního pankreatu. Histologické analýzy slinivek prováděné po dlouhodobé (dvouleté) léčbě sitagliptinem a vildagliptinem u stovek myší a potkanů v několikanásobcích terapeutických dávek nevykazovaly žádnou neoplazii buněk acinů, duktů či buněk endokrinních. Sitagliptin, který byl podáván po dobu tří měsíců u opic, 12 měsíců u psů a 24 měsíců u myší a potkanů v dávkách navozujících několikanásobnou expozici proti terapeutickým dávkám, nezpůsobil žádné detekovatelné makroskopické či mikroskopické abnormality.
Inhibice DPP-4 a zánětlivé procesy v pankreatu
Základní antidiabetické působení inhibitorů DPP-4 vyžaduje funkční receptory pro GLP-1 a GIP (gastric inhibitory polypeptide) [14, 15], nicméně jejich působení mimo metabolismus glukózy může být navozeno jinými substráty. Exprese a aktivita DPP-4 (CD26) na membráně buněk imunitního systému, a navíc i přítomnost receptoru pro GLP-1 u řady buněk imunitního systému je logickou platformou pro analýzu toho, do jaké míry inhibitory DPP-4 a agonisté GLP-1 modulují imunitní funkce. Naprostá většina funkcí DPP-4 v buňkách imunitního systému nesouvisí s enzymatickou funkcí tohoto proteinu. Jeho signální funkce v imunitních procesech je nezávislá na jeho katalytické účinnosti, a proto částečná inhibice katalytické aktivity vysoce selektivními inhibitory DPP-4 nevede k narušení imunitních funkcí.
Dokládají to i výsledky výzkumu, při němž nedošlo ke změnám funkce T lymfocytů u myší léčených vysoce selektivním inhibitorem DPP-4. V jednom preklinickém projektu studujícím vliv sitagliptinu u transgenních potkanů se zvýšenou mírou zánětlivé aktivity v pankreatu (tzv. hIAPP – human islet amyloid polypeptide) byly po 12týdenní léčbě detekovány u jednoho jedince z osmi změny charakteru fokálního zánětu pankreatu. S cílem ověřit vznik těchto abnormalit v exokrinním pankreatu u tohoto modelu potkana provedla skupina Aston-Mourney a kol. [16] po 12měsíční léčbě sitagliptinem analýzu depozice amyloidu, proliferace buněk duktů a velikosti pankreatů u exponovaných zvířat a nezjistila jakékoli změny. Jedinou odchylkou bylo zvýšení objemu masy β-buněk, což odpovídá známým účinkům sitagliptinu u hlodavců.
Léčba odvozená od inkretinů a zánětlivé markery
Mírné vzestupy plazmatických hladin amylázy a lipázy byly zjištěny u osob s diabetem léčených inhibitory DPP-4, konkrétně alogliptinem a sitagliptinem [17], a v odlišné observační studii byl pozorován u 35,6 % osob s diabetem léčených sitagliptinem, saxagliptinem nebo exenatidem nárůst plazmatických hladin amylázy a/nebo lipázy [18]. Nicméně zvýšené hodnoty byly zjištěny i u osob ve srovnávací skupině neléčené pomocí inhibitorů DPP-4 či agonistů receptoru pro GLP-1.
Není tedy zcela jasné, zda zvýšení aktivity enzymů odráží subklinický zánět, nebo poruchu regulace syntézy, sekrece či clearance těchto enzymů. Z řady dalších experimentů ovšem vyplývá, že inhibitory DPP-4 i agonisté receptoru pro GLP-1 působí protizánětlivě ve tkáních exokrinního i endokrinního pankreatu, a dokonce i v cirkulujících krevních buňkách, i když mechanismy tohoto působení nejsou doposud objasněny [19, 20]. I když je nezbytné přistupovat k hypotéze o možné proliferaci buněk navozené stimulací receptorů pro GLP-1 vážně, existuje zde další nepřímý důkaz o bezpečnosti v tomto směru: u nemocných, kteří podstoupili některé typy bariatrických výkonů, jsou hladiny GLP-1 elevovány po dlouhou dobu po operaci, a přesto nejsou pozorovány případy pankreatitid, karcinomů štítné žlázy, glukagonomů či karcinomu pankreatu ani při 10letém sledování těchto osob [21].
Na sklonku února 2014 vydala FDA a EMA své stanovisko k bezpečnosti léčiv odvozených od inkretinů ve vztahu k pankreatu [22]. V daném dokumentu je zdůrazněno, že obě instituce v průběhu roku 2013 nezávisle analyzovaly signály postmarketingových hlášení pankreatitid a karcinomu pankreatu u osob léčených inhibitory DPP-4 nebo agonisty receptoru pro GLP-1. Uvádí se, že spontánní hlášení nežádoucích účinků je zpravidla považováno za „bezpečnostní signál“, u něhož vyhodnocení kauzálního vztahu bývá limitováno některými faktory, např. vysokou frekvencí sledovaného onemocnění i bez vlivu terapie, delším obdobím latence a eventuálním přispěním samotného onemocnění. FDA opětovně hodnotila 250 toxikologických studií provedených na 15 480 hlodavcích a 2475 jiných zvířatech a uzavírá, že vyhodnocení mikroskopických nálezů neprokázalo žádné známky zřetelných toxických změn na pankreatu či známky pankreatitidy. Podobnou analýzu provedla i EMA u všech léčiv, která jsou schválena k použití v Evropské unii, a nebyly nalezeny léčivy indukované tumory pankreatu ani u zvířat léčených po dva roky (běžná délka života hlodavce) dávkami značně přesahujícími hladinu lidské terapeutické expozice. Návazně byly vyžádány od všech výrobců léčiv i 3měsíční studie pankreatické toxicity u zvířecích modelů diabetu spojené s pečlivým histopatologickým vyhodnocením endokrinní a exokrinní pankreatické tkáně. Tři z těchto studií již byly zkompletovány a předány k posouzení FDA – opět nebyly hlášeny nežádoucí účinky spojené s léčbou v oblasti pankreatu a FDA provedla v jedné ze studií i „druhé čtení“ vzorků tkání nezávislými patology, které se v podstatě shodovalo s nálezy uváděnými ve zprávách výrobců léčiv.
FDA uskutečnila i zcela nezávislou toxikologickou studii s exenatidem u zvířecích modelů nemoci: 1) u myšího modelu chemicky indukované pankreatitidy, 2) u Zuckerova modelu diabetického potkana, 3) u myšího modelu C57BL/6 krmeného dietou s vysokým obsahem tuků. U prvních dvou animálních modelů nebyly nalezeny žádné změny pankreatu navozené exenatidem. U posledního modelu byly po 12 týdnech léčby exenatidem patrné změny mírného až středního rozsahu, které měly charakter exacerbace již přítomné hyperplazie acinárních buněk, atrofie a periduktálního zánětu či fibrózy. Tento myší model není FDA oficiálně schválen jako model pro testování změn v pankreatu navozených léčivy, a proto je doporučeno pokračovat ve výzkumu.
V oblasti databází bezpečnosti léčiv FDA analyzovala data z 200 studií, v nichž aktivní léčbu inkretiny dostávalo více než 28 tisíc nemocných; podobné kroky provedla i EMA se závěrem, že byly zjištěny malé nesrovnalosti v četnosti hlášených pankreatitid, ale celkový počet příhod je velmi malý. S tímto nálezem koresponduje i analýza dat 14 611 nemocných s diabetem 2. typu léčených sitagliptinem, která neprokázala nárůst rizika vzniku pankreatitidy či karcinomu pankreatu. Hodnocení zvýšených hladin amylázy a lipázy pozorované při léčbě inkretiny považují obě instituce za relativně nezávažné, protože průměrné hodnoty sledovaných enzymů se vždy nacházely v normálním rozmezí a jejich změny nebyly závislé na gastrointestinálních nežádoucích účincích (nauzea, bolest břicha atd.). Přesvědčení o bezpečnosti léčby pomocí léčiv odvozených od inkretinů posilují i výsledky klinických studií s inhibitory DPP-4 SAVOR (the Saxagliptin Assessment of Vascular Outcomes Recorded) a EXAMINE (the Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care). Obě studie byly primárně zaměřeny na kardiovaskulární parametry, ovšem sledována byla i četnost případů akutní pankreatitidy a karcinomů pankreatu [23, 24]. Ve vztahu k velkému počtu nemocných zařazených do těchto klinických sledování (SAVOR – 16 492 osob, EXAMINE – 5380 osob) byla frekvence hlášených případů akutní pankreatitidy v obou projektech nízká a zároveň četnost v aktivní i placebové větvi byla podobná (SAVOR: 22 vs. 16, EXAMINE: 12 vs. 8). Výskyt karcinomu pankreatu byl ve studii SAVOR zaznamenán u 5 osob v aktivní větvi a u 12 osob ve větvi s placebem a ve studii EXAMINE nebyly hlášeny žádné případy tohoto onemocnění jak v aktivní, tak ani v placebové větvi.
Dále FDA i EMA provedly analýzu výsledků kohortových a tzv. case-control observačních studií, které ukazují na rozporuplné výsledky dané především metodologickými chybami. Na základě posouzení řady zdrojů vydaly obě instituce stanovisko, že dohady o příčinné souvislosti mezi léčivy odvozenými od inkretinů a pankreatitidou či karcinomem pankreatu neodpovídají současným datům. V této době proto FDA ani EMA nedospěly k definitivnímu stanovisku o zmíněné příčinné souvislosti. Přestože současná data navracejí důvěru k léčivům odvozeným od inkretinů, zůstává pankreatitida považována za jisté riziko spojené s touto léčbou, a to přinejmenším do doby, než budou k dispozici další informace, jež se stanou předmětem šetření obou regulačních autorit. FDA a EMA se zaměří na systematické podchycení všech dat o pankreatitidě a karcinomu pankreatu z probíhajících a následujících klinických studií; podobně i farmakovigilanční studie, jako např. SAFEGUARD (Safety Evaluation of Adverse Reactions in Diabetes), by mohla v budoucnosti přinést přesnější informace o poměru přínosu a rizik jednotlivých léčiv užívaných pro terapii diabetu.
Kardiovaskulární účinky inhibitorů DPP-4
V roce 2013 byly také publikovány první ze série studií s inhibitory DPP-4, které byly specificky zaměřeny na dopad léčby těmito přípravky na kardiovaskulární ukazatele. Jednalo se o již zmíněné studie SAVOR a EXAMINE.
V rámci stručného představení obou projektů je SAVOR studií, která zařadila 16 492 nemocných s diabetem 2. typu a prodělanou kardiovaskulární příhodou nebo s rizikem jejího vzniku a randomizovala je k léčbě saxagliptinem či placebem s následným sledováním po dobu 2,1 roku. Primárním sledovaným ukazatelem byl souhrn kardiovaskulárních úmrtí, infarktů myokardu a ischemických cévních mozkových příhod, který byl zaznamenán u 613 nemocných z větve se saxagliptinem a u 609 osob z větve s placebem, tj. 7,3 % vs.7,2 %; hazard ratio, HR 1,00 při 95% intervalu spolehlivosti, CI: 0,89–1,12; p = 0,99 pro superioritu, p < 0,001 pro non-inferioritu. Abstrakt studie uzavírá stručným konstatováním, že saxagliptin nezvýšil ani nesnížil četnost ischemických příhod ve vztahu k placebu, ačkoli počet hospitalizací pro srdeční selhání byl vyšší při léčbě saxagliptinem.
Ve studii EXAMINE byli nemocní s diabetem 2. typu po akutním infarktu myokardu či nestabilní angině pectoris vyžadující hospitalizaci randomizováni k léčbě alogliptinem či k podávání placeba k již zavedené antidia-
betické a kardiovaskulární farmakoterapii. EXAMINE byla koncipována jako non-inferioritní studie, která měla se studií SAVOR shodný primární ukazatel, a to souhrn kardiovaskulárních úmrtí, infarktů myokardu a ischemických cévních mozkových příhod. V jejím rámci bylo sledováno 5380 nemocných po dobu až 40 měsíců (medián délky sledování byl 18 měsíců) s výskytem primárního endpointu u 305 osob z větve s alogliptinem (11,3 %) a u 316 osob z větve s placebem (11,8 %), HR 0,96; horní hranice CI: 1,16; p < 0,001 pro non-inferioritu.
Obě studie tak přinesly v podstatě shodný výsledek pozorování neutrálního vlivu těchto dvou inhibitorů DPP-4 na kardiovaskulární aparát. Někteří odborníci očekávali na základě předchozích výzkumů více než non-inferioritu inhibitorů DPP-4 oproti placebu, nicméně tyto výsledky umožnily otevřenou diskusi a systematické vyhodnocení patofyziologických účinků DPP-4 ve vztahu ke kardiovaskulárnímu aparátu. Příslibem pozitivních očekávání ve vztahu ke kardiovaskulárním účinkům inhibitorů DPP-4 bylo především snížení hodnoty glykovaného hemoglobinu bez vyšší incidence hypoglykemických epizod, rovněž však údaje o pozitivním vlivu inhibitorů DPP-4 na postprandiální lipemii a důkazy o účinku inhibice DPP-4 na snížení markerů zánětu [20].
Vysvětlení, proč se tyto potenciální pozitivní účinky nepromítly do snížení četnosti kardiovaskulárních příhod v publikovaných studiích, má dvě roviny. První rovinou jsou nedávno získané znalosti o relativní efektivitě jednotlivých intervencí v rámci prevence kardiovaskulárních příhod. Výsledky metaanalýz přesvědčivě dokládají, že i když intervence spojená se snížením hodnot HbA 1c snižuje kardiovaskulární riziko, je redukce rizika dosažená léčbou LDL cholesterolu statiny nebo poklesem hodnoty krevního tlaku antihypertenzivy podstatně výraznější [25]. V krátkém časovém horizontu, který odpovídal délce trvání obou studií (řádově 2–3 roky), nedochází při použití léčiv ovlivňujících primárně HbA 1c k zásadním změnám na cévním řečišti, jež by se promítly do snížení četnosti makrovaskulárních příhod (zvláště pokud rozdíl v HbA 1c proti placebové skupině nebyl dramatický a dosahoval @ 0,3–0,4 %). To ostatně dokládají i výsledky delších projektů (doba sledování 5 let), v nichž bylo dosaženo výraznějšího poklesu hodnot HbA 1c, a přesto nedošlo v podobných kardiovaskulárních ukazatelích k zásadním změnám [26].
Výše zmíněné neutrální výsledky nevylučují pozitivní/negativní kardiovaskulární dopady léčby inhibitory DPP-4 při déletrvajícím podávání, které podle dosavadních zkušeností s jinými perorálními antidiabetiky musí být alespoň 10leté, než dojde ke zřetelnému ovlivnění procesu aterosklerózy. Druhou rovinou jsou prozatím nepříliš známé účinky inhibice DPP-4 na funkce endotelu, další funkce cévní stěny či působení na různé tkáně myokardu. Již delší dobu je známo, že substráty enzymatické aktivity DPP-4 nejsou jen GLP-1 a GIP, ale řada dalších peptidů, jako je např. SDF-1a (stromal cell-derived factor 1 alpha), neuropeptid Y, peptid YY, substance P, GLP-2 a neuropeptid PACAP-38, jež všechny vykazují účinky na cévní struktury [27–29]. I když samotný GLP-1 prokázal pozitivní vliv na funkce endotelu, tento účinek nebyl přítomen za všech metabolických okolností [30, 31].
V minulém roce byla publikována práce sledující efekt 6měsíčního podávání exendinu-4 a liraglutidu na „flow mediated dilation“ (FMD) jako často hodnocený parametr endoteliální funkce. V této studii nebylo prokázáno zlepšení odpovědi FMD u obézních nemocných s diabetem 2. typu [32]. Překvapivě v jiné studii vedlo podávání sitagliptinu a alogliptinu ke zhoršení odpovědi FMD u osob s diabetem 2. typu [33]. V této studii byly měřeny i hladiny GLP-1, které podle očekávání stoupaly s doprovodným poklesem glykemie; proto bylo jisté, že inhibice DPP-4 je účinná. Autoři zmiňují jako možné vysvětlení tohoto jevu působení metabolitu GLP-1 (9–36), který se při inhibici DPP-4 tvoří v omezené míře; jistou spekulací je úvaha o jeho vazodilatačním působení, které bylo ex vivo zprostředkováno pomocí oxidu dusnatého [30].
Zmiňované výsledky jsou v rozporu se závěry několika předchozích prací dokládajících zlepšení endoteliální funkce po podávání léčiv odvozených od inkretinů [34–36]. Celá problematika bude jistě námětem k širší diskusi, protože tyto studie byly často nerandomizované a zahrnuly nízký počet sledovaných osob. Do budoucna bude nezbytné provést větší randomizované projekty, které by mohly prokázat, zda léčiva odvozená od inkretinů mají přínos pro vaskulární aparát i mimo rámec léčby diabetu. V současné době mohou tyto rozporuplné závěry o působení na cévní systém napomoci vysvětlit „neutrální“ výsledky sledování inhibitorů DPP-4 ve studiích SAVOR a EXAMINE.
Inhibitory DPP-4 a srdeční selhání
Srdeční selhání si zaslouží samostatný rozbor dosavadních poznatků, protože je to kapitola ve vztahu k inhibici DPP-4 zcela specifická, ale zároveň klinicky velmi důležitá – nemocných s diabetem, kteří současně trpí kardiálním selháváním, je nezanedbatelné procento (udává se 12–25 %). Podobně značná část osob se srdečním selháváním má současně diabetes (cca 30 %). Při vývoji přípravků pro léčbu jiných onemocnění, než je srdeční selhání, není výrazný zájem zařazovat nemocné se srdečním selháním do klinických studií ze zcela oprávněné obavy, že tito nemocní mohou být vulnerabilní skupinou pro případné nežádoucí kardiální účinky nových léčiv.
Na druhé straně širší použití antidiabetických léčiv vyžaduje znalost jejich bezpečnostních aspektů i u osob se srdečním selháním, zejména za přítomnosti systolické dysfunkce. Poznatky o farmakodynamice léčiv odvozených od inkretinů na úrovni myokardu se v poslední době posunuly především díky experimentům výzkumné skupiny z Toronta [37]. Ta prokázala, že transkripty mRNA receptoru pro GLP-1 se vyskytují téměř výhradně ve svalovině síní, a nikoli komor. Léčiva odvozená od inkretinů tak působí prostřednictvím receptoru pro GLP-1 ve svalovině síní nebo v sinoatriálním uzlu. Aktivace receptoru pro GLP-1 ve svalovině síní zvyšuje sekreci atriálního natriuretického peptidu (ANP) a způsobuje tak snížení krevního tlaku. Plazmatické koncentrace ANP stoupaly po nakrmení myší s aktivními receptory pro GLP-1, ale nikoli u myší s „knockoutovanými“ receptory pro GLP-1. Tyto výzkumy ukázaly propojení linie střevo–srdce prostřednictvím GLP-1-dependentního mechanismu a současně na ANP závislou osu regulující krevní tlak. Aktivace receptoru pro GLP-1 v sinoatriálním uzlu má chronotropní efekt a zvyšuje tepovou frekvenci, kterou klinicky můžeme pozorovat při podávání agonistů receptoru pro GLP-1.
Na úrovni klinických výzkumů nedávno vzbudily intenzivní debaty výsledky dvou projektů s inhibitory DPP-4. Byla to již zmíněná studie SAVOR, v níž byl hlášen vyšší výskyt osob hospitalizovaných pro srdeční selhání ve větvi léčené saxagliptinem (3,5 %) než ve větvi s podáváním placeba (2,8 %); HR 1,27; 95% CI: 1,07–1,51; p = 0,007 [23]. Četnější hospitalizace pro srdeční selhání byly ve větvi léčené saxagliptinem neočekávané a může se jednat v rámci tak rozsáhlého projektu i o falešně pozitivní výsledek. Nicméně tento „signál“ bude nezbytné pečlivě sledovat v dalších studiích, a to s ohledem na výsledky jediného dosavadního projektu s inhibitory DPP-4 cíleně zaměřeného na nemocné se srdečním selháním, a sice studii VIVIDD (Vildagliptin in Ventricular Dysfunction Diabetes) [38].
V této studii bylo randomizováno v poměru 1 : 1 (vildagliptin : placebo) a sledováno po dobu jednoho roku 254 nemocných s různou tíží srdečního selhání – NYHA I (9,8 %), NYHA II (52,8 %) a NYHA III (37,4 %). Primárním endpointem byl vývoj ejekční frakce levé komory (EF LK) v 52. týdnu léčby. Tento parametr byl zlepšen jak ve větvi léčené vildagliptinem (o 4,1), tak i ve větvi s podáváním placeba (o 3,5), p = 0,67 potvrzující non-inferioritu. Překvapivým nálezem bylo zjištění, že došlo ke zvětšení enddiastolického objemu levé komory (LVEDV, left ventricular end-diastolic volume, p = 0,007), endsystolického objemu levé komory (LVESV, left ventricular end-systolic volume, p = 0,06) a tepového objemu („stroke volume“, p = 0,002). Zároveň byl ve studii zaznamenán pokles hladin BNP (brain natriuretic peptide) – ve skupině s placebem o 14 % a ve skupině léčené vildagliptinem o 28 %. Klinicky se vyskytlo zhoršení srdečního selhání u 22 osob v placebové skupině a u 23 osob ve skupině léčené vildagliptinem.
Hodnocení těchto dat je poměrně obtížné, protože pokud by zvětšení LVEDV a LVESV byla reálná, znamenalo by to nepříznivý vývoj odrážející zhoršení systolické funkce, což se ovšem při hodnocení EF LK neprokázalo. Podobně i pokles hladin BNP ve skupině léčené vildagliptinem naznačuje, že i přes nárůst objemu levé komory nedocházelo ke zvýšení napětí ve stěně levé komory. Pro tyto rozporuplné údaje prozatím nezbývá než konstatovat, že o kardiálních účincích inhibitorů DPP-4 u osob se srdečním selháním víme v současné době jen velmi málo, aby bylo možné provést seriózní závěr. Bude nezbytné vyčkat výsledků dalších kardiovaskulárních projektů s inhibitory DPP-4, které budou publikovány v brzké budoucnosti.
Seznam použité literatury
- [1] Butler AE, Campbell-Thompson M, Gurlo T, et al. Marked expansion of exocrine and endocrine pancreas with incretin therapy in humans with increased exocrine pancreas dysplasia and the potential for glucagon-producing neuroendocrine tumors. Diabetes 2013; 62: 2595–2604.
- [2] Butler PC, Elashoff M, Elashoff R, et al. A critical analysis of the clinical use of incretin-based therapies: are the GLP-1 therapies safe? Diabetes Care 2013; 36: 2118–2125.
- [3] Perfetti R, Zhou J, Doyle ME, et al. Glucagon-like peptide 1 induces cell proliferation and pancreatic-duodenum homeobox-1 expression and increases endocrine cell mass in the pancreas of old glucose-intolerant rats. Endocrinology 2000; 141: 4600–4605.
- [4] Koehler JA, Baggio LL, Lamont BJ, et al. Glucagon-like peptide-1 receptor activation modulates pancreatitis associated gene expression but does not modify susceptibility to experimental pancreatitis in mice. Diabetes 2009; 58: 2148–2161.
- [5] MatveyenkoAV, Dry S, Cox HI, et al. Beneficial endocrine but adverse exocrine effects of sitagliptin in the human islet amyloid polypeptide transgenic rat model of type 2 diabetes: interactions with metformin. Diabetes 2009; 58: 1604–1615.
- [6] Gier B, Matveyenko AV, Kirakossian D, et al. Chronic GLP-1 receptor activation by exendin-4 induces expansion of pancreatic duct glands in rats and accelerates of dysplastic lesions and chronic pancreatitis KrasG12D mouse model. Diabetes 2012; 61: 1250–1262.
- [7] Simpson PT, Reis-Filho JS, Gale T, et al. Molecular evolution of breast cancer. J Pathol 2005; 205: 248–254.
- [8] Drucker DJ. Incretin Action in the Pancreas: Potential Promise, Possible Perils and Pathological Pitfalls. Diabetes 2013; 62: 3316–3323.
- [9] Xiao X, Chen Z, Shiota C, et al. No evidence for β cell neogenesis in murine adults pancreas. J Clin Investigation 2013; 123: 2207–2217.
- [10] Perl S, Kushner JA, Buchholz BA, et al. Significant human beta cell turnover is limited to the first three decades of life as determined by in vivo thymidine analog incorporation and radiocarbon dating. J Clin Endocrinol Metab 2010; 95: E234–E239.
- [11] Hayashi Y, Yamamoto M, Mizoguchi H, et al. Mice deficient for glucagon gene-derived peptides display normoglycemia and hyperplasia of islet alpha-cells but not of intestinal cells. Mol Endocrinology 2009; 23: 1990–1999.
- [12] Dunning BE, Gerich JE. The role of alpha cells dysregulation in fasting and postprandial hyperglycemia in type 2 diabetes and therapeutic implications. Endocr Rev 2007; 28: 253–288.
- [13] Dunning BE, Foley JE, Ahrén B. Alpha cell function in health and disease: influence of glucagon-like peptide 1. Diabetologia 2005; 48: 1700–1713.
- [14] Flock G, Baggio LL, Longuet C, et al. Incretin receptors for glucagon-like peptide 1 and glucose dependent insulinotropic polypeptide are essential for the sustained metabolic action of vildagliptin in mice. Diabetes 2007; 56: 3006–3013.
- [15] Hansotia T, Baggio LL, Delmeire, et al. Double incretin receptor knockout (DIRKO) mice reveal an essential role for enteroinsular axis in transducing the glucoregulatory actions of DPP-4 inhibitors. Diabetes 2004; 53: 1326–1335.
- [16] Aston-Mourney K, Subramanian CL, Zraika S, et al. One year of sitagliptin treatment protects against islet amyloid-associated beta-cell loss and does not induce pancreatitis or pancreatic neoplasia in mice. Am J Physiol Endocrinol Metab 2013; 305: E475–E484.
- [17] Tokuyama H, Kawamura H, Fujimoto M, et al. A low-grade increase of serum pancreatic exocrine enzyme levels by dipeptidylpeptidase-4 inhibitor in patients with type 2 diabetes. Diabetes Res Clin Practice 2013; 100: 66–69.
- [18] Lando HM, Alattar M, Dua AP. Elevated amylase and lipase levels in patients using glucagon-like peptide-1 receptor agonists or dipeptidylpeptidase-4 inhibitors in the outpatient setting. Endocr Pract 2012; 18: 472–477.
- [19] Chaudhuri A, Ghanim H, Vora M, et al. Exenatide exerts a potent antiinflammatory effect. J Clin Endocrinol Metab 2012; 97: 198–207.
- [20] Makdissi A, Ghanim H, Vora M, et al. Sitagliptin exerts an antiinflammatory action. J Clin Endocrinol Metab 2012; 97: 3333–3341.
- [21] Sjöström L, Gummesson A, Sjöström CD, et al. Swedish obese subjects study effects of bariatric surgery on cancer incidence in obese patients in Sweden (Swedish obese subjects study): a prospective controlled intervention trial. Lancet Oncol 2009; 10: 653–662.
- [22] Egan AG, Blind E, Dunder K, et al. Pancreatic Safety of Incretin-Based Drugs – FDA and EMA Assessment. N Engl J Med 370; 9: 794–797.
- [23] Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369: 1317–1326.
- [24] White BW, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013; 369: 1327–1335.
- [25] Control Group, Turnbull FM, Abraira C, et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabetologia 2009; 52: 2288–2298.
- [26] The ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358: 2560–2572.
- [27] Sheikh SP. Neuropeptide Y and peptide YY: major modulators of gastrointestinal blood flow and function. Am J Physiol 1991; 261: G701–G715.
- [28] Brown NJ, Byiers S, Carr D, et al. Dipeptidyl peptidase IV inhibitor use associated with increased risk of ACE inhibitor associated angioedema. Hypertension 2009; 54: 516–523.
- [29] Otto C, Hein L, Brede M, et al. Pulmonary hypertension and right heart failure in pituitary adenylate cyclase-activating polypeptide type I receptor-deficient mice. Circulation 2004; 110: 3245–3251.
- [30] Ban K, Noyan-Ashraf H, Hoefer J, et al. Cardioprotective and Vasodilatory Actions of Glucagon-Like Peptide 1 Receptor Are Mediated Through both Glucagon-like peptide 1 Receptor- Dependent and -Independent Pathways. Circulation 2008; 117: 2340–2350.
- [31] Tesauro M, Schinzari F, Adamo A, et al. Effects of GLP-1 on forearm vasodilator function and glucose disposal during hyperinsulinemia in the metabolic syndrome. Diabetes Care 2013; 36: 683–689.
- [32] Hopkins ND, Cuthbertson DJ, Kemp GJ, et al. Effects of 6 months glucagon-like peptide-1 receptor agonist treatment on endothelial function in type 2 diabetes mellitus patients. Diab Obes Metab 2013; 15: 770–777.
- [33] Ayaori M, Iwakami N, Uto-Kondo H, et al. Dipeptidyl Peptidase-4 Inhibitors Attenuate Endothelial Function as Evaluated by Flow-Mediated Vasodilatation in Type 2 Diabetic Patients. J Am Heart Assoc 2013; 2: e003277.
- [34] Nystrom T, Gutniak MK, Zhang Q, et al. Effects of glucagon-like peptide-1 on endothelial function in type 2 diabetes patients with stable coronary artery disease. Am J Physiol Endocrinol Metab 2004; 287: E1209–E1215.
- [35] Koska J, Schwartz EA, Mulin MP, et al. Improvement of postprandial endothelial function after single dose of exenatide in individuals with impaired glucose tolerance and recent-onset type 2 diabetes. Diabetes Care 2010; 33: 1028–1030.
- [36] van Poppel PC, Netea MG, Smits P, et al. Vildagliptin improves endothelium-dependent vasodilatation in type 2 diabetes. Diabetes Care 2011; 34: 2072–2077.
- [37] Kim M, Platt JM, Shibasaki T, et al. GLP-1 receptor activation and Epac2 link atrial natriuretic peptide secretion to control of blood pressure. Nat Med 2013; 19: 567–575.
- [38] Souhrn údajů o přípravku Galvus 50mg tbl., dostupné na www. sukl.cz (navštíveno 20. března 2014).