Antiresorpční léčba postmenopauzální osteoporózy
Článek podává přehled o léčivech pro antiresorpční léčbu postmenopauzální osteoporózy. Jsou uvedeny hlavní indikace, dlouhodobá účinnost a nežádoucí účinky léčiv. Složení a mikrostruktura kosti se mění v závislosti na stupni útlumu remodelace a modelace kostní hmoty. Volba léčiva by se měla odvíjet nejenom od změn denzity kostního minerálu (BMD) a poklesu relativního rizika zlomenin v registračních studiích, ale také od dlouhodobého účinku léčiva na kvalitu kostní hmoty. Osteoporóza je chronické onemocnění. Po pěti letech užívání aminobisfosfonátů má být zvážena vhodnost pokračování této léčby. Dostatečně dokumentované studie rizika zlomenin po ukončení léčby zatím chybějí.
Osteoporóza je chronické a progredující onemocnění, jehož prvním projevem může být až zlomenina po nepřiměřeně mírném traumatu. V České republice bylo v roce 2010 registrováno 72 195 zlomenin u 3,8 milionu osob ve věku 50 a více let. Zhoršení kvality života u českých pacientů se zlomeninami bylo vyčísleno částkou 15,8 miliardy Kč. Na léčbu akutních zlomenin v České republice byly vynaloženy 4,1 miliardy Kč a dalších 1,4 miliardy Kč na léčbu starších fraktur. Zlomeniny jsou asociovány s bolestí, utrpením, invaliditou, závislostí na dopomoci, ale také se zvýšenou pravděpodobností úmrtí. V současné době jsou obě základní příčiny nízkotraumatických zlomenin, osteoporóza a tendence k pádům, nedostatečně diagnostikovány a nedostatečně léčeny. Dokonce i sekundární prevence zlomenin je zajišťována jen u jednoho z pěti pacientů, kteří už utrpěli zlomeninu v oblasti kyčle nebo jinou nízkotraumatickou zlomeninu [1]. Nedostatečná je také adherence k léčbě, a v algoritmu terapie osteoporózy je proto nezbytné farmakoekonomické posuzování jednotlivých způsobů léčby.
Zvýšená osteoresorpce a účinky antiresorpčních léků
Osteoporóza je poruchou remodelace kosti. Při involuční osteoporóze se uplatňuje především s věkem klesající funkce osteoblastů a porotizace a ztenčování kortikální kostní hmoty. Novotvorba kostní hmoty je významně utlumena také při osteoporóze indukované gl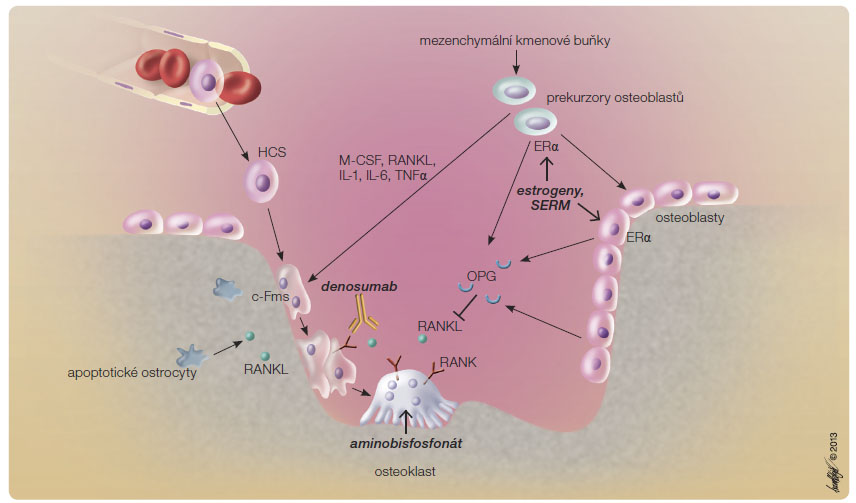 ukokortikoidy. Kvalita kostní hmoty se však významně a daleko rychleji než při stárnutí zhoršuje při vysokoobratové osteoporóze, kdy ani normální nebo zvýšená aktivita osteoblastů nestačí kompenzovat zrychlenou osteoklastickou osteoresorpci. Příčinou zvýšené osteoresorpce je nejčastěji nedostatek estrogenů v prvních letech po menopauze, ale mimo jiné jsou to také endokrinopatie (hypertyreóza, hyperparatyreóza), chronická zánětlivá onemocnění, kouření nebo podávání heparinu. Všechny tyto stavy se zvýšenou osteoresorpcí jsou spojeny s převahou produkce RANKL (ligand pro receptor aktivující jaderný faktor kappa B, NF-κB) nad produkcí osteoprotegerinu (OPG), (obr. 1). Kauzálním postupem při nadměrné osteoklastické osteoresorpci je proto antiresorpční terapie. Jejím cílem je zpomalit remodelaci kosti a
ukokortikoidy. Kvalita kostní hmoty se však významně a daleko rychleji než při stárnutí zhoršuje při vysokoobratové osteoporóze, kdy ani normální nebo zvýšená aktivita osteoblastů nestačí kompenzovat zrychlenou osteoklastickou osteoresorpci. Příčinou zvýšené osteoresorpce je nejčastěji nedostatek estrogenů v prvních letech po menopauze, ale mimo jiné jsou to také endokrinopatie (hypertyreóza, hyperparatyreóza), chronická zánětlivá onemocnění, kouření nebo podávání heparinu. Všechny tyto stavy se zvýšenou osteoresorpcí jsou spojeny s převahou produkce RANKL (ligand pro receptor aktivující jaderný faktor kappa B, NF-κB) nad produkcí osteoprotegerinu (OPG), (obr. 1). Kauzálním postupem při nadměrné osteoklastické osteoresorpci je proto antiresorpční terapie. Jejím cílem je zpomalit remodelaci kosti a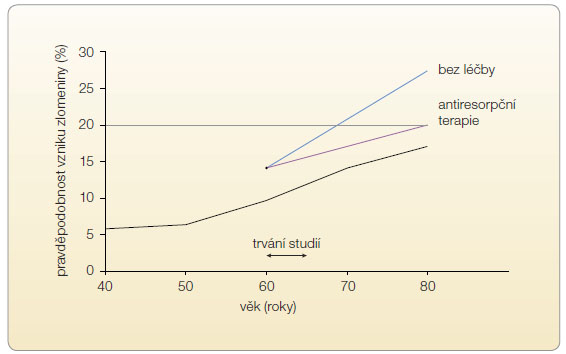 zabránit tak dalšímu zhoršování mikroarchitektury kosti a úbytku kostní hmoty. Pokud se kost neresorbuje, může pokračovat její sekundární mineralizace. Přibývá proto množství biologického hydroxyapatitu v jednotce objemu kostní hmoty. Úměrně útlumu osteoresorpce stoupá denzita kostního minerálu (bone mineral density, BMD), kost je tvrdší a mechanicky odolnější. Protože novotvorba kosti významně klesá s věkem, nezávisle na útlumu funkce osteoblastů antiresorpčními léky, riziko zlomenin s věkem stoupá i při antiresorpční léčbě, ale méně rychle, než by tomu bylo bez léčby (graf 1).
zabránit tak dalšímu zhoršování mikroarchitektury kosti a úbytku kostní hmoty. Pokud se kost neresorbuje, může pokračovat její sekundární mineralizace. Přibývá proto množství biologického hydroxyapatitu v jednotce objemu kostní hmoty. Úměrně útlumu osteoresorpce stoupá denzita kostního minerálu (bone mineral density, BMD), kost je tvrdší a mechanicky odolnější. Protože novotvorba kosti významně klesá s věkem, nezávisle na útlumu funkce osteoblastů antiresorpčními léky, riziko zlomenin s věkem stoupá i při antiresorpční léčbě, ale méně rychle, než by tomu bylo bez léčby (graf 1).
Pro dlouhodobou bezpečnost léčby jsou důležité mechanismy účinků jednotlivých antiresorpčních léků. Zkušenosti s dlouhodobou antiresorpční léčbou jsou ale limitované trváním kontrolovaných klinických studií účinnosti antiresorpční léčby na snížení rizika zlomenin (3–5 let, extenze nejvýše 10 let). Podle mechanismu účinků lze antiresorpční (antiosteokataboli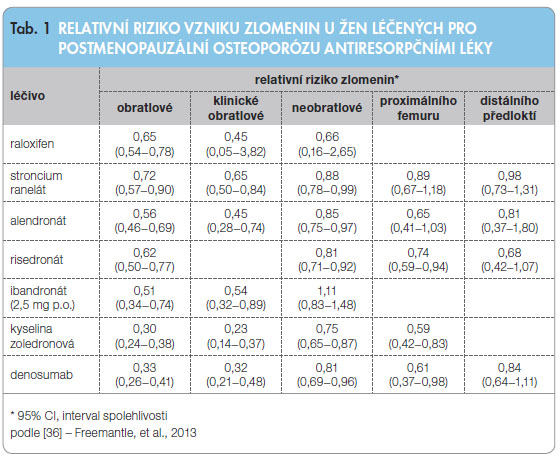 cké) přípravky registrované v České republice pro léčbu osteoporózy rozdělit do tří skupin. Především jsou to léky, které zpomalují rekrutování nových osteoklastů a tlumí osteoresorpční aktivitu osteoklastů ovlivněním signální cesty RANKL/NF-κB(estrogeny, selektivní modulátory estrogenních receptorů a denosumab). Druhou skupinou jsou aminobisfosfonáty (ABP) (alendronát, risedronát, ibandronát, kyselina zoledronová), které utlumením tvorby antiapoptotických proteinů přímo inhibují funkci osteoklastů. Do poslední skupiny pak patří stroncium ranelát, vápník a dosud neregistrované inhibitory katepsinu K. Účinnost jednotlivých antiresorpčních léků na snížení rizika zlomenin je obtížné srovnávat, určitým přiblížením jsou ale výsledky metaanalýzy různých studií (tab. 1).
cké) přípravky registrované v České republice pro léčbu osteoporózy rozdělit do tří skupin. Především jsou to léky, které zpomalují rekrutování nových osteoklastů a tlumí osteoresorpční aktivitu osteoklastů ovlivněním signální cesty RANKL/NF-κB(estrogeny, selektivní modulátory estrogenních receptorů a denosumab). Druhou skupinou jsou aminobisfosfonáty (ABP) (alendronát, risedronát, ibandronát, kyselina zoledronová), které utlumením tvorby antiapoptotických proteinů přímo inhibují funkci osteoklastů. Do poslední skupiny pak patří stroncium ranelát, vápník a dosud neregistrované inhibitory katepsinu K. Účinnost jednotlivých antiresorpčních léků na snížení rizika zlomenin je obtížné srovnávat, určitým přiblížením jsou ale výsledky metaanalýzy různých studií (tab. 1).
Regulátory signální cesty RANKL/NF-κB
Hormonální terapie
Estrogeny stimulují produkci OPG a tlumí produkci RANKL [3]. Dynamicky tak zachovávají zpětnovazebné regulační mechanismy kostní remodelace, a následně novotvorbu kostní hmoty (obr. 1). Vypovídá o tom histomorfometrické hodnocení vzorků kosti získaných biopsií z lopaty kosti kyčelní (graf 2a).
![Graf 2a, b Hodnoty MS/BS (ukazatele novotvorby kostní hmoty) u žen v placebové skupině a při užívání hormonální léčby (a) a u žen léčených raloxifenem (b); podle [29, 30] – Eriksen, et al., 1999; Ott, et al., 2002. MS/BS – mineralizing surface per bone surface (představuje procento povrchu kosti, který vykazuje novotvorbu kosti)](https://www.remedia.cz/photo-a-29540---.jpg) Hormonální (HT) nebo estrogenní terapie (ET) je vhodná pro prevenci osteoporózy u žen v prvních letech po menopauze, zejména pokud nejsou tolerovány nebo jsou kontraindikovány jiné léčivé přípravky pro prevenci osteoporózy (v České republice má tuto indikaci jen raloxifen). Pokud je HT/ET zahájena co nejdříve po menopauze a pokračuje do šedesáti let, představuje významné a fyziologické opatření k oddálení klinické manifestace osteoporózy [4]. HT/ET je pro prevenci zlomenin zdůvodněna také farmakoekonomicky.
Hormonální (HT) nebo estrogenní terapie (ET) je vhodná pro prevenci osteoporózy u žen v prvních letech po menopauze, zejména pokud nejsou tolerovány nebo jsou kontraindikovány jiné léčivé přípravky pro prevenci osteoporózy (v České republice má tuto indikaci jen raloxifen). Pokud je HT/ET zahájena co nejdříve po menopauze a pokračuje do šedesáti let, představuje významné a fyziologické opatření k oddálení klinické manifestace osteoporózy [4]. HT/ET je pro prevenci zlomenin zdůvodněna také farmakoekonomicky.
Dávkování estrogenu a způsob podání (s výhodou ≤ 0,05 mg estradiolu denně transdermálně) a volba progestinu (dle dávky i použitého progestinu se objevují různé nežádoucí účinky) mají být individuální podle klinického stavu pacientky. Ženy po hysterektomii ve fertilním věku mohou užívat kontinuálně estrogen v dávce účinné k prevenci úbytku kostní hmoty, ostatní ženy musejí dostávat cyklicky nebo kontinuálně estrogen a progestin. V každém případě má být léčba zajišťována z indikace a pod vedením gynekologa. Bezpečnost kombinované HT závisí na správné indikaci po zvážení přínosů a rizik, která je třeba vysvětlit pacientce.
HT/ET spolehlivě a bez ohledu na věk upravuje kostní remodelaci do premenopauzálních hodnot a stabilizuje kostní hmotu. Při léčbě se BMD zvyšuje průměrně o 2 % v páteři a o 1 % v krčku femuru za rok. Ve studii Women´s Health Initiative se u žen léčených kombinovanou HT snížilo za 5,6 roku riziko zlomenin obratlů o 34 % a riziko zlomenin v oblasti kyčle o 34 %. Podobně se i u žen léčených jen estrogenem snížilo za 6,8 roku riziko zlomenin obratlů o 38 % a riziko zlomenin v oblasti kyčle o 39 %. Ženy, které užívají HT, mají po pěti letech o 51 % nižší riziko zlomeniny distálního předloktí [5]. Po ukončení HT/ET je nezbytné monitorovat BMD a metabolickou aktivitu skeletu a při vysokoobratové osteopenii nebo osteoporóze zvážit volbu další farmakoterapie.
Tibolon
K prevenci osteoporózy je alternativou HT syntetický progestin se slabým estrogenním a androgenním účinkem tibolon, selektivní regulátor tkáňové estrogenní aktivity (selective tissue estrogenic activity regulator, STEAR). V denní dávce 1,25 mg průkazně snižuje riziko zlomenin obratlů (o 45 %), neobratlových zlomenin (o 26 %), ale také karcinomu prsu a tlustého střeva (o 68 % a 69 %). U starších žen však tibolon zdvojnásobuje riziko iktu, a není proto pro ně vhodným lékem osteoporózy [6].
Selektivní modulátory estrogenních receptorů
Selektivní modulátory estrogenních receptorů (SERM) jsou syntetické sloučeniny, které se v různých tkáních vážou na receptor pro estrogeny, ale působí tkáňově specifickými účinky jako agonisté nebo antagonisté estradiolu. Pro léčbu postmenopauzální osteoporózy jsou registrovány raloxifen a bazedoxifen, které dynamicky stimulují produkci OPG a tlumí produkci RANKL [4].
Příznivý účinek raloxifenu na novotvorbu kosti (v porovnání s účinky silných antiresorpčních léků) potvrdila kostní histomorfometrie (graf 2b). Raloxifen se podává denně perorálně v dávce 60 mg. Raloxifen se osvědčil v prevenci postmenopauzálního úbytku kostní hmoty, ale také při léčení již prokázané postmenopauzální osteoporózy a těžké postmenopauzální osteoporózy. BMD se u žen užívajících raloxifen nesnížila ani po osmi letech a ve srovnání s hodnotami u žen bez léčby byla vyšší o 2,2 % v bederní páteři a o 3 % v proximálním femuru [7]. Ukončení léčby raloxifenem navodí již po roce významný pokles BMD, srovnatelný s poklesem BMD po vysazení HT. Během registrační studie trvající tři roky se riziko morfometrické zlomeniny obratle snížilo o 55 % u žen s postmenopauzální osteoporózou, ale bez dosud prodělané zlomeniny, a o 30 % u žen s prevalentní zlomeninou. U žen s denzitometricky prokázanou osteoporózou v proximálním femuru bylo riziko morfometrické zlomeniny obratle snížené o 69 % a klinické zlomeniny nebyly zjištěny vůbec. Riziko klinických zlomenin obratlů se významně snižovalo již po šesti měsících léčby. U žen s již prodělanou těžkou zlomeninou obratle se riziko neobratlové zlomeniny po třech letech léčby raloxifenem snížilo o 47 %.
V tomto ohledu jsou výsledky léčby raloxifenem a alendronátem srovnatelné, přestože statisticky významné zvýšení BMD u žen léčených raloxifenem bylo jen poloviční ve srovnání se zvýšením BMD při tříleté léčbě alendronátem. Navíc, riziko karcinomu prsu se u žen léčených raloxifenem snížilo o 62 %, srovnatelně s léčbou tamoxifenem. Ženy, které v léčbě raloxifenem pokračovaly, měly po osmi letech riziko invazivního karcinomu prsu z buněk s pozitivitou receptoru pro estrogeny o 76 % nižší než neléčené ženy, nekleslo však riziko karcinomu bez pozitivity na estrogenní receptory [8]. Léčba nemění riziko koronární komplikace. Raloxifen neovlivňuje endometrium (riziko hyperplazie, krvácení, karcinomu). K nežádoucím komplikacím léčby patří 2,2krát zvýšené riziko hluboké žilní trombózy, o 44 % vyšší riziko cévní mozkové příhody, křeče lýtek a častější vegetativní symptomy deficience estrogenů (návaly horka, pocení).
Denosumab
Denosumab je plně humánní monoklonální protilátka třídy IgG2 proti RANKL, která má vysokou afinitu a specifitu pro RANKL, neváže se na jiné receptory a nevyvolává tvorbu neutralizujících protilátek. Blokováním vazby RANKL na receptor (RANK) brání denosumab tvorbě a aktivaci osteoklastů a osteoklastické osteoresorpci (obr. 1). Plní tak obdobnou úlohu, jakou fyziologicky má OPG, který však není zcela specifický pro RANKL a po parenterálním podání navozuje tvorbu prot![Graf 3a–d Hodnoty MS/BS (ukazatele novotvorby kostní hmoty) u žen v placebové skupině a žen léčených aminobisfosfonáty anebo denosumabem; podle [31–34] – Eriksen, et al., 2002; Chavassieux, et al., 1997; Recker, et al., 2008; Reid, et al., 2010. MS/BS – mineralizing surface per bone surface (představuje procento povrchu kosti, který vykazuje novotvorbu kosti)](https://www.remedia.cz/photo-a-29541---.jpg) ilátek. Výhodou denosumabu proti OPG je také jeho delší biologický poločas eliminace. Zatímco OPG inhibuje vazbu RANKL na RANK v závislosti na dávce, denosumab inhibuje tuto vazbu plně a eliminuje tak rekrutování nových osteoklastů a osteoklastickou osteoresorpci tak dlouho, dokud je jeho koncentrace v krvi dostatečně vysoká. Úměrně tomu při dlouhodobém podávání tlumí novotvorbu kostní hmoty (graf 3a). Rekrutování nových osteoklastů a útlum remodelace kosti denosumabem se tedy řídí principem „vše, nebo nic“.
ilátek. Výhodou denosumabu proti OPG je také jeho delší biologický poločas eliminace. Zatímco OPG inhibuje vazbu RANKL na RANK v závislosti na dávce, denosumab inhibuje tuto vazbu plně a eliminuje tak rekrutování nových osteoklastů a osteoklastickou osteoresorpci tak dlouho, dokud je jeho koncentrace v krvi dostatečně vysoká. Úměrně tomu při dlouhodobém podávání tlumí novotvorbu kostní hmoty (graf 3a). Rekrutování nových osteoklastů a útlum remodelace kosti denosumabem se tedy řídí principem „vše, nebo nic“.
Po podání 60 mg denosumabu do podkoží klesá osteoresorpce do 12 hodin, maxima koncentrace denosumabu v krvi je dosaženo po 3–21 dnech, biologický poločas denosumabu v oběhu je 6–52 dní a osteoresorpce zůstává snížena 6 měsíců. Po šesti měsících jsou koncentrace denosumabu v krvi neměřitelné u 53 % pacientů.
Denosumab je indikován k léčbě postmenopauzální osteoporózy u žen se zvýšeným rizikem obratlových a neobratlových zlomenin a zlomenin v oblasti kyčle. Denosumab (60 mg) se podává injekčně do podkoží každých šest měsíců. Tento režim![Graf 4a, b Změny denzity kostního minerálu v bederní páteři (a) a změny markeru osteoresorpce S-CTX (b) během prvních dvou let léčení denosumabem; podle [35] – Miller, et al., 2008. BMD – denzita kostního minerálu; S-CTX – sérový C-terminální telopeptid kolagenu typu I](https://www.remedia.cz/photo-a-29542---.jpg) podávání zajišťuje 100% compliance. Na rozdíl od alendronátu se denosumab v kosti nekumuluje. Proto (na rozdíl od pokračujícího útlumu remodelace kosti po vysazení alendronátu) se remodelace kosti po přerušení léčby denosumabem rychle obnovuje, dočasně převýší stupeň resorpce před léčbou a během 18 až 24 měsíců se spontánně upravuje k hodnotám před léčbou. Ke vstupním hodnotám klesá také BMD. V uvedeném období se riziko zlomenin nezvyšuje. Pokud se později podávání denosumabu opakuje, navodí obdobné zvýšení BMD a pokles osteoresorpce jako u dříve neléčených osob (graf 4a, b). Při léčbě se zvyšuje mechanická odolnost kosti.
podávání zajišťuje 100% compliance. Na rozdíl od alendronátu se denosumab v kosti nekumuluje. Proto (na rozdíl od pokračujícího útlumu remodelace kosti po vysazení alendronátu) se remodelace kosti po přerušení léčby denosumabem rychle obnovuje, dočasně převýší stupeň resorpce před léčbou a během 18 až 24 měsíců se spontánně upravuje k hodnotám před léčbou. Ke vstupním hodnotám klesá také BMD. V uvedeném období se riziko zlomenin nezvyšuje. Pokud se později podávání denosumabu opakuje, navodí obdobné zvýšení BMD a pokles osteoresorpce jako u dříve neléčených osob (graf 4a, b). Při léčbě se zvyšuje mechanická odolnost kosti.
Při léčbě denosumabem se BMD v pivotní studii i v její prodloužené fázi, v porovnání s placebem, významně zvyšovala nejenom v bederní páteři a velkém trochanteru, kde převažuje trámčitá kostní hmota, ale také v místech s převahou kompaktní (kortikální) kostní hmoty, tedy v proximálním femuru, v krčku femuru, v distální třetině radia a také celotělově [9, 10]. Denosumab zvyšoval BMD bederní páteře, proximálního femuru i předloktí významně více než alendronát. Možným vysvětlením, proč je účinnost ABP na BMD v úsecích skeletu s převážně kortikální strukturou nižší než při léčbě denosumabem, je kumulace ABP v úsecích s největší remodelační aktivitou (tedy více v trámčité kosti). Naproti tomu denosumab se krevním oběhem dostává rovnoměrně na všechny kostní povrchy.
V pivotní studii denosumabu u žen s postmenopauzální osteoporózou (věk 60–91 let, BMD v bederní páteři nebo v proximálním femuru ≤ -2,5 až ≥ -4,0 T-skóre) se po třech letech léčby statisticky významně snížilo riziko morfometrických zlomenin obratlů o 68 %, klinických zlomenin obratlů o 69 %, neobratlových zlomenin o 20 % i zlomenin v oblasti kyčle (o 40 %) [11], tab. 1. Ženy, které už prodělaly zlomeninu několika obratlů nebo měly jednu středně těžkou nebo těžkou zlomeninu obratle, měly v registrační studii po třech letech podávání denosumabu (v porovnání s podáváním placeba) riziko nových zlomenin obratlů snížené o 55 % (p < 0,001). U žen s BMD ≤ -2,5 T-skóre v krčku femuru a s prevalentní zlomeninou obratle klesalo riziko nové zlomeniny obratle o 60 %. Ženy s BMD v krčku femuru ≤ -2,5 T-skóre měly při léčbě denosumabem průkazně nižší incidenci zlomenin také v oblasti proximálního femuru (o 47 %). U žen ve věku 75 let a více se relativní riziko zlomenin obratlů kyčle po třech letech léčení denosumabem snížilo o 62 %. Mortalita byla při léčbě denosumabem u žen ve věku 75 let a více, které již prodělaly zlomeninu obratle a měly nízkou BMD v krčku femuru, nejenom nižší než u žen neléčených, ale byla dokonce nižší než u léčených mladších žen.
Účinnost i bezpečnost denosumabu pro kost i jiné tkáně byla dokumentována u žen, které pokračovaly v léčbě po dobu až osmi let [10]. V klinických studiích nebyly zaznamenány častěji se vyskytující nežádoucí účinky u žen léčených denosumabem v porovnání se ženami užívajícími placebo, s výjimkou kožních infekcí (3 % léčba denosumabem, 1,7 % placebo) a nadýmání (2,2 % léčba denosumabem, 1,4 % placebo). Hypokalcemii lze laboratorně prokázat v prvních dnech po podání denosumabu, pokud není zajištěna saturace vápníkem a vitaminem D. Podání denosumabu nenavozuje reakci akutní fáze. V klinických studiích se neobjevily významně častější infekce ani nádorová onemocnění, atypické zlomeniny nebyly zjištěny. I při léčbě osteoporózy však může velmi vzácně dojít k osteonekróze čelisti (viz níže). U starších pacientů je výhodou léčby nejenom způsob podání a nepřítomnost reakce akutní fáze, ale také možnost léčit pacienty s poruchami renálních funkcí (při poklesu odhadované míry glomerulární filtrace, eGFR, až k hodnotám 0,5 ml/s/1,73 m2). Podle experimentálních zkušeností s hojením zlomenin není třeba u pacientů s nízkotraumatickou zlomeninou v oblasti kyčle a zajištěnou saturací vitaminem D odkládat zahájení léčby denosumabem.
Subkutánní aplikace léku každých šest měsíců zajišťuje plnou compliance a umožňuje potřebný kontakt lékaře s pacientem. To je důležitým předpokladem dlouhodobého setrvávání pacientů na této léčbě (perzistence). Ve srovnávací studii byla adherence, compliance a perzistence při léčbě denosumabem statisticky významně lepší než při podávání alendronátu. Po dvou letech byla nedostatečná adherence k léčbě denosumabem zjištěna u 7,5 % žen, při léčbě alendronátem u 36,5 % žen. Nežádoucí účinky byly při obou způsobech léčby (bolesti hlavy, kloubů, zad, končetin a kašel) srovnatelně časté a hlásilo je méně než 10 % pacientek [12]. Adherence k léčbě osteoporózy je významně asociována se snížením rizika vzniku zlomenin obratlů, proximálního femuru a dalších neobratlových fraktur [13]. V systematickém rozboru publikovaných farmakoekonomických dat byl denosumab v porovnání s ostatními způsoby antiresorpční léčby osteoporózy u žen s vysokým rizikem zlomenin hodnocen jako farmakoekonomicky výhodný, a to i v porovnání s generickým alendronátem [14].
Aminobisfosfonáty
ABP jsou syntetická analoga pyrofosfátu, která jsou na rozdíl od pyrofosfátu rezistentní vůči hydrolýze endogenními pyrofosfatázami; ABP jsou proto potenciálně toxickými chemickými sloučeninami, které nemohou být z těla metabolicky odstraněny. Díky své chemické struktuře se ABP vážou poměrně specificky na kostní minerál. Risedronát a ibandronát jsou typické slabou vazbou na kost a rychlým uvolněním z kosti, nízkým opakovaným navázáním na kostní povrch a velkou difuzí do kosti. Zoledronát a alendronát se na kost vážou silně, málo se z kosti uvolňují a poté se zase silně navážou, ale do kosti difundují málo. Afinita ABP ke kostnímu minerálu, respektive jejich stupeň vazby na kost, závisí na postranních řetězcích jejich molekuly. Tím je dáno množství ABP, které se dostává do kontaktu s kostními buňkami a které může být internalizováno do osteoklastu a později zabudováno do kosti. Pokud je úsek kosti v dalších měsících nebo letech znovu resorbován, uplatní se uvolněný ABP opět inhibicí funkčních osteoklastů, a to ve stupni, který odpovídá typu (biologické účinnosti) a množství uvolněného ABP. Po ukončení léčby různými ABP přetrvává jejich účinek na kost různě dlouhou dobu.
Farmakodynamickým účinkem společným pro všechny ABP je útlum osteoklastické osteoresorpce. ABP inhibují katalytickou aktivitu farnesyldifosfát syntázy, jednoho z klíčových enzymů mevalonátové metabolické cesty syntézy cholesterolu. Stupeň inhibice závisí na postranním řetězci molekuly a stoupá v gradientu alendronát–ibandronát–risedronát–zoledronát. Důsledkem inhibice enzymu je nedostatečná syntéza difosfátů nutných pro prenylaci malých GTPáz. Tím se aktivují pro-apoptotické kaspázy a porušuje se morfologie, funkce a adheze osteoklastů k mineralizované kostní matrix.
Alendronát
Alendronát se podává v dávce 70 mg p.o. jednou týdně ráno nalačno. Po třech letech se průměrná BMD v bederní páteři zvyšuje o 6,2 % a v krčku femuru o 4,1 %. Biochemické ukazatele osteoresorpce i novotvorby se významně snižují, třetina až polovina léčených žen může mít hodnoty markerů osteoresorpce (S-βCTX, serum type I collagen cross-linked C-terminal telopeptide) pod dolní hranicí referenčních hodnot. Mimořádně významně je utlumena i histomorfometricky dokumentovaná novotvorba kostní hmoty (grafy 3b a 4). V porovnání se ženami, kterým je podáváno placebo, významně klesá relativní riziko morfometrických zlomenin obratlů u žen bez prevalentní zlomeniny po třech až čtyřech letech o 44 %, u žen s prevalentní zlomeninou o 47 %. U žen s prevalentní zlomeninou bylo významně (o 54 %) sníženo riziko klinických zlomenin obratlů, o 51 % se snížilo riziko zlomenin v oblasti kyčle, o 48 % riziko fraktury distálního předloktí.
Významné snížení rizika neobratlových zlomenin léčbou alendronátem (o 29 %) bylo dokumentováno teprve v metaanalýze pěti kontrolovaných studií, trvajících alespoň dva roky, pokud byly vyloučeny ženy s BMD > -2,0 T-skóre [15, 16]. Ukončení léčby alendronátem po třech až pěti letech jeho podávání navodí během dalšího roku mírné zvýšení remodelace kosti, ale útlum remodelace kosti přetrvává další čtyři roky. Během tří až pěti let po vysazení alendronátu klesala BMD v bederní páteři (o 3,7 %) i v proximálním femuru (o 2,4 %) v porovnání se ženami, které v léčbě pokračovaly; riziko vzniku obratlových ani neobratlových zlomenin se neměnilo.
Risedronát
Risedronát se podává v dávce 35 mg p.o. jednou týdně ráno nalačno. Při léčení risedronátem se průměrná BMD v bederní páteři po třech letech zvyšuje o 5,4–5,9 % a v krčku femuru o 1,6–3,1 %. Biochemické ukazatele osteoresorpce i novotvorby se při léčbě risedronátem významně snižují do dolního pásu referenčních hodnot. Souhlasí to s histomorfometrickým hodnocením kostní novotvorby (graf 3c). U žen s prevalentní zlomeninou obratle klesá relativní riziko morfometrických zlomenin obratlů o 41 %, riziko neobratlových zlomenin o 39 % [17]. U žen ve věku 70–79
let s dokumentovanou osteoporózou, prodělanou zlomeninou obratle a rizikem pádu risedronát průkazně snižuje riziko neobratlových zlomenin a zejména zlomenin proximálního femuru [18]. Snížení rizika obratlových zlomenin léčbou rise-
dronátem bylo potvrzeno i u žen s osteoporózou starších 80 let. Risedronát také významně snižuje riziko rekurentní zlomeniny proximálního femuru.
Ibandronát
Ibandronát se podává perorálně v dávce 150 mg jednou za měsíc ráno nalačno, intravenózně pak 3 mg ibandronátu každé tři měsíce. BMD v bederní páteři se po třech letech zvyšuje o 5,2 % a v proximálním femuru o 4,1 %. Biochemické ukazatele osteoresorpce i novotvorby se při léčbě ibandronátem snižují úměrně roční kumulativní dávce. Hodnoty markerů kostní osteoresorpce se snižují pod dolní referenční hranici a přes mírné kolísání zůstávají trvale nízké. Interval mezi podáním ibandronátu, ať už měsíční, anebo tříměsíční, neumožňuje, aby se rekrutovala nová populace osteoblastů, a markery novotvorby kosti jsou proto trvale nízké.
Ibandronát je bisfosfonátem s nejhůře dokumentovanou účinností. V jeho registračních studiích nebyla prokázána účinnost na riziko vzniku neobratlových zlomenin, klinických zlomenin a zlomenin proximálního femuru [19]. Relativní riziko nové morfometrické zlomeniny obratle klesá po tříleté léčbě dávkou 2,5 mg p.o. denně o 62 %, při léčbě dávkou 20 mg p.o. podávanou obden (12 dávek každé 3 měsíce) o 50 %. Údaje o účinnosti léčby ibandronátem v registrovaných dávkovacích schématech na riziko neobratlových zlomenin byly odvozeny ze závislosti tohoto rizika na roční kumulativní expozici ibandronátu v různých studiích. I pokud byly z celé populace vybrány ženy s vyšším rizikem fraktury (prodělaná zlomenina a BMD krčku femuru < -3,0 SD, směrodatná odchylka), klesalo riziko neobratlových zlomenin jen u žen užívajících ibandronát denně, ale nikoli při podávání léku obden.
Kyselina zoledronová
Kyselina zoledronová se podává jednorázově po dobu nejméně 15 minut (5 mg ve 100 ml roztoku) intravenózní infuzí jednou za rok. Před podáním infuze musí být pacient dostatečně hydratován, má mít doporučený denní příjem vápníku a sérovou koncentraci 25-hydroxyvitaminu D (S-25(OH)D) > 50 nmol/l. V pivotní studii byla BMD po třech letech u léčených žen významně vyšší oproti kontrolní skupině, a to o 6,7 % v bederní páteři, o 6,0 % v proximálním femuru, o 5,1 % v krčku femuru a o 3,2 % v distální části radia. Útlum biochemických markerů kostní resorpce a novotvorby se na konci každého jednoročního období upravoval do premenopauzální úrovně a podle histomorfometrických měření u většiny pacientek pokračovala v tomto období aktivnější novotvorba kosti než při léčbě alendronátem (graf 3d). Relativní riziko zlomeniny obratle se snížilo o 70 %, riziko klinické zlomeniny obratle o 77 %, neobratlových zlomenin o 25 %, riziko zlomeniny v oblasti kyčle o 41 %, riziko klinických fraktur o 33 %. Léčba průkazně snižovala riziko klinických zlomenin obratlů a neobratlových zlomenin také v subpopulaci starších žen (průměrný věk 79 let) [20, 21]. Účinnost jednorázové infuze kyseliny zoledronové může přetrvávat u žen s postmenopauzální osteoporózou nejméně pět let.
Sekundární prevence zlomenin podáváním kyseliny zoledronové pacientům po recentně prodělané nízkotraumatické zlomenině v oblasti kyčle byla ověřena v randomizované, dvojitě zaslepené, placebem kontrolované studii u 2127 pacientů (průměrný věk 74,5 let). Během 90 dnů po chirurgickém ošetření zlomeniny kyčle a každých dalších 12 měsíců pacienti dostali infuzi kyseliny zoledronové nebo placebo. Během sledování (v průměru 1,9 roku) se u léčených pacientů snížilo relativní riziko klinické zlomeniny o 35 %, riziko klinické zlomeniny obratle o 46 % a riziko neobratlových fraktur o 27 % [22]. Pokles rizika zlomenin kyčle (o 30 %) nedosáhl statistické významnosti. S klinickým nálezem korelovala i hodnota BMD. Riziko úmrtí bylo při léčbě o 28 % nižší než v placebové skupině. Výskyt závažných nežádoucích účinků byl v obou skupinách srovnatelný. Hojení zlomenin nebylo léčbou nepříznivě ovlivněno, podávání kyseliny zoledronové je však doporučeno až po šesti a více týdnech od úrazu.
Bezpečnost a nežádoucí účinky aminobisfosfonátů
ABP jsou kontraindikovány při alergii na tyto léky, během těhotenství a kojení. Léčba ABP není vhodná při kontraindikaci podávání vápníku či vitaminu D, při koncentraci vápníku v séru nižší než 2,1 mmol/l a převyšující 2,65 mmol/l, při deficienci vitaminu D (pokud jsou koncentrace S-25(OH)D < 25 nmol/l), při leukopenii (< 2500/µl), při zvýšení aktivity alaninaminotransferáz (ALT) nad dvojnásobek normy a při snížení koncentrace S-albuminu pod hranici 30 g/l. Podání ABP dětem a dospívajícím se vzhledem k nedostatečným údajům o bezpečnosti a účinnosti léků nedoporučuje. Při eGFR < 0,6 ml/s/1,73 m2 by neměl být žádný ABP podáván, protože za těchto podmínek není známa bezpečnost léčby.
Nejčastějším důvodem vysazení perorálních ABP v klinické praxi jsou dyspepsie, nauzea, zvracení a bolesti břicha, uváděné až u 62 % pacientů. Zkušenosti z klinické praxe upozornily na toxicitu alendronátu pro sliznici jícnu a žaludku, zejména ulcerativní ezofagitidu, pokud pacientky striktně nedodržovaly doporučený způsob užívání tablety. Při užívání jednou týdně nebo jednou měsíčně je výskyt nežádoucích gastrointestinálních účinků nižší než při denním režimu. Riziko nežádoucích gastrointestinálních příhod při léčbě alendronátem, ale nikoli risedronátem, je významně zvýšeno u pacientů užívajících nesteroidní antirevmatika. Léčba perorálními ABP není vhodná u pacientů neschopných zůstat ve vzpřímené poloze po dobu 30 minut (resp. 60 minut při léčbě ibandronátem), při krvácení do gastrointestinálního traktu v posledním roce a při zvýšeném riziku tohoto krvácení vůbec (například u pacientů léčených warfarinem, zejména pokud je problematické systematické sledování protrombinového času − hodnot INR), u pacientů s rekurentní nebo aktivní vředovou chorobou gastroduodenální, s gastroezofageálním refluxem nebo pokud je prokázána striktura, achalasie nebo porucha motility jícnu. Bezpečnost a účinnost léčby generickými přípravky ABP může být jiná než při užívání originálního přípravku.
Dalším častěji uváděným nežádoucím účinkem léčby ABP je reakce akutní fáze. Její symptomy (horečka, artralgie, myalgie) se mohou projevit do tří dnů zpravidla po prvním podání ABP. Symptomy reakce akutní fáze se po infuzi kyseliny zoledronové uvádějí až u 45 % pacientů, po i.v. podání ibandronátu u 7 % pacientů a velmi vzácně po perorálních ABP. Většina z příznaků vymizí do tří dnů. Tíži příznaků lze snížit podáním paracetamolu 1000 mg nebo ibuprofenu 400 mg do čtyř hodin po podání infuze a pak opakovaně po šesti hodinách po dobu tří dnů od infuze.
Vzácně se při léčbě ABP uvádí skleritida, uveitida a synovitida. K dalším vzácným komplikacím ABP patří osteonekróza čelisti a atypické zlomeniny. Přes 90 % všech případů osteonekrózy čelisti při léčbě ABP nebo denosumabem je u pacientů s nádorovým onemocněním, kdy se tyto léky podávají často a ve vysokých dávkách [23]. Antiresorpční léčba představuje v etiologii osteonekrózy čelisti u onkologických pacientů jen jeden z řady možných rizikových faktorů. Při léčení osteoporózy perorálními ABP se incidence osteonekrózy čelisti uvádí až u 2,8 : 10 000 pacientů za rok. Doporučuje se, aby pacienti s osteoporózou, zejména pokud jsou léčeni také glukokortikoidy, nekontrolovaně nepodstupovali po dobu léčby ABP nebo denosumabem invazivní zubní zákroky. Účinky denosumabu na kost odeznívají po šesti měsících od podání injekce a stomatochirurgický výkon lze zpravidla odložit. Účinky alendronátu přetrvávají řadu let a před výkonem je vhodné zajistit ústní hygienu, případně prevenci komplikací antibiotiky.
Mimořádně vzácnou komplikací dlouhodobé léčby ABP mohou být atypické zlomeniny [24]. Uvádějí se u jedné z tisíce léčených osob za rok. Tyto stresové únavové příčné subtrochanterické nebo diafyzální zlomeniny mohou vznikat po dlouhodobém (5letém nebo delším) podávání ABP (zejména alendronátu), a to spíše u pacientů, jejichž novotvorba kosti je zhoršená už před léčbou, např. glukokortikoidy, nebo při diabetu mellitu. Jako „atypické“ ostatně mohou radiologicky imponovat také subtrochanterické fraktury při hypotyreóze nebo u pacientů s osteopetrózou.
Podávání ABP by mělo trvat po dobu 4–5 let, po kterou klinické studie doložily bezpečnost léčby pro kvalitu kosti. Poté je třeba zvážit riziko pokračování nebo ukončení léčby. Nicméně přiměřený útlum remodelace kostní hmoty je základním farmakodynamickým předpokladem úspěchu antiresorpční léčby. Bezpečnost dlouhodobého útlumu osteoklastické osteoresorpce antiresorpční terapií při léčbě osteoporózy závisí na správné indikaci léku v klinické praxi, kdy jej užívají pacientky se závažnými komorbiditami. Stupeň obnovy kostní hmoty klesá s věkem a k útlumu kostní novotvorby mohou přispívat některá onemocnění, jako diabetes mellitus, léčba glukokortikoidy nebo některými antidepresivy.
I když neznáme všechny příčiny zvyšující se incidence atypických zlomenin a osteonekrózy čelisti, je možná asociace těchto komplikací s dlouhodobým užíváním účinných antiresorpčních léků důležitým upozorněním, že už při zahájení léčby je nutné respektovat patofyziologii různých typů osteoporózy a dalších kostních onemocnění. Antiresorpční léky je tedy nutné volit nejenom se znalostí mechanismu jejich účinků, ale také se znalostí klinických faktorů rizika zlomenin a metabolického stavu skeletu dané pacientky. Je také třeba zdůraznit, že žádný z dostupných antiresorpčních léků nemůže eliminovat riziko zlomeniny, ale že toto riziko pouze snižuje. Samotná nová zlomenina u ženy léčené ABP nebo denosumabem tedy není projevem selhání léčby a důvodem pro volbu jiného léku.
Stroncium ranelát
Vysoké dávky stroncium ranelátu, užívané experimentálně, zvyšují replikaci prekurzorů osteoblastů a tlumí produkci RANKL a aktivitu osteoklastů. Výrobce léčivého přípravku vychází z výsledků studií in vitro a vysvětluje účinnost stroncium ranelátu znovunastolením rovnováhy kostního obratu ve prospěch kostní formace. Duální ani osteoanabolický účinek stroncium ranelátu sám výrobce neuvádí. Tento účinek ostatně nebyl v histomorfometrických studiích nepárových ani párových biopsií u lidí léčených doporučenými dávkami stroncium ranelátu prokázán. Naopak, ve vzorcích kosti odebraných před léčbou a po roce léčby stroncium ranelátem u 46 žen se novotvorba a objem trámčité kostní hmoty významně snížily a kostní trámce byly významně tenčí [25]. Pro duální efekt (současné snížení resorpce a zvýšení novotvorby kosti) nesvědčí ani biochemické markery. V pivotní studii u žen se při léčbě stroncium ranelátem v prvních šesti měsících sérové koncentrace kostní alkalické fosfatázy (bALP, enzym významný pro mineralizaci kosti) lehce zvyšovaly (o 8 %), ale u mužů mírně klesaly. V jiné studii u žen naopak významně klesala sérová koncentrace N-terminálního propeptidu prokolagenu I (PINP), který je doporučeným markerem pro hodnocení syntézy kolagenu typu I, respektive novotvorby organické kostní matrix. Všechny studie souhlasně prokázaly v prvním roce léčení stroncium ranelátem mírný pokles sérového markeru degradace kolagenu typu I (βCTX). Ve druhém roce léčby u žen i u mužů se však sérové hodnoty bALP i βCTX zvyšovaly nad hodnoty před léčbou.
Mechanismy účinku léčiva na snížení rizika zlomenin tedy dosud nebyly jednoznačně vysvětleny. U lidí snižuje stron-
cium ranelát osteoresorpci obdobně jako vápník. Tento účinek lze vysvětlovat vazbou stroncia na specifický receptor pro vápník. V příštítných tělískách tento receptor reguluje sekreci parathormonu a při léčbě stroncium ranelátem sérová koncentrace parathormonu klesá.
Stroncium ranelát se používá k léčbě osteoporózy u žen po menopauze a u mužů s vysokým rizikem zlomenin při nesnášenlivosti nebo kontraindikaci jiných antiresorpčních léků nebo při výskytu závažných nežádoucích účinků vyvolaných těmito léky. Podávají se 2 g zrněného prášku s obsahem 0,6 g stroncia, večer, dvě hodiny po jídle, jako suspenze ve sklenici vody. Jídlo a přípravky obsahující vápník mohou snížit biologickou dostupnost léku o 60–70 %.
V pivotní klinické studii i v její extenzi se BMD trvale zvyšovala (v páteři během 10 let o 34,5 ± 20,2 %, v proximálním femuru o 11,7 ± 13,6 %) [26]. Zvyšování BMD při léčbě stroncium ranelátem je však výrazem ukládání stroncia v kostech, kde stroncium absorbuje rentgenové záření více než vápník a výpověď osteodenzitometrie nekontrolovaně nadhodnocuje. Změn BMD ani sérových markerů kostní remodelace nelze u jednotlivých pacientů užít k monitorování účinnosti léčby.
Po třech letech léčby bylo u léčených žen v porovnání se ženami ve skupině s placebem riziko zlomenin obratlů sníženo o 41 %. U žen v průměrném věku 77 let s hodnotou BMD v krčku femuru ≤ -2,5 T-skóre a s již prodělanou neobratlovou zlomeninou se snížilo riziko neobratlových zlomenin o 16 %, ale riziko zlomeniny v oblasti kyčle se průkazně nesnížilo [27, 28]. Pokud se dodatečně hodnotily výsledky jen u žen starších 74 let s BMD v krčku femuru ≤ -3,0 T-skóre a s již prodělanou neobratlovou zlomeninou, bylo relativní riziko zlomeniny v oblasti kyčle snížené o 36 %. Snížení rizika obratlových i neobratlových zlomenin bylo zachováno i po dalších pěti letech nezaslepené léčby stroncium ranelátem.
V klinických studiích nebyly uváděny rozdíly v nežádoucích účincích u léčených a kontrolních skupin pacientek. Po uvedení léku do klinické praxe však byly ojediněle během 3–6 týdnů léčby hlášeny velmi závažné případy syndromu DRESS (Drug Rash with Eosinophilia and Systemic Symptoms), s vyrážkou (až s puchýři nebo slizniční lézí), horečkou, eozinofilií a s poškozením jater, ledvin nebo plic. Z nashromážděných randomizovaných placebem kontrolovaných studií u postmenopauzálních pacientek s osteoporózou bylo zjištěno signifikantně zvýšené riziko infarktu myokardu při léčbě stroncium ranelátem ve srovnání s placebem.
Po klinických zkušenostech je kontraindikací léčby stroncium ranelátem hypersenzitivita, trombóza hlubokých žil (i v anamnéze), imobilizace, ischemická choroba srdeční, periferní arteriální onemocnění a/nebo cerebrovaskulární onemocnění a hypertenze neupravená léčbou. Stroncium ranelát se také nedoporučuje při snížení renálních funkcí (eGFR < 0,5 ml/s/1,73 m2). Dalšími nežádoucími účinky mohou být průjmy, nauzea, bolest hlavy. V lednu 2014 doporučila komise Evropské lékové agentury (The European Medicines Agency‘s Pharmacovigilance Risk Assessment Committee), aby regi-
strovaný přípravek stroncium ranelátu (Protelos) nebyl používán k léčbě osteoporózy, pokud nebudou dostupná jiná data o účinnosti a bezpečnosti léku.
Závěr
Všechna uvedená antiresorpční léčiva byla pro postmenopauzální osteoporózu registrována na základě prokázaného účinku na snížení relativního rizika zlomenin obratlů, případně i rizika neobratlových zlomenin a rizika zlomeniny v oblasti kyčle, a to u žen splňujících kritéria pro zařazení do studie a s potvrzenou osteoporózou. V klinické praxi však kritéria pivotních studií většina nemocných nesplňuje, a před zahájením léčby u jednotlivých pacientů je proto třeba vždy stanovit klinickou (nikoli denzitometrickou) diagnózu osteoporózy, tzn. vyloučit jiná metabolická a nádorová kostní onemocnění. V klinických studiích nebyla kritéria pro zařazení pacientů do sledování jednotná a až na výjimky nejsou k dispozici přímá porovnání léků u téže populace pacientů se zcela obdobným absolutním rizikem zlomeniny na začátku studie. Pouze několik studií poskytlo údaje o účinnosti léků u pacientů starších 70–75 let, tedy ve věku, kdy se v klinické praxi nejvíce objevují zlomeniny v oblasti kyčle.
Indikace antiresorpční terapie postmenopauzální osteoporózy v klinické praxi se má odvíjet od individuálně stanovené pravděpodobnosti prodělat v dalších deseti letech nízkotraumatickou zlomeninu podle algoritmu FRAX (graf 1), od aktivity remodelace kostní hmoty a očekávaného přínosu uvažovaného léku pro snížení rizika nejenom obratlových, ale zejména neobratlových zlomenin, které již u sedmdesátiletých osob tvoří tři čtvrtiny všech fraktur. Současně je třeba zvažovat mechanismus účinku léku, jeho bezpečnost pro kost a další tkáně, a konečně farmakoekonomické aspekty, závisející také na vhodnosti zvoleného léčiva pro jeho dlouhodobé užívání, na adherenci k léčbě a preferencích pacienta. Před zahájením léčby je vhodné ověřit stupeň resorpce a novotvorby (podle hodnot biochemických markerů v séru) a zásobení vitaminem D a dokumentovat prevalentní obratlové i neobratlové zlomeniny.
Pro prevenci postmenopauzální osteoporózy u žen s vysokoobratovou osteopenií mladších 60 let je vhodným opatřením včasná HT/ET, u žen s rizikem nádorového onemocnění prsu raloxifen. U žen s vysokoobratovou osteoporózou a s již manifestovanou osteoporózou je z hledisek účinnosti, bezpečnosti, adherence a farmakoekonomiky léčbou první volby opakované podávání denosumabu, případně (po upozornění na možnou reakci akutní fáze) jednorázová infuze kyseliny zoledronové. Vhodnou alternativou mezi perorálními ABP je z hlediska dlouhodobé účinnosti a bezpečnosti risedronát, který má nižší afinitu ke kostnímu minerálu a v užívané dávce netlumí nadměrně osteoresorpci.
Při antiresorpční léčbě osteoporózy má být vždy zajištěn pravidelný denní přívod vápníku (1000 mg denně, preferenčně potravou) a vitaminu D (800 IU denně). K potvrzení očekávaných účinků antiresorpční léčby postačuje úprava biochemického markeru kostní remodelace k premenopauzálním hodnotám za 4–6 měsíců po zahájení léčby. Nová zlomenina nebo průkazný pokles kostní hmoty (při respektování chyby užité metody měření) během léčení je důvodem k ověření etiologie kostního procesu (základní klinické diagnózy), dávky a způsobu užívání medikace. Léčba chronického onemocnění osteoporózou je dlouhodobá. Pokud je ze závažného důvodu přerušena, má být stav kostní hmoty monitorován a při jeho zhoršování mají být znovu zvážena vhodná opatření.
Poděkování: Práce byla podpořena grantem VZMZ 00023728.
Seznam použité literatury
- [1] Dell RM, Greene D, Anderson D, et al. Osteoporosis disease management: What every orthopaedic surgeon should know. J Bone Joint Surg Am 2009; 91 (Suppl 6): 79–86.
- [2] Ma YL, Zeng QQ, Chiang AY, et al. Effects of Teriparatide on Cortical Histomorphometric Variables in Postmenopausal Women With or Without Prior Alendronate Treatment. Bone 2013, v tisku (DOI 10.1016/j.bone.2013.11.011).
- [3] Viereck V, Grundker C, Blaschke S, et al. Raloxifene concurrently stimulates osteoprotegerin and inhibits interleukin-6 production by human trabecular osteoblasts. J Clin Endocrinol Metab 2003; 88: 4206–4213.
- [4] Bowring CE, Francis RM. National Osteoporosis Society’s Position statement on hormone replacement therapy in the prevention and treatment of osteoporosis. Menopause Int 2011; 17: 63–65.
- [5] Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321–333.
- [6] Cummings SR, Ettinger B, Delmas PD, et al. The effects of tibolone in older postmenopausal women. N Engl J Med 2008; 359: 697–708.
- [7] Siris ES, Harris ST, Eastell R, et al. Skeletal effects of raloxifene after 8 years: results from the continuing outcomes relevant to Evista (CORE) study. J Bone Miner Res 2005; 20: 1514–1524.
- [8] Barrett-Connor E, Mosca L, Collins P, et al. Raloxifene Use for The Heart Trial I. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med 2006; 355: 125–137.
- [9] Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361: 756–765.
- [10] McClung MR, Lewiecki EM, Geller ML, et al. Effect of denosumab on bone mineral density and biochemical markers of bone turnover: 8-year results of a phase 2 clinical trial. Osteoporos Int 2013; 24: 227–235.
- [11] McClung MR, Lewiecki EM, Cohen SB, et al. Denosumab in postmenopausal women with low bone mineral density. N Engl J Med 2006; 354: 821–831.
- [12] Freemantle N, Satram-Hoang S, Tang ET, et al. Final results of the DAPS (Denosumab Adherence Preference Satisfaction) study: a 24-month, randomized, crossover comparison with alendronate in postmenopausal women. Osteoporos Int 2012; 23: 317–326.
- [13] Patrick AR, Brookhart MA, Losina E, et al. The complex relation between bisphosphonate adherence and fracture reduction. J Clin Endocrinol Metab 2010; 95: 3251–3259.
- [14] Hiligsmann M, Boonen A, Dirksen CD, et al. Cost-effectiveness of denosumab in the treatment of postmenopausal osteoporotic women. Expert Rev Pharmacoecon Outcomes Res 2013; 13: 19–28.
- [15] Ensrud KE, Black DM, Palermo L, et al. Treatment with alendronate prevents fractures in women at highest risk: results from the Fracture Intervention Trial. Arch Intern Med 1997; 157: 2617–2624.
- [16] Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996; 348: 1535–1541.
- [17] Harris ST, Watts NB, Genant HK, et al. Effects of risedronate treatment on vertebral and non-vertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. JAMA 1999; 282: 1344–1352.
- [18] McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. N Engl J Med 2001; 344: 333–340.
- [19] Chesnut IC, Skag A, Christiansen C, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004; 19: 1241–1249.
- [20] Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356: 1809–1822.
- [21] Boonen S, Black DM, Colon-Emeric CS, et al. Efficacy and safety of a once-yearly intravenous zoledronic acid 5 mg for fracture prevention in elderly postmenopausal women with osteoporosis aged 75 and older. J Am Geriatr Soc 2010; 58: 292–299.
- [22] Lyles KW, Colon-Emeric CS, Magaziner JS, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007; 357: 1799–1809.
- [23] Stopeck AT, Lipton A, Body JJ, et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol 2010; 28: 5132–5139.
- [24] Shane E, Ebeling PR, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: Second report of a task force of the American society for bone and mineral research. J Bone Miner Res 2013, v tisku (DOI 10.1002/jbmr.1998).
- [25] Chavassieux P, Meunier PJ, Roux JP, et al. Bone histomorphometry of transiliac paired bone biopsies after 6 or 12 months of treatment with oral strontium ranelate in 387 osteoporotic women. Randomized comparison to alendronate. J Bone Miner Res 2013, v tisku (DOI 10.1002/jbmr.2074).
- [26] Reginster JY, Kaufman JM, Goemaere S, et al. Maintenance of antifracture efficacy over 10 years with strontium ranelate in postmenopausal osteoporosis. Osteoporos Int 2012; 23: 1115–1122.
- [27] Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350: 459–468.
- [28] Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium ranelate reduces the risk of non-vertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005; 90: 2816–2822.
- [29] Eriksen EF, Langdahl B, Vesterby A, et al. Hormone replacement therapy prevents osteoclastic hyperactivity: A histomorphometric study in early postmenopausal women. J Bone Miner Res 1999; 14: 1217–1221.
- [30] Ott SM, Oleksik A, Lu Y, et al. Bone histomorphometric and biochemical marker results of a 2-year placebo-controlled trial of raloxifene in postmenopausal women. J Bone Miner Res 2002; 17: 341–348.
- [31] Eriksen EF, Melsen F, Sod E, et al. Effects of long-term risedronate on bone quality and bone turnover in women with postmenopausal osteoporosis. Bone 2002; 31: 620–625.
- [32] Chavassieux PM, Arlot ME, Reda C, et al. Histomorphometric assessment of the long-term effects of alendronate on bone quality and remodeling in patients with osteoporosis. J Clin Invest 1997; 100: 1475–1480.
- [33] Recker RR, Delmas PD, Halse J, et al. Effects of intravenous zoledronic acid once yearly on bone remodeling and bone structure. J Bone Miner Res 2008; 23: 6–16.
- [34] Reid IR, Miller PD, Brown JP, et al. Effects of denosumab on bone histomorphometry: the FREEDOM and STAND studies. J Bone Miner Res 2010; 25: 2256–2265.
- [35] Miller PD, Bolognese MA, Lewiecki EM, et al. Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: a randomized blinded phase 2 clinical trial. Bone 2008; 43: 222–229.
- [36] Freemantle N, Cooper C, Diez-Perez A, et al. Results of indirect and mixed treatment comparison of fracture efficacy for osteoporosis treatments: a meta-analysis. Osteoporos Int 2013; 24: 209–217.