Biologická léčba axiálních spondylartritid
V úvodu se autoři zabývají problémem výkladu pojmů a definicí axiální spondylartritidy (SpA). V další části jsou uvedena diagnostická kritéria pro axiální SpA, která umožňují diagnostiku onemocnění ještě před vývojem definitivní radiologické sakroiliitidy. Kritéria zahrnují též vyšetření přítomnosti antigenu HLA-B27, vyšetření sakroiliakálních kloubů magnetickou rezonancí (MRI) a nově definovanou zánětlivou bolest v zádech (low back pain).
Dále je pojednáno o terapii ankylozující spondylitidy (AS) z pohledu medicíny založené na důkazech. Z tohoto pohledu je účinná edukace, cvičení a fyzikální léčba, z farmakologických postupů pak nesteroidní antirevmatika, intraartikulární aplikace kortikoidů a u periferních forem sulfasalazin. Velkým přínosem je léčba inhibitory TNF-α. Působí velmi rychle a mohutně a jejich efekt je dlouhodobý. Příznivě ovlivňuje všechny tři aspekty postižení muskuloskeletálního (artritida, spondylitida, entezitida), ale i postižení mimokloubního (uveitida, idiopatický střevní zánět, psoriáza, osteoporóza). Některá data z registrů naznačují možné snížení kardiovaskulární mortality.
Rentgenologické studie zatím nepotvrdily schopnost inhibitorů TNF-αzpomalit rentgenovou progresi AS. Může to být způsobeno malou senzitivitou doposud používaných rentgenologických kritérií. Zvlášť nejasný je způsob, jak posuzovat častou disociaci mezi změnami destruktivními (eroze, zúžení štěrbin) a osteoproliferativními (syndesmofyty). Určitou nadějí může být vývoj nových modifikací metod MRI. Spektrum nežádoucích účinků léčby AS inhibitory TNF-α je shodné jako u revmatoidní artritidy, jejich výskyt v registrech je však nižší (infekce, závažné infekce, TBC).
Úvod
Poslední dekáda přinesla zcela mimořádný vývoj klinických, vědeckých i terapeutických aspektů chápání spondylartritid (SpA). Tento vývoj byl alespoň částečně podpořen i nečekaně dobrým terapeutickým efektem inhibitorů TNF. Současně s novými biologickými léky se začala uplatňovat magnetická  rezonance (MRI) jako nová zobrazovací metodika, která zásadně přispěla k časné detekci synovitidy, následnému monitorování průběhu choroby i k pochopení patogeneze spondylartritid.
Spondylartritidy zahrnují tyto jednotky: ankylozující spondylitidu, psoriatickou artritidu/spondylitidu, enteropatickou artritidu/spondylitidu, reaktivní artritidu a nediferencovanou spondylartritidu. Tato onemocnění mají celou řadu společných rysů, viz tab. 1 . Další možnou klasifikací SpA je rozdělení na pacienty s převažující axiální (páteřní) lokalizací a s převažující periferní lokalizací (artritidou). Ve smyslu této klasifikace se přítomností urogenitální a gastrointestinální (GIT) infekce, psoriázy či idiopatického střevního zánětu zařazení do kategorie nemění [1].
rezonance (MRI) jako nová zobrazovací metodika, která zásadně přispěla k časné detekci synovitidy, následnému monitorování průběhu choroby i k pochopení patogeneze spondylartritid.
Spondylartritidy zahrnují tyto jednotky: ankylozující spondylitidu, psoriatickou artritidu/spondylitidu, enteropatickou artritidu/spondylitidu, reaktivní artritidu a nediferencovanou spondylartritidu. Tato onemocnění mají celou řadu společných rysů, viz tab. 1 . Další možnou klasifikací SpA je rozdělení na pacienty s převažující axiální (páteřní) lokalizací a s převažující periferní lokalizací (artritidou). Ve smyslu této klasifikace se přítomností urogenitální a gastrointestinální (GIT) infekce, psoriázy či idiopatického střevního zánětu zařazení do kategorie nemění [1].
Časná diagnostika
Nejčastější spondylartritidou je ankylozující spondylitida (AS). Velkým problémem v přístupu k terapii nemocných s AS je zpoždění v diagnóze, které činí v průměru 6–9 let, dle našeho vlastního výzkumu v ČR pak 9,3 roku. Příčinou zpoždění v diagnóze jsou nedostatečné znalosti nerevmatologů o této nemoci, pozdní odeslání k revmatologovi, ale i problémy při detekci 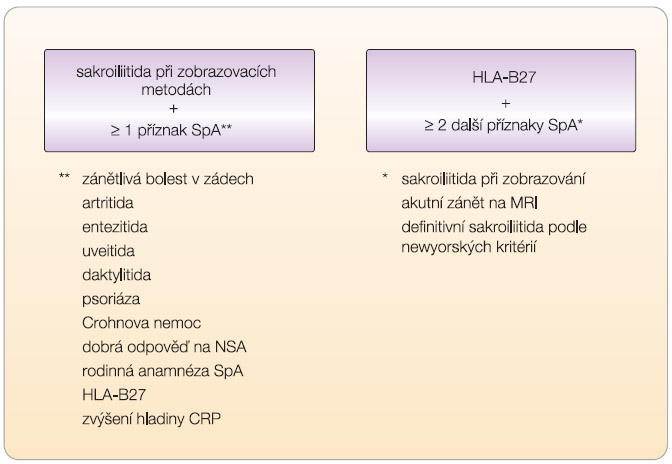 především časných forem sakroiliitidy. Při přítomnosti rentgenové (rtg) sakroiliitidy (bilaterální II. stadia či unilaterální III. stadia) již nemocný splňuje rtg podmínku pro diagnózu AS dle newyorských kritérií, ale vývoj definitivní sakroiliitidy může trvat několik let. Proto se dnes někdy hovoří o intervalu, kdy ještě není jasná rtg sakroiliitida, jako o preradiologickém období AS ( obr. 1 ). Někdy se také hovoří o stadiu tzv. nediferencované spondylartritidy. V novějších konceptech se pro formy s čistě či převážně páteřní symptomatologií (zahrnuje formy nediferencované i diferencované) hovoří jako o axiálních spondylartritidách.
především časných forem sakroiliitidy. Při přítomnosti rentgenové (rtg) sakroiliitidy (bilaterální II. stadia či unilaterální III. stadia) již nemocný splňuje rtg podmínku pro diagnózu AS dle newyorských kritérií, ale vývoj definitivní sakroiliitidy může trvat několik let. Proto se dnes někdy hovoří o intervalu, kdy ještě není jasná rtg sakroiliitida, jako o preradiologickém období AS ( obr. 1 ). Někdy se také hovoří o stadiu tzv. nediferencované spondylartritidy. V novějších konceptech se pro formy s čistě či převážně páteřní symptomatologií (zahrnuje formy nediferencované i diferencované) hovoří jako o axiálních spondylartritidách.
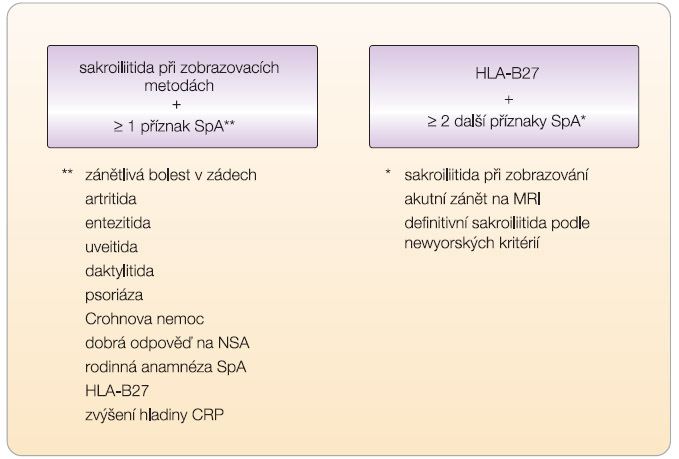 Pro diagnostiku těchto časných stadií axiálních spondylartritid byla zcela nedávno publikována diagnostická kritéria skupiny ASAS (Assessment of SpondyloArthritis Society) [2] ( obr. 2 ). Diagnóza axiální SpA je tedy možná při detekci sakroiliitidy zobrazovací metodikou (rtg nebo MRI) spolu s přítomností jednoho dalšího specifického příznaku spondylartritid; další možností je kombinace pozitivity antigenu HLA-B27 se dvěma specifickými příznaky spondylartritid. Definice zánětlivé bolesti zad byla navržena na základě vlastní studie nově [3] a poněkud se liší od tzv. berlínských kritérií [4]. Studie Rudwaleita a kol. [5] prokázaly, že non-rtg i rtg SpA jsou stejně klinicky závažné (bolest, ztuhlost, kvalita života) a že vývoj sakroiliitidy je především funkcí času. Rentgenová sakroiliitida je pouze výrazem chronicity (závažnosti). Proto je nutné zahájit účinnou léčbu časně, a to již v preradiologickém stadiu. Např. biologické léky prokázaly účinnost již v tomto časném stadiu. Dle hodnocení pomocí MRI navíc dochází k průkaznému potlačení zánětlivé aktivity jak na sakroiliakálních (SI) kloubech, tak na páteři [6].
Pro diagnostiku těchto časných stadií axiálních spondylartritid byla zcela nedávno publikována diagnostická kritéria skupiny ASAS (Assessment of SpondyloArthritis Society) [2] ( obr. 2 ). Diagnóza axiální SpA je tedy možná při detekci sakroiliitidy zobrazovací metodikou (rtg nebo MRI) spolu s přítomností jednoho dalšího specifického příznaku spondylartritid; další možností je kombinace pozitivity antigenu HLA-B27 se dvěma specifickými příznaky spondylartritid. Definice zánětlivé bolesti zad byla navržena na základě vlastní studie nově [3] a poněkud se liší od tzv. berlínských kritérií [4]. Studie Rudwaleita a kol. [5] prokázaly, že non-rtg i rtg SpA jsou stejně klinicky závažné (bolest, ztuhlost, kvalita života) a že vývoj sakroiliitidy je především funkcí času. Rentgenová sakroiliitida je pouze výrazem chronicity (závažnosti). Proto je nutné zahájit účinnou léčbu časně, a to již v preradiologickém stadiu. Např. biologické léky prokázaly účinnost již v tomto časném stadiu. Dle hodnocení pomocí MRI navíc dochází k průkaznému potlačení zánětlivé aktivity jak na sakroiliakálních (SI) kloubech, tak na páteři [6].
Hodnocení spondylartritid
Kromě časné diagnostiky je před stanovením terapeutického plánu u pacientů se SpA nutné určit několik dalších faktorů. Především je nutné rozhodnout o typu artritidy – účelné se jeví především rozdělení na formy s periferní artritidou a na čistě axiální, protože účinnost syntetických DMARD se liší podle lokalizace. Dále je nutné určit aktivitu onemocnění. K tomuto účelu může nejlépe sloužit skóre BASDAI [7]. Je vhodné určit počet aktivních kloubů (oteklých, palpačně citlivých) a počet aktivních entezitid. Nutné je zhodnocení bolesti, funkce a disability. Dále je nutné stanovit reaktanty akutní fáze (sedimentace erytrocytů nebo CRP) a zvážit přítomnost tzv. extraskeletálních manifestací (uveitida, idiopatický střevní zánět, psoriáza). Za velmi důležité kritérium při hodnocení SpA se považuje názor experta.
Terapie axiálních spondylartritid
Základním předpokladem pro úspěšnou léčbu AS je monitorování aktivity onemocnění a potažmo účinnosti léčby. Pracovní skupina ASAS publikovala nedávno základní ukazatele, které je vhodné monitorovat. Důležité je používat validizované numerické ukazatele ( tab. 2 ) [8]. Tyto ukazatele je vhodné  vyhodnocovat např. v tříměsíčních intervalech a v případě nedostatečné odpovědi změnit flexibilně strategii. Např. při zavedení biologické léčby by mělo během tří měsíců dojít k poklesu BASDAI (Bath ankylosing spondylitis disease activity index) o 50 % či k absolutnímu poklesu o 20 mm na vizuální analogové škále (VAS). Pro hodnocení morfologické progrese se doporučuje při použití rentgenové metodiky používat tzv. modifikované Stoke skóre [9]. Progresivní metodikou pro hodnocení aktivity zánětu SI kloubů a páteře je magnetická rezonance, přičemž již byly navrženy skórovací numerické ukazatele [10].
vyhodnocovat např. v tříměsíčních intervalech a v případě nedostatečné odpovědi změnit flexibilně strategii. Např. při zavedení biologické léčby by mělo během tří měsíců dojít k poklesu BASDAI (Bath ankylosing spondylitis disease activity index) o 50 % či k absolutnímu poklesu o 20 mm na vizuální analogové škále (VAS). Pro hodnocení morfologické progrese se doporučuje při použití rentgenové metodiky používat tzv. modifikované Stoke skóre [9]. Progresivní metodikou pro hodnocení aktivity zánětu SI kloubů a páteře je magnetická rezonance, přičemž již byly navrženy skórovací numerické ukazatele [10].
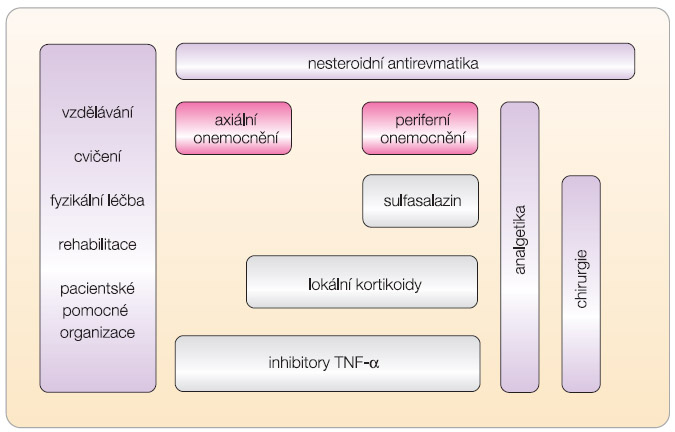 Základní principy léčby AS byly definovány v Doporučeních EULAR (European League Against Rheumatism) pro léčbu AS [11] ( obr. 3 ). Optimální léčba AS by měla kombinovat nefarmakologický a farmakologický přístup. Nefarmakologická léčba by měla zahrnovat edukaci pacienta, pravidelné cvičení (individuální a skupinové, fyzikální léčbu, včetně lázeňské terapie). Systematický přehled fyzikální léčby potvrdil její účinnost [12].
Základní principy léčby AS byly definovány v Doporučeních EULAR (European League Against Rheumatism) pro léčbu AS [11] ( obr. 3 ). Optimální léčba AS by měla kombinovat nefarmakologický a farmakologický přístup. Nefarmakologická léčba by měla zahrnovat edukaci pacienta, pravidelné cvičení (individuální a skupinové, fyzikální léčbu, včetně lázeňské terapie). Systematický přehled fyzikální léčby potvrdil její účinnost [12].
Nesteroidní antirevmatika (NSA) jsou považována za základní stavební kámen léčby AS. Dobrý protizánětlivý efekt NSA se projevuje již během 24–72 hodin, když dochází ke snížení bolesti a zkrácení doby trvání ranní ztuhlosti. Při podávání NSA u AS je stále diskutován fakt, zdali se NSA mají podávat „on demand“ (jen při bolestech a krátkodobě), nebo zdali se mají podávat kontinuálně. Krátkodobé podávání NSA je v podstatě doporučováno ve všech indikacích, protože při dlouhodobém podávání se stávají problémem gastrointestinální a kardiovaskulární (CV) nežádoucí účinky. Nicméně u AS byly provedeny studie, které prokázaly, že dlouhodobé podávání NSA (konkrétně celekoxibu) může mít inhibiční vliv na růst syndesmofytů na rtg, čili strukturu modifikující efekt [13]. Toxicita NSA při dlouhodobém podávání je známa, ale tyto studie byly většinou prováděny na jiných populacích než u pacientů s AS, a jednalo se tedy většinou o jedince starší a s větším počtem komorbidit. Dlouhodobá snášenlivost NSA u nemocných s AS tedy není jasně popsána a možná je lepší než v jiných indikacích. Pacienti jsou většinou mladší 60 let a nemají zvýšené gastrointestinální a kardiovaskulární riziko. Jejich riziko vzniku závažné GIT a CV nežádoucí příhody je menší než 1 %, pokud jsou léčeni déle než jeden rok. Lze tedy uzavřít, že pokud jsou pacienti opravdu v klinicky aktivním stadiu, měli by být léčeni plnou dávkou NSA po dostatečně dlouhou dobu. Samozřejmě rizika léčby by jim měla být včas vysvětlena [14].
Chorobu modifikující léky (DMARD) účinné u RA, jako je sulfasalazin, methotrexát a leflunomid, neprokázaly žádnou účinnost u AS [15, 16] s výjimkou sulfasalazinu u periferních forem AS a SpA [17]. Nejsou k dispozici žádné důkazy o účinnosti systémově podávaných kortikoidů [11], a proto tato léčba není doporučována. Je naopak doporučováno lokální podání kortikoidů intraartikulárně, ale také do místa entezitidy i tendinitidy či sakroiliitidy. Jde však o názor expertů, přičemž randomizované kontrolované studie nebyly provedeny, a je nutné mít na paměti potenciální riziko šlachové ruptury.
Terapie axiálních spondylartritid inhibitory TNF-α
První skutečně účinnou léčbu AS představuje aplikace inhibitorů TNF-α (tumor necrosis factor a ). Randomizované kontrolované studie prokázaly účinnost všech tří léčiv (infliximab, etanercept, adalimumab) u AS [18–20]. Velikost účinku (effect size) inhibitorů TNF-α u AS je značná a počet pacientů, které je třeba léčit k dosažení odpovědi (NNT), je nízký [11]. Nástup účinku léčby inhibitory TNF-α je velmi rychlý, ale zároveň bylo prokázáno, že efekt přetrvává dlouhodobě [21, 22]. Po přerušení léčby však může docházet rychle k exacerbaci onemocnění. Antagonisté TNF-α jsou také prvními léky, které u AS příznivě ovlivňují jak periferní kloubní syndrom, tak i axiální syndrom. Kromě ovlivnění spondylitidy a synovitidy snižují i výskyt entezitidy, který se hodnotí tzv. entezitickým skóre [20]. V dvojitě slepé studii za použití MRI prezentované zcela nedávno prokázal Dougados a kol. statisticky významný vliv na snížení výskytu a intenzity entezitidy v oblasti paty [23]. Některé studie sice ukazovaly fakt, že inhibitory TNF-α mohou být účinnější u AS s kratší dobou trvání nemoci, ve studii ATLAS byl ovšem prokázán efekt i u pacientů s totální ankylózou páteře [20]. Většina studií s antagonisty TNF-α byla provedena u pacientů splňujících tzv. newyorská kritéria pro AS, včetně definitivní sakroiliitidy na rtg. Nově bylo provedeno několik studií, které zařazovaly pacienty v časné (preradiologické) fázi AS. Např. do studie Haibela a kol. [24] byli zařazeni pacienti, pokud splňovali tři z následujících šesti kritérií: zánětlivá bolest v zádech, pozitivita antigenu HLA-B27, průkaz sakroiliitidy či zánětu páteře pomocí MRI, dobrá odpověď na NSA, přítomnost jednoho nebo více mimokloubních projevů a SpA v rodinné anamnéze. Výsledky (v hodnotách ASAS 20, 40 a BASDAI 50 %) byly vysoce signifikantní ve prospěch adalimumabu oproti placebu. Ve stejné indikaci axiální SpA bez rtg sakroiliitidy bylo dosaženo obdobně vynikajících výsledků i po aplikaci infliximabu [25]. Mimoskeletální manifestace SpA, jako je uveitida, psoriáza a idiopatický střevní zánět (IBD), se vyskytují až u 40 % pacientů se SpA. Proto je důležité zhodnotit, jestli je mezi jednotlivými inhibitory TNF-α rozdíl v ovlivnění těchto mimoskeletálních manifestací. Zatímco monoklonální protilátky jsou účinné u Crohnovy nemoci (infliximab, adalimumab) a ulcerózní kolitidy (infliximab), etanercept u těchto chorob účinnost neprokázal. Není proto překvapivé, že v hodnocení rizika vzplanutí IBD u revmatologických pacientů léčených pro AS byl značně účinnější infliximab než etanercept. Nízký počet pacientů léčených adalimumabem hodnocení neumožnil [26]. Jiná metaanalýza ukázala snížený výskyt vzplanutí uveitidy po aplikaci inhibitoru TNF-α , přičemž efekt infliximabu byl výraznější než efekt etanerceptu [27]. Výraznější vliv na snížení výskytu uveitid prokázala i retrospektivní analýza ve francouzské monocentrické studii [28]. Snížený výskyt vzplanutí uveitidy byl zaznamenán v prospektivní otevřené studii i po léčbě adalimumabem [29]. Všechny tři inhibitory TNF-α pak prokázaly svoji účinnost u psoriázy a psoriatické artritidy [30].
Otevřenou otázkou zatím zůstává, zdali inhibitory TNF-α zpomalují rtg progresi AS, přičemž výsledky publikovaných randomizovaných studí tento strukturální efekt nepotvrdily [31, 32]. U revmatoidní artritidy (RA) byl strukturální efekt inhibitorů TNF-α prokázán zpomalením vzniku erozí (skóre erozí) a počtem zúžení kloubních štěrbin. U AS je problém v tom, že kromě destruktivních změn (výše zmíněné eroze a zúžení kloubních štěrbin) se vyskytují i změny opačného charakteru, tzn. osteoproliferace a ankylóza. Tyto změny jsou vyvolávány jiným patofyziologickým mechanismem, často nekorelují se změnami destruktivními a je možné, že pro hodnocení progrese AS jsou důležitější [33]. Je tedy možné, že nejčastější dosud používané skórovací systémy pro hodnocení progrese AS, tzn. mSASSS (modifikované Stoke Ankylosing Spondylitis Spine Score) [34], nejsou dostatečně vhodné a ani senzitivní pro zachycení strukturálních změn. Zdá se, že určitou nadějí do budoucna může být metodika MRI a navržené skórovací systémy [1]. Dosavadní zkušenosti s MRI ukazují podstatné snížení intenzity zánětu.
Indikační kritéria pro terapii inhibitory TNF-α
 Kritéria pro zahájení léčby inhibitory TNF-α byla definována doporučeními ASAS a EULAR [11]. Léčba by měla být zahajována u pacientů, kteří splňují newyorská kritéria pro AS [35]. Dále by měla být choroba aktivní, přičemž navržená hodnota je BASDAI > 4 (na škále 0–10) ve dvou návštěvách po 4 týdnech za sebou. Dalším kritériem je selhání léčby NSA, terapie sulfasalazinem u periferních forem AS a selhání lokální léčby intraartikulárními kortikoidy (u monoartritidy či entezopatií). Kritéria České revmatologické společnosti jsou identická, navíc je zde kritérium CRP > 10 mg/l [36] ( tab. 3 ).
Kritéria pro zahájení léčby inhibitory TNF-α byla definována doporučeními ASAS a EULAR [11]. Léčba by měla být zahajována u pacientů, kteří splňují newyorská kritéria pro AS [35]. Dále by měla být choroba aktivní, přičemž navržená hodnota je BASDAI > 4 (na škále 0–10) ve dvou návštěvách po 4 týdnech za sebou. Dalším kritériem je selhání léčby NSA, terapie sulfasalazinem u periferních forem AS a selhání lokální léčby intraartikulárními kortikoidy (u monoartritidy či entezopatií). Kritéria České revmatologické společnosti jsou identická, navíc je zde kritérium CRP > 10 mg/l [36] ( tab. 3 ).
Výsledky léčby AS v České republice v registru ATTRA
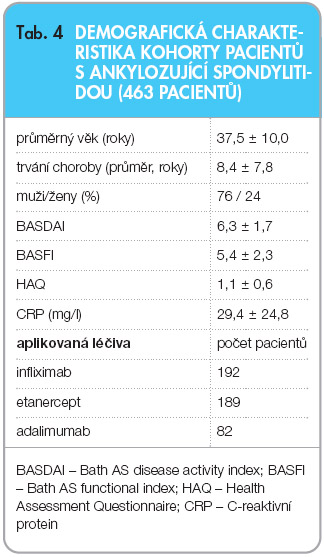 V České republice jsou pacienti léčeni v centrech biologické léčby a jsou zařazováni do registru biologické léčby ATTRA. V současné době je do registru zařazeno 750 pacientů, přičemž 463 jich bylo ve sledování nejméně 1 rok. Šlo o mladé pacienty s průměrným věkem 37,5
6 10 roků a průměrným trváním nemoci 8,4 6 7,8 roku. Aktivita nemoci byla relativně vysoká s BASDAI (Bath AS disease activity index) 6,3 6 1,7 a CRP 29,4 6 24,8 ( tab. 4 ) [37]. Účinnost léčby byla velmi dobrá s rychlým poklesem ukazatelů aktivity za tři měsíce, přičemž tento efekt přetrvával i tři roky po
V České republice jsou pacienti léčeni v centrech biologické léčby a jsou zařazováni do registru biologické léčby ATTRA. V současné době je do registru zařazeno 750 pacientů, přičemž 463 jich bylo ve sledování nejméně 1 rok. Šlo o mladé pacienty s průměrným věkem 37,5
6 10 roků a průměrným trváním nemoci 8,4 6 7,8 roku. Aktivita nemoci byla relativně vysoká s BASDAI (Bath AS disease activity index) 6,3 6 1,7 a CRP 29,4 6 24,8 ( tab. 4 ) [37]. Účinnost léčby byla velmi dobrá s rychlým poklesem ukazatelů aktivity za tři měsíce, přičemž tento efekt přetrvával i tři roky po 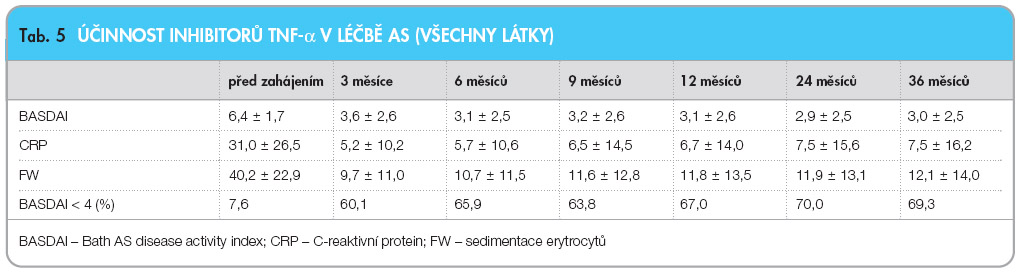 zahájení léčby ( tab. 5 ). Proporce pacientů s BASDAI < 4 stoupla ze 7,6 % na začátku léčby na 69,3 % na konci léčby. Setrvání pacientů v léčbě bylo signifikantně lepší než v naší kohortě nemocných s RA, sledovaných rovněž v registru ATTRA ( graf 1 ). Výskyt závažných nežádoucích účinků, závažných infekcí a tuberkulózy byl ve skupině nemocných s AS nižší než ve skupině nemocných s RA ( tab. 6 ). Tento fakt je velmi důležitý, protože v poslední době se často diskutuje bezpečnost inhibitorů TNF-α u AS v běžné klinické praxi, která se hodnotí např. v observačních studiích nebo v registrech.
zahájení léčby ( tab. 5 ). Proporce pacientů s BASDAI < 4 stoupla ze 7,6 % na začátku léčby na 69,3 % na konci léčby. Setrvání pacientů v léčbě bylo signifikantně lepší než v naší kohortě nemocných s RA, sledovaných rovněž v registru ATTRA ( graf 1 ). Výskyt závažných nežádoucích účinků, závažných infekcí a tuberkulózy byl ve skupině nemocných s AS nižší než ve skupině nemocných s RA ( tab. 6 ). Tento fakt je velmi důležitý, protože v poslední době se často diskutuje bezpečnost inhibitorů TNF-α u AS v běžné klinické praxi, která se hodnotí např. v observačních studiích nebo v registrech. 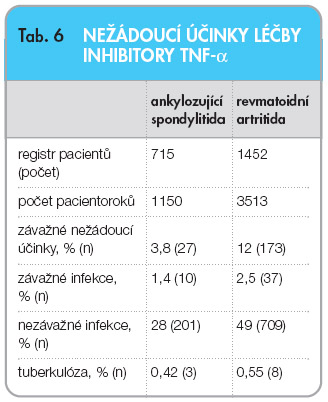 Nutno konstatovat, že dat z těchto observačních studií je podstatně méně než u RA. Nabízí se tedy otázka, zda lze bezpečnostní data z registrů vztahovat také na AS. Teoreticky by měl být výskyt
Nutno konstatovat, že dat z těchto observačních studií je podstatně méně než u RA. Nabízí se tedy otázka, zda lze bezpečnostní data z registrů vztahovat také na AS. Teoreticky by měl být výskyt 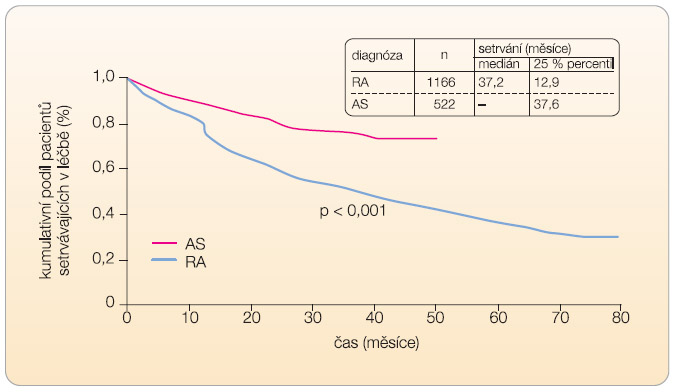 nežádoucích účinků u AS nižší. Pacienti s AS jsou v průměru mladší, méně často užívají další DMARD a kortikoidy. Naše studie jako jedna z prvních opravdu prokázala větší bezpečnost léčby inhibitory TNF-α u AS než u RA. Nižší výskyt nežádoucích účinků zmíněný výše ovšem neznamená jejich nepřítomnost a respektování kontraindikací léčby inhibitory TNF-α a monitorování bezpečnosti léčby je samozřejmostí.
nežádoucích účinků u AS nižší. Pacienti s AS jsou v průměru mladší, méně často užívají další DMARD a kortikoidy. Naše studie jako jedna z prvních opravdu prokázala větší bezpečnost léčby inhibitory TNF-α u AS než u RA. Nižší výskyt nežádoucích účinků zmíněný výše ovšem neznamená jejich nepřítomnost a respektování kontraindikací léčby inhibitory TNF-α a monitorování bezpečnosti léčby je samozřejmostí.
Závěr
Biologická léčba je první účinnou terapií, která intenzivně potlačuje zánětlivou aktivitu u spondylartritid, a to všechny projevy kloubní i mimokloubní. Data z randomizovaných studií potvrzují i výsledky z běžné praxe z Českého národního registru ATTRA. Výskyt nežádoucích účinků léčby inhibitory TNF-α je u ankylozující spondylitidy nižší než u revmatoidní artritidy.
Seznam použité literatury
- [1] Sieper J. Developments in the scientific and clinical understanding of the spondyloarthritides. Arthritis Res Ther 2009;11:208/doi:10.1186/ ar2562/.
- [2] Rudwaleit M, van der Heide D, Landewe R, et al. The development of Assessment of Spondylarthropathies international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68: 770–776.
- [3] Sieper J, van der Heide D, Landewe R, et al. New criteria for inflammatory back pain in patients with chronic back pain: a real patient exercise by experts from the Assessment of SpondyloArthritis Society (ASAS). Ann Rheum Dis 2009; 68: 784–788.
- [4] Rudwaleit M, Metter A, Listing J, et al. Inflammatory back pain in ankylosing spondylitis: a reassessment of the clinical history for application as classification and diagnostic criteria. Arthritis Rheum 2006; 54: 569–578.
- [5] Rudwaleit M, Khan MA, Sieper J. The challenge of diagnosis and classification in early ankylosing spondylitis: do we need new criteria? Arthritis Rheum 2005; 52: 1000–1008.
- [6] Barkham N, Keen H, Coates LC, et al. Clinical and imaging efficacy of infliximab in HLA B27 positive patients with magnetic resonance imaging-determined early sacroiliitis. Arthritis Rheum 2009; 60: 946–954.
- [7] Garret S, Jenkinson T, Kennedy LG, et al. A new approach to define disease status in ankylosing spondylitis: the Bath Ankylosing Spondylitis Disease Activity Index. J Rheumatol 1994; 21: 2286–2291.
- [8] Sieper J, Rudwaleit M, Baraliakos X, et al. The Assessment of SpondyloArthritis international Society (ASAS) handbook: a guide to asses spondyloarthritis. Ann Rheum Dis 2009; 68 (suppl. II): ii1-ii 44.
- [9] Creemers MCV, Franssen MJAM, van Hof MA, et al. Assessment of outcome in ankylosing spondylitis: an extended radiographic scoring system. Ann Rheum Dis 2005; 64: 127–129.
- [10] Rudwaleit M, Jurik AG, Hermann KGA, et al. Defining active sacroiliitis on magnetic resonance imaging (MRI) for classification of axial spondyloarthritis – a consensual approach by the ASAS/ OMERACT MRI group. Ann Rheum Dis in press.
- [11] Zochling J, van der Heide D, Burgos-Vergas R, et al. ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2006; 65: 442–452.
- [12] Dagfinrud H, Kvien T, Hagen K. Physiotherapy interventions for ankylosing spondylitis. Cochrane Database Syst Rev 2004; (4): CD002822.
- [13] Wanders A, Heide D, Landewe R, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: randomized clinical trial. Arthritis Rheum 2005; 52: 1756–1765.
- [14] Song IH, Poddubnyy DA, Rudwaleit MA, et al. Benefits and risk of ankylosing spondylitis treatment with nonsteroidal antiinflammatory drugs. Arthritis Rheum 2008; 58: 929–938.
- [15] Haibel H, Rudwaleit M, Sieper J, et al. Six month open label trial of leflunomide in active ankylosing spondylitis. Ann Rheum Dis 2005; 64: 124–126.
- [16] Chen J, Liu C. Methotrexate for ankylosing spondylitis. Cochrane Database Syst Rev 2004; (3): CD004524.
- [17] Chen J, Liu C. Sulfasalazine for ankylosing spondylitis. Cochrane Database Syst Rev 2005; (2): CD004800.
- [18] Braun J, Brandt J, Listing J, et al. Treatment of active ankylosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet 2002; 359: 1187–1193.
- [19] Davis JC, van der Heide D, Braun J, et al. Recombinant human tumor necrosis factor receptor (etanercept) for treating ankylosing spondylitis: a randomised, controlled trial. Arthritis Rheum 2003; 48: 3230–3236.
- [20] van der Heide D, Kiviz A, Schiff MH, et al. Efficacy and safety of adalimumab in patients with ankylosing spondylitis: results of a multicenter, randomized, double blind, placebo controlled trial. Arthritis Rheum 2006; 54: 2136–2146.
- [21] Davis JC, van der Heide DSM, Braun J, et al. Efficacy and safety of up to 192 weeks of etanercept therapy in patients with ankylosing spondylitis. Ann Rheum Dis 2008; 67: 346–352.
- [22] Baraliakos X, Listing J, von der Recke A, et al. The natural course of radiographic progression in ankylosing spondylitis – detailed analysis of a large retrospective cohort. Ann Rheum Dis 2008; 67 (Suppl. II), 375. Abstract EULAR FRI0288.
- [23] Dougados M, Combe B, Braun J, et al. Short-term symptomatic efficacy of etanercept in refractory heel enthesitis related to spondylarthritis: results of a double blind placebo controlled trial. Ann Rheum Dis 2009; 68: (Suppl. 3): 72.
- [24] Haibel H, Rudwaleit M, Listing J, et al. Efficacy of adalimumab in the treatment of axial spondylarthritis without radiographically defined sacroiliitis: results of a twelve-week randomized, double-blind, placebo-controlled trial followed by an open-label extension up to week fifty-two. Arthritis Rheum 2008; 58: 1981–1991.
- [25] Barkham N, Keen HI, Coates LC, et al. Clinical response and time to active disease following infliximab therapy in patients with HLA B27 positive very early ankylosing spondylitis. Ann Rheum Dis 2009; 69: (Suppl. 3): 72.
- [26] Braun J, Baraliakos X, Listing J, et al. Differences in the incidence of flares or new onset of inflammatory bowel diseases in patients with ankylosing spondylitis exposed to therapy with anti-tumor necrosis factor alpha. Arthritis Rheum 2007; 57: 639–647.
- [27] Braun J, Baraliakos X, Listing J, et al. Decrease incidence of anterior uveitis in patients with ankylosing spondylitis treated with the anti – tumor necrosis factor agents infliximab and etanercept. Artrhritis Rheum 2005; 52: 2447–2451.
- [28] Guignard S, Gossec L, Salliot C, et al. Efficacy of tumour necrosis factor blockers in reducing uveitis flares in patients with spondylarthropathy: a retrospective study. Ann Rheum Dis 2006; 65: 1631–1634.
- [29] Rudwaleit M, Rodevand E, Holck P, et al. Adalimumab effectively reduces the rate of anterior uveitid flares in patients with active ankylosing spondylitis: results of a prospective open-label study. Ann Rheum Dis 2009; 68: 696–701.
- [30] Kavanaugh AF, Ritchlin CT, GRAPPA Treatment Guideline Committee. Systematic review of treatments for psoriatic arthritis: an evidence based approach and basis for treatment guidelines. J Rheumatol 2006; 33: 1417–1421.
- [31] Pavelka K, Forejtová Š, Štolfa J, et al. Anti-TNF therapy of ankylosing spondylitis in clinical practice. Results from the Czech national registry ATTRA. Clin Exp Rheumatol (accepted for publication).
- [32] Braun J, Baraliakos X, Brandt J, et al. Persistent clinical response to the anti-TNF alpha antibody infliximab in patients with ankylosing spondylitis over three years. Rheumatology 2005; 44: 670–676.
- [33] van der Heijde D, Landawe R, Einstein S, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008; 58: 1324–1331.
- [34] van der Heijde D, Landawe R, Deodhar A, et al. Radiographic progression in patients with ankylosing spondylitis after 2 years of treatment not inhibited with infliximab. Ann Rheum Dis 2007; 66 (Suppl. II): 85–86 (OP0111).
- [35] van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York Criteria Arthritis Rheum 1984; 27: 361–368.
- [36] Pavelka K, Štolfa J, Vencovský J. Doplněk standardních léčebných postupů u ankylozující spondylitidy. Česká revmatol 2004; 12: 30–35.
- [37] Pavelka K, Forejtová Š, Štolfa J, et al. Anti TNF therapy of ankylosing spondylitis in clinical practice. Results from Czech National Registry. Ann Rheum Dis 2009; 69: (Suppl. 3): s. 72.
- [38] Rudwaleit M, van der Heijde D, Khan MA, et al. How to diagnose axial spondyloarthritis early. Ann Rheum Dis 2004; 63: 535–543.