Chronická myelocytová leukémia – súčasné možnosti farmakoterapie
Souhrn:
Za posledné desaťročie sa prognóza pacientov s chronickou myelocytovou leukémiou výrazne zmenila. Vďaka pochopeniu molekulárnej podstaty ochorenia a tým možnosti vytvorenia presne cielenej liečby sa vnímanie chronickej myelocytovej leukémie ako fatálneho ochorenia zmenilo na chronickú poruchu jednoducho zvládnuteľnú perorálnou liečbou. Článok sa zaoberá ozrejmením podstaty ochorenia, súčasnými možnosťami farmakoterapie a jej nežiaducimi účinkami.
Key words:
chronic myeloid leukemia – thyrosin kinase inhibitors – imatinib – nilotinib – dasatinib – bosutinib – ponatinib.
Summary:
The prognosis of patients with chronic myeloid leukemia has changed significantly over the last decade. The perception of chronic myeloid leukemia as a fatal illness has changed into a chronic disorder easily manageable with oral therapy due to the understanding of the molecular pathogenesis and the possibility to develop precisely targeted treatment. The article summarizes the main features of the disease, the treatment options, and their side effects.
Úvod
Chronická myelocytová leukémia (CML) je chronická nádorová myeloproliferácia vznikajúca poruchou hematopoetickej kmeňovej bunky. Je charakterizovaná prítomnosťou recipročnej translokácie medzi dlhými ramenami chromozómov 9 a 22, čím vzniká tzv. chromozóm Philadelphia (Ph) – t(9;22)(q34;q11) – a leukemický fúzny gén BCR‑ABL1. Gén ABL1 kóduje nereceptorovú tyrozínkinázu, ktorej neregulovaná aktivita vedie k ovplyvneniu zásadných bunkových procesov v zmysle rozvoja zvýšenej proliferácie a rezistencie na apoptózu. Fúzny gén BCR‑ABL1 je vždy pri vzniku ochorenia prítomný a práve táto skutočnosť bola kľúčová pri jeho využití ako unikátneho biomarkeru nielen pre diagn![Obr. 1 Mechanizmus účinku inhibítora tyrozínkinázy (STI571) ako kompetitívneho inhibítora kinázy Bcr-Abl1 nahradením adenozíntrifosfátu (ATP); podľa [7] – Druker, et al., 2001.](https://www.remedia.cz/photo-a-30530---.jpg) ostiku a monitorovanie odpovede na liečbu, ale najmä pri plánovaní cielenej liečby pomocou inhibítorov tyrozínkinázy (TKIs) (obr. 1) [1].
ostiku a monitorovanie odpovede na liečbu, ale najmä pri plánovaní cielenej liečby pomocou inhibítorov tyrozínkinázy (TKIs) (obr. 1) [1].
Chronická myelocytová leukémia sa svojím výskytom radí k menej častým hematologickým ochoreniam. Jeho incidencia sa dá očakávať na úrovni jedného novo diagnostikovaného chorého na 100 000 obyvateľov a rok s mierne mužskou prevahou. V západnom svete má zastúpenie približne 15 % medzi všetkými novými prípadmi leukémií. Pred zavedením liečby pomocou TKIs bol medián prežitia pacientov dosahovaný liečbou interferónom 5–7 rokov. V súčasnosti sa odhaduje, že chorí s CML, ktorí po liečbe TKIs dosiahli optimálnu odpoveď, majú pravdepodobnosť celkového prežitia porovnateľnú s ostatnou bežnou populáciou. V dôsledku toho dochádza pri nezmenenej incidencii CML k významnému nárastu prevalencie a v budúcnosti sa očakáva jej ďalší vzostup. Napríklad v Spojených štátoch amerických sa predpokladá nárast prevalencie CML z 70 000 prípadov v roku 2010 na 112 000 v roku 2020 [2].
Priebeh CML sa vyznačuje troma fázami: najviac prípadov ochorenia je diagnostikovaných v chronickej fáze, ktorá môže byť zvládnuteľná aj paliatívnou cytostatickou liečbou hydroxyureou, ale bez účinnej terapeutickej intervencie ochorenie postupne progreduje do akcelerovanej fázy až do terminálnej blastickej krízy. Chronická myelocytová leukémia môže byť asymptomatická a diagnostikovaná náhodne pri bežnom vyšetrení krvného obrazu, kde dominuje leukocytóza, ktorá v priemere dosahuje hodnoty okolo 100 × 109/l, s posunom doľava, a často býva prítomný zvýšený počet eozinofilov, bazofilov a trombocytov. Medzi najčastejšie symptómy patrí únava, nočné potenie, pokles telesnej hmotnosti, zväčšená slezina; medzi menej časté prejavy CML zaraďujeme krvácanie, trombózy, bolesť kostí, hepatomegáliu, lymfadenopatiu alebo priapizmus.
Prechod CML do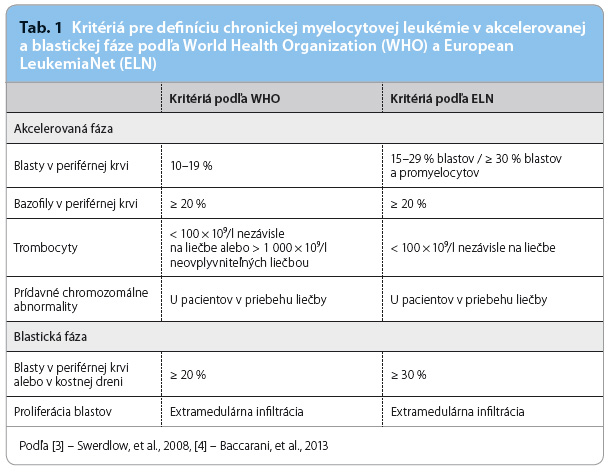 akcelerovanej a blastickej fázy môžeme potvrdiť predovšetkým pomocou zastúpenia blastov v periférnej krvi alebo v kostnej dreni, pričom blastický zvrat je rozdielne definovaný kvantitatívnymi kritériami určenými dvoma organizáciami: Svetovou zdravotníckou organizáciou (World Health Organization, WHO) a Európskou leukemickou sieťou (European LeukemiaNet, ELN) [3,4] (tab. 1). Keďže podľa niektorých retrospektívnych štúdií sa nepotvrdilo, že by pacienti s 20–30‑percentným zastúpením blastov mali prognózu ekvivalentnú s blastickou fázou, je logickejšie používať definíciu ELN, aj keď nezodpovedá obecným diagnostickým kritériám platným pre akútne leukémie.
akcelerovanej a blastickej fázy môžeme potvrdiť predovšetkým pomocou zastúpenia blastov v periférnej krvi alebo v kostnej dreni, pričom blastický zvrat je rozdielne definovaný kvantitatívnymi kritériami určenými dvoma organizáciami: Svetovou zdravotníckou organizáciou (World Health Organization, WHO) a Európskou leukemickou sieťou (European LeukemiaNet, ELN) [3,4] (tab. 1). Keďže podľa niektorých retrospektívnych štúdií sa nepotvrdilo, že by pacienti s 20–30‑percentným zastúpením blastov mali prognózu ekvivalentnú s blastickou fázou, je logickejšie používať definíciu ELN, aj keď nezodpovedá obecným diagnostickým kritériám platným pre akútne leukémie.
Pri diagnóze sa odporúča stanoviť rizikovosť ochorenia podľa dostupných skórovacích systémov. Sokalovo skóre vzniklo pre pacientov liečených v minulosti busulfanom a hydroxyureou, Hasfordovo (EURO) skóre bolo používané u pacientov liečených interferónom α, ale obe sú stále hodnotné aj v súčasnej dobe. Prvé skóre určené pre odhad rizikovosti ochorenia u pacientov liečených s TKIs bolo skóre EUTOS, ktorého výhodou bola jednoduchosť výpočtu a praktickejšie rozdelenie pacientov do dvoch rizikových skupín. Najnovšie skóre, vypracované štatistikmi zo skupiny ELN s cieľom oddeliť úmrtia na CML od úmrtí na komorbidity (ktoré v poslednom období logicky nadobúdajú väčšiu dôležitosť), sa opiera o vstupné hodnoty počtu trombocytov, percento blastov, veľkosť sleziny a vek pacienta a opäť rozdeľuje chorých do troch skupín s rozdieľnou pravdepodobnosťou prežitia [5].
Možnosti liečby chronickej myelocytovej leukémie
Prvé pokusy o liečbu CML zlúčeninami arzénu pochádzajú z 19. storočia. Na začiatku 20. storočia sa lekári snažili ožiarením zmenšiť veľkosť sleziny, čo v roku 1960 nahradili alkylačnými látkami. Tieto intervencie pravdepodobne neovplyvnili prirodzený vývoj choroby – medián prežitia ostával na úrovni asi 3,5 roka.
Prvá randomizovaná štúdia potvrdila účinnosť busulfanu, u ktorého sa neskôr ukázalo, že nie vždy normalizuje krvný obraz, navyše má mutagénne účinky, a môže dokonca podporiť prechod do blastickej krízy; preto bol nahradený cytoredukčnou látkou hydroxyureou. Tieto dve cytostatiká upravia krvný obraz a zmiernia symptómy, a aj keď môžu navodiť hematologickú remisiu, neovplyvnia prirodzený priebeh ochorenia, nie sú schopné indukovať cytogenetickú odpoveď a maximálne oddialia prechod CML do blastickej fázy.
Významnejšie predĺženie prežitia pacientov nastalo až s príchodom interferónu α v sedemdesiatych rokoch. Interferón však priniesol významné zlepšenie len približne pre pätinu pacientov (väčšinou s nízkym rizikom), u ktorých sa podarilo dosiahnuť kompletnú cytogenetickú odpoveď. U prevažnej väčšiny pacientov došlo k rozvoju primárnej alebo sekundárnej rezistencie a ostatní nedokázali dlhodobú liečbu tolerovať pre množstvo nežiaducich účinkov [6]. Zlepšenie sa nepodarilo dosiahnuť ani kombináciou interferónu s inými látkami.
Inhibítory tyrozínkinázy
Skutočná revolúcia v liečbe nastala až po pochopení molekulárnej podstaty ochorenia na prelome osemdesiatych a deväťdesiatych rokov minulého storočia. Vedci zo spoločnosti Ciba‑Geigy v spolupráci so skupinou Briana Drukera testovali počiatkom deväťdesiatych rokov stovky molekúl zo skupiny tyrfostínov s cieľom identifikovať účinný inhibítor leukemickej tyrozínkinázy Bcr‑Abl1 [1]. Ďalšie skupiny boli k tomuto úsiliu prevažne skeptické, pretože neverili, že malá molekula inhibujúca receptor pre adenozíntrifosfát (ATP) v molekule kinázy bude klinicky použiteľná. Čakali, že bude interferovať s ďalšími pre bunku vitálne dôležitými cieľmi, čo povedie k závažným nežiaducim účinkom. Tieto obavy sa našťastie nenaplnili – revolučný inhibítor s najlepšími výsledkami STI571 (imatinib) bol v prvých klinických testoch veľmi dobre tolerovaný, takže éra prevratnej cielenej liečby – éra použitia TKIs u CML – mohla začať. V Spojených štátoch bol imatinib schválený pre liečbu CML v roku 2001 [7]. Odvtedy boli pre prvú líniu liečby CML schválené ďalšie dva TKIs – nilotinib a dasatinib.
Klinická odpoveď na liečbu pomocou TKIs sa meria v presne stanovených intervaloch troma hlavnými parametrami, ktoré sú definované expertnou skupinou ELN (tab. 2).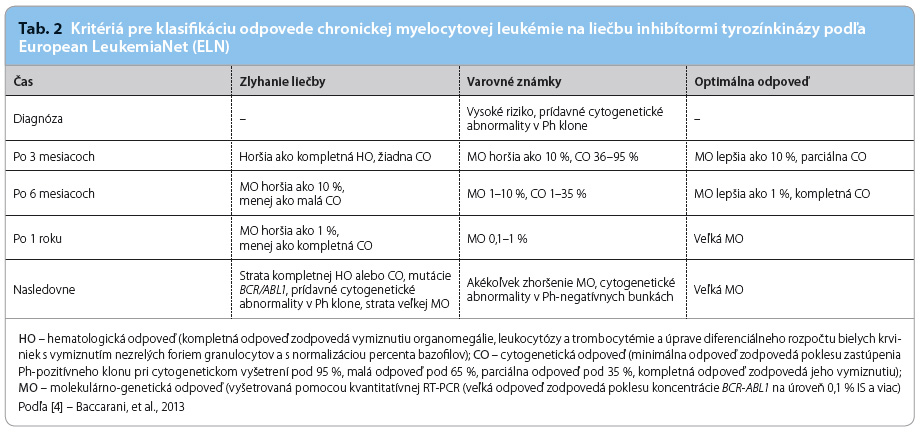
Kompletná hematologická odpoveď je definovaná ako zníženie počtu leukocytov na menej ako 10 × 109/l, zníženie počtu trombocytov na menej ako 450 × 109/l, strata nezrelých krvných elementov z periférnej krvi, strata všetkých symptómov ochorenia a dosiahnutie normálnej veľkosti sleziny.
Cytogenetická odpoveď na liečbu je rozdelená na kompletnú, čiastočnú, malú a minimálnu odpoveď. Kompletná cytogenetická odpoveď (CCyR) je definovaná ako neprítomnosť buniek s pozitivitou chromozómu Philadelphia (Ph+) pri hodnotení aspoň 20 buniek v metafáze mitotického delenia, čiastočná (parciálna) odpoveď ako 1–35 % mitóz s Ph+, malá odpoveď ako 35–64 %, minimálna 65–95 % a žiadna odpoveď viac ako 95 % mitóz s prítomnosťou Ph.
Najcitlivejším meraním pre monitoráciu ochorenia je molekulárna odpoveď. Využíva kvantifikáciu koncentrácie transkriptov BCR‑ABL1 pomocou polymerázovej reakcie v reálnom čase (Q‑RT‑PCR) v periférnej krvi. Veľká molekulárna odpoveď (MMR) je definovaná ako pokles koncentrácie transkriptov BCR‑ABL1 väčší ako 3 log (< 0,1 %). V súčasnosti je vyšetrovacia metóda taká citlivá, že dovoľuje určit pokles transkriptov BCR‑ABL1 až na hodnotu 4,5–5 log (MR4,5, MR5), čo označujeme ako hlbokú molekulárnu odpoveď [4]. Pre optimálnu odpoveď je žiaduce podľa aktuálne platnej verzie odporúčaní dosiahnuť kompletnú cytogenetickú a súčasne veľkú molekulárnu odpoveď do jedného roku od započatia liečby. Pravdepodobnosť prežitia chorých s CML s touto odpoveďou by sa mala vyrovnávať pravdepodobnosti prežitia bežnej populácie. Hlbšia odpoveď má na druhej strane pravdepodobne význam pri pokusoch o prerušenie liečby a dosiahnutie „treatment‑free remission“, aktuálne skúmanej štúdiou ELN EURO‑SKI.
Inhibítor tyrozínkinázy prvej generácie
Imatinib
Prvé in vitro dáta o vysoko selektívnej látke 2‑fenylaminopyrimidíne publikovali v roku 1996 Druker a spol. [1]. Do prvej fázy klinického skúšania vstupoval imatinib pod skratkou ST1571, kde sa u pacientov s pokročilou fázou ochorenia ukázalo, že imatinib nielenže zlepšuje parametre krvného obrazu a udržuje ochorenie v chronickej fáze, ale navyše rýchlo indukuje významnú cytogenetickú odpoveď [7]. Druhá fáza skúšania ukázala, že u pacientov, u ktorých zlyhala predchádzajúca liečba interferónom α, je vo veľkom počte prípadov možné dosiahnuť cytogenetickú odpoveď [8]. O dva roky nasledovala štúdia IRIS (International Randomized Study of Interferon, Cytarabine and ST1571), ktorá zahrnula 1 100 novo diagnostikovaných prípadov CML, a jej pozitívne výsledky v prospech imatinibu spôsobili revolúciu v liečbe CML [9].
Imatinib bol registrovaný pre liečbu CML v prvej línii v roku 2001. Patrí do farmakoterapeutickej skupiny inhibítorov proteín‑tyrozínkinázy, ktoré účinne inhibujú aktivitu tyrozínkinázy Bcr‑Abl1 a ďalších receptorových kináz – receptora pre rastový faktor kmeňových buniek kódovaný protoonkogénom c‑Kit, receptorov diskoidínovej domény, receptora pre faktor stimulujúci kolónie a receptorov pre doštičkové faktory α a β (PDGFα a PDGFβ). Pre dospelých pacientov s ochorením v chronickej fáze je odporúčané perorálne podávanie imatinibu v dávke 400 mg/deň, v akcelerovanej fáze a v blastickej fáze je odporúčaná dávka 600 mg/deň [10]. Trvanie liečby a jej ukončenie v prípade pretrvávania hlbokej molekulárnej odpovede je predmetom aktuálnych štúdií.
Účinnosť imatinibu, ako bolo vyššie uvedené, je založená na miere molekulárnej odpovede a na dobe prežitia bez progresie ochorenia. Tento rok boli zverejnené výsledky dlhodobých štúdií dvoch kooperatívnych skupín, ktoré sa za najmenej šesťročné, resp. osemročné obdobie používania imatinibu zaoberali jeho účinnosťou a bezpečnosťou. Podľa nemeckej štúdie CML IV predstavuje imatinib naďalej výbornú voľbu v iniciálnej liečbe pacientov s CML, pričom hlboká molekulárna odpoveď bola najrýchlejšie dosiahnutá pri dávkovaní 800 mg denne. Zaujímavé je tiež zistenie, že molekulárna odpoveď sa u pacientov postupne prehlbuje aj v posledných rokoch sledovania. Po mediáne šiesť rokov sledovania 65 % pacientov stále užíva imatinib a pravdepodobnosť prežitia sa pohybuje na úrovni 84 %.
Pri pravidelnom užívaní imatinibu sa za osem rokov pozorovania v 76 % prípadov vyskytuje aspoň jeden nežiaduci účinok a až v 49 % prípadov viac ako jeden. Nežiaduce účinky sa vyskytujú najčastejšie v prvých troch rokoch užívania lieku a novo vzniknutá neskorá toxicita sa neočakáva. Medzi najčastejšie nežiaduce účinky imatinibu patria zadržiavanie tekutín, gastrointestinálne problémy, myalgie, artralgie a kožné prejavy (tab. 3). Väčšina nežiaducich účinkov je 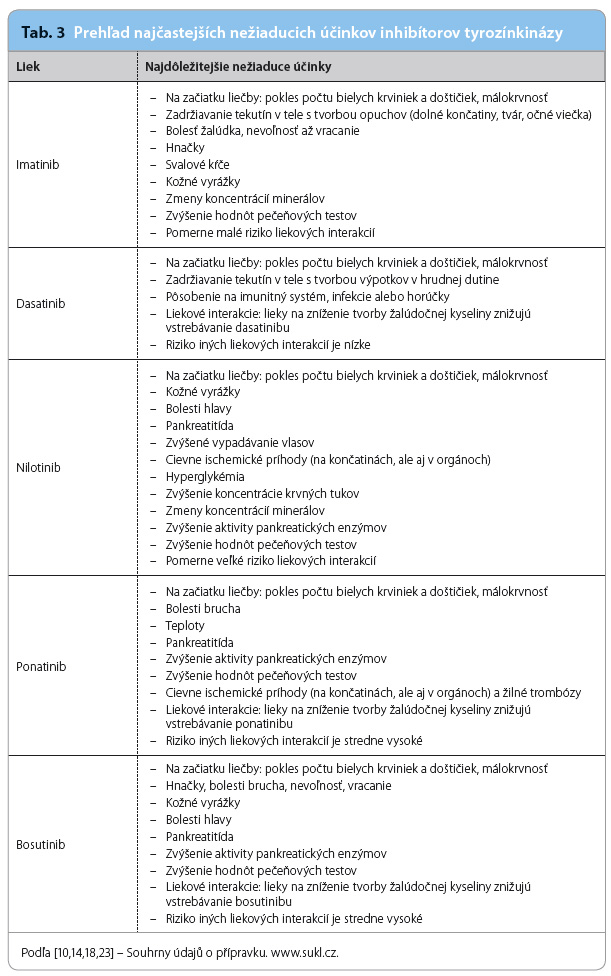 zvládnuteľná symptomatickou liečbou alebo znížením dávky imatinibu; asi v 15 % prípadov sa vyskytuje závažný nežiaduci účinok.
zvládnuteľná symptomatickou liečbou alebo znížením dávky imatinibu; asi v 15 % prípadov sa vyskytuje závažný nežiaduci účinok.
Podľa nemeckej štúdie počas osemročného sledovania prešlo ochorenie do blastickej fázy u 5,6 % pacientov liečených imatinibom [11]. Talianska CML skupina GIMENA zverejnila podobnú štúdiu, v ktorej uvádza až 89% celkové šesťročné prežitie pacientov s CML, vyjadruje však názor, že štandardné dávkovanie imatinibu 400 mg denne je dostačujúce iba pre pacientov s nízkym, prípadne stredným rizikom, ale pre chorých s vysokým vstupným rizikom CML ostáva určiť optimálnu liečbu ďalšími štúdiami. Štúdia navyše potvrdila dôležitosť skorej odpovede podľa kritérií ELN pre úspech dlhodobej liečby [12].
Napriek pozitívnym celkovým dlhodobým výsledkom sa u významného podielu pacientov vyskytuje rezistencia na imatinib, ktorú rozdelujeme podľa načasovania na primárnu a sekundárnu. Ako primárnu rezistenciu označujeme stav, keď sa nikdy nedostaví očakávaná odpoveď na liečbu. Sekundárna rezistencia sa vyvíja až po tom, čo sa dostavila odpoveď na liečbu. Hlavným mechanizmom vzniku rezistencie je na jednej strane vývoj mutácií v ABL‑kinázovej doméne, čo zapríčiní nedostačnú väzbu medzi TKIs a väzobným miestom pre ATP, čo pochopiteľne vedie k zvýšenej expresii fúzneho génu BCR‑ABL1, a na druhej strane mechanizmy nezávislé na BCR‑ABL1 (prídavné cytogenetické abnormality, resp. aktivácia iných signálnych dráh v bunke). Pri ostávajúcich prípadoch rezistencie hrá úlohu zvýšená expresia adhéznych molekúl, ako CXCR4, znížená expresia influxných proteínov, ako sú katiónové pumpy, a iné. Klinicky môže byť veľmi dôležitá nedostatočná spolupráca pacienta, vedúca k nepravidelnému užívaniu lieku [13]. V prípade zlyhania liečby a progresie ochorenia či pri výskyte závažného nežiaduceho účinku sú k dispozícii TKIs druhej a tretej generácie.
Inhibítory tyrozínkinázy druhej generácie
V súčasnosti sú v prípade zlyhania imatinibu k dispozícii tri TKIs druhej generácie, pričom dva z nich sú schválené v USA i v Európe tiež v prvej línii. Výber ďalšieho TKIs v druhej línii liečby je závislý predovšetkým na účinnosti voči spektru mutácií v ABL‑kinázovej doméne a na profile nežiaducich účinkov, ktoré prípravok vyvoláva.
Dasatinib
Dasatinib je registrovaný pre liečbu CML od roku 2006. Jeho účinok spočíva v inhibícii aktivity kinázy Bcr‑Abl1, kináz zo skupiny SRC, kináz c‑KIT, kináz efrinového receptora a receptora pre PDGFβ. Dasatinib je pri testovaní in vitro výrazne účinnejší ako imatinib a pôsobí už pri nízkych koncentráciách. Viaže sa ako na neaktívnu, tak na aktívnu konformáciu enzýmu. Dasatinib účinkuje aj pri rezistencii na imatinib vznikajúcej aktiváciou alternatívnych signálnych dráh a zvýšenou expresiou génov multiliekovej rezistencie. Odporúčaná zahajovacia dávka pre liečbu CML v chronickej fáze je 100 mg jedenkrát denne v perorálnej forme, pre liečbu CML v akcelerovanej a blastickej fáze 140 mg jedenkrát denne. Liečba dasatinibom sa ukončuje, ak nastane progresia ochorenia počas liečby alebo ak pacient prestane dasatinib tolerovať [14]. V prvej fáze klinického skúšania dosiahlo kompletnú cytogenetickú odpoveď 35 % pacientov, u ktorých predtým zlyhala liečba imatinibom. Podobný výsledok u väčšej skupiny pacientov bol zaznamenaný aj v druhej fáze klinického skúšania [15]. Prvá fáza štúdie DASISION (Dasatinib versus Imatinib Study in Treatment‑Naive CML‑CP) ukázala, že podávanie dasatinibu významne zlepšuje dosiahnutie skorej cytogenetickej a molekulárnej odpovede v liečbe novo diagnostikovanej chronickej fázy CML v porovnaní s imatinibom. U pacientov liečených v prvej línii dasatinibom sa vyskytuje užšie spektrum mutácií BCR‑ABL1, navyše počet mutácií na jedného pacienta pri liečbe imatinibom je výrazne vyšší. Pacienti s viacerými mutáciami BCR‑ABL1 majú horšie liečebné výsledky, čo vedie k nutnosti liečbu zmeniť [16]. Medzi najčastejšie významné nežiaduce účinky patria myelosupresia, krvácanie a zadržiavanie tekutín (tab. 3). Významná je tvorba pleurálnych efúzií, ktoré sa môžu pri dlhodobej liečbe vyskytovať až u jednej tretiny chorých. Pleurálne výpotky bývajú často spojené so sprievodnými vírusovými infekciami a vyskytujú sa prevažne u chorých s dobrou odpoveďou na liečbu. Medzi neskoršie popísané nežiaduce účinky dasatinibu patrí pľúcna arteriálna hypertenzia. V prípade jej vzniku je vždy nevyhnutné liečbu týmto liekom ukončiť [17]. Vzhľadom na riziko nežiaducich účinkov je aktuálne odporúčané pred zahájením liečby dasatinibom vylúčiť významné pridružené kardiopulnonárne ochorenia [17].
Nilotinib
Nilotinib bol vyvinutý s cieľom dosiahnutia maximálne presnej väzby medzi receptorovou kapsou pre ATP a molekulou inhibítora. Nilotinib bol pri testovaní in vitro významne účinnejší ako imatinib. Je in vitro aj klinicky účinný proti 32 z 33 imatinib‑rezistentných mutantných foriem BCR‑ABL1 s malým alebo žiadnym účinkom na väčšinu ďalších hodnotených tyrozínkináz. Nilotinib bol prvýkrát registrovaný pre liečbu CML v roku 2007. Odporúčaná denná dávka pre prvú líniu liečby je 300 mg dvakrát denne perorálne nalačno. Vzhľadom na biologickú dostupnosť prípravku a žiaducu bezpečnosť je odporúčané neužívať liek súčasne s jedlom alebo bezprostredne po jedle. Pre druhú líniu liečby je schválené odlišné dávkovanie – 400 mg dvakrát denne [18]. Prvá fáza klinického skúšania zaznamenala v porovnaní s imatinibom veľmi podobné výsledky ako u dasatinibu – 35 % imatinib‑rezistentných pacientov dosiahlo cytogenetickú odpoveď; podobný výsledok bol dosiahnutý aj v druhej fáze klinického skúšania na väčšom súbore pacientov [19]. Výsledky podávania dasatinibu a nilotibu voči imatinibu sú v štúdiách porovnateľné; potvrdila to aj štúdia ENESTnd, v ktorej sa porovnával nilotinib s vysokodávkovaným imatinibom. Potvrdila sa podobná účinnosť v danom dávkovaní, avšak nižšia toxicita u nilotibu. Za tri roky bola dosiahnutá hlboká molekulárna odpoveď u 32 % pacientov liečených nilotinibom, ale iba u 15 % pacientov užívajúcich imatinib [20]. Najčastejšie nehematologické nežiaduce účinky nilotinibu sú nízkeho stupňa závažnosti – vyrážka, bolesti hlavy, nauzea, menej často zápcha, svalové kŕče, bolesti brucha a kĺbov alebo alopécia (tab. 3). Medzi hematologickými nežiaducimi účinkami môžeme pozorovať myelosupresiu; biochemické nežiaduce účinky zahŕňajú zvýšenie aktivity pečeňových alebo pankreatických enzýmov a zhoršenie lipidového spektra [18]. Nedávno bolo potvrdené, že po podávaní nilotinibu dochádza okrem zvýšenia koncentrácie LDL‑cholesterolu u časti pacientov k rozvoju prediabetu a k vaskulárnym nežiaducim účinkom [21,22]. Mechanizmus týchto nežiaducich účinkov je potrebné objasniť, ale vzhľadom na to, že oba nežiaduce účinky sú nebezpečné pre civilizačne ovplyvnenú obéznu populáciu vyspelých západných krajín, boli odporúčané preventívne opatrenia, ktoré majú za cieľ znížiť pomocou TKIs výskyt klinicky významných nežiaducich udalostí súvisiacich s liečbou ohrozených pacientov [14].
Bosutinib
Bosutinib (pôvodne označovaný tiež ako SKI‑606) je tzv. duálnym inhibítorom – inhibuje abnormálnu kinázu Bcr‑Abl1 a kinázy rodiny SRC. V in vitro štúdiách bosutinib inhiboval 16 z 18 foriem BCR‑ABL1 rezistentných na imatinib. Bosutinib bol schválený pre druhú líniu liečby CML v roku 2012. Odporúčaná denná dávka je 500 mg jedenkrát denne perorálne [23]. Do prvej a druhej fázy klinického skúšania boli vybraní pacienti, u ktorých zlyhala predchádzajúca liečba dvoma, či dokonca tromi TKIs a ktorí dosiahli cytogenetickú odpoveď až v 24 % [24,25]. Štúdia BELA porovnávala účinnosť bosutinibu 500 mg s imatinibom v bežnej dávke. Cytogenetická odpoveď za tri roky bola takmer totožná; rozdiel bol pozorovaný v molekulárnej odpovedi, ktorá bola u bosutinibu 41 % a u imatinibu 27 % [26]. Najčastejšími nežiaducimi účinkami sú hnačky (vyskytujú sa na začiatku liečby takmer u všetkých pacientov), nauzea, trombocytopénia, vracanie, bolesti brucha, vyrážka, anémia, febrílie a zvýšené hodnoty pečeňových testov (tab. 3). Závaženejšie nežiaduce účinky sú spojené prevažne s myelosupresiou a so zvýšením hodnôt pečeňových testov [23].
Inhibítor tyrozínkinázy tretej generácie
Ponatinib
Ponatinib, ktorý bol vyvinutý s cieľom prekonať rezistenciu na TKIs spôsobenú obávanou mutáciou T315I, bol v roku 2012 na základe výsledkov štúdie PACE schválený pre liečbu CML v chronickej, akcelerovanej aj blastickej fáze s rezistenciou na iné TKIs alebo s intoleranciou iných TKIs, resp. s mutáciou T315I [27,28]. O rok neskôr však bola jeho indikácia revidovaná vzhľadom na významný výskyt závažných cievnych príhod v štúdii EPIC. K periférnym aj centrálnym cievnym príhodam dochádza vo zvýšenej miere pri aktuálne odporúčanom dávkovaní 45 mg jedenkrát denne. Pretože uvedená dávka bola súčasne maximálne tolerovaná a zdá sa, že liek je účinný aj pri nižšom dávkovaní, prebieha v súčasnosti štúdia OPTIC, ktorá má tieto skutočnosti overiť [29]. Podľa výsledkov klinických štúdií prvej fázy bol ponatinib účinný prakticky u všetkých mutácií v ABL1‑kinázovej doméne [27]. Podľa nezávislých in vitro experimentov by však mohla byť voči ponatinibu rezistentná mutácia E255V alebo aj klony obsahujúce tzv. kompozitné („compound“) mutácie; tie boli potvrdené ako rezistentné najmä v blastickej fáze CML [28,30]. Udáva se, že ponatinib inhibuje tiež FLT3, KIT, RET, SRC, VEGFR a PDGF.
Nejčastejšími nehematologickými nežiaducimi účinkami boli kožná vyrážka (34 %), bolesti brucha (22 %) a pankreatitída (5 %). Ďalej se vyskytovali bolesti hlavy, myalgie, artralgie, z laboratórnych abnormalít najmä zvýšenie hodnôt pankreatických alebo pečeňových testov (tab. 3). Z hematologickej toxicity dominovala trombocytopénia (37 %), nasledovaná neutropéniou (19 %) a anémiou (13 %).
Výber inhibítorov tyrozínkinázy
Podľa odporúčaní ELN sú pre prvú líniu liečby schválené tri TKIs: imatinib, dasatinib a nilotinib. Lekár nemá k dispozícii žiadne pevné pravidlá pre výber konkrétneho TKI. Zásadným![Obr. 2 Algoritmus výberu inhibítorov tyrozínkinázy pre liečbu chronickej myelocytovej leukémie; podľa [4] – Baccarani, et al., 2013. alo-SCT – alogénna transplantácia krvotvorných buniek; HLA – ľudské leukocytárne antigény; TKIs – inhibítory tyrozínkinázy](https://www.remedia.cz/photo-a-30534---.jpg) i pre rozhodnutie sa stali charakteristiky ochorenia: rizikovosť ochorenia podľa skórovacích systémov, molekulárne a cytogenické charakteristiky na jednej strane a samotný pacient na strane druhej s jeho komorbiditami, ktoré musí lekár zvažovať s ohľadom na bezpečnostný profil daného liečiva (obr. 2). Stále najpreferovanejším TKI u pacientov s nízkym rizikom v prvej línii liečby je imatinib. V situácii, keď pacient prestáva reagovať na liečbu imatinibom, sa už neodporúča zvyšovať jeho dávku, ale skôr prejsť na liečbu iným TKI. V prípade prechodu na druhú líniu liečby musia byť vždy zvažované prítomné mutácie s ich citlivosťou na konkrétny TKI na jednej strane a nežiaduce účinky a toxicita jednotlivých TKIs na strane druhej [31].
i pre rozhodnutie sa stali charakteristiky ochorenia: rizikovosť ochorenia podľa skórovacích systémov, molekulárne a cytogenické charakteristiky na jednej strane a samotný pacient na strane druhej s jeho komorbiditami, ktoré musí lekár zvažovať s ohľadom na bezpečnostný profil daného liečiva (obr. 2). Stále najpreferovanejším TKI u pacientov s nízkym rizikom v prvej línii liečby je imatinib. V situácii, keď pacient prestáva reagovať na liečbu imatinibom, sa už neodporúča zvyšovať jeho dávku, ale skôr prejsť na liečbu iným TKI. V prípade prechodu na druhú líniu liečby musia byť vždy zvažované prítomné mutácie s ich citlivosťou na konkrétny TKI na jednej strane a nežiaduce účinky a toxicita jednotlivých TKIs na strane druhej [31].
Záver
Pri dostupnosti účinných TKIs môžeme konštatovať, že sa CML v súčasnosti stala skutočne chronickým ochorením, resp. že pri súčasných možnostiach výberu pre cielenú liečbu CML nebola ešte nikdy doteraz táto liečba tak účinná a bezpečná. Rozhodnutie o výbere konkrétneho TKI u novo diagnostikovaných prípadov CML by malo byť vždy komplexné, s prihliadnutím predovšetkým na rizikovosť ochorenia a na nežiaduce účinky spojené s konkrétnym TKI. Pacienti s nízkym rizikom podľa skórovacích systémov majú zrejme dostatočný prospech z liečby imatinibom, čo bolo nedávno doložené analýzami nemeckej aj talianskej kooperatívnej skupiny pre liečbu CML. Optimálna liečba chorých s vyšším rizikom bude najskôr predmetom ďalších štúdií, ale v súčasnosti by mali byť podávané TKIs druhej generácie nilotinib alebo dasatinib podľa komorbidít pacienta. Podávanie TKIs druhej, ale predovšetkým tretej generácie v ďalších líniách liečby by malo byť podložené znalosťou konkrétnej mutácie pri rezistencii na TKIs nižších generácií. Pri liečbe CML je treba stále venovať vyššiu pozornosť prevencii a liečbe komorbidít, pretože z dlhodobého hľadiska sú tieto zodpovedné za úmrtie približne polovice pacientov. Podľa niektorých štúdií sa dokonca ukazuje, že komorbidity pacientov môžu ovplyvniť dlhodobé prežitie výraznejšie ako samotné hematologické ochorenie [32]. Ďalej bude potrebné doriešiť príčiny a mechanizmy vzniku kardiovaskulárnych a metabolických nežiaducich účinkov niektorých TKIs a taktiež otázku optimálneho dávkovania ponatinibu. V prípade úplného zlyhania terapie pomocou TKIs ostáva priestor pre liečbu interferónom, omacetaxinom, pre klinické štúdie alebo v prípade dostupnosti vhodného darcu pre alogénnu transplantáciu krvotvorných buniek.
Práca bola podporená grantom Univerzity Palackého IGA‑LF‑2016‑001.
Seznam použité literatury
- [1] Druker BJ, et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr Abl positive cells. Nature Med 1996; 2: 561–566.
- [2] Huang XI, Cortes J, Kantarjan H. Estimations of the increasing prevalence and plateau prevalence of chronic myeloid leukemia in the era of tyrosine kinase inhibitor therapy. Cancer 2012; 118: 3123–3127.
- [3] Swerdlow SH, et al. WHO Classification of Tumours of Heamatopoietic and Lymphoid Tissues, 4th ed. In: WHO Classification of Tumours, vol. 2. Geneva: World Health Organization, 2008.
- [4] Baccarani M, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013; 122: 872–884.
- [5] Pfirrmann M, et al. Prognosis of long term survival considering disease specific death in patients with chronic myeloid leukemia. Leukemia 2015; publikované elektronicky 3. novembra 2015; doi: 10. 1038/leu.2015.261.
- [6] Apperly J. Chronic myeloid leukaemia. Lancet 2015; 385: 1447–1459.
- [7] Druker BJ, et al. Efficacy and safety of a specific inhibitor of the BCR ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001; 344: 1031–1037.
- [8] Kantarjian H, et al. and the International STI571 CML Study Group. Hematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med 2002; 346: 645–652.
- [9] O`Brien SG, et al., and IRIS Investigators. Imatinib compared with interferon and low dose cytarabine for newly diagnosed chronic phase chronic myeloid leukemia. N Engl J Med 2003; 348: 994–1004.
- [10] Souhrn údajů o přípravku. www.sukl.cz.
- [11] Kalmanti L, et al. Safety and efficacy of imatinib in CML over a period of 10 years: data from the randomized CML study IV. Leukemia 2015; 29: 1123–1132.
- [12] Castagnetti F, et al. Long term outcome of chronic myeloid leukemia patients treated frontline with imatinib. Leukemia 2015; 29: 1823–1831.
- [13] Talati C, et al. How we will treat chronic myeloid leukemia in 2016. Blood Rev 2015; 29: 137–142.
- [14] Souhrn údajů o přípravku. www.sukl.cz.
- [15] Hochhaus A, et al. Dasatinib induces durable cytogenetic responses in patients with chronic myelogenous leukemia in chronic phase with resistance or intolerance to imatinib. Leukemia 2008; 22: 1200–1206.
- [16] Kantarjian HM, et al. Dasatinib or imatinib in newly diagnosed chronic phase chronic myeloid leukemia: 2 year follow up from a randomized phase 3 trial (DASISION). Blood 2012; 119: 1123–1129.
- [17] Moslehi JJ, Deininger M. Tyrosine kinase inhibitor associated cardiovascular toxicity in chronic myeloid leukemia. J Clin Oncol 2015; publikované elektronicky 14. septembra 2015; DOI: 10.1200/JCO.2015.62.4718.
- [18] Souhrn údajů o přípravku. www.sukl.cz.
- [19] Kantarijan H, et al. Nilotinib in imatinib resistant CML and Philadelphia chromosome positive ALL. N Engl J Med 2006; 354: 2542–2551.
- [20] Larson RA, et al. Nilotinib vs imatinib in patients with newly diagnosed Philadelphia chromosome positive chronic myeloid leukemia in chronic phase: ENESTnd 3 year follow up. Leukemia 2012; 26: 2197–2203.
- [21] Valent P, Hadzijusufovic E, Schernthaner G H, et al. Vascular safety issues in CML patients treated with BCR/ABL1 kinase inhibitors. Blood 2015; 125: 901–906.
- [22] Chai Adisaksopha C, Lam W, Hillis C. Major arterial events in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: a meta analysis. Leuk Lymphoma 2015; publikované elektronicky 5. októbra 2015; DOI: 10.3109/10428194.2015.1091929.
- [23] Souhrn údajů o přípravku. www.sukl.cz.
- [24] Khoury HJ, et al. Bosutinib is active in chronic phase chronic myeloid leukemia after imatinib and dasatinib and/or nilotinib therapy failure. Blood 2012; 119: 3403–3412.
- [25] Gambacorti Passerini C, et al. Bosutinib efficacy and safety in chronic phase chronic myeloid leukemia after imatinib resistance or intolerance: minimum 24 month follow up. Am J Hematol 2014; 89: 732–742.
- [26] Cortes JE, et al. Bosutinib versus imatinib in newly diagnosed chronic phase chronic myeloid leukemia: results from the BELA trial. J Clin Oncol 2012; 30: 3486–3492.
- [27] Cortes JE, et al. Ponatinib in refractory Philadelphia chromosome positive leukemias. N Eng J Med 2012; 367: 2075–2088.
- [28] Cortes JE, et al. A phase 2 trial of ponatinib in Philadelphia chromosome positive leukemias. N Engl J Med 2013; 369: 1783–1796.
- [29] Pritchard J, et al. Analysis of the relationship between dose and BCR ABL halving time in CP CML patients treated with ponatinib or imatinib. Haematologica 2015; 100(S1): 448–449.
- [30] O’Hare T, et al. AP24534, a pan BCR ABL inhibitor for chronic myeloid leukemia, potently inhibits the T315I mutant and overcomes mutation based resistance. Cancer Cell 2009; 16: 401–412.
- [31] Redaelli S, et al. Three novel patient derived BCR/ABL mutants show different sensitivity to second and third generation tyrosine kinase inhibitors. Am J Hematol 2012; 87: E125–E128.
- [32] Saussele S, et al. Impact of comorbidities on overal survival in patients with chronic myeloid leukemia: results of the randomized CML Study IV. Blood 2015; 126: 42–49.