Člověk a mikroorganismy – proti sobě, nebo raději spolu?
Souhrn
Krejsek J. Člověk a mikroorganismy – proti sobě, nebo raději spolu? Remedia 2023; 33: 242–245.
Život na Zemi pravděpodobně vznikl a je určován různými typy mikroorganismů. Mikroorganismy představují faktor, který výrazně ovlivňuje evoluci člověka. Evoluční interakce jsou tak významné, že část genetické informace člověka má původ v mikrobiálním světě. Energetické potřeby lidských buněk zajišťují mitochondrie, které jsou archebakteriálními endosymbionty. Současné lidstvo je výsledkem permanentního selekčního tlaku, který byl ve významné míře zprostředkován patogenními mikroorganismy. I současná medicína se v převažující míře soustředí na působení patogenních mikroorganismů. Teprve v posledním desetiletí díky metodologickému pokroku získáváme obrovské množství informací, které dokládají, že naše tělo je osídleno mikrobiálními společenstvími – mikrobiotou, jež má zásadní vliv na zdraví člověka. Moderní člověk navíc ztrácí přirozené kontakty s mikrobiálním světem, který je negativně zásadně měněn v souvislosti se zhoršujícím se životním prostředím.
Klíčová slova: člověk – mikrobi – evoluce – mikrobiota.
Summary
Krejsek J. Human and microbes – against each other, or rather together? Remedia 2023; 33: 242–245.
The life on the Earth has very likely commenced and is being permanently influenced by various microbes. Microbes exert a significant impact on the human evolution. Evolutionary interplay between microbes and humans is so crucial that a part of human genome is rooted in microbial world. The principal source of energy in human cells is represented by mitochondria, endosymbionts of archaebacterial origin. Contemporary humankind is the result of permanent natural selection pressure with substantial participation of microbial pathogens. Until now, medicine has been largely focusing on pathogenic microorganisms. However, a huge sum of scientific information has been gained recently, documenting that the human body is inhabited by numerous microbial communities, i.e. microbiota, which is essential for human health. We are witnessing a gradual loss of natural contacts with microbial world in modern human population. In addition, the very microbial world surrounding us is deteriorating “hand‑in‑hand” with the environment.
Key words: human – microbes – evolution – microbiota.
Úvod
Člověk je integrální součástí přírody. Vyvíjel se v kontextu přírodních podmínek, které utvářely jeho současnou individuální i společenskou podobu. Zásadní vliv na jeho evoluci měly a mají mikroorganismy. Evoluční spojení s mikrobiálním světem je natolik intenzivní, že lidský genom obsahuje sekvence nepochybně virového původu, které jsou pro fungování např. specifické imunitní soustavy zásadní. Do buněk evolučních předchůdců člověka pronikly archebakterie, které jsou v našich buňkách přítomny jako endosymbiotické mitochondrie poskytující buňkám nejvýznamnější zdroj energie. Každý jedinec si v průběhu života vytváří složitá mikrobiální společenstva, která osidlují především jeho kožní i slizniční povrchy a jsou přítomna prakticky ve všech tělních oddílech. Člověk byl a je permanentně vystaven mikrobiálnímu světu ve svém životním prostředí. Zásadní úlohu v této expozici sehrávají mikroorganismy obsažené v potravě. V životním prostředí člověka se vyskytuje řada mikrobiálních podnětů, které zdánlivě nemají bezprostřední vliv na jeho život, v evolučním kontextu ho však zásadně formují. Jistě zaslouženou pozornost věnujeme patogenním mikroorganismům. Patogenní viry, bakterie, houby a parazité byli hlavní selekční silou v evoluci člověka. Přežili a rozmnožili se pouze ti jedinci, kteří selekčnímu tlaku odolali. Byli k tomu vybaveni nástroji, které zajistily účinný obranný zánět [1].
Z evolučního pohledu teprve před velmi krátkou dobou zhruba dvou set let si člověk osvojil postupy, jak se vyrovnat se selekčním tlakem nejvýznamnějších patogenů. Vyvinul a rozvinul totiž metody aktivní imunizace, které jsou v současné době globálně aplikovány. Chrání před působením nejvýznamnějších patogenů. Jsou natolik účinné, že vedly v případě varioly k eradikaci virového původce onemocnění z lidské populace. Aktivní imunizace, pokud bude populačně důsledně provedena, může vést k eradikaci i dalších závažných lidských patogenů. Bez nadsázky lze aktivní imunizaci označit za jeden z nejvýznamnějších civilizačních výdobytků. Objev a zavedení látek s antibakteriálními účinky, především antibiotik přibližně před 70 lety, znamenaly další významný nástroj k omezení negativních dopadů bakteriálních patogenů na člověka. Evoluční procesy však vedou přirozeně ke vzniku rezistentních bakteriálních kmenů. Vznikají obavy o perspektivu těchto postupů po desetiletí úspěšně používaných ke kontrole patogenních bakterií. Zapomínat nesmíme na zavedení postupů asepse a sterility v medicíně, které zde umožnily obrovský pokrok. Mikrobiální svět je také využíván po celou historii lidstva pro různé praktické účely. Jedná se především o mikroorganismy, které zkvašují potraviny, např. mléko, ovocné šťávy, a uplatňují se při výrobě nápojů a kvašených potravin. Mikrobiální (bakteriální) metabolické schopnosti jsou využívány průmyslově ve výrobě mnohých užitečných produktů, včetně léčiv [2].
Biomedicína se po dlouhá desetiletí oprávněně soustředí na patogenní mikroorganismy. Bohužel to vytváří názor, že mikrobiální svět je vůči člověku jako jednotlivci i lidské populaci nepřátelský a je třeba s ním bojovat všemi prostředky. Tento názor je zcela neopodstatněný. Patogenní mikroorganismy představují pouze nepatrnou část mikrobiálního světa. Drtivá většina mikrobiálního světa není pro člověka bezprostředním rizikem. O mnohých přímých nebo zprostředkovaných benefitech těchto mikrobů se postupně dozvídáme. S jistotou je už nyní možné prohlásit, že je lépe „být s mikroby, než být proti nim“. Přirozená mikrobiální společenstva, která nás osidlují, můžeme označit za „staré přátele“, kteří nám poskytují mnoho nenahraditelných podnětů ovlivňujících fungování všech tělních soustav. Vyjádřit se budeme moci pouze k jejich vlivu na imunitní systém, vznik a rozvoj individuální imunitní reaktivity. Epidemiologická data jasně dokládají, že křivku snižování výskytu infekčních nemocí v populaci vyspělých zemí zrcadlově doplňuje nárůst neinfekčních nemocí, někdy zvaných civilizační. Mezi nimi zvláštní postavení zaujímají imunopatologické choroby. Od konce osmdesátých let minulého století se prosazuje v biomedicíně koncept „příliš čistí/příliš špinaví“ (too clean/too dirty). Velmi jednoduše se tím myslí negativní dopad ztráty přirozeného kontaktu s mikrobiálními podněty, k níž došlo z evolučního pohledu během okamžiku, tj. v průběhu asi tří generací. V tomto časovém horizontu jsme naopak skokově vystaveni nejrůznějším škodlivinám charakteru xenobiotik ve vnějším prostředí, stravě a podobně. Abychom mohli zvrátit tyto negativní trendy a nalézt postupy, jimiž můžeme preventovat nejrůznější neinfekční patologie, měli bychom co nejlépe porozumět interakcím mezi mikrobiálním světem a člověkem jako jednotlivcem i lidskou populací [3].
Mikrobiální svět
Mikrobi představují svými biologickými vlastnostmi velmi heterogenní množinu. Jedním z kritérií může být jejich velikost. Mikrobi jsou obvykle malí tak, že je nelze rozeznat pouhým okem. Původně byli objeveni v 17. století pomocí jednoduchých mikroskopů. Při mikroskopické analýze nebylo zřejmé, že se jedná o živé organismy. To muselo být doloženo v následujícím čase řadou experimentů, které jsou nyní považovány za běžnou součást biomedicíny, ale ve své době šlo o mimořádně inovativní postupy. Kritériem života je přítomnost nukleových kyselin, jež představují „konstrukční rámec“ pro množení organismů. Výjimkou jsou priony, které se prokazatelně zmnožují, aniž by k tomu využívaly nukleové kyseliny. Nejjednoduššími mikroorganismy, které mají všechny atributy živého, jsou viry. I viry mají v porovnání s ostatními mikroorganismy unikátní vlastnosti. Především k množení potřebují živou buňku, kdy využívají její aparát. Mimo živou buňku se chovají jako chemické entity, ribo‑ nebo deoxyribonukleoproteiny. Z evolučního hlediska mohly vzniknout až poté, kdy na Zemi byly k dispozici hostitelské buňky. Podle současných dokladů došlo ke vzniku života na Zemi před asi 3,95 miliardami let. Je formulována jednotka živého označovaná jako LUCA (last universal common ancestor), z níž došlo k diverzifikaci všeho živého na planetě Zemi [4]. Při vývoji probíhal a probíhá horizontální přenos genetické informace, která představuje významný motor evoluce [5]. V těchto horizontálních přenosech genetické informace sehrávaly a sehrávají značnou úlohu viry včetně bakteriofágů a přenos extrachromozomálních bakteriálních replikonů označovaných jako plazmidy. Buňky všech organismů jsou potenciálně infikovatelné virovými agens. Výjimkou nejsou ani lidské buňky. Infikovány mohou být i bakteriální buňky viry označovanými jako bakteriofágy [6].
Bakterie představují mimořádně heterogenní množinu jednobuněčných živých organismů, které s ohledem na jejich strukturu označujeme jako prokaryota. Jejich vznik umožnil evoluci života na Zemi nebo k ní přinejmenším přispěl. Bakterie mají velmi rozmanité metabolické schopnosti, a díky tomu mohou obsazovat prakticky všechny niky na planetě. Bakterie jsou schopny žít a rozmnožovat se i v podmínkách, kde jiné formy života žít nemohou. Hovoříme o tzv. extremofilních bakteriích. Jsou schopny jako zdroj živin a energie využívat anorganické sloučeniny. Pro člověka bezprostředně relevantní jsou organotrofní bakterie.
Energetickým zdrojem pro drtivou část života na Zemi je sluneční záření. Jeho konverzi do formy organických sloučenin využitelné pro živé systémy zajišťují procesy fotosyntézy. Schopnost fotosyntézy mají některé bakterie. Převážná část fotosyntézy je však zprostředkována jednobuněčnými řasami a vícebuněčnými zelenými organismy, především rostlinami. Fotosyntéza ve vícebuněčných organismech je zajišťována plastidy, které jsou endosymbiotickými mikroorganismy, jež evolučně, podobně jako mitochondrie, pronikly do těchto organismů. Díky fotosyntéze vznikají organické látky, jednou z významných je celulóza. Ta je pro většinu organismů bezprostředně nevyužitelná. Její konverzi do stravitelných forem zajišťují složitá mikrobiální společenství, která jsou např. u přežvýkavců přítomna v jejich žaludku. Veškerá organická hmota musí být nakonec rozložena. Rozklad živé hmoty zajišťují mikroorganismy. Rozkladem vzniklé živiny obohacují půdu, vodu a zajišťují koloběh života. Fosilní paliva, která jsou stále hlavním zdrojem energie pro lidstvo, mají rovněž původ ve fotosyntéze. Ze stručně naznačeného je jasné, že život na Zemi by bez přispění mikroorganismů nebyl možný [7].
Infekce virem lidské imunodeficience 1 (HIV‑1), která do lidské populace vešla před zhruba sto lety, a zcela nedávno vstup vysoce patogenních koronavirů SARS‑CoV‑2 nás znovu přesvědčují, že mikrobiální svět představuje pro člověka i lidstvo také stálou hrozbu, která je navíc akcentována společenskými změnami spojenými s komplexním jevem označovaným jako globalizace.
Mikrobi a člověk
Historicky je věnována mimořádná pozornost negativnímu působení mikroorganismů na člověka. Již ve starověku bylo doloženo, že některé nemoci jsou „přenositelné“. Byly popsány způsoby, jak zdroje těchto nemocí identifikovat. Jediným řešením byla izolace jedinců. Příkladem může být malomocenství, mor. Samozřejmě až do novověku nebyly k dispozici žádné postupy, které by dokázaly, že se jedná o infekční nemoci způsobené patogenními mikroorganismy. Zlomem v této oblasti byl objev a zdokonalování mikroskopu. Paradoxně však mikroskopické analýzy zdůrazňovaly vnitřní patologii vycházející z buněk a tkání. Tento koncept prosazoval svou mimořádně vlivnou autoritou profesor Virchow v první polovině 19. století. Fakt, že mnohé závažné, či dokonce smrtící nemoci mají vnější původ, doložil až profesor Pasteur na začátku druhé poloviny 19. století. Profesor Pasteur a jeho žáci našli způsoby, jak kultivovat a identifikovat mikroorganismy. Byly přineseny důkazy, především profesorem Kochem, že některé mikroorganismy jsou skutečně původci lidských onemocnění. Spolu s těmito zakladateli mikrobiologie začínají také další odborníci studovat interakce mezi člověkem a mikroorganismy. Tím byl dán základ vzniku nového oboru, imunologie. Uvedené objevy se velmi brzy zúročily v klinické medicíně.
Viry a bakterie jsou svým složením velmi jednoduché, pokud je porovnáme s eukaryotními buňkami. Není tedy překvapením, že se staly široce využívanými experimentálními modely v biologii. S jejich pomocí byly především po druhé světové válce položeny základy molekulární biologie. Byla jimi doložena úloha DNA jako molekuly kódující genetickou informaci. Byly odvozeny základní biologické procesy spojené s replikací nukleových kyselin, jejich transkripcí a translací. Studium bakteriofágů a bakterií dalo základ znalostem regulací na molekulární úrovni. Na těchto základech byly následně postaveny postupy biotechnologií, jejichž produkty v současnosti bohatě využíváme ve vědě, diagnostice i léčbě lidských nemocí.
V medicíně se soustřeďujeme, jak již bylo řečeno, na interakce člověka s patogenními organismy. Další úvahy budou zaměřeny pouze na bakterie. Zatím bylo kultivováno přibližně 3 000 bakteriálních druhů relevantních pro člověka. Jejich identifikace a pojmenování mají přesné základy v taxonomii a nomenklatuře. Lékaři jsou permanentně vystaveni změnám „v názvosloví“ bakteriálních původců. Tyto změny vycházejí z pokroku v poznávání bakteriálního světa. Naše znalosti o bakteriích zásadně v posledních asi dvaceti letech proměňují postupy molekulární biologie. Těmi jsou postupně definovány genetické základy bakteriálních druhů. Připomínáme, že prvním geneticky plně zmapovaným bakteriálním druhem byla v roce 1995 patogenní bakterie Haemophilus influenzae. Pro genomovou identifikaci bakterií se používá analýza 16S rRNA. V databázi GTDB (Genome Taxonomy Data Base) jsou v současnosti k dispozici údaje o desítkách tisíc bakteriálních druhů, které nejsou zatím kultivovatelné, a nemohou být tedy pojmenovány podle zásad uvedených výše. Je fascinující, že podle kvalifikovaných odhadů přitom máme zatím popsáno pouze kolem 0,5 % bakteriálních druhů. Jsou navrhovány způsoby, jak tyto geneticky určené nekultivovatelné bakterie pojmenovat. Zatím zcela mimo realitu je popis jejich postavení a úlohy ve zdraví a nemoci člověka [8,9].
Mikrobi a člověk za fyziologických podmínek
Biochemické procesy v bakteriálních buňkách jsou velmi rozmanité, pokud porovnáme různé bakteriální taxony. Mnohé z nich se zásadně odlišují od lidských biochemických drah. Mikroorganismy, bakterie, mohou vhodným způsobem doplňovat biochemický, fyziologický a metabolický potenciál člověka. Mohou poskytovat člověku látky, které sám neumí vytvořit. Mohou rozkládat často potenciálně škodlivé látky, které člověk degradovat nedokáže. Suma genů bakteriální mikrobioty, která osidluje různě tělní oddíly člověka a je označována jako mikrobiom, o několik řádů převyšuje počet funkčních lidských genů, jenž je odhadován na zhruba 23 000. K tomu můžeme připočíst zásadní přínos endosymbiotických mitochondrií. Oprávněně je tedy stále více využíván termín „holobiont“, který představuje člověka v úzké spolupráci s mikrobiálním osídlením [10], obrázek 1.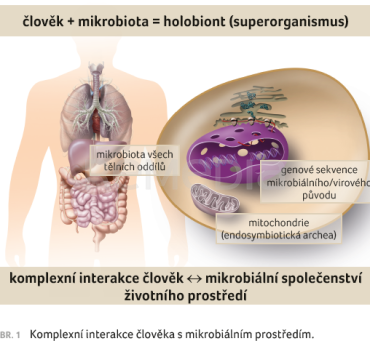
Mikrobiální, bakteriální, osídlení je prokázáno ve všech tělních oddílech člověka. Citlivé molekulární biologické metody prokazují přítomnost genetické informace bakterií za fyziologických podmínek např. i v krvi. Mikrobiální osídlení každého jedince je budováno v jeho ontogenezi v postupných vysoce regulovaných krocích, které odrážejí jeho genetickou dispozici a reflektují také expozici nesmírné množině faktorů vnějšího světa, jimž je každý člověk v průběhu života vystaven. Fyziologické osídlení odráží ontogenetické i momentální potřeby každého jedince s cílem adaptovat se na dané podmínky. Nejvíce informací o dynamice osidlování máme pro trávicí trakt [11]. K osídlení trávicí trubice dochází již při prostupu plodu porodním kanálem. Takto získaná mikrobiota představuje první vlnu osídlení. Za fyziologických podmínek je novorozenec kojen mateřským mlékem. To obsahuje v největším množství a pestrosti pro člověka nestravitelné oligosacharidy označované jako prebiotika. Prebiotika optimálním způsobem stimulují rozvoj střevní mikrobioty, především tenkého a tlustého střeva. Kojenému dítěti musí být mezi ukončeným čtvrtým měsícem a ne později než v šestém měsíci postupně zařazována do jídelníčku pevná strava. V tomto období se otvírá tzv. toleranční okno, které nastavuje slizniční i systémovou imunitu každého jedince pro zbytek života. Každá chyba v těchto prvotních kolonizačních procesech má za následek zvýšené riziko patologií postihujících imunitu, metabolismus a velmi pravděpodobně ovlivňuje i fyziologické funkce CNS. Střevní mikrobiotu ovlivňuje strava, kterou přijímáme, a to pozitivně i negativně se všemi důsledky pro zdraví. Podobné úvahy můžeme vést pro všechna mikrobiální společenství našeho těla [12–14].
Mikrobiota neovlivňuje člověka pouze přímo, ale je schopna interakcí s genetickým aparátem lidí. To se děje epigenetickými mechanismy, které ovládají několika způsoby transkripci lidských genů. Podstatné je, že mikrobiotou indukované epigenetické mechanismy se přenášejí i do dalších lidských generací. Z toho vyplývá, že pozitivní, ale i negativní vlivy mikrobioty a jejích působků ovlivní následující generace.
Mikrobi a člověk za patofyziologických podmínek
K dispozici máme obrovské množství vědeckých poznatků, které popisují změny mikrobioty střeva, ale i mikrobioty jiných tělních oddílů za různých patofyziologických situací. S použitím experimentálních zvířecích modelů je možné hledat příčinné souvislosti těchto změn. Vždy se však jedná pouze o modely, které vytrhují malý segment mikrobiálního osídlení z celkového kontextu. U člověka zatím nelze rozhodnout, zda popisované rozdíly v kvalitativním i kvantitativním složení mikrobioty nalézané u nemocných osob v porovnání se zdravými osobami jsou příčinou, či důsledkem. Je pro to mnoho důvodů, z nichž zdůrazníme fakt, že nemáme k dispozici údaje o tom, jaké je složení mikrobioty ve zdraví. Všechny studie jsou zatíženy proměnnými, které jsou spojeny s typem vyšetřovaných vzorků biologického materiálu, způsobem jejich odběru, technologií použitých k jejich analýze. Z těchto důvodů je obtížné generalizovat informace získané studiem mikrobiálních společenství za různých patofyziologických situací. Je prakticky nemožné se vyjádřit na individuální úrovni. Přesto je velmi dobré, že tyto studie probíhají. Jasně ukazují, že mikrobiální svět, vnitřní i vnější, představuje podstatnou součást našeho života [15].
Mikrobi, člověk a vnější svět
Jsme svědky dramaticky rychlé proměny životních podmínek člověka. V rámci přibližně tří generací je obrazně řečeno všechno jinak. Lidská společenství vyspělých zemí jsou extrémně urbanizovaná. Ztrácejí kontakt s přirozenými mikrobiálními podněty, jimž bylo lidstvo v minulosti vystaveno. Koncentrace obyvatel proměňuje vzory přenosu nejen patogenních mikroorganismů, ale i jiných mikrobů nutných pro optimální individuální vývoj člověka [3]. Vysoká úroveň sanitace a na druhé straně expozice mikrobiálním společenstvím v nepřirozeném životním prostředí zřejmě významným způsobem modifikují fyziologické funkce člověka. Vše můžeme dobře doložit na proměnách stravování. Strava byla až donedávna významným pozitivním podnětem nejen pro střevní mikrobiotu, protože obsahovala v převaze složky rostlinného původu. Byla charakterizována vysokým obsahem zdraví prospěšných mikroorganismů, které představují přirozené podněty MAMP (microbe‑associated molecular patterns) pro střevní epitelové buňky i slizniční a zprostředkovaně systémovou imunitu. Mohly samozřejmě obsahovat i patogenní mikroorganismy. Průmyslově vyráběné vysoce zpracované potraviny tyto přirozené podněty neposkytují. Musejí být totiž „bezpečné“. Cena za odstranění patogenních mikroorganismů je značná, protože výrobní postupy eliminují veškeré mikroorganismy. Strava člověka žijícího ve vyspělých zemích je programově těmito postupy „debacilována“. Naprosto zásadní a dosud prakticky nepopsanou změnu prodělávají mikroorganismy přírodního prostředí. Extrémní uvolňování xenobiotik, nanočástic, antibiotik a dalších chemických látek s velkou jistotou decimuje přirozená, evolučně složitě strukturovaná výhodná společenství mikroorganismů vnějšího světa. Jsou nahrazována nenormálními mikrobiálními společenstvími, která přinejmenším nebudou poskytovat člověku (lidstvu) evolučně potřebné podněty, pokud ho nebudou přímo ohrožovat [16].
Jsou studovány možnosti, jak promyšlenými zásahy do mikrobiálního světa zlepšit zdraví lidí a preventovat některé choroby. Je třeba doufat, že extrémní pokrok v diskutované oblasti bude lidem ku prospěchu [1].
Závěrem
Proměny našeho uvažování o vztahu mikroorganismů a člověka můžeme závěrem doložit na změně imunologického paradigmatu. Původní koncept schopnosti imunity odlišit mezi „vlastním“, které nevyvolá imunitní reakci, a „cizím“, které vyvolá imunitní reakci, bohatě dokumentovaný experimentálně, se zhruba před třiceti lety ukázal jako neudržitelný. I z klinické praxe víme, že za určitých podmínek může dojít k rozvinutí imunitní odpovědi na „vlastní“. Vždy jsme respektovali, i když bez pochopení, že „cizí“ v podobě fyziologického mikrobiálního osídlení těla imunitní odpověď nevyvolá. Postupně bylo prokázáno, že striktní odlišení mezi „vlastním“ a „cizím“ je charakteristickým rysem specifické (adaptivní) imunity. Uskutečňuje se prostřednictvím evolučně vysoce sofistikovaných receptorů TcR na T lymfocytech a receptorů BcR na B lymfocytech. Složky vrozené imunity a ve větší či menší míře všechny buněčné struktury těla jsou však vybaveny asi stovkou evolučně vysoce konzervovaných receptorů označovaných jako PRR (pattern recognition receptors). Jsou vyjádřeny na povrchu buněk, v cytoplazmě, organelách i rozptýleny v tělních tekutinách. Receptory PRR jsou schopny v rámci mikrobiálního světa identifikovat fundamentální molekulové vzory PAMP (pathogen‑associated molecular patterns) charakterizující invazi patogenních mikoroorganismů, reflektují však také přítomnost prospěšných mikrobiálních vzorů MAMP. Je podstatné, že prostřednictvím PRR naše tělo odliší rovněž mezi intaktními tělními strukturami, tj. vzory „bezpečí“, a vzory vnitřního „poškození“ vlastních struktur - DAMP (damage‑associated molecular patterns). Naše tělo jako celek, i když s vydatným podílem imunity, reaguje na přítomnost vzorů mikrobiální invaze PAMP a/nebo vzorů poškození DAMP komplexní zánětlivou reakcí. Její charakteristiky, intenzitu, dynamiku, trvání přesně odrážejí příčiny jejího vzniku s cílem obnovit homeodynamiku. Ze stručně naznačeného je jasné, že naše dosavadní představy o přesném oddělení vlastního a mikrobiálního světa jsou překonány. Člověk (lidstvo) se s mikrobiálním světem funkčně prolíná [3].
Tento výstup vznikl v rámci programu Cooperation, vědní oblast IMMU.
Literatura
[1] Aggarwal N, Kitano S, Puah GRY, et al. Microbiome and human health: current understanding, engineering, and enabling technologies. Chem Rev 2023; 123: 31–72.
[2] Sharma A, Gilbert JA. Microbial exposure and human health. Curr Opin Microbiol 2018; 44: 79–87.
[3] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016; http://www.imunologie‑cloveka‑krejsek.cz
[4] Weiss MC, Preiner M, Xavier JC, et al. The last universal common ancestor between ancient Earth chemistry and the onset of genetics. PLoS Genet 2018; 14: e1007518.
[5] Sitaraman R. Prokaryotic horizontal gene transfer within the human holobiont: ecological‑evolutionary inferences, implictions and possibilities. Microbiome 2018; 6: 163.
[6] Koonin EV, Wolf YI. Evolution of microbes and viruses: a paradigm shift in evolutionary biology? Front Cell Infect Microbiol 2012; 2: 119.
[7] Preiner M, Asche S, Becker S, et al. The future of origin of life research: bridging decades‑old divisions. Life (Basel) 2020; 10: 20.
[8] Pallen MJ, Telatin A, Oren A. The next milion names for Archaea and Bacteria. Trends Microbiol 2021; 29: 289–298.
[9] Murray AE, Freudenstein J, Gribaldo S, et al. Roadmap for naming uncultivated Archaea and Bacteria. Nature Microbiol 2020; 5: 987–994.
[10] Salvucci E. Microbiome, holobiont and the net of life. Crit Rev Microbiol 2016; 42: 485–494.
[11] Wan X, Yang Q, Wang X, et al. Isolation and cultivation of human gut microorganisms: a review. Microorganisms 2023; 11: 1080.
[12] Olmo BMG, Butler MJ, Barrientos RM. Evolution of the human diet and its impact on gut microbiota, immune responses, and brain health. Nutrients 2021; 13: 196.
[13] Jeyakumar T, Beauchemin N, Gros P. Impact of the microbiome on the human genome. Trends Parasitol 2019; 35: 809–821.
[14] Levy M, Thaiss ChA, Elinav E. Metagenomic cross‑talk: the regulatory interplay between immunogenomics and the microbiome. Genome Medicine 2015; 7: 120.
[15] Sorboni SG, Moghaddam HS, Jafarzadeh‑Esfehani R, et al. A comprehensive review on the role of the gut microbiome in human neurological disorders. Clin Microbiol Rev 2022; 35: e00338‑20.
[16] Gupta N, Yadav VK, Gacem A, et al. Deleterious effect of air pollution on human microbial community and bacterial flora: a short review. Int J Environmental Res Public Health 2022; 19: 15494.