Diabetes mellitus 1. typu a roztroušená skleróza: opomíjená asociace autoimunitních onemocnění
Souhrn:
Prázný M. Diabetes mellitus 1. typu a roztroušená skleróza: opomíjená asociace autoimunitních onemocnění. Remedia 2021; 31: 374–377.
Diabetes mellitus 1. typu (DM1) je autoimunitní onemocnění, které se často sdružuje s dalšími autoimunitně podmíněnými chorobami. Velmi častá je jeho asociace s autoimunitní tyreoiditidou, vitiligem, Addisonovou nemocí, atrofickou gastritidou nebo celiakií. Roztroušená skleróza (RS) je také autoimunitní onemocnění, ale o vzájemné souvislosti a sdruženém výskytu DM1 a RS se příliš nediskutuje. RS se totiž často asociuje s genotypy HLA (lidské leukocytární antigeny), které jsou naopak pro DM1 protektivní. Až nedávné studie ukazují na několikanásobně zvýšené riziko rozvoje RS zejména u pacientek s DM1. I když je tato asociace relativně vzácná, můžeme se s ní v klinické praxi setkat. Obě nemoci mají významný negativní vliv na kvalitu života pacientů, a proto je velmi dobrou zprávou, že v současné době existují kvalitní možnosti léčby DM1 založené na technologiích a v případě RS je optimální časné využití moderní biologické léčby. Používání moderních léčebných postupů vede u obou onemocnění ke snížení rizika komplikací, k prodloužení doby dožití, snazšímu návratu k běžným činnostem a k výraznému zlepšení kvality života pacientů.
Summary:
Prazny M. Type 1 diabetes mellitus and multiple sclerosis: a neglected association of autoimmune disorders. Remedia 2021; 31: 374–377.
Type 1 diabetes mellitus (DM1) is an autoimmune disease that often co‑occurs with other diseases based on autoimmunity. It is most frequently associated with autoimmune thyroiditis, vitiligo, Addison disease, atrophic gastritis and celiac disease. Multiple sclerosis (MS) is also an autoimmune disease but mutual association and co‑occurence of DM1 and MS is not discussed too much. MS is actually often associated with human leukocyte antigen (HLA) genotypes that are, by contrast, protective in DM1. Only recent studies have shown a manifold increase in MS risk particularly in patients with DM1. Even though this association is relatively rare, we can encounter it in clinical practice. Both diseases have significant negative influence on the quality of life of these patients. Therefore, it is a very good news that currently there are high‑quality treatment possibilities of DM1 based on technologies, and in the case of MS, early use of modern biologic treatment is optimal. Using modern treatment approaches leads to a decrease in the risk of complications for both diseases, to a prolongation of survival time, to an easier return to everyday activities and to a significant increase in the quality of life for patients.
Key words: type 1 diabetes mellitus, multiple sclerosis, autoimmune disease, continual glucose monitoring, hybrid closed loop.
Úvod
Diabetes mellitus 1. typu (DM1) je dlouho známé autoimunitní onemocnění, které ve svém důsledku vede k destrukci B buněk v Langerhansových ostrůvcích v pankreatu a k plné závislosti na inzulinu. DM1 tvoří asi 5 % všech případů pacientů s diabetem. Predispozice k DM1 je dědičná, zakódovaná v genech HLA (lidský leukocytární antigen, human leukocyte antigen) systému. Tyto geny jsou kódovány v lokusu hlavního histokompatibilního komplexu (major histocompatibility complex, MHC) na krátkém raménku 6. chromozomu (obr. 1).
Některé alely HLA genů II. třídy
jsou spojeny se zvýšeným rizikem vývoje DM1. V České
republice se jedná především o genotyp
DQA1*05 DQB1*0201/DQA1*03 DQB1*0302 [1]. Na druhou
stranu byly nalezeny i alely, které jsou spojovány
s protektivním působením na vznik onemocnění - například
DQB1*0602, DRB1*0403. Haplotypy asociované se zvýšeným rizikem,
či naopak snižující riziko výskytu autoimunitního diabetu se
však výrazně liší v závislosti na geografické poloze
a složení populace. Navíc bylo zjištěno, že kromě HLA
systému existuje ještě celá řada dalších lokusů ovlivňujících
rozvoj DM1 [2].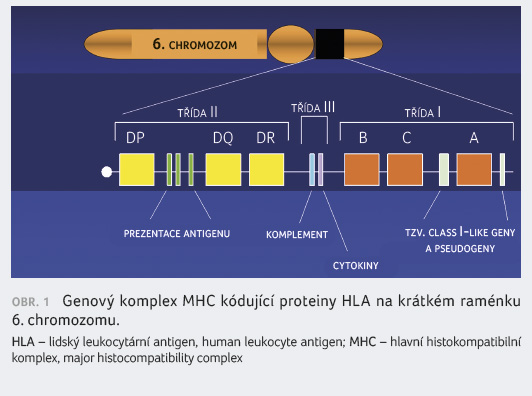
Mechanismus autoimunitní reakce je pro řadu autoimunitních onemocnění společný. Molekuly HLA II. třídy vážou peptidy, které vznikají proteolýzou tělu vlastních i cizorodých bílkovin. Avidita vazby je rozhodující v procesu klonální selekce při vývoji T lymfocytů v thymu. Negativní selekce probíhá u klonů, u nichž vzniká vysokoafinní vazba k danému antigenu, což má eliminovat autoreaktivitu. HLA molekuly kódované některými rizikovými alelami zejména genu HLA DQB1 (podjednotka β HLA II. třídy) mají modifikovaná vazebná místa pro antigen. Proto vážou antigen s afinitou střední až nízkou a daný lymfocytární klon není v thymu eliminován, dále se vyvíjí a po určité stimulaci spouštěcím faktorem (například virovým zánětem) se rozvine autoimunitní reakce. Samotné její spuštění a intenzitu procesu však mohou ovlivnit další geny lokalizované uvnitř i vně lokusu MHC [3,4].
Důležité je zmínit, že autoreaktivně se chovají B lymfocyty i T lymfocyty. Zatímco B lymfocyty tvoří autoprotilátky, na jejichž přítomnosti v séru je dnes založena diagnostika většiny autoimunitních onemocnění, cytotoxické T lymfocyty jsou vlastním efektorem destrukce cílových buněk. Destrukci B buněk autoimunitním zánětem, tzv. inzulitidu, lze dnes dobře predikovat pomocí stanovení autoprotilátek v séru. Perzistující pozitivita alespoň dvou specifických autoprotilátek proti autoantigenům B buněk je téměř jistým prediktorem rozvoje DM1 v následujících letech [5]. Efektivní prevence DM1 však zatím neexistuje, i když pomocí různých postupů a signálních molekul podílejících se na imunitní reakci organismu se již v klinických studiích podařilo nástup DM1 o několik měsíců oddálit. Přestože jsou interakce v rámci imunitního systému velice komplexní a složité, je jejich pochopení klíčové pro porozumění vzniku autoimunity a pro vyvinutí metod k prevenci autoimunitních onemocnění či k indukci anergie u již probíhajícího onemocnění.
Sdružená autoimunitní onemocnění
u diabetes mellitus 1. typu
Vlohy organismu k autoreaktivitě způsobují, že DM1 je často sdružen s dalšími autoimunitně podmíněnými poruchami endokrinních orgánů. Společně s DM1 se proto vyskytuje autoimunitní tyreoiditida či autoimunitní adrenalitida. Postiženy však mohou být i orgány neendokrinní – běžná je vyšší incidence atrofické gastritidy či glutenové enteropatie [6]. Poslední dvě jmenovaná onemocnění se též mohou podílet na malabsorpci a malnutrici, v klinické praxi se však s jejich metabolickými projevy, které by mohly mít dopad na průběh DM1, setkáváme zřídka. Bezesporu však mohou díky zvýšeným nárokům na nefarmakologická opatření (např. dieta při celiakii navíc k regulované stravě u pacienta s diabetem) zhoršovat kvalitu života nemocných.
Autoimunitní tyreoiditida je nejčastějším autoimunitním onemocněním vyskytujícím se současně s DM1. Prevalence sdruženého výskytu autoprotilátek se mírně liší podle geografických oblastí a podle věku pacientů, v období nástupu DM1 se většinou pohybuje mezi 8-25 %.
Addisonova choroba je dalším onemocněním, které se sdružuje s DM1. Vzniká na podkladě autoimunitní adrenalitidy. Rozvinuté onemocnění se projevuje nízkou plazmatickou koncentrací kortizolu a klinickými příznaky hypokortikalismu.
Celiakie je onemocnění spojené s permanentní intolerancí lepku, respektive jeho složek, které jsou obsaženy v obilovinách jako zásobní proteiny (prolaminy), u pšenice označovány názvem gliadiny. Celiakie je někdy řazena k autoimunitním onemocněním, byla prokázána její genetická vazba s některými haplotypy HLA DR3 a HLA DR4, u diabetiků v České republice je častá asociace s genotypem DQA1*05 DQB1*0201 [7]. Základním léčebným opatřením je zahájení bezglutenové (bezlepkové) diety - vyloučení všech potravin, k jejichž přípravě je použita mouka z pšenice, žita, ječmene i ovsa. Dodržování této bezlepkové diety je celoživotním opatřením. Po vyloučení glutenu z potravy dochází u nemocných s klasickou formou celiakie k remisi, ústupu obtíží a při vyšetření bioptických vzorků je prokázán normální histologický obraz. V období vzniku DM1 je popisována prevalence celiakie mezi 2,5-3 % pacientů.
Autoimunitní polyglandulární
syndromy
Zvláštní formou přidružených nemocí jsou autoimunitní polyglandulární syndromy (APS). V současné době rozeznáváme tři typy APS. Rozlišují se podle cílových orgánů autoimunitního zánětu, klinického průběhu onemocnění a typických přidružených onemocnění. Zatímco první typ APS má zcela unikátní postavení, protože je známa jeho příčina na molekulární úrovni, zbývající dva typy tohoto syndromu jsou v řadě aspektů podobné a jejich rozlišení nemusí být vždy jednoznačné.
APS 1 (také syndrom Whitakerův, Blizzardův či APECED – autoimmune polyendocrinopathy candidiasis ectodermal dystrophy) je onemocnění postihující nejen endokrinní žlázy, ale i neendokrinní orgány. Manifestuje se nejčastěji v dětském věku a v dalším průběhu onemocnění se klinický obraz mění a vyvíjí. Pro diagnózu APS 1 je rozhodující přítomnost alespoň dvou ze tří následujících poruch či onemocnění: chronické mukokutánní kandidózy, hypoparatyreózy a autoimunitní adrenalitidy s rizikem rozvoje hypokortikalismu. Dalšími častými sdruženými příznaky bývají dystrofie ektodermu (postihující zubní sklovinu a nehty), vitiligo, hypergonadotropní hypogonadismus a alopecie, může se vyskytnout i DM1, autoimunitní tyreoiditida, hypofyzitida či perniciózní anémie a chronická atrofická gastritida s přítomností autoprotilátek proti komponentám žaludeční sliznice [8]. Klinicky rozvinutý DM1 však není příliš častou součástí APS 1, vyskytuje se podle různých zdrojů pouze ve 2-12 % případů. Daleko častější bývá klinicky němá pozitivita protilátek proti ostrůvkovým buňkám, například u anti GAD až v 50 % případů. Mukokutánní kandidóza bývá nejčastěji prvním projevem APS 1 již v dětském věku, přičemž časný nástup prvního příznaku je spojován s těžším průběhem tohoto syndromu a s vysokou pravděpodobností rozvinutí více příznaků. Příčinou APS 1 je mutace genu AIRE 1 (autoimmune regulator), a APS 1 je tak jediným známým autoimunitním onemocněním, jehož dědičnost je monogenní a gen zodpovědný za poruchu imunity je lokalizován mimo region MHC. Mechanismus působení AIRE není zcela znám. Zatím nejpravděpodobnější je hypotéza, že AIRE funguje jako koaktivátor s nukleárním receptorem Nur77 exprimovaným v thymu a v nadledvinách. Je proto možné, že v thymu se systém AIRE Nur77 podílí na klonální deleci autoreaktivních T lymfocytů, zatímco v nadledvinách se podílí na řízení exprese enzymů steroidogeneze, které jsou také nejčastějším autoantigenem u APS 1.
APS 2 (podle postižených orgánů též syndrom Schmidtův nebo Carpenterův) je onemocnění projevující se přítomností autoimunitní Addisonovy choroby a DM1 nebo autoimunitní tyreoiditidy. Dalšími přidruženými poruchami mohou být vitiligo, hypogonadismus nebo perniciózní anémie. Nejčastěji začíná v dospělosti, ale může se projevit i v dětství nebo v adolescenci. Onemocnění je asi dvakrát častější u žen a je známa jeho asociace s HLA haplotypem DR3 a B8. APS 3 se projevuje porušenou funkcí štítné žlázy a současně dalším autoimunitním postižením s výjimkou Addisonovy choroby. Tento syndrom se částečně překrývá s APS 2.
Asociace diabetes mellitus 1. typu
a roztroušené sklerózy
DM1 a roztroušená skleróza (RS) jsou orgánově specifické choroby, které se liší klinickými projevy a patogenezí, obě se však řadí k autoimunitním onemocněním. Neurologické poruchy spojené s RS jsou důsledkem poškození myelinových obalů v centrálním nervovém systému a neuronů samotných. Na rozvoji RS se stejně jako v případě DM1 podílí genetická predispozice a vlivy prostředí, stejně tak se předpokládá i role infekčních agens. Obecně je vliv genetických faktorů u RS popsán s menší jistotou než u DM1. Příkladem může být i nedávná studie z Nizozemska, v níž byl prozkoumán rodokmen 48 pacientů s RS. U 24 pacientů byli nalezeni společní předci ve 14 generacích, nebyla popsána žádná asociace s DM1 nebo onemocněním štítné žlázy, stejně tak neměli statisticky významnou HLA predispozici [9]. Již dříve se vyskytly popisy sdruženého výskytu RS a DM1, většina pozorování však byla založena na kazuistikách, malých sériích pacientů nebo malých epidemiologických studiích omezených skromným počtem pacientů. Obecně byla tematika sdruženého výskytu DM1 a RS spíše opomíjena, protože haplotypy HLA nejčastěji asociované s RS (DRB1*15 DQA1*0102 DQB1*0602) jsou pro DM1 naopak protektivní [10].
I v případě RS a DM1 se ukazuje význam výzkumu prováděného na specifických populacích. Sardinie je právě takovým příkladem populace s omezenou genetickou heterogenitou. Překvapivě bylo zjištěno, že prevalence DM1 byla u sardinských pacientů s RS a u zdravých sourozenců v rodinách s RS významně vyšší než v běžné populaci [11]. Na Sardinii je ale RS asociována s haplotypy DRB1*0405 DQA1*0501 DQB1*0301 a DRB1*0301 DQA1*0501 DQB1*0201 a tyto již pro DM1 rizikové jsou, stejně jako pro tyreoiditidu a celiakii. Skutečně jsou obě naposledy zmíněná autoimunitní onemocnění na Sardinii častější.
Studie provedená v dánských registrech o několik let později rovněž ukazuje zvýšené riziko RS u pacientů s DM1 [12]. Ačkoliv byl absolutní počet nemocných s oběma chorobami nízký (11 pacientů s RS mezi více než 6 000 pacienty s DM1), statistická analýza ukázala významnou asociaci obou onemocnění. Pacienti s DM1 zde měli více než třikrát vyšší riziko rozvoje RS a příbuzní prvního stupně pacientů s RS měli o 40-60 % zvýšené relativní riziko pro rozvoj DM1, v závislosti na příbuznosti. Recentní studie stejného autora ukazuje, že podle dánských registrů je riziko RS více než dvojnásobné u potomků matek s pregestačním diabetes mellitus, ale nikoliv u matek s gestačním diabetem nebo u otců s diabetem [13].
Ve studii ze Spojených států amerických uvedla 2 % žen s DM1 a 0,5 % jejich sester jako další diagnózu RS [14]. U mužských probandů nebo sourozenců nebyly pozorovány žádné případy RS a v kontrolních rodinách RS zcela chyběla. Publikované míry prevalence RS se v USA pohybují od 0,06 do 0,17 % (v průměru 0,1 %) u dospělých žen. V případě studované populace se tedy jednalo o dvacetinásobný nárůst prevalence RS u pacientek s DM1. Jejich nediabetické sestry měly ve srovnání s běžnou populací riziko RS zvýšené pětinásobně, ale tento výsledek nebyl statisticky významný. Vzájemné sdružení DM1 a RS jistě vyžaduje další výzkum, nicméně je jisté, že případy pacientů s oběma chorobami můžeme v klinické praxi potkat a také se s nimi skutečně (naštěstí docela vzácně) setkáváme.
Management pacientů s diabetes
mellitus 1. typu a roztroušenou sklerózou
Jak přítomnost DM1, tak přítomnost RS má velmi negativní dopad na kvalitu života pacientů a přináší jim zvýšené nároky na péči o jejich onemocnění. Obtíže při dosahování uspokojivé kompenzace diabetu, nebo dokonce nemožnost uspokojivé kompenzace diabetu dosáhnout a obecně vysoké nároky na selfmanagement nemoci jsou běžně spojeny s velkou mírou psychické nepohody, kterou označujeme jako diabetický distres. Je jisté, že paralelní onemocnění RS, které dále zhoršuje kvalitu života vlivem řady neurologických symptomů, bude psychologický distres diabetika ještě více zhoršovat.
Z léčebného hlediska je proto velmi významný nedávný pokrok, kterého bylo v léčbě DM1 dosaženo. Léčba DM1 je založena na přesném dávkování inzulinu, které je pro pacienty nesmírně náročné. Nově přicházejí do klinické praxe diabetologa hybridní uzavřené okruhy pro automatické dávkování inzulinu, které spočívají ve vzájemném propojení glukózového senzoru a inzulinové pumpy. Pokročilý algoritmus pak dávkuje inzulin samostatně. Dávku inzulinu může v případě poklesu glykemie snížit nebo i zastavit, a naopak v případě vyšší glykemie dávku inzulinu zvýší. Algoritmus pouze vyžaduje oznámení o množství přijímaných sacharidů. Pacientům tak odpadá složité vypočítávání korekčních dávek inzulinu, aktivního inzulinu a inzulinu k jídlu. Čerstvé zkušenosti diabetologů s hybridními uzavřenými okruhy ukazují, že se jedná o léčbu vhodnou prakticky pro všechny pacienty s DM1, kteří jsou ochotni senzor a pumpu používat téměř denně. Při kontrolách pak běžně sdělují, že s menšími nároky dosahují snáze léčebných cílů.
Moderní léčba diabetu je však dostupná i pro pacienty, kteří z nějakých důvodů inzulinové pumpy používat nechtějí. Podle aktuálních doporučení pro léčbu DM1 by měl každý pacient používat kontinuální monitoraci glukózy pomocí senzorů, která je v České republice velmi dobře dostupná. Dále je možné a vhodné využívat moderních inzulinových analog, ať už se jedná o ultrarychle působící inzulin k jídlu, nebo naopak bazální inzuliny 2. generace, které mají dlouhodobý profil a vyrovnané působení s nižším rizikem hypoglykemie. Používání hybridních uzavřených okruhů pro dávkování inzulinu při kontinuální monitoraci glukózy vede ke snížení diabetického distresu a k výraznému zvýšení kvality života pacientů s DM1.
Rovněž v případě RS se zlepšují a rozšiřují možnosti léčby, která je komplexní a liší se podle stadia onemocnění. Pacienti mají být co nejdříve sledováni a léčeni ve vysoce specializovaných centrech. Dříve byla léčba RS založena především na imunosupresi, nověji se však ve farmakoterapii RS časně uplatňují moderní biologická léčiva s cílem co nejdéle prodloužit dobu bez příznaků a zhoršení, minimalizovat délku hospitalizace a umožnit pacientovi brzký návrat do života i pracovního procesu. I zde má pokrok v léčbě významný dopad na kvalitu života pacientů s RS.
Závěr
Kombinace diabetes mellitus 1. typu a roztroušené sklerózy je relativně vzácná, ale neměla by nás překvapit. V každém případě se jedná o dvě onemocnění, která - pokud nejsou optimálně léčena - mohou mít velmi závažné dopady na zdraví pacientů, pozdní komplikace, a zejména velmi negativní dopad na kvalitu života nemocných. Je dobrou zprávou, že se v případě obou onemocnění rozšiřují terapeutické možnosti a že zároveň používání těchto nových léčebných přístupů výrazně zvyšuje kvalitu života pacientů, snižuje výskyt komplikací a nutnost hospitalizací. Do budoucna je jistě nutno stimulovat další výzkum, který by měl být zacílen nejen na včasnou predikci, ale zejména na účinnou prevenci obou onemocnění. Vzhledem k tomu, že obě choroby mají imunopatologický podklad a interakce v imunitním systému jsou velmi komplexní, bude tento úkol jistě nelehký. O to důležitější je využívat všech možností, které máme již nyní, a léčit jimi naše pacienty včas.
Seznam použité literatury
- [1] Cinek O, Kolousková S, Snajderová M, et al. HLA class II genetic association of type I diabetes mellitus in Czech children. Pediatric Diabetes 2001; 2: 98−102.
- [2] Redondo MJ, Eisenbarth GS. Genetic control of autoimmunity in Type I diabetes and associated disorders. Diabetologia 2002; 45: 605−622.
- [3] Baker JR, et al. Endokrinní choroby. In: Stites DP, Terr AI (eds.). Základní a klinická imunologie. Praha: Victoria Publishing, 1994: 419429.
- [4] Fučíková T, et al. Klinická imunologie v praxi. 2. vydání. Praha: Galén, 1997: 143−146.
- [5] Verge CF, Gianani R, Kawasaki E, et al. Prediction of type I diabetes in first‑degree relatives using a combination of insulin, GAD, and ICA512bdc/IA‑2 autoantibodies. Diabetes 1996; 45: 926−933.
- [6] Prázný M, Škrha J, Límanová Z, et al. Screening for associated autoimmunity in type 1 diabetes mellitus with respect to diabetes control. Physiol Res 2005; 54: 4148.
- [7] Sumník Z, Kolousková S, Cinek O, et al. HLA‑DQA1*05‑DQB1*0201 positivity predisposes to coeliac disease in Czech diabetic children. Acta Paediatrica 2000; 89: 1426−1430.
- [8] Betterle C, Greggio NA, Volpato M. Clinical review 93: Autoimmune polyglandular sydrome type 1. J Clin Endocrinol Metab 1998; 83: 1049−1055.
- [9] Hoppenbrouwers IA, Pardo Cortes LM, Aulchenko YS, et al. Familial clustering of multiple sclerosis in a Dutch genetic isolate. Mult Scler 2007; 13: 17−24.
- [10] Lernmark A. Multiple sclerosis and type 1 diabetes: an unlikely alliance. Lancet 2002; 359: 1450−1451.
- [11] Marrosu MG, Cocco E, Lai M, et al. Patients with multiple sclerosis and risk of type 1 diabetes mellitus in Sardinia, Italy: a cohort study. Lancet 2002; 359: 1461−1465.
- [12] Nielsen NM, Westergaard T, Frisch M, et al. Type 1 diabetes and multiple sclerosis: A Danish population‑based cohort study. Arch Neurol 2006; 63: 1001−1004.
- [13] Nielsen NM, Gørtz S, Hjalgrim H, et al. Maternal diabetes and risk of multiple sclerosis in the offspring: A Danish nationwide register‑based cohort study. Mult Scler J 2020: 1352458520977120.
- [14] Dorman JS, Steenkiste AR, Burke JP, et al. Type 1 diabetes and multiple sclerosis: together at last. Diabetes Care 2003; 26: 3192−3193.