Diabetická neuropatie
Souhrn:
Krollová P, Malá Š, Pelechová B, Kvapil M. Diabetická neuropatie. Remedia 2018; 28: 229–234.
Diabetická neuropatie je jednou z nejčastějších komplikací diabetu. Přesná prevalence není známa, udává se rozmezí 25–90 %. Etiologie je multifaktoriální, dominantní vliv má hyperglykemie, resp. délka expozice hyperglykemii. Základním příznakem diabetické periferní senzitivní neuropatie jsou parestezie. Klinické příznaky kardiální autonomní neuropatie jsou chudé (ortostatická hypotenze, snížená tolerance námahy). Typickým projevem je klidová tachykardie, závažnou komplikací jsou maligní arytmie. Diagnosticky pomáhá vyšetření variability RR intervalu. Základem terapie a zároveň prevence rozvoje diabetické neuropatie je intenzifikace léčby diabetu s co nejlepší kompenzací. Většina současné medikamentózní terapie je pouze symptomatická, se zaměřením na zmírnění subjektivních obtíží. S ohledem na vysoký výskyt nežádoucích účinků je nutno při této léčbě postupovat racionálně. Jedinou současně dostupnou léčivou látkou s prokazatelným vlivem na patofyziologické procesy, které vedou k diabetické neuropatii, je kyselina thioktová.
Summary:
Krollova P, Mala S, Pelechova B, Kvapil M. Diabetic neuropathy. Remedia 2018; 28: 229–234.
Diabetic neuropathy is one of the most common complications of diabetes. Its exact prevalence is not known but is supposed to range between 25% and 90%. The etiology of diabetic neuropathy is multifactorial, with a dominant role played by hyperglycemia or length of exposure to hyperglycemia. The basic symptom of diabetic peripheral sensitive neuropathy is represented by paresthesias. Clinical symptoms and signs of cardiac autonomic neuropathy are scarce (orthostatic hypotension, reduced exercise tolerance). While resting tachycardia is a typical sign, malignant arrhythmia is a severe complication. Evaluation of RR interval variability may be helpful. The mainstay of diabetic neuropathy treatment and prevention of its development are both based on intensification of diabetes therapy, aiming at its optimal compensation. Most of the current pharmacotherapy is just symptomatic, alleviating the patient’s subjective complaints. This therapy has to be rational, given the high prevalence of pharmacotherapy side effects. Thioctic acid is the only available drug which clearly influences the pathophysiological processes behind diabetic neuropathy.
Key words: diabetes mellitus, diabetic neuropathy, diabetic cardiac autonomic neuropathy, thioctic acid.
Úvod
Diabetická neuropatie patří mezi nejčastější komplikace diabetes mellitus. Jedná se o typ neuropatie s nejvyšším výskytem v západním světě. Data o její prevalenci se v jednotlivých studiích značně rozcházejí, a to v rozmezí 25–90 %[1]. Tento rozdíl je dán odlišnými diagnostickými metodami a hlavně mírou vyšetřování diabetiků. Diabetická neuropatie se u nemocných manifestuje po různé době trvání diabetu. Neuropatie s poškozením tenkých vláken může diagnózu diabetes mellitus dokonce předcházet. Několik studií prokázalo asociaci prediabetu a diabetické neuropatie.
Diabetická neuropatie je nezánětlivé poškození struktury a funkce nervů. Morfologicky jde o axonopatii s primárním postižením distálních senzorických a autonomních vláken. Motorické axony a senzorická ganglia jsou postiženy až sekundárně. Na rozvoji se podílí i endoteliální dysfunkce s přestavbou vasa nervorum, která vede ke ztrátě nervových vláken [2].
Rozdělení diabetické neuropatie
Klinická manifestace diabetické neuropatie je značně
heterogenní [2,3]. To je dáno postižením různých částí
nervového systému [1], dle kterých lze diabetickou neuropatii
rozdělit do několika skupin (viz tab. 1). Mezi nejčastější formy patří
senzoricko motorická a autonomní neuropatie [1]. V běžné
klinické praxi je však třeba vždy zvažovat i možnost
výskytu ostatních typů při jakýchkoliv neurologických
příznacích pacienta.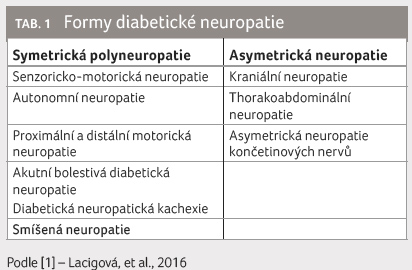
Pojem diabetická neuropatie často splývá s termínem
senzoricko motorická distální symetrická neuropatie, jejíž
prevalence dosahuje až 50 %. Většinou se manifestuje poruchou
senzitivity v oblasti nohou. Typickým rysem je skutečnost, že
rozložení na povrchu kůže nekopíruje dermatomy. Typická je
„ponožková“ lokalizace, obr. 1A–D [3]. Dalšími
projevy jsou subjektivní příznaky – parestezie nebo palčivé
a řezavé bolesti [3]. Při další progresi může dojít
k postižení motorických vláken, ke vzniku svalové
slabosti a k omezení hybnosti končetin. Tento typ
neuropatie je úzce spjat s rozvojem defektů dolních končetin
a s následnými zánětlivými změnami s poruc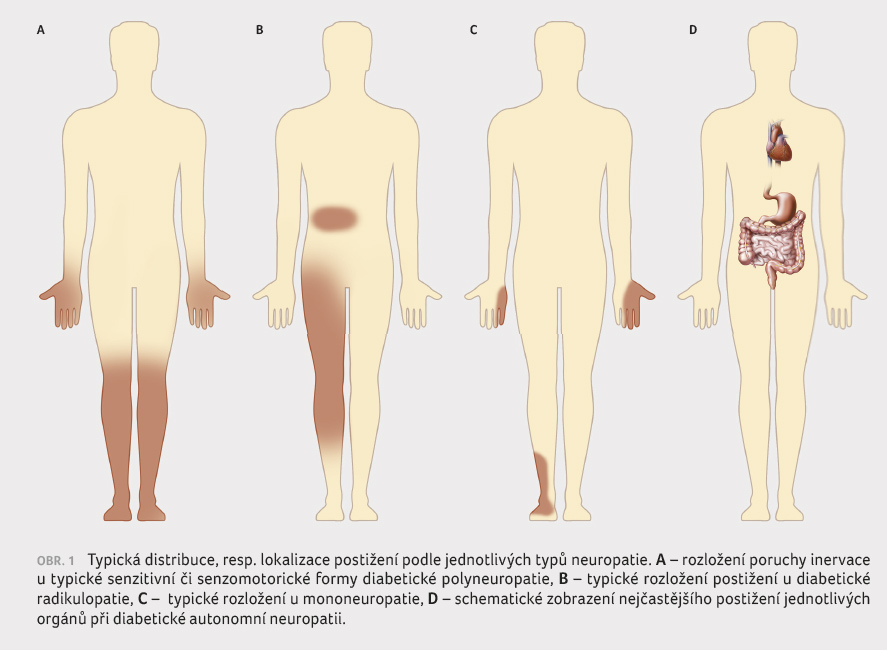 hou
integrity tkání, které mohou vést až k amputaci (syndrom
diabetické nohy).
hou
integrity tkání, které mohou vést až k amputaci (syndrom
diabetické nohy).
Autonomní neuropatie znamená postižení autonomního (vegetativního) nervového systému. Může postihovat inervaci jednoho orgánu i celých systémů, od čehož se odvíjejí klinické příznaky. Například postižení gastrointestinálního traktu se projevuje poruchami motility jícnu, žaludku a střev, průjmy, nebo naopak zácpami. U kardiálního systému jsou to např. ortostatická hypotenze, klidová tachykardie. Urogenitální postižení může vést k inkontinenci, močovým retencím či k sexuálním dysfunkcím [1].
Patofyziologie diabetické neuropatie
Patogeneze diabetické neuropatie je multifaktoriální [2,3]. Podílí se na ní jak narušení metabolických procesů, tak mikro i makrovaskulární poškození. Trvání a závažnost hyperglykemií (stav kompenzace diabetu) je základním prvkem ovlivňujícím vývoj diabetické neuropatie. Další rizikové faktory jsou stejné jako u vaskulárního poškození – dyslipidemie, obezita, hypertenze, kouření.
Jedním ze závažných nežádoucích účinků hyperglykemie je vystupňované uvolňování reaktivních forem kyslíku (reactive oxygen species, ROS) s následným zvýšením oxidačního stresu. Produkce ROS probíhá různými metabolickými cestami.
Vlivem hyperglykemie dochází k neenzymové glykaci proteinů s tvorbou pokročilých produktů glykace (advanced glycation products, AGE), které dalším působením snižují expresi endotelové NO syntázy a tvorbu prostacyklinů, zvyšují expresi endotelinu a cytoadhezivních molekul. Dochází k vazokonstrikci, ke spuštění zánětlivé reakce, ke zvýšení permeability cév a prokoagulační aktivity. Hyperglykemie je příčinou hromadění produktu alternativních metabolických cest – dochází tak k nadprodukci meziproduktů glykolýzy polyolovou, hexosaminovou a diacylglycerolovou cestou. Přímým důsledkem většího zatížení polyolové cesty je zvýšení produkce sorbitolu, jenž je osmoticky aktivní, jeho hromadění vede k porušení redoxní rovnováhy buněk a k jejich poškození. Hexosaminová cesta vede k nadprodukci difosfát N acetyl glukosaminu, k ovlivnění normální funkce buňky, k jejímu poškození a k nárůstu oxidačního stresu. Diacylglycerol ve zvýšené koncentraci aktivuje proteinkinázu C, která indukuje expresi řady růstových faktorů a ovlivňuje jejich účinky. Dále působí vazokonstrikci s následnou hypoxií nervových buněk a tvorbu ROS. Superoxid zpětně aktivuje proteinkinázu C. Při nadprodukci ROS selhávají přirozené antioxidační mechanismy a dochází k poškození endotelu a nervových vláken, což přispívá k rozvoji chronických komplikací diabetu.
Stanovení diagnózy
Jakkoliv je vždy naprostým základem klinického vyšetření, v případě diabetické neuropatie je odběr anamnézy skutečně klíčovým momentem pro stanovení diagnózy, případně pro vyslovení podezření na tuto diagnózu. Pro unifikaci a racionalizaci postupu se v současnosti používá několik typů dnes dostupných dotazníků zaměřených na diabetickou neuropatii. Senzitivita a specifita jsou sice nízké, ale pomáhají alespoň vyslovit podezření. Důležitá pro diagnózu diabetické neuropatie je přítomnost jednoho ze tří kritérií: klinické příznaky, objektivní nebo pozitivní nález při elektromyografickém vyšetření.
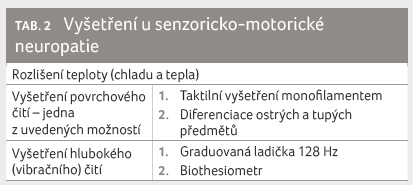 Podle platných doporučení České diabetologické společnosti
by mělo být minimálně jednou ročně provedeno u pacienta
s diabetes mellitus vyšetření nohou na senzoricko motorickou
neuropatii (tab. 2).
U pacientů s diabetes mellitus 2. typu ihned
po stanovení diagnózy, u pacientů s diabetes
mellitus 1. typu po pěti letech od manifestace [1].
Podle platných doporučení České diabetologické společnosti
by mělo být minimálně jednou ročně provedeno u pacienta
s diabetes mellitus vyšetření nohou na senzoricko motorickou
neuropatii (tab. 2).
U pacientů s diabetes mellitus 2. typu ihned
po stanovení diagnózy, u pacientů s diabetes
mellitus 1. typu po pěti letech od manifestace [1].
Vyšetření přítomnosti autonomní neuropatie se provádí u diabetiků s příznaky postižení jednotlivých systémů. Nemá výpovědní hodnotu u polymorbidních pacientů vzhledem k vysoké pravděpodobnosti působení dalších faktorů. Základní klinická vyšetření, která lze provést v ambulanci specialisty i praktického lékaře a jejichž patologické výsledky by mohly upozornit na přítomnost diabetické autonomní neuropatie, představují:
- objektivní vyšetření tepové frekvence cestou EKG nebo holterovské monitorace,
- test na sudomotorickou dysfunkci nohou pomocí speciálního proužku na jedno použití,
- reakce krevního tlaku na ortostázu.
Při pozitivitě nálezu je indikováno dovyšetření na specializovaném pracovišti. Dalšími diagnostickými metodami jsou vyhodnocení variability RR intervalu, reakce variability na jednotlivé manévry (hluboké dýchání, ortostáza, Valsalvův manévr) a reakce tlaku na ortostázu – vyšetření na nakloněné rovině. Mezi další specializované testy na autonomní neuropatii patří například vyšetření rychlosti vyprazdňování žaludku (scintigrafické), manometrické testy gastrointestinálního [4] a urologického traktu.
Diabetická neuropatie má mnoho forem často klinicky připomínajících jiná onemocnění. Jejich diagnostika je komplikovaná. Standardním postupem je diagnóza per exclusionem. Tedy diagnózu lze stanovit až po vyloučení jiných organických příčin poruchy funkce příslušného orgánu. Přitom je třeba zvážit, že určité formy nediabetických neuropatií se dokonce u pacientů s diabetes mellitus vyskytují častěji než v běžné populaci (např. neuropatie z nedostatku vitaminu B12 [metformin], chronická zánětlivá demyelinizační polyneuropatie). Při atypických příznacích (např. asymetrický nález na končetinách, rychlá progrese neuropatie, převaha motorických obtíží nebo dominující postižení proximální části končetin) je nutné doplnit podrobné neurologické vyšetření.
Specifické aspekty diabetické kardiální autonomní neuropatie
Kar diální autonomní neuropatie (KAN) je relativně opomíjenou
komplikací déletrvajícího diabetu. Jejím nejzávažnějším
důsledkem je zvýšené riziko maligních arytmií. Klinické
symptomy jsou obecně chudé, proto je u rizikové populace
(tab. 3) třeba
aktivně pátrat po příznacích KAN [1]. Prevalence není
zcela známá, opět, dle některých autorů, v definovaných
souborech dosahuje až 90 % [5–7].
diální autonomní neuropatie (KAN) je relativně opomíjenou
komplikací déletrvajícího diabetu. Jejím nejzávažnějším
důsledkem je zvýšené riziko maligních arytmií. Klinické
symptomy jsou obecně chudé, proto je u rizikové populace
(tab. 3) třeba
aktivně pátrat po příznacích KAN [1]. Prevalence není
zcela známá, opět, dle některých autorů, v definovaných
souborech dosahuje až 90 % [5–7].
V obecné rovině se příznaky diabetické neuropatie nejdříve manifestují na delších nervových vláknech, proto je prvním příznakem KAN postižení parasympatické inervace zprostředkované nervus vagus. Výsledkem je na jedné straně klidová tachykardie (převaha sympatiku), na straně druhé pak snížení variability RR intervalu (fyziologická variabilita je důsledkem trvalého vyrovnávání obou autonomních systémů). Po delším trvání dochází i k postižení sympatické inervace. Důsledkem je pak snížená schopnost adaptace oběhového systému na zátěž. Neuropatie postihuje také senzorickou inervaci, klinickým korelátem je asymptomatická ischemie, tedy „němý“ infarkt myokardu, či porucha vnímání hypoglykemie.
Subklinické formy KAN, které lze diagnostikovat pouze speciálními vyšetřeními, jsou obvykle asymptomatické. Příznaky plně vyvinuté KAN jsou zastoupeny v různém poměru, typická je klidová tachykardie a ortostatická hypotenze až synkopy. Dále se nemocní s klinicky závažnou formou KAN vyznačují pooperační oběhovou nestabilitou, zhoršenou reakcí oběhového systému na zátěž, zvýšenou únavností až pocity exhausce při cvičení, klidovou tachykardií a závratěmi.
Typickým korelátem KAN je snížení variability RR intervalu [6,8] a patologicky prodloužený korigovaný interval QT (> 420 ms), resp. jeho disperzita [9,10]. Změny depolarizace zřejmě kauzálně souvisejí se zvýšeným sklonem k maligní tachykardii [11]. Právě změny RR intervalu jsou jedním ze základních klinických diagnostických kritérií KAN, jež postuloval Ewing [12] a která se doposud používají jako referenční vyšetření. S ohledem na klinickou významnost a na skutečnost, že se pacienti s diabetem dožívají delšího věku, resp. „déle žijí se svou nemocí“, se problematika KAN dostává v současnosti do popředí zájmu [12,14]. Situace je o to naléhavější, že medicína má k dispozici pouze omezené možnosti terapeutické intervence.
DEKAN (Deutsche Kardiale Autonome Neuropathie Study) byla randomizovaná, dvojitě zaslepená a placebem kontrolovaná klinická studie, která hodnotila účinek čtyřměsíční léčby 800 mg kyseliny thioktové denně na srdeční variabilitu u pacientů s diabetes mellitus 2. typu a s přítomnou KAN [15]. Hodnocené parametry byly odvozeny od variace RR intervalu. S ohledem na velikost souboru (n = 39, resp. 34 osob) bylo statisticky významné zlepšení nalezeno pro část parametrů, u jiných byla zaznamenána zřetelná tendence ke zlepšení. Autoři na základě získaných výsledků uzavírají, že čtyřměsíční léčba perorální formou kyseliny thioktové může lehce pozitivně ovlivnit projevy KAN odvozené od variability RR intervalu.
Terapie diabetické neuropatie
S ohledem na patogenezi diabetické neuropatie by základem každé léčby a zároveň i prevence diabetické neuropatie měla být intenzifikace terapie diabetu se zlepšením kompenzace a v ideálním případě dosažení normoglykemie. V několika studiích byl prokázán signifikantní vliv těsné kompenzace na snížení rizika vzniku diabetické neuropatie – především u diabetiků 1. typu (studie DCCT, resp. EDIC). Důležitý je časný záchyt neuropatie s důkladnou edukací pacienta.
Většina léků používaných v dnešní době na diabetickou neuropatii představuje pouze terapii symptomatickou, používanou ke zmírnění neuropatických bolestí, případně parestezií. Jedinou alespoň částečně etiopatogeneticky působící terapií je v současnosti kyselina thioktová (alfa lipoová) [17].
Pro symptomatickou terapii senzoricko motorické neuropatie jsou doporučeny [1]:
- tricyklická a jiná antidepresiva (např. amitriptylin, duloxetin, venlafaxin, ad.),
- antikonvulziva (např. pregabalin, gabapentin),
- opioidy a opioidům podobná analgetika (např. tramadol, oxykodon, ad.),
- nefarmakologická terapie (např. fyzikální terapie, lokální terapie).
Symptomatická terapie autonomní neuropatie odpovídá postižení jednotlivých systémů [1]:
- kardiovaskulární systém – selektivní betablokátory, inhibitory angiotenzin konvertujícího enzymu (ACEI), bandáže dolních končetin, dostatek tekutin, fludrokortison, midodrin,
- gastrointestinální systém – prokinetika (např. metoklopramid), kodein, loperamid, ad.,
- potní žlázy – catapresan, oxybutinin.
Je nutné zdůraznit, že veškerá výše uvedená terapie je
pouze symptomatická. Není proto indikována pro konečné stadium
vývoje symptomatické periferní senzitivní diabetické neuropatie,
kdy pacient nic necítí, nemá ani parestezie. Efektivitu léčby je
z klinického pohledu nutno hodnotit v první řadě
na základě zmírnění subjektivních příznaků. Bohužel
terapie je často doprovázena řadou 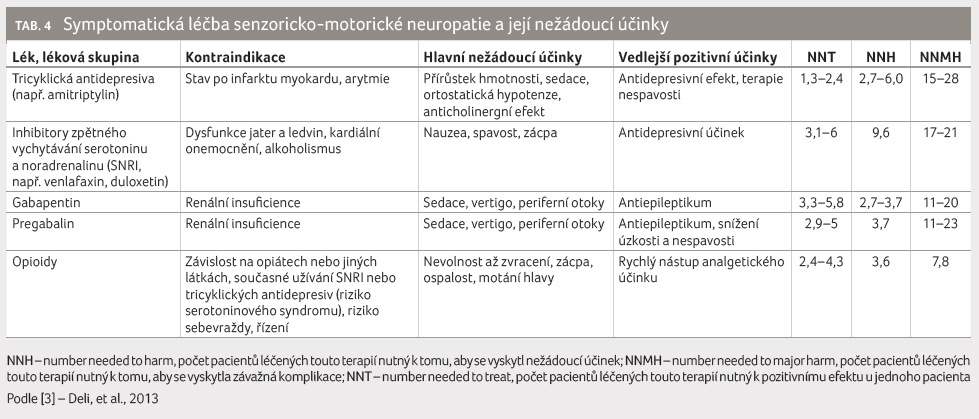 nežádoucích účinků (tab. 4), jakožto i relativně nízkou účinností.
nežádoucích účinků (tab. 4), jakožto i relativně nízkou účinností.
U všech výše uvedených léčiv je prokázán superiorní účinek v léčbě diabetické neuropatie v porovnání s placebem. Uvedená analýza však ukazuje velmi vysokou incidenci nežádoucích účinků, které se často svým výskytem na počet léčených pacientů vyrovnávají pozitivnímu efektu této léčby a někdy jej až překračují. Je proto nutné se vždy zamyslet nad volenou symptomatickou terapií, jejímž cílem je zlepšit kvalitu života pacienta, a volit ji striktně individuálně s případným důrazem na kontrolu rozvoje nežádoucích účinků, stejně jako rozvažovat reálný poměr subjektivního přínosu pro pacienta (který je odvozen od snížení intenzity subjektivních příznaků) k vyvolaným nežádoucím účinkům.
Kyselina thioktová v léčbě diabetické neuropatie
Významnou roli v rozvoji diabetické neuropatie hraje oxidační stres a zvýšená tvorba ROS [18]. Kyselina thioktová patří k účinným antioxidantům. V metaanalýze klinických studií zahrnujících 1 258 pacientů (ALADIN I, ALADIN III, SYDNEY, NATHAN II) byl jednoznačně prokázán efekt kyseliny thioktové (podávané po dobu tří týdnů v dávce 600 mg/den i.v.) na redukci neuropatické bolesti a necitlivosti. Největší pozitivní efekt byl právě u pacientů trpících pálivými bolestmi při senzoricko motorické neuropatii. Došlo nejen ke zmírnění symptomatických příznaků, ale i ke zlepšení fyzikálního nálezu při diagnostických vyšetřeních [19].
Studie NATHAN sledovala perorální terapii kyselinou thioktovou podávanou po dobu čtyř let v dávce 600 mg/den p.o. u 460 pacientů. Během této doby bylo prokázáno zlepšení hodnot NIS (neuropathic impairment score), především funkce svalů a tenkých nervových vláken [20].
Nežádoucí účinky terapie kyselinou thioktovou jsou velmi vzácné. Patří mezi ně alergická reakce, porucha chuti či dyspeptické obtíže. Ve zmíněných studiích nebyl jejich výskyt častější než při podávání placeba. Počet pacientů, kteří musejí být léčeni pro dosažení účinku (number needed to treat, NNT), byl sice trochu vyšší než při léčbě některými symptomatickými léky, ale s ohledem na bezpečnost užívání této terapie nejde o klinicky významný rozdíl.
Výzkum v terapii diabetické neuropatie se dále zaměřuje na ovlivnění patogeneze. Potenciální léčba zahrnuje zatím inhibitory aldózoreduktázy, růstové faktory i inhibitory proteinkinázy C. Terapie inhibitory aldózoreduktázy byla s ohledem na nežádoucí účinky zatím přerušena. Zdá se, že i přes nižší robustnost dat by kyselina thioktová u symptomatických pacientů mohla být léčbou volby [21].
Závěr
Diabetická neuropatie (především v podobě senzoricko motorické a autonomní neuropatie) je jednou z nejčastějších komplikací diabetu. Je nutno se proto zaměřit na její časnou diagnostiku, která by měla být součástí každoročního screeningu komplikací u pacientů s diabetem. Základem terapie a zároveň prevencí jejího rozvoje je intenzifikace léčby diabetu s co nejlepší kompenzací. Většina současné medikamentózní terapie je pouze symptomatická, se zaměřením na zmírnění subjektivních obtíží. S ohledem na vysoký výskyt nežádoucích účinků je nutno při této léčbě postupovat racionálně. Jediným současně dostupným lékem s efektem na patofyziologické procesy, které vedou k diabetické neuropatii, je kyselina thioktová, jež je účinným antioxidantem. Z osobních zkušeností s jejím užíváním na našem pracovišti můžeme potvrdit významný pozitivní efekt u celé škály pacientů s minimálním výskytem nežádoucích účinků.
Seznam použité literatury
- [1] Lacigová S, Ryšavý Z, Jirkovská A, Škrha J. Doporučený postup diagnostiky a léčby diabetické neuropatie (2016). Diabetologie, metabolismus, endokrinologie, výživa 2016; 19: 57−63.
- [2] Forbes JM, Cooper ME. Mechanisms of diabetic complications. Physiol Rev 2013; 93: 137−188.
- [3] Deli G, Bosnyak E, Pusch G, et al. Diabetic Neuropathies: Diagnosis and Management. Neuroendocrinology 2013; 98: 267−280.
- [4] Šťovíček J. Diabetes mellitus a gastrointestinální trakt – nové perspektivy. In Kvapil M. ed.: Diabetologie 2016. Praha: Triton, 2016; s. 234–238.
- [5] Maser RE, Lenhard MJ. Cardiovascular autonomic neuropathy due to diabetes mellitus: clinical manifestations, consequences, and treatment. J Clin Endocrinol Metab 2005; 90: 5896−5903.
- [6] Spallone V, Ziegler D, Freeman R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab Res Rev 2011; 27: 639−653.
- [7] Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: clinical manifestations and current treatments. Lancet Neurol 2012; 11: 521−534.
- [8] Spallone V, Bellavere F, Scionti L, et al. Diabetic Neuropathy Study Group of the Italian Society of Diabetology. Recommendations for the use of cardiovascular tests in diagnosing diabetic autonomic neuropathy. Nutr Metab Cardiovasc Dis 2011; 21: 69−78.
- [9] Stern K, Cho YH, Benitez‑Aquirre P, et al. QT interval, corrected for heart rate, is associated with HbA1c concentration and autonomic function in diabetes. Diabet Med 2016; 33: 1415−1421.
- [10] Kumhar MR, Agarwal TD, Singh VB, et al. Cardiac autonomic neuropathy and its correlation with QTc dispersion in type 2 diabetes. Indian Heart J 2000; 52: 421−426.
- [11] Pop‑Busui R. Cardiac autonomic neuropathy in diabetes: a clinical perspective. Diabetes Care 2010; 33: 434−441.
- [12] Ewing DJ, Martyn CN, Young RJ, Clarke BF. The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care 1985; 8: 491−498.
- [13] Pelechová B, Kvapil M. Kardiální autonomní neuropatie – klinické důsledky a možnosti terapie. Acta medicinae 2018; 7: 36−37.
- [14] Malá Š, Kvapil M. Význam kardiální autonomní neuropatie a hodnocení délky QT intervalu v její diagnostice. In Kvapil M. ed: Diabetologie 2018. Praha: Triton, 2018; s. 315–319.
- [15] Ziegler D, Schatz H, Conrad F, et al. Effects of treatment with the antioxidant alpha‑lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4‑month randomized controlled multicenter trial (DEKAN Study). Deutsche Kardiale Autonome Neuropathie. Diabetes Care 1997; 20: 369−373.
- [16] Rochette L, Ghibu S, Muresan A, Vergely C. Alpha‑lipoic acid: molecular mechanisms and therapeutic potential in diabetes. Can J Physiol Pharmacol 2015; 93: 1021−1027.
- [17] Callaghan BC, Little AA, Feldman EL, Hughes RA. Enhanced glucose control for preventing and treating diabetic neuropathy. Cochrane Database Syst Rev 2012; (6): CD007543.
- [18] Škrha J. Oxidační stres a jeho vztah ke komplikacím diabetu. Interní Med 2010; 12: 414−418.
- [19] Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with antioxidant α‑lipoic acid: A meta‑analysis. Diabet Med 2014; 21: 114−121.
- [20] Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with α‑lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes Care 2011; 34: 2054−2060.
- [21] Han T, Bai J, Liu W, Hu Y. A systematic review and meta‑analysis of α‑lipoic acid in the treatment of diabetic peripheral neuropathy. Eur J Endocrinol 2012; 167: 465−471.
- [22] Tesfaye S, Stevens LK, Stephenson JM, et al. Prevalence of diabetic peripheral neuropathy and its relation to glycaemic control and potential risk factors: the EURODIAB IDDM Complications Study. Diabetologia 1996; 39: 1377−1384.