Fosfomycin – staronové antibiotikum se širokým spektrem účinku, ale se záludnostmi v testování účinnosti in vitro
Souhrn
Adámková V, Kroneislová G. Fosfomycin – staronové antibiotikum se širokým spektrem účinku, ale se záludnostmi v testování účinnosti in vitro. Remedia 2023; 33: 92–96.
Fosfomycin je baktericidní antibiotikum, které inhibuje syntézu buněčné stěny grampozitivních i gramnegativních bakterií. Mechanismus je unikátní a předchází inhibici syntézy buněčné stěny betalaktamovými antibiotiky. Inhibice enzymu MurA zabrání biosyntéze peptidoglykanu již v prvním kroku. Přirozená rezistence je většinou dána mutací MurA. Získaná rezistence je nejčastěji způsobena modifikací membránových transportérů, které zabrání vstupu fosfomycinu do buňky, nebo ziskem plazmidově kódovaných genů pro inaktivaci fosfomycinu anebo opět mutací MurA. Metodou volby pro laboratorní stanovení citlivosti bakterií vůči fosfomycinu je agarová diluční metoda. Fosfomycin je klinicky dobře snášen, výborně proniká do tkání, nemá potenciál k selekci rezistentních mutant a je účinný i na multirezistentní kmeny grampozitivních i gramnegativních bakterií.
Klíčová slova: fosfomycin – rezistence – agarová diluční metoda – hypernatremie – antimikrobní stewardship.
Summary
Adamkova V, Kroneislova G. Fosfomycin – “new old” antibiotic with a wide spectrum of action but tricky characteristics concerning in vitro effectiveness testing. Remedia 2023; 33: 92–96.
Fosfomycin inhibits bacterial cell wall synthesis through a unique mechanism of action at a step prior to that inhibited by β‑lactams. It inhibits MurA, which initiates peptidoglycan biosynthesis of the bacterial cell wall of gram‑positive and gram‑negative bacteria. Inherent resistance to fosfomycin is mainly through MurA mutations. Acquired resistance involves modifications of membrane transporters that prevent fosfomycin from entering the bacterial cell, acquisition of plasmid‑encoded genes that inactivate fosfomycin, and MurA mutations. Agar dilution method gold standard method for susceptibility testing fosfomycin in vitro. Fosfomycin is an antibiotic with bactericidal activity, good tolerance, good tissue penetration, absence of induction of multidrug‑resistant microorganisms and activity against multidrug‑resistant gram‑positive and gram‑negative bacteria.
Key words: fosfomycin – resistance – agar dilution method – sodium overload – antimicrobial stewardship.
Úvod

Fosfomycin byl objeven již v roce 1969, kdy byl izolován z kultur Streptomyces fradiae, S. viridochromogenes a S. wedomorensis. Jedná se o derivát kyseliny fosforečné s velmi nízkou molekulovou hmotností (138 Da) [1]. Součástí molekuly fosfomycinu je unikátní epoxidová skupina, která je odpovědná za biologickou účinnost. V perorální formě je fosfomycin určen k léčbě nekomplikovaných močových infekcí vyvolaných citlivými kmeny bakterií, především Escherichia coli, včetně kmenů produkujících širokospektré betalaktamázy. Intravenózní forma má výrazně širší indikační možnosti (tab. 1) a lze ji podávat jak v monoterapii, tak v kombinaci s jinými antibiotiky. Spektrum účinku je uvedeno v tabulce 2 [2].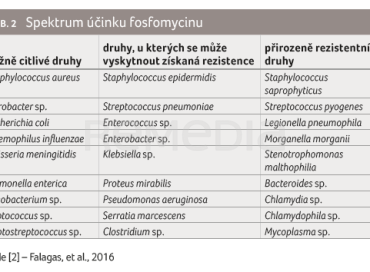
Mechanismus účinku
Fosfomycin proniká do bakteriální buňky dvěma různými transportními systémy, a to jednak pomocí L‑alfa‑glycerol‑3‑fosfátového (glycerol‑3‑phosphate transporter, GlpT), jednak pomocí glukóza‑6‑fosfátového transportéru (uptake of hexose phosphates transporter, UhpT), resp. molekula fosfomycinu imituje jak glycerol‑3‑fosfát, tak glukóza‑6‑fosfát, které se normálně přenášejí pomocí GlpT a UhpT, a indukuje jejich expresi. Cyklický adenosin monofosfát (cAMP) je zcela esenciální pro expresi genů obou transportních systémů. Účinek fosfomycinu je dán inhibicí syntézy peptidoglykanu cestou inhibice UDP‑N‑acetylglukosamin‑enolpyruvyl‑transferázy (MurA), jež se podílí na transportu enolpyruvylové části fosfofenolpyruvátu na 3‑hydroxylovou skupinu UDP‑N‑acetylglukosaminu, který je základním stavebním kamenem peptidoglykanu. Fosfomycin vytváří kovalentní vazbu s thiolovou skupinou cysteinu a inaktivuje aktivní místo MurA. Kromě přímé antibakteriální aktivity vykazuje fosfomycin též imunomodulační efekt alterací tumor nekrotizujícího faktoru alfa (TNFα), interleukinů a leukotrienů, dále snižuje přilnavost bakterií k epitelu dýchacích a močových cest [3,4].
Mechanismy přirozené rezistence
Inherentní rezistence k fosfomycinu je dána mutací genu MurA, kdy dochází k náhradě cysteinu aspartátem v aktivním místě MurA, což brání vazbě fosfomycinu na MurA. Dále byl popsán nový mechanismus rezistence, tzv. recyklační dráha při syntéze peptidoglykanu na místo jeho de novo syntézy u kmenů Pseudomonas aeruginosa a P. putida. Specifický vztah k fosfomycinu má Listeria monocytogenes, která in vitro vykazuje rezistenci, avšak in vivo je citlivá. In vitro nedokáže L. monocytogenes přijímat fosfomycin, ale in vivo nebo během infekce dochází k expresi glukóza‑6‑fosfát permeázy (hexose phosphates transporter, Hpt), která umožní vstup fosfomycinu do bakteriální buňky, a tímto se stává L. monocytogenes vnímavou vůči fosfomycinu. Nově popsaný gen abrp vede k čtyřnásobné redukci citlivosti Acinetobacter baumannii k fosfomycinu, stejně jako k tigecyklinu, tetracyklinům a chloramfenikolu. Gen je chromozomálně vázaný a vede ke snížení membránové permeability. Je esenciální pro bakteriální růst, jeho delece redukuje bakteriální růst o 17 % [5–7].
Mechanismy získané rezistence
Získaná rezistence je dána mnoha mechanismy a liší se u Pseudomonas aeruginosa a ostatních bakterií (tab. 3, 4) [8].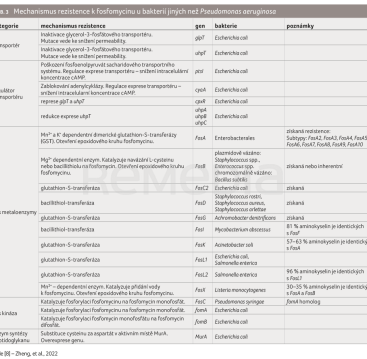
Změna fosfomycinových transportních mechanismů
Příčinou rezistence jsou v tomto případě chromozomální mutace strukturálních genů kódujících membránové transportéry GlpT a UhpT, které slouží k transportu glycerolu a ostatních látek důležitých pro metabolismus bakterie. Fosfomycin využívá pro vstup do buňky stejné transportní mechanismy, proto tato mutace vede k zablokování průniku fosfomycinu do bakteriální buňky. Alterace genů ptsI a cyaA vede k redukci intracelulární koncentrace cAMP, což má za následek nižší expresi GlpT a UhpT, a tím i snížený průnik fosfomycinu do buňky. Mutace genů ptsI a cyaA navíc také snižuje syntézu bakteriálních pilů, jejímž důsledkem je nižší adherence bakterií k epitelu močových cest, což by vysvětlovalo nízkou virulenci fosfomycin rezistentních kmenů v patogenezi močových infekcí [9,10].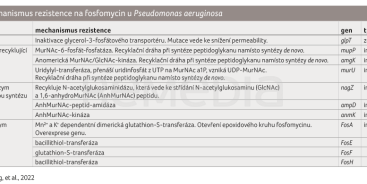
Alterace MurA
Mutace vedoucí k substituci cysteinu za aspartát na pozici 115 u Escherichia coli MurA má za následek změnu citlivosti k fosfomycinu z bakterie velmi dobře citlivé na bakterii vysoce rezistentní [11].
Modifikace molekuly fosfomycinu
Rezistence na fosfomycin může být dána i získáním plazmidově vázaných genů kódujících produkci enzymů inaktivujících molekulu antibiotika. Plazmidově vázané Fos enzymy náležejí k rodině glyoxaláz. Mechanismus byl poprvé popsán u glutathion‑S‑transferázy kódované FosA, přičemž tento enzym využívá ionty Mn2+ a K+ jako kofaktory. Glutathion‑S‑transferáza inaktivuje fosfomycin otevřením epoxidového kruhu a začleněním sulfhydrylové skupiny cysteinu na pozici C1 epoxidového kruhu. FosA se nachází u Pseudomonas sp., Acinetobacter sp. a Enterobacterales. FosB je z 38 % identický s FosA, ale na rozdíl od FosA je Mg2+ dependentní a jako donor thiolové skupiny využívá l‑cystein. Katalyzuje navázání l‑cysteinu nebo bacillithiolu k fosfomycinu, čímž dojde ke ztrátě baktericidních vlastností antibiotika. FosB je exprimován především u grampozitivních bakterií a je vázán buď plazmidově (u Staphylococcus sp., Enterococcus sp.), nebo chromozomálně u Bacillus subtilis. FosX je hydroláza z 30–35 % identická s FosA a FosB, je chromozomálně kódována a Mn2+ dependentní. FosX inaktivuje fosfomycin navázáním molekuly vody na C1 pozici fosfomycinu a otevřením epoxidového kruhu, podobně jako ostatní Fos enzymy.
Kinázy detekované u bakterií Streptomyces wedomorensis a S. fradiae, které produkují fosfomycin, se chrání před baktericidním účinkem fosfomycinu jeho fosforylací. Jsou kódovány geny fomA a fomB. Gen fomA katalyzuje fosforylaci fosfátové skupiny fosfomycinu na fosfomycin monofosfát a fomB konvertuje fosfomycin monofosfát na fosfomycin difosfát. Obě reakce jsou katalyzovány ATP a ionty Mg2+ [12–14].
Farmakokinetika a farmakodynamika parenterálního fosfomycinu
Farmakokinetika fosfomycinu je lineární. Po jednorázové intravenózní infuzi 4 g, resp. 8 g fosfomycinu podané mladým zdravým mužům činila maximální koncentrace v séru (cmax) přibližně 200 μg/ml, resp. 400 μg/ml. Biologický poločas eliminace byl přibližně 2 hodiny. U starších a/nebo kriticky nemocných mužů a žen byla po podání jednorázové intravenózní dávky 8 g fosfomycinu zjištěna průměrná hodnota cmax 350–380 μg/ml a biologický poločas eliminace činil 3,6–3,8 hodiny [15]. Distribuční objem je asi 273 ml/kg; plazmatická clearance asi 130 ml/kg/h. Vazba na plazmatické bílkoviny je velmi nízká.
Fosfomycin je dobře distribuován do tkání, vysokých koncentrací dosahuje v kostech, svalech, kůži, podkoží, plicní tkáni či žluči. Prochází přes placentu, avšak při pokusech na myších nevykazuje teratogenní účinky při dávkách odpovídajících doporučenému dávkování u člověka. V likvoru dosahuje až 50% koncentrace odpovídající sérové koncentraci.
Fosfomycin není metabolizován ani se neúčastní enterohepatálního oběhu. Až 90 % fosfomycinu je vyloučeno ledvinami v nezměněné biologicky aktivní formě. U pacientů s poruchou ledvin se prodlužuje biologický poločas, a proto je třeba úprava dávkování u pacientů s clearance kreatininu (CrCl) < 40 ml/min [2,15].
Dávkování

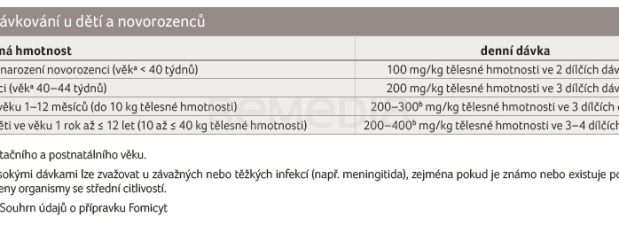
Denní dávka fosfomycinu se řídí indikací, závažností infekce a v neposlední řadě citlivostí původce. U dětské populace je nutné vzít v potaz i věk a tělesnou hmotnost. Doporučené dávkování pro dospělé, děti a pacienty se sníženou funkcí ledvin je uvedeno v 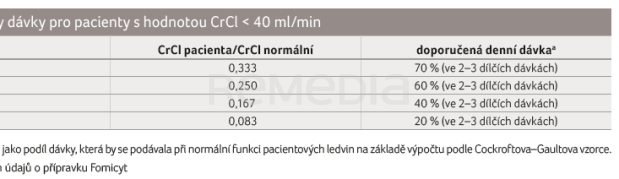 tabulkách 5–7 [16].
tabulkách 5–7 [16].
Nežádoucí účinky
Mezi nejčastější nežádoucí účinky patří erytematózní výsev vyrážky na kůži, a především porucha iontové rovnováhy, dále pak reakce v místě vpichu injekce, porucha chuti a gastrointestinální poruchy. K dalším významným nežádoucím účinkům patří anafylaktický šok, postantibiotická kolitida a pokles počtu leukocytů.
Hypokalemie může vyvolávat různé příznaky, např. slabost, únavu nebo otoky a/nebo svalové záškuby. Závažné formy mohou způsobovat hyporeflexii a srdeční arytmii. Hypernatremie může být spojována s žízní, zvýšeným krevním tlakem a známkami tekutinového přetížení. Závažné formy pak mohou vést ke zmatenosti, hyporeflexii, záchvatům či kómatu [16].
Laboratorní stanovení citlivosti

Klinické použití fosfomycinu vyžaduje in vitro testování citlivosti pro správnou kategorizaci ve výsledkovém listu. Disková difuzní metoda, jako nejčastěji používaná metoda stanovení citlivosti, ani bujonová diluční metoda (BDM), doporučovaná CLSI (Clinical and Laboratory Standards Institute), neposkytují v případě fosfomycinu správné výsledky. Proto pro stanovení minimální inhibiční koncentrace (MIC) je jako „zlatý standard“ doporučena agarová diluční metoda. V současné době je komerčně dostupný panel pro detekci MIC fosfomycinu založený na principu agarové diluční metody. Přesto mnoho laboratoří používá buď automatizované systémy stanovení MIC na principu BDM, nebo tzv. E‑testy. Porovnání jednotlivých metod vůči doporučené agarové diluční metodě přináší značné rozčarování a velký rozptyl ve výsledcích. Souhlasného výsledku v interpretaci „citlivý/rezistentní“ (categorical agreement, CA) s referenční metodou bylo u BDM dosaženo v 62,1 % testovaných kmenů a u E‑testů v 69,7 %; nesouhlasná interpretace ve smyslu hodnocení výsledku „rezistentní“, zatímco referenční metoda hodnotí nález jako „citlivý“, tedy major errors, dosahovala 8,5 % v případě obou porovnávaných metod a výsledek označený jako very major errors (VME), kdy referenční metoda hodnotí nález jako „rezistentní“ a ostatní metody jako „citlivý“, představoval u BDM 3,4 % a při E‑testu 13,8 %. Vysoký výskyt VME u E‑testu, jedné z nejpoužívanějších metod stanovení MIC v českých laboratořích, může vést k závažnému poškození pacienta a ohrozit ho na životě, protože mu bude podáno antibiotikum, na něž je původce infekce rezistentní [17]. Interpretační kritéria (breakpointy) pro hodnocení in vitro citlivosti k fosfomycinu jsou uvedena v tabulce 8. Pro Pseudomonas aeruginosa nejsou zatím tato kritéria stanovena, ale lze použít tzv. ECOFF (epidemiological cut‑off value), jehož hodnota je 256 mg/l [18].
Role fosfomycinu v antimikrobiálním stewardshipu
Narůstající rezistence bakterií na antimikrobní přípravky je alarmující, a proto jsou stále častěji využívány nástroje tzv. antimikrobního stewardshipu pro správné používání antibiotik s cílem omezit šíření rezistence, zajistit jejich dostupnost a nákladovou efektivitu.
Fosfomycin má unikátní mechanismus účinku, inhibice syntézy peptidoglykanu buněčné stěny jak proti grampozitivním, tak proti gramnegativním bakteriím. Zkřížená rezistence s ostatními antibiotiky je velmi vzácná a lze ho bezpečně kombinovat s jinými antibakteriálními přípravky, kde má synergický efekt. V kombinaci s nefrotoxickými antibiotiky vykazuje fosfomycin imunomodulační a nefroprotektivní efekt díky inhibici uvolnění histaminu z žírných buněk. Poměrně vysoká účinnost fosfomycinu v biofilmu mu dává příležitost u infekcí, jako je ventilátorová pneumonie či infekční komplikace u cystické fibrózy, kde tvorba biofilmu je jedním ze základních patogenetických mechanismů. Fosfomycin může být použit k léčbě infekcí, jako jsou perzistující bakteriemie, iniciální či sekvenční terapie infekcí kůže a měkkých tkání, nitrobřišních infekcí vyvolaných multirezistentními bakteriemi typu methicilin rezistentní Staphylococcus aureus (MRSA), vankomycin rezistentní enterokoky (VRE) a penicilin rezistentní Streptococcus pneumoniae (PRSP). Možnost použití fosfomycinu u multirezistentních grampozitivních bakterií namísto vankomycinu lze chápat i jako glykopeptid šetřící strategii. Podobně je možné využít fosfomycin i u gramnegativních bakterií místo karbapenemů, což opět spadá do kategorie antibiotikum šetřící strategie [19,20].
Závěr
Fosfomycin je baktericidní antibiotikum vyznačující se dobrou snášenlivostí a výborným průnikem do tkání. Má široké spektrum účinku jak na gramnegativní, tak na grampozitivní bakterie, včetně multirezistentních kmenů. Dále vykazuje nízký potenciál k selekci rezistentních mutant. Jeho role v programech antibiotického stewardshipu není ještě zcela etablována v našich podmínkách, neboť není tak dlouho komerčně dostupný a lékaři s ním zatím mají málo zkušeností. Nicméně je třeba zdůraznit, že zásadní problém, který může vyvstat, představuje falešná laboratorní necitlivost při použití jiných způsobů testování, než je doporučená agarová diluční metoda.
Literatura
[1] Hendlin D, Stapley EO, Jackson M, et al. Phosphonomycin, a new antibiotic produced by strains of streptomyces. Science 1969; 166: 122–123.
[2] Falagas ME, Vouloumanou EK, Samonis G, Vardakas KZ. Fosfomycin. Clin Microbiol Rev 2016; 29: 321–347.
[3] Saiprasad PV, Krishnaprasad K. Exploring the hidden potential of fosfomycin for the fight against severe Gram‑negative infections. Indian J Med Microbiol 2016; 34: 416–420.
[4] Bensen DC, Rodriguez S, Nix J, et al. Structure of MurA (UDP‑N‑acetylglucosamine enolpyruvyl transferase) from Vibrio fischeri in complex with substrate UDP‑N‑acetylglucosamine and the drug fosfomycin. Acta Crystallogr Sect F Struct Biol Cryst Commun 2012; 68: 382–385.
[5] Yokota S, Okabayashi T, Yoto Y, et al. Fosfomycin suppresses RS‑virus‑induced Streptococcus pneumoniae and Haemophilus influenzae adhesion to respiratory epithelial cells via the platelet‑activating factor receptor. FEMS Microbiol Lett 2010; 310: 84–90.
[6] Kumar S, Parvathi A, Hernandez RL, et al. Identification of a novel UDP‑N‑acetylglucosamine enolpyruvyl transferase (MurA) from Vibrio fischeri that confers high fosfomycin resistance in Escherichia coli. Arch Microbiol 2009; 191: 425–429.
[7] Gisin J, Schneider A, Nagele B, et al. A cell wall recycling shortcut that bypasses peptidoglycan de novo biosynthesis. Nat Chem Biol 2013; 9: 491–493.
[8] Zheng D, Bergen PJ, Landersdorfer CB, Hirsch EB. Differences in Fosfomycin Resistance Mechanisms between Pseudomonas aeruginosa and Enterobacterales. Antimicrob Agents Chemother 2022; 66: e0144621.
[9] Scortti M, Lacharme‑Lora L, Wagner M, et al. Coexpression of virulence and fosfomycin susceptibility in Listeria: molecular basis of an antimicrobial in vitro‑in vivo paradox. Nat Med 2006; 12: 515–517.
[10] Takahata S, Ida T, Hiraishi T, et al. Molecular mechanisms of fosfomycin resistance in clinical isolates of Escherichia coli. Int J Antimicrob Agents 2010; 35: 333–337.
[11] Marchese A, Gualco L, Debbia EA, et al. In vitro activity of fosfomycin against gram‑negative urinary pathogens and the biological cost of fosfomycin resistance. Int J Antimicrob Agents 2003; 22(Suppl 2): 53–59.
[12] Venkateswaran PS, Wu HC. Isolation and characterization of a phosphonomycin‑resistant mutant of Escherichia coli K‑12. J Bacteriol 1972; 110: 935–944.
[13] Pakhomova S, Rife CL, Armstrong RN, Newcomer ME. Structure of fosfomycin resistance protein FosA from transposon Tn2921. Protein Sci 2004; 13: 1260–1265.
[14] Kobayashi S, Kuzuyama T, Seto H. Characterization of the fomA and fomB gene products from Streptomyces wedmorensis, which confer fosfomycin resistance on Escherichia coli. Antimicrob Agents Chemother 2000; 44: 647–650.
[15] Monurol. Product Monograph Template. Dostupné na: https://paladin‑labs.com
[16] Souhrn údajů o přípravku Fomicyt 40 mg/ml inf plv sol 10×4g. Dostupné na: https://www.sukl.cz
[17] Smith EC, Brigman HV, Anderson JC, et al. Performance of Four Fosfomycin Susceptibility Testing Methods against an International Collection of Clinical Pseudomonas aeruginosa Isolates. J Clin Microbiol 2020; 58: e01121‑20.
[18] EUCAST (European Committee on Antimicrobial Susceptibility Testing) Breakpoint Tables. Dostupné na: https://www.eucast.org/clinical_breakpoints
[19] Kaye KS, Gales AC, Dubourg G. Old antibiotics for multidrug‑resistant pathogens: from in vitro activity to clinical outcomes. Int J Antimicrob Agents 2017; 49: 542–548.
[20] Yanagida C, Ito K, Komiya I, Horie T. Protective effect of fosfomycin on gentamicin‑induced lipid peroxidation of rat renal tissue. Chem Biol Interact 2004; 148: 139–147.