Gastrointestinální nežádoucí účinky protinádorové léčby
Chemoterapie a radioterapie patří v léčbě nádorového onemocnění k vysoce efektivním metodám, které ovšem mohou zároveň negativně působit na zdravou tkáň. K takovým nežádoucím účinkům patří poškození v oblasti zažívacího traktu. Pacient může mít nepříjemnou zkušenost s nauzeou, zvracením, s průjmy či s bolestí při mukozitidě. Moderní profylaktické metody významně snižují možnou toxicitu léčby. Základem ideální péče o nemocného je dobrá komunikace a pochopení mezi onkologem a pacientem.
Úvod
Nežádoucí účinky se mohou projevit po podání kteréhokoli léčiva. Cytostatika neselektivně inhibují buněčnou proliferaci, proto jsou nejčastější nežádoucí účinky těchto léčiv vázány na cytotoxický účinek chemoterapie v normálních proliferujících buňkách. Výskyt jiných, méně závažných nežádoucích účinků souvisí s chemickou strukturou cytostatika, se zvláštnostmi jeho mechanismu účinku, distribuce nebo vylučování. Občas se vyskytnou i zcela neobvyklé projevy toxicity, popisované jako kuriózní kazuistiky.
Podle frekvence výskytu rozeznáváme nežádoucí účinky pravidelné, časté a vzácné. Z jiného hlediska je lze dělit na objektivní a subjektivní, lokální a systémové. Užitečné je rozlišení podle časového faktoru, respektive podle doby, která uplyne od aplikace cytostatika.
Toxicita cytostatika nezávisí jen na jeho povaze, ale zejména na dávce, a to jak jednorázové, tak i kumulativní. Někdy mohou cytostatika těžce poškodit pacienta, pokud se zpomalí jejich vylučování (např. při nemocech jater nebo ledvin) nebo je-li inhibována jejich metabolická inaktivace. Mimoto existují i značné individuální rozdíly mezi nemocnými – stejná dávka léčiva způsobí rozdílné projevy toxicity u dvou různých pacientů [1].
Komplexní přístup a používání intenzivních léčebných režimů v současné onkologii výrazně zlepšilo výsledky léčby pacientů s nádorovým onemocněním, zároveň však přineslo i vyšší výskyt nežádoucích účinků. Toxické projevy léčby zasahující oblast zažívacího traktu patří mezi závažné a pacientem velmi negativně vnímané. Každý lékař pečující o onkologicky nemocného pacienta zohledňuje při volbě léčiva jeho terapeutický index (poměr mezi účinností přípravku a jeho toxicitou). Na jedné straně je to účinnost léku a na druhé straně jeho toxicita, které jsou tenkou lávkou, na níž klinický onkolog balancuje. Ve snaze zvýšit účinnost terapie dochází často k úpornému zvyšování dávky, jež však s sebou nese i toxické projevy a v dalším průběhu podávání chemoterapie znemožňuje. A naopak, ve snaze nezvyšovat toxicitu je cytostatická léčba velmi často poddávkována, a nemá tedy patřičnou účinnost [2].
Mukozitida
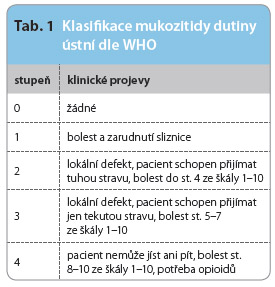
Inhibice proliferace buněk epitelu může postihnout kterýkoliv úsek trávicí trubice a vede ke snížení rychlosti obměny buněk. Nejčastějším klinickým projevem je mukozitida. Ta bývá doprovázena diskomfortem s bolestivostí úst, odmítáním potravy a rizikem rozvoje dalších komplikací. Rozvoj orální mukozitidy koreluje s fyziologickou obnovou sliznice, léze vznikají přibližně jeden týden po podání chemoterapie a ustupují po 14 dnech. Mitotická aktivita buněk je vyšší u mladších jedinců, proto je i výskyt mukozitidy u mladých jedinců častější [2]. K hodnocení závažnosti slouží řada skórovacích systémů, mezi nejčastěji používané patří hodnocení dle WHO (tab. 1).
Výsledkem narušení integrity epitelu dutiny ústní je možnost vstupu četných mikroorganismů, které kolonizují dutinu ústní, do celého organismu. Tak se dutina ústní může stát zdrojem sepse u granulopenických pacientů. Bakteriemii mohou způsobit viridující alfa-hemolytické streptokoky, pronikat mohou však i anaeroby, koaguláza-negativní stafylokoky (S. epidermidis) nebo gramnegativní tyčky (Klebsiella pneumoniae či Pseudomonas aeruginosa); kvasinky Candida sp. způsobí mykotickou infekci [3, 4]. Ulcerózní stomatitida může být komplikována xerostomií (snížené množství slin v ústech), jež vzniká účinkem cytostatik na slinné žlázy. Sliznice mohou být oteklé, někdy dochází ke kývání zubů, bolest může být tak silná, že vyžaduje i systémové podání opioidů. Častá je i mykotická superinfekce. Stejný nález může být i na sliznici jícnu.
Nejčastěji se ústní mukozitida objevuje u pacientů podstupujících vysokodávkovanou intenzivní chemoterapii před následnou alogenní nebo autologní transplantací krvetvorby (75–80 % pacientů), z toho se ve 25–60 % případů jedná o mukozitidu 3.–4. stupně dle klasifikace WHO [3, 5]. Při standardní chemoterapii je četnost výskytu závažných forem mukozitidy nižší (1–15 %).
Mezi riziková cytostatika poškozující sliznici patří zejména antimetabolity 5-fluorouracil a methotrexát. S mukozitidou se setkáváme i po léčbě taxany či antracykliny, avšak v menší míře. Riziko je ovlivněno použitým chemoterapeutickým režimem (druh cytostatika, jejich kombinace, dávka a způsob podání) a zvyšuje se s počtem aplikovaných cyklů a s předchozí epizodou mukozitidy [4, 6]. Výskyt mukozitidy můžeme očekávat také po radioterapii oblasti dutiny ústní a krku, často bývá spojena s xerostomií. Rozsah postiženého místa závisí na povrchu ozářené sliznice a frakcionaci, je nutno s ní počítat už při dávce přesahující 20 Gy [3, 5]. Kombinovaná chemoradioterapie nebo alterované frakcionační režimy zvyšují prevalenci, závažnost a trvání akutní mukozitidy. Léčba zářením je nejčastěji potencována platinovým derivátem. Mukozitida 3.–4. stupně byla popsána asi u 40 % těchto případů [5]. Mukozitida snižuje kvalitu života; snižuje až znemožňuje příjem potravy, a proto je důležité zaměřit se na její profylaxi a léčbu.
Profylakticky doporučujeme důslednou péči o hygienu dutiny ústní, vyplachování úst studeným fyziologickým roztokem; důležitá je péče o chrup, vynětí poškozeného chrupu před zahájením léčby, nepoužívání zubních náhrad. Strava musí být nedráždivá, spíše chladná nebo studená, samozřejmostí je doporučení nekouřit, nepít alkohol.
Léčba zahrnuje dostatečné zajištění hydratace, normalizaci vnitřního prostředí, výplachy anestetiky (lidokainem nebo trimekainem), u mírnějších forem je možnost podání pastilek s obsahem benzokainu (často v kombinaci s chlorhexidinem); lokálně je vhodné přikládat ledové obklady. Dostupné jsou i další protizánětlivé pastilky (např. s obsahem benzydaminu), spreje, lokální gely a roztoky ke kloktání. Bolest a suchost sliznice pomáhají odstranit také přípravky s viskózními základy, které vytvoří jemný film a působí mírně analgeticky.
V případě, že nemocný může přijímat alespoň tekutiny, podávají se nemocnému chlazené nápoje slámkou či formou popíjení po malých jednotlivých dávkách, tzv. sipping (srkání, upíjení). V některých případech je pacient odkázán na sondovou enterální, případně parenterální výživu. Nemocným s chemoterapií v konkomitanci s ozařováním oblasti hlavy a krku profylakticky zavádíme perkutánní gastrostomii, protože někteří nejsou schopni polykat ani sliny.
V případě neustupujících bolestí doplňujeme terapii o celkovou analgetickou léčbu (vhodný je slabý opioid tramadol, u silných bolestí pak morfin).
Léčba mukozitidy dále zahrnuje podávání lokálních či systémových antibiotik, v případě mykotické infekce pak antimykotik. Zásadní roli při hojení hraje kyselina hyaluronová [3, 7], která je jedním z nejdůležitějších glykoamino-
glykanů produkovaných fibroblasty v průběhu hojení defektů. Kyselina hyaluronová ovlivňuje zánětlivé procesy na základě uvolňování cytokinů a chemokinů, zháší volné kyslíkové radikály, ovlivňuje proliferaci a diferenciaci buněk, dokonce je popsáno i její analgetické působení [7]. Novinku na trhu v roce 2014 představuje přípravek, který je kombinací kyseliny hyaluronové s aminokyselinami (leucin, lysin, glycin, prolin), prekurzory kolagenu [4].
Zánět sliznice střevní a průjem
Citlivost sliznice střevní vůči působení cytostatik je ještě vyšší než citlivost sliznice dutiny ústní. Pacient má bolesti až křeče, trpí nadýmáním, motilita střeva je porušena. Stolice může být až vodnatá a s příměsí krve. Na zánětlivé změny probíhající ve střevech mohou nasednout bakteriální komplikace. Přidávají se další doprovodné symptomy: horečka, třesavka, zimnice, zvracení a další. V tenkém střevě může porucha plynulé obnovy epitelií způsobit malabsorpci.
Profylakticky se doporučuje v průběhu chemoterapie jíst lehká, nedráždivá, nekořeněná a nenadýmavá jídla, raději častěji a po menších množstvích. Nevhodné je velké množství vlákniny a zcela nevhodné je pití alkoholu a kouření. Základem léčby je úprava diety, zajištění hydratace, případně podání antibiotik.
Při ozařování malé pánve může vzniknout poškození endotelu cév ve střevní stěně, což v akutní fázi vede k vaskulárním infarktům s tvorbou ulcerací, v chronické fázi potom kvůli proliferaci vaziva k jizevnatým změnám.
V důsledku radiační proktitidy a kolitidy dominují zvýšené počty stolic, případně mírné průjmy, tenesmy (nutkavý pocit na stolici s defekací malého množství stolice nebo hlenu s krví). K vzácným, ale možným komplikacím patří profuzní průjmy nebo krvácení z konečníku. Frekvence takových závažnějších komplikací se pohybuje okolo 1–3 % v závislosti na použité modalitě léčby.
Míra výskytu chronických nežádoucích účinků je závislá na dávce záření, ale souvisí též s mírou radiační reakce a v raritních případech je určována genotypem jedince (u některých nemocných je horší tolerance radioterapie v důsledku insuficience enzymů a proteinů reparujících poškození DNA způsobené léčbou). Tyto nežádoucí účinky vznikají postupně a jsou jen těžce ovlivnitelné.
Chronické postižení střevní sliznice se objevuje nejčastěji v průběhu 24 měsíců po skončení léčby a u většiny pacientů dochází ke zlepšení až vymizení příznaků do dvou let. Při těžkém postižení však mohou příznaky přetrvávat až do konce života [8].
V akutní fázi se střevní potíže objevují ve druhé polovině léčby a odeznívají do dvou měsíců po jejím ukončení. Jsou zvládnutelné dietními a režimovými opatřeními, případně medikamentózní léčbou. Pokud počet stolic za den nepřesahuje osm a nejsou přítomny jiné rizikové faktory, doporučíme dietu s omezením podílu nestravitelných zbytků (hrubé vlákniny) – suchary, rýži, syrové banány (pro obsah draslíku) a další. Postupně přidáváme těstoviny, brambory nebo bramborové pyré, vařené maso. Vhodné nejsou mléčné potraviny, alkohol, tučná a smažená jídla, ovoce a zelenina, ovocné džusy, nadýmavé potraviny. Důležitý je dostatečný přísun tekutin, nejlépe čaje.
Střevní motilitu tlumíme loperamidem (v maximální denní dávce 16 mg). Při plynatosti se doporučuje užívat dimeticon nebo simeticon. Přípravky s obsahem smektitu, resp. diosmektitu, jsou vhodné u vodnatých průjmů, protože váží vodu a toxické i kvasné produkty. Dobrý efekt mohou prokázat i mukoprotektivní látky, které stimulují buněčnou regeneraci střevního epitelu, zvyšují produkci hlenu a stimulují slizniční makrofágy (např. sukralfát). V léčbě ulcerací radiační proktitidy užíváme čípky nebo klyzmata s mesalazinem, nálevy s trimekainem, metronidazolem, v těžších případech kortikoidy v čípku nebo topické kortikoidy v klyzmatu. Při intenzivním krvácení je možné použít antifibrinolytikum (acidum tranexamicum). Teleangiektazie ošetřujeme argonovou plazmakoagulací při opakovaných návštěvách [9].
Zácpa
Zácpa je při léčbě chemoterapií méně častou komplikací. U onkologických pacientů spíše souvisí s omezením pohybu a léčbou opioidy. Poruchy střevní pasáže mohou vznikat po aplikaci cytostatik s neurotoxickými vedlejšími účinky (vinka-alkaloidy – vinkristin, vinblastin; taxany – paklitaxel). Příčinou je porucha autonomní inervace způsobená účinkem těchto cytostatik na mikrotubuly.Pacient musí dodržovat dietní a režimová opatření, tedy přijímat dostatek tekutin, rozpustnou vlákninu, pokud možno mít i více pohybu. V případě podávání projímadel upřednostňujeme laktulózu a solná projímadla, eventuálně suppositoria glycerini, nevhodná jsou pak dráždivá kontaktní laxativa (pikosulfát, bisakodyl, sennové antrachinony).
Poškození jater a pankreatu
Cytostatika jsou metabolizována v játrech. Opakované cykly a kombinace chemoterapie mohou vyústit až v poškození jater, které je ale méně časté, než by se vzhledem k jejich klíčové úloze v metabolismu léčiv očekávalo [1]. Mírná elevace jaterních testů byla popsána po aplikaci většiny cytostatik. Tuková degenerace jater může být důsledkem léčby cisplatinou nebo L-asparaginázou, intrahepatální cholestázu může způsobit azathioprin. Chronická fibróza jater bez předchozí akutní léze může vzniknout i po aplikaci nízkých dávek cytostatika methotrexátu. Masivní nekrózu jaterní tkáně může vyvolat dakarbazin, výjimečně i vysoké dávky methotrexátu. Venookluzivní choroba je možnou komplikací objevující se po vysokých dávkách cytostatik používaných před transplantací kostní dřeně. Reverzibilní obraz sklerózující cholangitidy se vyskytuje po intraarteriální aplikaci cytostatik do a. hepatica. Riziko poškození jater je podstatně vyšší u nemocných se stávající jaterní chorobou. Projevy poškození jater mohou nastoupit až opožděně po týdnech až měsících.
Profylakticky doporučujeme dietu s omezením smažených pokrmů a eliminaci konzumace alkoholu. Je možné podpořit jaterní funkci podáním hepatoprotektiv. Poškození pankreatu bylo popsáno po podání azathioprinu a projevuje se jako akutní pankreatitida, výjimečně fokálně nekrotizující.
Nevolnost a zvracení
Nevolnost a zvracení patří k závažným nežádoucím účinkům léčby, protože jsou pacientem vnímány jako velmi nep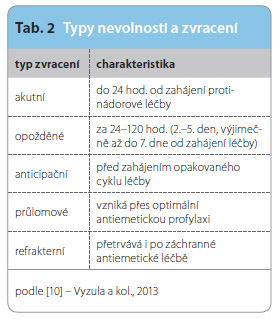 říjemné a někdy bývají důvodem odmítání další léčby.Vzhledem k časovému vztahu k chemoterapii rozlišujeme tři různé druhy zvracení (tab. 2). Naším cílem by měla být především prevence, nikoliv až léčba vzniklých potíží. Nevolnost a zvracení může přetrvávat ještě další 2–4 dny po skončení chemoterapie. Při opakovaných cyklech chemoterapie mají potíže spíše progresivní charakter. Nauzea je častější než zvracení a je hůře ovlivnitelná. Opožděné zvracení se častěji vyskytuje u nemocných, u nichž se objevilo i zvracení akutní. Prodělaná nevolnost a zvracení může být příčinou anticipačního zvracení, které je vlastně naučenou odpovědí na léčbu cytostatiky. K těmto projevům dochází v dalších cyklech již před vlastním podáním cytostatika nebo například jen při příchodu pacienta do nemocnice [10].
říjemné a někdy bývají důvodem odmítání další léčby.Vzhledem k časovému vztahu k chemoterapii rozlišujeme tři různé druhy zvracení (tab. 2). Naším cílem by měla být především prevence, nikoliv až léčba vzniklých potíží. Nevolnost a zvracení může přetrvávat ještě další 2–4 dny po skončení chemoterapie. Při opakovaných cyklech chemoterapie mají potíže spíše progresivní charakter. Nauzea je častější než zvracení a je hůře ovlivnitelná. Opožděné zvracení se častěji vyskytuje u nemocných, u nichž se objevilo i zvracení akutní. Prodělaná nevolnost a zvracení může být příčinou anticipačního zvracení, které je vlastně naučenou odpovědí na léčbu cytostatiky. K těmto projevům dochází v dalších cyklech již před vlastním podáním cytostatika nebo například jen při příchodu pacienta do nemocnice [10].
Emetogenita 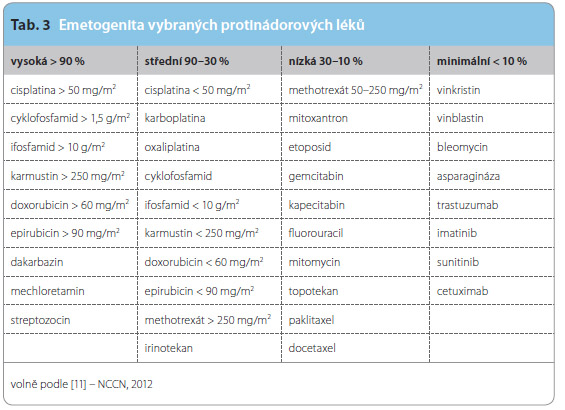 jednotlivých protinádorových léků se liší podle různých zdrojů, zde uvádíme verzi NCCN (National Comprehensive Cancer Network) z roku 2012 [11] (tab. 3).
jednotlivých protinádorových léků se liší podle různých zdrojů, zde uvádíme verzi NCCN (National Comprehensive Cancer Network) z roku 2012 [11] (tab. 3).
Je zajímavé, že zvýšené riziko zvracení se častěji vyskytuje u mladších pacientů, zejména u žen, a dále také u nemocných, kteří mají v anamnéze projevy kinetózy. Rizikovější je také úzkostný pacient a pacient s pokročilým nádorovým onemocněním s metastázami a kachexií.
Naopak nižší výskyt je pozorován u starších pacientů a také u osob s vysokou konzumací alkoholu [12].
Tab. 4 uvádí základní přehled používaných antiemetik. V současné době je doporučováno profylaktické podávání antiemetik všem nemocným 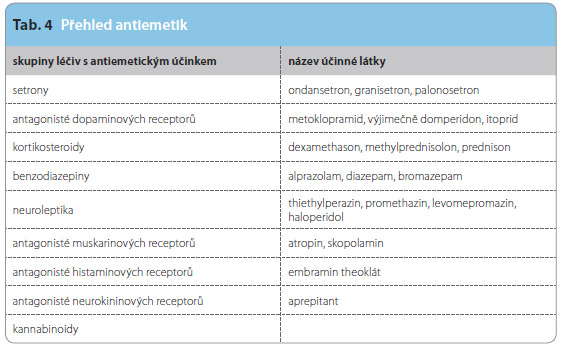 s chemoterapií s rizikem vysoké a střední emetogenity. Algoritmus jejich výběru a doporučené dávkování shrnuje tab. 5.
s chemoterapií s rizikem vysoké a střední emetogenity. Algoritmus jejich výběru a doporučené dávkování shrnuje tab. 5.
Nejúčinnějšími léčivy pro profylaxi i léčbu akutního zvracení jsou blokátory receptorů 5-HT3, tzv. setronová antiemetika. Používají se v profylaxi akutní emeze i u nejvíce emetogenních režimů. Stejnou účinnost má jejich podání jak cestou intravenózní, tak i perorální.
Novějším antiemetikem je palonosetron, účinný, vysoce selektivní antagonista receptorů 5-HT3. Je indikován pro prevenci akutní nauzey a zvracení při vysoce emetogenní chemoterapii nádorů u dospělých a pro prevenci nauzey a zvracení při středně emetogenní chemoterapii nádorů u dospělých.Účine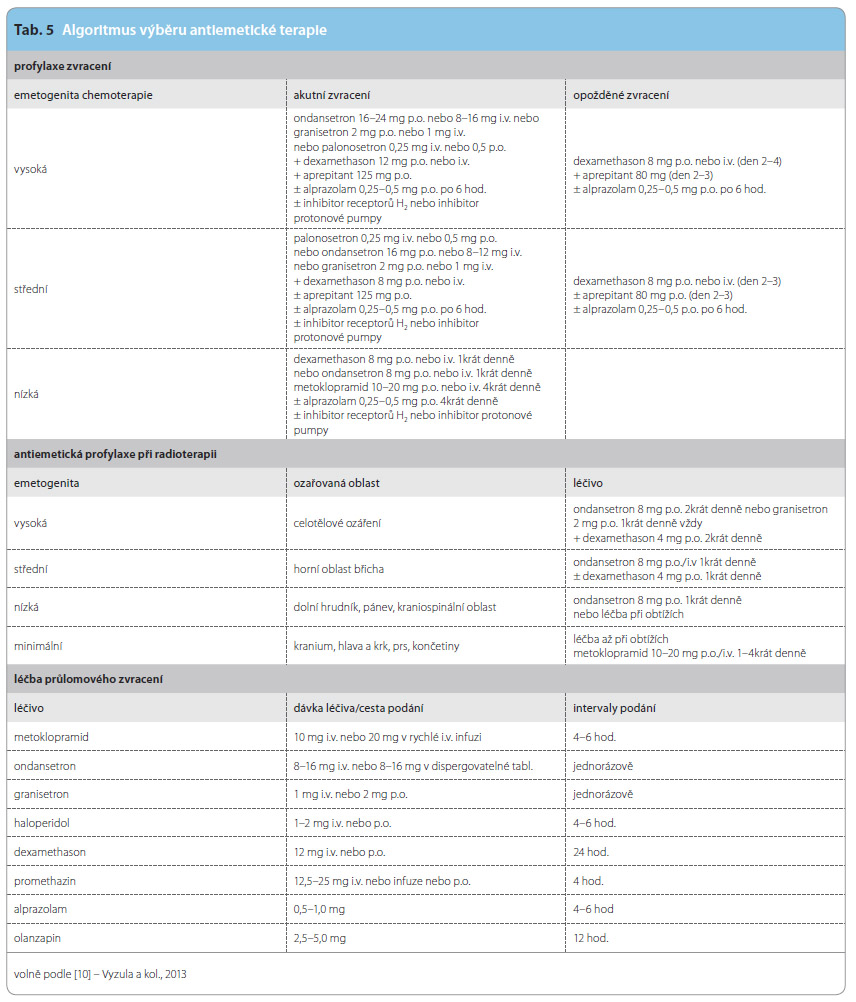 k setronů může být zesílen podáním kortikosteroidů, zejména dexamethasonu v dávce 8–20 mg 1krát denně. Kortikosteroidy mají samostatný antiemetický efekt i u tzv. opožděného zvracení, které se dostavuje v období 2–7 dní po ukončení chemoterapie. Léčba může být doplněna prokinetiky, používá se zejména metoklopramid, který má periferní i centrální účinky. Metoklopramid není vhodné kombinovat s thiethylperazinem a dalšími fenothiaziny pro riziko vzniku extrapyramidových příznaků. Itoprid aktivuje gastrointestinální propulzní motilitu antagonistickým účinkem na periferní dopaminové D2 receptory a inhibicí acetylcholinesterázy, má i účinek antiemetický.
k setronů může být zesílen podáním kortikosteroidů, zejména dexamethasonu v dávce 8–20 mg 1krát denně. Kortikosteroidy mají samostatný antiemetický efekt i u tzv. opožděného zvracení, které se dostavuje v období 2–7 dní po ukončení chemoterapie. Léčba může být doplněna prokinetiky, používá se zejména metoklopramid, který má periferní i centrální účinky. Metoklopramid není vhodné kombinovat s thiethylperazinem a dalšími fenothiaziny pro riziko vzniku extrapyramidových příznaků. Itoprid aktivuje gastrointestinální propulzní motilitu antagonistickým účinkem na periferní dopaminové D2 receptory a inhibicí acetylcholinesterázy, má i účinek antiemetický.
Mezi novější antiemetika dále patří aprepitant, selektivní antagonista s vysokou afinitou pro neurokininové receptory 1 lidské substance P. Aprepitant je indikován v prevenci akutní a pozdní nevolnosti a zvracení u dospělých v souvislosti s vysoce emetogenní protinádorovou chemoterapií založenou na bázi cisplatiny a v prevenci nevolnosti a zvracení u dospělých v souvislosti se středně emetogenní protinádorovou chemoterapií.
Aprepitant i palonosetron zlepšují kontrolu zvracení po vysoce i středně emetogenní chemoterapii, ale náklady na tuto léčbu jsou podstatně vyšší, což ovlivňuje podmínky úhrady zdravotními pojišťovnami [10].Léčba již vzniklého anticipačního zvracení je velmi obtížná, dokonce se může podáním antiemetik (včetně setronů) i zhoršit. Doporučen je alprazolam v počáteční dávce 0,5 mg 3–4krát denně. Úspěch může přinést behaviorální terapie (hypnóza). V některých případech je možno anticipační zvracení zmírnit malými dávkami dalších benzodiazepinů [12]; kromě zmiňovaného alprazolamu podáváme například diazepam či bromazepam.Nežádoucí účinky antiemetik jsou mírné, zahrnují bolest hlavy nebo zácpu. Při léčbě dexamethasonem je nutno zvažovat zejména jejich imunosupresivní působení a riziko zvýšené glykemie. Pacientům s hyperglykemií (> 10 mml/l nalačno) je třeba doporučit diabetickou dietu, dále eventuálně aplikaci inzulinu, volit snížené dávky dexamethasonu a při vícedenní kortikoterapii zvažovat podání perorálních antidiabetik. Lékař by měl vždy zhodnotit, zda zvracení nemá jinou příčinu – např. nádorové postižení střeva, mozkové metastázy, elektrolytové poruchy, gastroparézu, léčbu opioidy a jiné.
Nedostatečný příjem potravy
S mukozitidou, nevolností a zvracením může souviset i nedostatečný příjem stravy. V průběhu chemoterapie není žádoucí měnit stravovací návyky. Pacient by měl přijímat lehkou a dobře stravitelnou potravu, jíst menší porce vícekrát za den, nekonzumovat přepálené tuky, příliš tučnou stravu, nejíst nadýmavá jídla. Pacient by neměl pít alkohol, měl by mít dostatečný přísun tekutin. Často bývá lépe snášena studená strava a chladné nápoje. V den aplikace chemoterapie není nutné hladovět, je možné posnídat lehkou snídani. Důležitá je i duševní pohoda při jídle a po jídle je dobré zůstat chvíli v klidu vsedě nebo vleže. Samotná nutriční intervence musí být prováděna systematicky a někdy i dlouhodobě. Nutriční podpora může zlepšit celkový výsledek onkologické léčby, ale má-li být účinná, musí být indikována včas. Kde nemůžeme nutriční potřebu nahradit jen úpravou stravování a dietní radou, je namístě použití nutriční podpory formou sippingu. V současné době je na trhu řada výrobků s různým složením a příchutěmi. Nutriční podpora není jen otázkou kvantity, ale také kvalitativního složení a vedle nutričního vlivu má i významný účinek metabolický a farmakologický [13]. Cílem je zlepšení proteinové rovnováhy a imunitní odpovědi, zvýšení citlivosti pacienta k chemoterapii a radioterapii. Největší pokrok byl učiněn využitím glutaminu, argininu, mastných kyselin ω-3 a fermentované vlákniny [14]. V průběhu chemoterapie doporučujeme pacientům „obětovat“ některou příchuť sippingu, aby k ní pak neměli averzi.
Závěr
Nežádoucí účinky onkologické léčby představují závažnou komplikaci, která zvyšuje morbiditu a mortalitu onkologického pacienta a zvyšuje celkové finanční náklady na léčbu. Zásadní je prevence a včasná léčba již vzniklých symptomů.
Seznam použité literatury
- [1] Klener P. Protinádorová chemoterapie. Praha, Galén, 1996, 169–170.
- [2] Vorlíček J, Vyzula R, Adam Z. Praktická onkologie, vybrané kapitoly. Praha, Grada Publishing, 2000, 17–25.
- [3] Hynková L, Šlampa P, Červená R, et al. Mukozitida dutiny ústní u onkologických pacientů. Remedia 2012; 22: 26–30.
- [4] Ševčíková E. Mukozitida dutiny ústní u onkologických pacientů. In: Svoboda M, Kozáková Š, Vyzula R. Nové léky v onkologické praxi, 1. vydání, Praha, Ambit media a.s., 2013, 93–96.
- [5] Peterson DE, Lalla RV. Oral mucositis. The new paradigma. Curr Opin Oncol 2010; 22: 318–322.
- [6] Kostler WJ, Hejna M, Wenzel C. Oral mucositis complicating chemotherapy and /or radiotherapy: options for prevention and treatment. CA Cancer J Clin 2001; 51: 290–315.
- [7] Vokurka S. Oral and gastrointestinal mucositis in patients after chemotherapy – review. Klin Onkol 2007; 20: 23–28.
- [8] Kubeš J. Postavení radioterapie v léčbě karcinomu prostaty. Postgrad Med 2010; 3: 300–304.
- [9] Šachlová M. Gastrointestinální slizniční toxicita po radioterapii karcinomu prostaty. Urolog pro Praxi 2011; 12: 203–207.
- [10] Vyzula R a kol. Modrá kniha České onkologické společnosti, Brno, Masarykův onkologický ústav, 2013, 172–178.
- [11] National Comprehensive Cancer Network: Practice Guidelines in Oncology, version 1. 2012: Antiemesis.
- [12] Tomíška M. Antiemetická profylaxe chemoterapií indukované nevolnosti a zvracení. Remedia 2011; 21: 441–447.
- [13] Zadák T. Výživa v onkologii. Brevíř 2012/2013. Medical Tribune 2013, 449.
- [14] Ganze A. New perspective for nutritional support of cancer patients: Enteral/parenteral nutrition. Exp Ther Med 2011; 2: 675–684.