Hypoglykémie – důležitý fenomén moderní léčby diabetu mellitu
Škrha J. Hypoglykémie – důležitý fenomén moderní léčby diabetu mellitu. Remedia 2008; 18: S34–S41.
Hypoglykémie je závažnou abnormalitou při léčbě diabetu, která vyvolává syndrom nepoznané hypoglykémie, zvýšení glykemického prahu a defektní kontraregulaci. Je tudíž nežádoucím fenoménem při dosahování co nejlepší kompenzace diabetu. Vedle základních hypoglykemizujících antidiabetik je třeba pamatovat na lékové interakce při kombinaci farmak s perorálními antidiabetiky a dále na další léky vyvolávající hypoglykémie. Cílem moderní léčby diabetu je předcházet hypoglykémiím.
Úvod
Hypoglykémie je jednak laboratorní hodnotou vyjadřující sníženou koncentraci glukózy v krvi, jednak znamená rozmanitou klinickou symptomatologii od zcela mírných příznaků až po hlubokou poruchu vědomí. Hypoglykémie může být tudíž drobnou odchylkou, kterou nositel nevnímá, ale na druhé straně i závažnou poruchou ohrožující život. Tím se významně odlišuje od hyperglykémie, s níž diabetik žije řadu let, aniž by mu působila větší subjektivní 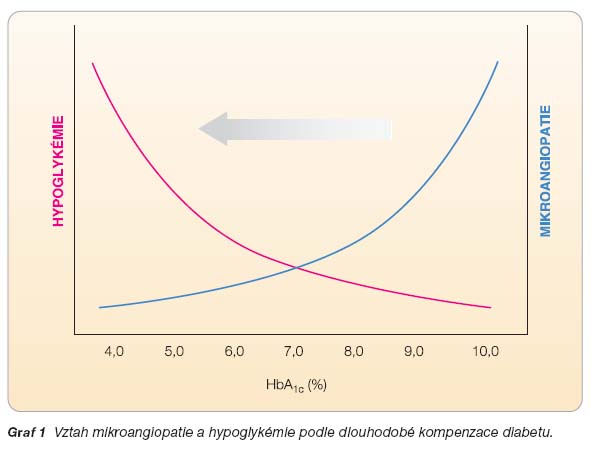 potíže, ale která vede později k chronickým komplikacím. Současné moderní trendy přinesly v diabetologii řadu důkazů, že dlouhodobě neuspokojivá kompenzace je pro diabetika nežádoucí, neboť podmiňuje vývoj diabetických cévních změn. Na druhé straně však úsilí o co nejlepší kompenzaci diabetu vede k častějším hypoglykemickým epizodám. Proto časné a správné odhalení hypoglykémie, a zejména volba vhodných opatření mají v klinické praxi prvořadý význam [1].
potíže, ale která vede později k chronickým komplikacím. Současné moderní trendy přinesly v diabetologii řadu důkazů, že dlouhodobě neuspokojivá kompenzace je pro diabetika nežádoucí, neboť podmiňuje vývoj diabetických cévních změn. Na druhé straně však úsilí o co nejlepší kompenzaci diabetu vede k častějším hypoglykemickým epizodám. Proto časné a správné odhalení hypoglykémie, a zejména volba vhodných opatření mají v klinické praxi prvořadý význam [1].
Udržování diabetika na glykémiích blízkých normálním hodnotám snižuje riziko diabetické mikroangiopatie, kdežto frekvence hypoglykemických příhod narůstá (graf 1). Z uvedeného vztahu vyplývá, že moderní léčba diabetu musí respektovat oba fenomény a hledat optimální opatření.
Patofyziologické poznámky
Plazmatická koncentrace glukózy se udržuje za fyziologických poměrů v úzkém rozmezí účinkem hormonů a humorálních působků, které mají regulační nebo modulační vliv. Hypoglykemizující účinky inzulinu se vyrovnávají čtyřmi kontraregulačními hormony, tj. glukagonem, adrenalinem, růstovým hormonem a kortisolem, které zaujímají v kontraregulaci určité nezaměnitelné postavení. Hypoglykémie vzniká na základě relativní nebo absolutní převahy inzulinu, která je u diabetika 1. typu podmíněna přívodem exogenního inzulinu, kdežto u diabetika 2. typu zejména farmaky uvolňujícími endogenní inzulin (tzv. inzulinovými sekretagogy) nebo aplikací exogenního inzulinu. Hypoglykémie se rozvíjí buď v důsledku zvýšeného odsunu glukózy z krve, tedy při její zvýšené clearance, a nebo v důsledku sníženého přísunu glukózy do krve. První mechanismus se uplatňuje, je-li dávka aplikovaného inzulinu nebo inzulinového sekretagoga příliš velká vzhledem k potřebám organismu. Hypoglykémie se pak často dostaví při zvýšené fyzické námaze, která urychluje odsun glukózy z krve do tkání, kdežto stejná dávka inzulinu podaná u pacienta bez fyzické aktivity nemusí hypoglykémii způsobit. Ve druhém případě příliš malá dávka jídla nebo opomenutí jeho konzumace mohou být příčinou nedostatečného přísunu glukózy do krve. Většinou se však příčiny kombinují a nepoměr mezi příjmem jídla, fyzickou aktivitou a aplikovaným farmakem pak vede k hypoglykémii.
Na kolísání glykémie organismus velmi citlivě reaguje. Její pokles pod fyziologickou mez pak vyvolává poruchu regulací provázenou jevy, které jsou klinicky významné a dostavují se bez vztahu k příčině hypoglykémie.
Syndrom nepoznané hypoglykémie
Diabetici léčení inzulinem, kteří mají opakované hypoglykémie, přestávají rozpoznávat nebo si neuvědomují hypoglykémii (tzv. hypoglycemia unawareness) [2]. Postižený jedinec nemá při rozvíjející se hypoglykémii varovné příznaky, které by jej na ni upozornily a umožnily mu, aby požil jídlo zamezující dalšímu poklesu glykémie. Stav vzniká jako následek porušené odpovědi sympatického nervstva a nadledvin (tzv. sympatochromafinního systému) na klesající glykémii, která nepostačuje jako stimulus, aby vyvolala vzestup plazmatické koncentrace adrenalinu [3]. K tomu je nutný hlubší pokles glykémie. Pacient má vyšší glykemický práh nutný k aktivaci kontraregulačních hormonů, především katecholaminů, než je tomu u zdravé osoby, což znamená, že k vyvolání reakce je zapotřebí silnější hypoglykemický podnět [3]. Syndrom nepoznané hypoglykémie není podmíněn diabetickou autonomní neuropatií, jak se původně myslelo, ale vyskytuje se i u pacientů bez této komplikace.
Syndrom je důsledkem proběhlé hypoglykémie, která vyvolá „toleranci“ organismu k následné hypoglykémii, při níž je utlumena reakce kontraregulačních hormonů [4]. Fenomén se objevuje již po jedné hypoglykémii navozené nejen u diabetika, ale i u zdravého jedince. Jde tedy o reaktivní změny, které nesouvisejí s diabetem, ale jsou ve vztahu s hypoglykémií.
Syndrom nepoznané hypoglykémie je reverzibilní, a zabrání-li se rozvoji hypoglykémie, obnovuje se fyziologická odpověď kontraregulačních mechanismů. Reverzibilita syndromu byla popsána i u pacientů s inzulinomem, u nichž se obnovila po operačním odstranění zdroje hyperinzulinismu normální reaktivita i normální glykemický práh.
Defektní kontraregulace
V časné fázi vývoje diabetu 1. typu se postupně zhoršuje sekrece glukagonu jako odpověď na pokles glykémie [5]. Tato porucha je selektivním defektem, neboť sekreční odpověď glukagonu na jiné podněty zůstává zachována. Jde o poruchu vzájemného působení obou hormonů uvnitř ostrůvků. Exogenní inzulin totiž způsobí zvýšenou koncentraci hormonu uvnitř ostrůvků, která neklesne při hypoglykémii, což vyvolá defektní odpověď v sekreci glukagonu (tzv. vypínací hypotéza sekrece glukagonu) [6]. Naproti tomu za fyziologického stavu pokles sekrece inzulinu při hypoglykémii podmíní nastartování sekrece glukagonu. V počátcích diabetu se porucha ještě neprojeví, neboť adrenalin ji stačí kompenzovat. V dalším vývoji diabetu 1. typu se však postupně objevuje i defekt sekrece adrenalinu, přičemž růstový hormon a kortisol již nejsou schopny poruchu kompenzovat. V této fázi narůstá až 25krát riziko iatrogenní hypoglykémie. Při diabetu 2. typu se zachovalou, i když defektní sekrecí inzulinu tato porucha ještě není přítomna.
Defektní kontraregulace se nevztahuje k diabetické autonomní neuropatii, jak se dříve myslelo, neboť byla pozorována také u diabetiků bez této poruchy.
Zvýšený glykemický práh
U každého jedince se objevují hypoglykemické příznaky při určité výši glykémie (tzv. glykemickém prahu). Zatímco u chronicky špatně kompenzovaného diabetika je zapotřebí relativně nižší pokles glykémie, aby se dostavily příznaky, a to i při hodnotách vyšších, než je normální rozpětí (jde o nízký glykemický práh) [7], pacienti s výbornou kompenzací často tolerují i výrazné hypoglykémie, aniž by se objevily příznaky. Teprve značně nízké glykémie vedou k vyvolání příznaků, jde o vysoký glykemický práh. Zatímco u zdravého jedince je glykemický práh stálou veličinou, u diabetiků se mění podle aktuálního stavu kompenzace. Podobně jako výše uvedená defektní kontraregulace, nesouvisí ani glykemický práh s autonomní neuropatií [7]. Vyšší glykemický práh je adaptačním fenoménem ovlivněným extrakcí glukózy mozkem, která chrání organismus před rozvojem klinicky zjevné hypoglykémie. Pokud by se práh neměnil, došlo by při poklesu glykémie k výrazným projevům neuroglykopenie [3].
Autonomní selhání podmíněné hypoglykémií
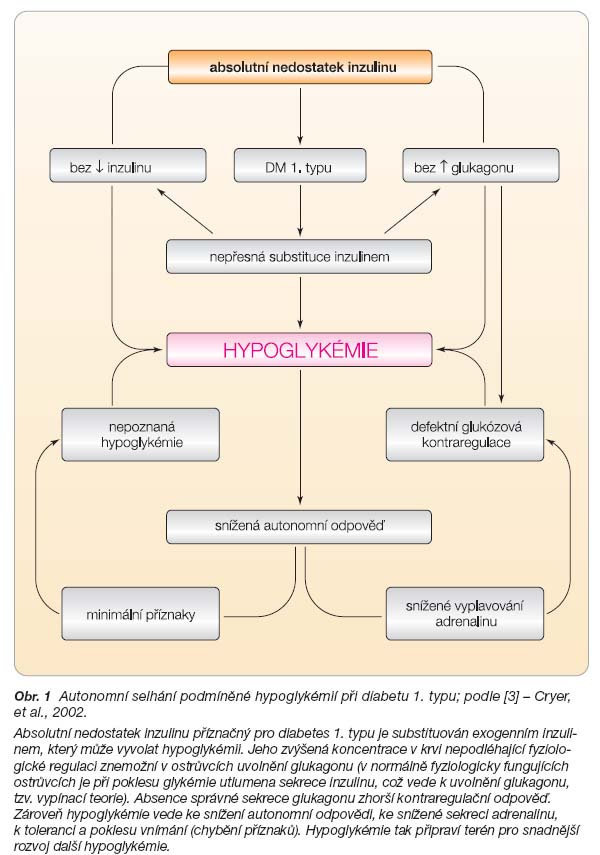 Uvedené tři fenomény se označují jako autonomní selhání podmíněné hypoglykémií [3]. Jedná se o samostatný patofyziologicko-klinický syndrom, který je spojen s vysokým rizikem výskytu iatrogenních hypoglykémií. Jedním z hlavních patogenetických činitelů u diabetika podílejících se na vzniku tohoto syndromu je právě iatrogenní hypoglykémie. Tato představa vychází z pozorování, že již jediná hypoglykémie vede ke zvýšení glykemického prahu pro autonomní reakce i neurogenní a neuroglykopenické symptomy (obr. 1). Podobně dochází vlivem předchozí hypoglykémie k poruše kontraregulace [4]. Rozvoj uvedených změn v důsledku proběhlé hypoglykémie současně vytváří podmínky pro další hypoglykémii, čímž se uzavírá bludný kruh, který může vést u diabetika k výrazné kumulaci hypoglykémií. Jediným východiskem je pak zamezit vzniku „spouštěcí“ hypoglykémie.
Uvedené tři fenomény se označují jako autonomní selhání podmíněné hypoglykémií [3]. Jedná se o samostatný patofyziologicko-klinický syndrom, který je spojen s vysokým rizikem výskytu iatrogenních hypoglykémií. Jedním z hlavních patogenetických činitelů u diabetika podílejících se na vzniku tohoto syndromu je právě iatrogenní hypoglykémie. Tato představa vychází z pozorování, že již jediná hypoglykémie vede ke zvýšení glykemického prahu pro autonomní reakce i neurogenní a neuroglykopenické symptomy (obr. 1). Podobně dochází vlivem předchozí hypoglykémie k poruše kontraregulace [4]. Rozvoj uvedených změn v důsledku proběhlé hypoglykémie současně vytváří podmínky pro další hypoglykémii, čímž se uzavírá bludný kruh, který může vést u diabetika k výrazné kumulaci hypoglykémií. Jediným východiskem je pak zamezit vzniku „spouštěcí“ hypoglykémie.
Syndrom autonomního selhání podmíněného hypoglykémií se odlišuje od diabetické autonomní neuropatie v několika znacích [3]. Za prvé se obě poruchy vyskytují na sobě nezávisle u různých pacientů, za druhé jsou změny při autonomním selhání podmíněny hypoglykémií, kdežto abnormality pozorované v reakcích sympatiku a parasympatiku při neuropatii jsou následkem specifických změn postihujících nervový systém jako následek chronického působení hyperglykémie. Podstatná reverzibilita syndromu kontrastuje s poznatky o nevratnosti diabetické autonomní neuropatie.
Změny v reakcích organismu na proběhlou hypoglykémii mají zásadní význam pro vedení léčby diabetika. Je jasné, proč je zapotřebí věnovat hypoglykémii náležitou pozornost, neboť její odstraňování může významně přispět ke zlepšení průběhu diabetu i vnímání celkového stavu samotným pacientem.
Klinický obraz a diagnóza
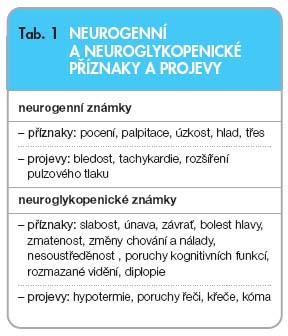 Koncentrace glukózy v krvi se u zdravých osob udržuje nalačno v úzkém rozmezí od 3,3 do 5,6 mmol/l [8]. Hraniční nebo mírně snížené hodnoty ještě nebývají provázeny klinickými příznaky. Příznaky vznikají jednak při aktivaci autonomního nervstva (neurogenní příznaky), jednak jsou následkem neuroglykopenie (neuroglykopenické příznaky), viz tab. 1 [9]. Již při glykémiích kolem 3,6 mmol/l se uplatňuje působení glukagonu a adrenalinu, při dalším poklesu se zapojuje růstový hormon a ještě později kortisol. Hodnota glykémie, při níž se účastní kontrainzulární hormony, se může snížit vlivem opakovaných hypoglykémií, jak bylo popsáno u intenzivně léčených diabetiků. Pokles glykémie aktivuje nejdříve vegetativní nervový systém, takže se dostavuje neklid, třes, pocení, palpitace, úzkost, případně hlad, který nebývá vždy považován za součást aktivace tohoto systému.
Koncentrace glukózy v krvi se u zdravých osob udržuje nalačno v úzkém rozmezí od 3,3 do 5,6 mmol/l [8]. Hraniční nebo mírně snížené hodnoty ještě nebývají provázeny klinickými příznaky. Příznaky vznikají jednak při aktivaci autonomního nervstva (neurogenní příznaky), jednak jsou následkem neuroglykopenie (neuroglykopenické příznaky), viz tab. 1 [9]. Již při glykémiích kolem 3,6 mmol/l se uplatňuje působení glukagonu a adrenalinu, při dalším poklesu se zapojuje růstový hormon a ještě později kortisol. Hodnota glykémie, při níž se účastní kontrainzulární hormony, se může snížit vlivem opakovaných hypoglykémií, jak bylo popsáno u intenzivně léčených diabetiků. Pokles glykémie aktivuje nejdříve vegetativní nervový systém, takže se dostavuje neklid, třes, pocení, palpitace, úzkost, případně hlad, který nebývá vždy považován za součást aktivace tohoto systému.
Při poklesu glykémie pod 2,8 mmol/l dochází ke snížení dodávky glukózy do nervových buněk, které tím ztrácejí rychle dostupný energetický substrát. Objevují se neuroglykopenické příznaky jako neschopnost soustředění, únava, bolesti hlavy, poruchy řeči (rozmazaná řeč), a dále různě kvantitativně odstupňovaná porucha vědomí, somnolence, sopor až kóma. Příznaky podmíněné aktivací autonomního nervstva nemusí vždy předcházet neuroglykopenickým projevům. Zejména při opakované hypoglykémii může vegetativní symptomatologie chybět, kdežto neuroglykopenické projevy se rozvíjejí přímo. Vedle neurologických příznaků jsou někdy v popředí poruchy chování a jednání nezřídka vedoucí k odeslání pacienta na psychiatrii při neznalosti základní diagnózy. Rozhodující význam má proto podrobná analýza klinických příznaků zejména u osob nepoužívajících hypoglykemizující látky, u nichž nevzniká bezprostřední podezření na hypoglykémii, neboť pestrý klinický obraz vede často k mylné diagnóze jiné nemoci. Naopak u diabetika léčeného inzulinem je diagnóza zřejmá, i když někdy se nemusí zcela objasnit příčina vzniku hypoglykémie.
Rozvoj klinických příznaků teprve při velmi nízkých glykémiích v důsledku zvýšeného glykemického prahu způsobí, že pacient bez varovných známek se dostane náhle do těžké hypoglykémie s poruchou vědomí [10]. Recidivující hypoglykémie vedou k postupné deterioraci funkcí nervového systému (CNS), které se mohou projevit poklesem intelektuálních schopností a poruchami paměti, zejména vštípivosti nových poznatků. Zároveň tyto nálezy odůvodňují, proč jsou nežádoucí opakované hypoglykémie u dětských pacientů s vyvíjejícím se nervovým systémem.
Rozvoj hypoglykémií je často velmi rychlý, takže mu pacient není vždy schopen zabránit požitím sladkého nápoje či pokrmu, zejména chybějí-li varovné příznaky. Podobně může nastupovat u diabetiků užívajících inzulin nebo deriváty sulfonylurey v situacích, kdy oddálení příjmu obvykle konzumovaného jídla nebo nadměrná fyzická námaha umožní léčivu, aby jeho působení bylo výraznější. Příhoda je tedy důsledkem nepoměru mezi dávkou hypoglykemizujícího léčiva a potřebou glukózy. Kombinace příčin může vyústit do těžké hypoglykémie ohrožující i život pacienta.
Diagnóza je jednoduchá, prokáže-li se při podezření na hypoglykémii. U farmakologicky léčených diabetiků je třeba z opakovaných vyšetření glykémie (např. pomocí prováděných sebekontrol glukometrem) odkrývat situace, při nichž se zjistí hypoglykémie. Při stanovení diagnózy hypoglykémie u diabetika se nelze proto spoléhat jen na zjevné klinické příznaky. Klinické projevy hypoglykémií jsou velmi pestré a často mohou vést lékaře k podezření na jinou diagnózu. Je proto vhodné, aby při symptomech, které mohou být podmíněny hypoglykémií, byla stanovena koncentrace glukózy v krvi.
Příčiny hypoglykémie při diabetu
Hypoglykémie vzniká těmito mechanismy: jednak při nedostatečném přísunu glukózy do krve, jednak při jejím nadměrném odsunu. Pokles glykémie při diabetu je způsoben nepoměrem mezi účinkem aplikovaného hypoglykemizujícího léčiva a potřebou glukózy organismem. Dochází ke zvýšenému vychytávání glukózy tkáněmi a s tím k její zvýšené metabolické clearance. Hypoglykémie se rozvíjí v důsledku zvýšeného účinku inzulinu, a to buď vlastního (endogenního) při používání perorálních antidiabetik při diabetu 2. typu nebo vlivem inzulinu dodaného aplikací (exogenního). Hypoglykémie podmíněné zvýšenou utilizací glukózy mohou významně ohrozit pacienta na životě, a proto je zapotřebí, aby se důkladně analyzovaly jejich příčiny, a především pak aby se bránilo v jejich rozvoji. Léčba diabetu inzulinem a později i deriváty sulfonylurey podmínila častější vznik hypoglykémií. Některé práce uvádějí 5–10 těžších hypoglykemických příhod ročně u pacientů léčených konvenčně dvěma dávkami inzulinu denně, kdežto intenzivní léčba vedoucí ke snížení průměrných glykémií, a tedy ke zlepšení kompenzace byla provázena až trojnásobně vyšším výskytem hypoglykémií [11]. Ve studii UKPDS se hypoglykémie vyskytovaly třikrát až čtyřikrát častěji u diabetiků léčených inzulinem v porovnání s perorálními antidiabetiky.
Inzulin
Obvyklá aplikace inzulinu, která je z řady důvodů nefyziologická, podmiňuje periferní hyperinzulinémii. Podaná dávka totiž neodpovídá aktuální potřebě diabetika, inzulin se vstřebává z podkoží přímo do velkého oběhu, a to bez ohledu na to, v jakém stavu se organismus nachází a jaké jsou jeho potřeby. Pokud se vyskytnou další podpůrné faktory jako nedostatečná konzumace jídla či přímo hladovění, větší fyzická aktivita či současně konzumace alkoholu, rozvíjí se hypoglykémie. Diagnóza hypoglykémie u léčeného diabetika je ve vztahu k příčině snadná. Vedle exogenního inzulinu se na rozvoji hypoglykémie u diabetiků 1. typu účastní i regulační změny. Autonomní selhání podmíněné změnou glykemického prahu, nepoznaná hypoglykémie a poruchy kontraregulačních hormonů se uplatní po první vzniklé hypoglykémii. Příznaky mohou být málo vyjádřené, pokud jsou přítomny známky autonomního selhání. Křečové stavy považované za epilepsii nebo hemiparetická hypoglykémie u dospělých i u dětí, z nichž se pacient zotavuje různě dlouhou dobu po podání glukózy, patří k závažným projevům [12]. Oba stavy jsou reverzibilní, takže budí dojem tranzitorní ischemické ataky. Dále se vyskytuje hypotermie, která může doprovázet hypoglykémii, jejíž léčba pak vede ke vzestupu tělesné teploty [13].
Hypoglykémie vzniká při léčbě inzulinem v kteroukoli denní dobu, nalačno i po jídle. Je mnohdy iatrogenně podmíněna. Hlavním důvodem těchto příhod je použití vyšších dávek depotních inzulinů, zejména při představě, že má diabetik sníženou citlivost tkání na inzulin. Jsou-li opakovaně naměřeny vyšší glykémie jako následek předchozí nezjištěné hypoglykémie, vede zvyšování dávky inzulinu k dalšímu prohloubení hypoglykémií, a tedy ke zhoršení kompenzace diabetu při výraznější posthypoglykemické hyperglykémii. Hypoglykémie se vyskytují často i po aplikaci rychle působícího inzulinu, a to opět při aplikaci větší dávky, než která je přiměřená. Jednoduchým ukazatelem přiměřenosti terapie inzulinem je tělesná hmotnost pacienta. Zvýšená dávka inzulinu podněcuje větší chuť k jídlu, a tím vede i k výraznějšímu hmotnostnímu přírůstku.
Při konvenční léčbě dvěma dávkami inzulinu dochází k větším výkyvům glykémií s rizikem hypoglykémie v poledních hodinách, v pozdním odpoledni a v nočních hodinách. Noční hypoglykémie pak způsobují ranní hyperglykémie jako typický příklad posthypoglykemické hyperglykémie (Somogyiho fenomén). Tyto epizody se zvýrazňují, pokud si pacient zapomene vzít kolem 22. hodiny malou, tzv. druhou večeři nebo kdy je v ní obsah sacharidů nízký. K nepravidelným hypoglykémiím může docházet často i u diabetiků léčených intenzifikovanými režimy, a to i přes dodržování režimových opatření. Jde o labilní průběh diabetu, který vyžaduje intenzivní zapojení pacienta, lékaře i sester. Situaci může zlepšit změna inzulinu, v současné době volba dlouze působícího analoga inzulinu (např. glarginu nebo detemiru).
Diabetik se snaží „kompenzovat“ příznaky hypoglykémie konzumací rychle vstřebatelných sacharidů, což vede ke zvýraznění následné hyperglykémie. Správně provedená analýza klinického stavu současně s glykemickým profilem získaným pomocí sebekontrol glykémií glukometrem umožní rychle odhalit pravou příčinu opakovaných hyperglykémií.
Perorální antidiabetika
Léky zvyšující sekreci inzulinu, tzv. inzulinová sekretagoga, vedou k riziku hypoglykémie, neboť jejich efekt nastoupí bez zřetele na to, v jaké aktuální metabolické situaci se organismus nachází. Hypoglykémie se rozvine, pokud hladina léku převýší koncentraci potřebnou k udržení vyrovnané glykémie. Tento stav nastane:
- při nadměrné dávce hypoglykemizujícího léčiva,
- sníženým odbouráváním hypoglykemizujícího léčiva,
- sníženou potřebou organismu při malém příjmu jídla,
- při zvýšené fyzické aktivitě.
V prvním případě dochází k iatrogenní hypoglykémii, kdy pacient dostává nepřiměřeně vysokou dávku léku. Riziko stoupá, má-li léčivý přípravek dlouhý biologický poločas (např. glibenklamid), ale i krátce působící deriváty (např. glipizid) mohou vyvolat těžkou hypoglykémii. Ve studii UKPDS se vyskytly hypoglykémie s frekvencí 2,4 % za rok při léčbě metforminem, ve 3,3 % u pacientů léčených deriváty sulfonylurey a v 11 % při léčbě inzulinem [14]. Vyšší věk sice není absolutní kontraindikací léčby deriváty sulfonylurey, ale snížená clearance inzulinu u starších jedinců vysvětluje, proč je riziko hypoglykémie ve stáří vyšší. Současně bývá přítomna porušená reakce kontraregulačních hormonů [15], která může způsobit zpomalený návrat glykémie do normy. Také rozpoznání hypoglykémie je ve stáří sníženo. Výskyt dalších chorob, např. ischemické choroby srdeční, může zvyšovat riziko komplikací, které mohou být vyvolány právě nepoznanou hypoglykémií. V důsledku iontových změn (hypokalémie při hypoglykémii) pak může dojít i k nečekanému fatálnímu průběhu. Léčbě deriváty sulfonylurey ve stáří je proto zapotřebí věnovat pozornost. Současně je třeba pátrat po přítomnosti dalších onemocnění (např. chronické jaterní procesy, chronická nedostatečnost ledvin), která mohou ovlivňovat eliminaci léčivé látky z organismu. Hlavním opatřením zabraňujícím rozvoji hypoglykémie je použití co nejnižší účinné udržovací dávky. Jsou-li přítomny kontraindikace léčby deriváty sulfonylurey, nelze se pak obejít bez léčby inzulinem.
Při léčbě deriváty sulfonylurey je třeba pamatovat na lékové interakce, neboť podání léku, jehož kinetika v organismu je obdobná jako v případě derivátu sulfonylurey, může způsobit uvolnění derivátů sulfonylurey z vazby na transportní bílkoviny, a tím se zvýrazní jejich účinek. Přehled preparátů, které zvyšují účinnost derivátů sulfonylurey, je uveden v tab. 2. Proto u pacienta léčeného současně dikumarolovým léčivem je třeba volit dávkování obou léčivých přípravků tak, aby nedošlo k hypoglykémii, která se častěji objevila právě u těchto pacientů.
Pro hypoglykémii při léčbě deriváty sulfonylurey je příznačný dlouhý průběh a její recidiva po vysazení infuze glukózy, která se může dostavit až do 72 hodin. Proto klinicky manifestní hypoglykémie s poruchou vědomí u pacienta léčeného uvedenými preparáty je indikací k přijetí do nemocnice. Současně je třeba provést revizi léčby antidiabetiky ve vztahu k ostatní medikaci a celkovému stavu pacienta.
Také další inzulinová sekretagoga (například glinidy) mohou vyvolat hypoglykémii. Naproti tomu hypoglykémie při terapii metforminem je vzácná a jde spíše o následek kombinace s dalšími léky (např. inhibitory ACE). Kombinace metforminu nebo thiazolidindionů s inzulinovými sekretagogy však může zvýšením inzulinové senzitivity vést ke snadnějšímu vzniku hypoglykémie než při terapii samotnými sekretagogy.
Moderní léčba diabetu 2. typu využívá spíše antidiabetika s kratším poločasem právě proto, aby nedocházelo ke kumulaci hladin léčivých látek, a tím k vyššímu riziku hypoglykémie.
Fyzická aktivita
Fyzická aktivita je základní součástí terapie diabetu. Vede k větší spotřebě energie, která se tudíž neukládá do zásob, a tím snižuje riziko rozvoje obezity. Současně zvyšuje účinnost inzulinu především ve svalové tkáni se snížením inzulinové rezistence. Zlepšuje se transport glukózy do myocytu zprostředkovaný aktivovanými transportéry GLUT4 a následně i oxidativní zpracování glukózy s tvorbou energie v cyklu trikarboxylových kyselin. Zatímco diabetikovi léčenému pouze dietou hypoglykémie nehrozí, podání inzulinu nebo inzulinových sekretagog zvyšuje riziko hypoglykémie při fyzické aktivitě. Podle délky fyzického zatížení může dojít k hypoglykémii ještě v jeho průběhu, ale vedle toho je třeba počítat i s jejím opožděným nástupem. Zejména večerní aktivity (např. v posilovně nebo jízda na kole aj.) mohou být zdrojem i poměrně těžké hypoglykémie v noci, pokud se charakteru diabetu nepřizpůsobí intenzita i druh fyzického zatížení současně s farmakoterapií. Snížení dávky krátce působícího inzulinu před fyzickou aktivitou spolu s malou dávkou jídla v průběhu aktivity může podstatně snížit riziko rozvoje hypoglykémie. Také prováděná sebekontrola glykémií může snadno odhalit reakci organismu na zátěž a podpořit pak rozhodnutí o úpravě terapie.
Dietní opatření
Druhou součástí nefarmakologických opatření je dieta. Nedojde-li k vybalancování individuálně doporučené diety s fyzickou aktivitou a farmakoterapií, pak je následkem buď přírůstek hmotnosti současně se zhoršenou kompenzací diabetu včetně nárůstu inzulinové rezistence, nebo naopak z nepoměru vznikne hypoglykémie. Změna energetického obsahu stravy nebo jejího složení (např. při cestě do ciziny) může být někdy i impulzem pro opakované hypoglykémie. Také změna jídelníčku (např. přechod na vegetariánskou stravu) může být pro diabetika léčeného inzulinem nebo inzulinovými sekretagogy zdrojem náhle vzniklých problémů. Energeticky chudá strava není jen omezeným zdrojem substrátů, ale po její konzumaci dochází i ke zvýšení inzulinové senzitivity. Nezměněná dávka hypoglykemizujícího léku vede k relativní hyperinzulinémii s následným poklesem koncentrace glukózy v plazmě.
Alkohol je další příčinou rozvoje hypoglykémie, a zejména jeho samotná konzumace bez jídla může mít fatální důsledky. Ethanol vede k zablokování glukoneogeneze v játrech, ale nikoli glykogenolýzy. Větší obsah glykogenu tudíž chrání před rozvojem hypoglykémie po požití alkoholu, kdežto delší lačnění kombinované s požíváním samotného alkoholu je zdrojem těžké hypoglykémie. Navíc alkohol vede k inhibici kontraregulačních hormonů, zejména růstového hormonu a kortisolu, takže pak vznikne těžká hypoglykémie nalačno s poruchou vědomí, která při neznalosti příčiny může vést k podezření na inzulinom [16]. Vedle hypoglykémie nalačno může alkohol vyvolat i reaktivní hypoglykémii. Alkohol působí stimulačně na sekreci inzulinu podmíněnou glukózou. Proto kombinace alkoholu a sacharózy vede k nadměrné sekreci inzulinu, a tím vznikne postprandiálně reaktivní symptomatická hypoglykémie i u zdravého člověka, pokud nepožije vedle alkoholu ještě další jídlo [17].
Jiné exogenně podmíněné hypoglykémie
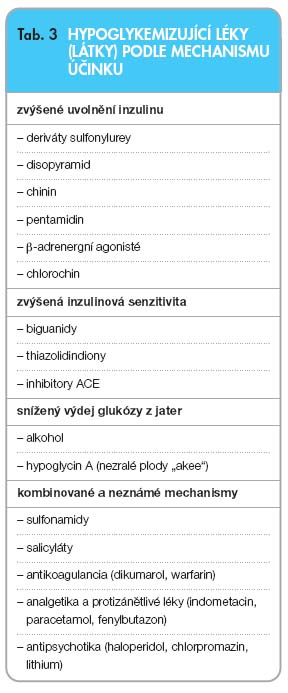 Vedle inzulinu a perorálních antidiabetik existují další látky, které mohou vyvolávat hypoglykémii. V současné době narůstá seznam léků, které se mohou podílet různým mechanismem na vzniku hypoglykémie (tab. 3). Vedle toho se může jednat o souběh působení účinné látky a individuálních dispozic jedince, případně i jeho nemoci, které usnadní rozvoj hypoglykémie. Mechanismus vzniku je trojí. Dochází:
Vedle inzulinu a perorálních antidiabetik existují další látky, které mohou vyvolávat hypoglykémii. V současné době narůstá seznam léků, které se mohou podílet různým mechanismem na vzniku hypoglykémie (tab. 3). Vedle toho se může jednat o souběh působení účinné látky a individuálních dispozic jedince, případně i jeho nemoci, které usnadní rozvoj hypoglykémie. Mechanismus vzniku je trojí. Dochází:
- ke zvýšenému uvolnění inzulinu buď vystupňovanou sekrecí nebo vlivem toxického působení látky na β-buňku,
- ke zvýšené utilizaci glukózy v periferní tkáni,
- ke snížené tvorbě glukózy v játrech [18].
Při kombinaci léků je třeba pátrat po možných interakcích. Některé léky působí hypoglykémii kombinovaným mechanismem účinku, u řady vysvětlení chybí.
Terapie a prevence hypoglykémií
Zamezení vzniku hypoglykémií, jejichž akutní i chronické následky jsou někdy podceňovány, je pro další prognózu nemoci diabetika velmi důležité, a proto jim musí být věnována patřičná pozornost.
Léčba hypoglykémií závisí na stupni a tedy závažnosti příhody. Lehké formy zvládne diabetik sám konzumací oslazeného nápoje a současně stravy obsahující komplexnější sacharidy. K úpravě se obvykle doporučuje dávka 10–20 g sacharidů. Těžké stavy hypoglykémií musí často řešit druhá osoba. Může se použít glukagon, a jakmile stav dovolí, podají se sacharidy perorální cestou. U většiny příhod dochází k „předávkování“ sacharidy, takže se posléze rozvíjí výrazná hyperglykémie. Při těžké hypoglykémii, zejména s poruchou vědomí, se podává infuze glukózy nitrožilně a délka jejího podání je přitom závislá na příčině. Zatímco při hypoglykémii vzniklé náhodně u pacienta léčeného inzulinem někdy stačí i jednorázová dávka (bolus) aplikovaná stříkačkou (40–80 ml 40% glukózy) s následnou úpravou pokrmem, u protrahovaných hypoglykémií při léčbě deriváty sulfonylurey je zapotřebí podat i několik infuzí v průběhu 48 hodin a monitorovat glykémie i 72 hodin. U nejasných stavů s protrahovanou hypoglykémií vyžadující opakované infuze glukózy vzniká podezření na hypoglycemia factitia.
Cílem správné léčby diabetu není léčit hypoglykémie, ale zabránit jejich vzniku. Prevence vychází z představy, že hypoglykémie jsou nežádoucí, neboť samy podmiňují rozvoj autonomního selhání. U každého diabetika je proto nezbytné po hypoglykémii cíleně pátrat. Je třeba rozlišovat mezi jedinci, u nichž hypoglykémie vzniká při diabetu dobře kompenzovaném konvenční léčbou používající vyšších dávek inzulinu, a těmi, u nichž je dosaženo tzv. těsné (tj. výborné) kompenzace diabetu při použití intenzivního (intenzifikovaného) způsobu léčby inzulinem. V prvním případě se uplatňuje vyšší dávka inzulinu, kdežto v druhé situaci se mohou účastnit i regulační změny včetně posunutí glykemického prahu.
Nejprve je třeba zhodnotit dávku inzulinu aplikovaného před hypoglykemickou příhodou. Na první pohled paradoxní snížení této dávky někdy jen o 2–4 jednotky vede jak ke snížení rizika hypoglykémie, tak i následné hyperglykémie. Současně je třeba posoudit denní režim, tj. konzumaci jídla a fyzickou aktivitu, které předcházely rozvoji hypoglykémie. Jejich úprava spolu s dávkou inzulinu přispívá k odstranění mnoha hypoglykémií. Pacient musí být poučen o úpravě (snížení) dávky rychle působícího inzulinu, který si aplikuje před plánovanou fyzickou aktivitou, nebo si vezme navíc malou dávku sacharidů. V případě nočních hypoglykémií je nutné se zaměřit jak na dávku večerního inzulinu, tak na složení tzv. druhé večeře nebo i na fyzickou aktivitu provozovanou v druhé polovině dne.
Po zavedení rychle působících analog inzulinů byl popsán v některých studiích pokles výskytu hypoglykémií, v jiných byl výskyt srovnatelný s léčbou klasickým inzulinem. Metaanalýza zpracovávající 8 větších multicentrických studií, které zahrnuly 2576 diabetiků 1. typu, svědčí o snížení frekvence závažných hypoglykémií u pacientů léčených inzulinovým analogem [19]. K podobným závěrům docházejí studie využívající dlouhodobá analoga inzulinu [20, 21]. Nelze však zapomínat, že hypoglykémie jsou odezvou nejen typu použitého inzulinu, ale především dávky a celkového přístupu k léčbě diabetu.
Komplikace
Hypoglykémie vede ke sníženému přísunu rychlého zdroje energie, jakým je glukóza, do životně důležitých orgánů, zejména do CNS. Proto je pokles koncentrace glukózy provázen neuroglykopenickými příznaky. Pokud nejsou dostupné jiné zdroje, jako např. ketolátky, stává se nedostatek glukózy pro organismus kritickým.
Komplikace mohou vzniknout jednak v důsledku těžké jednorázové hypoglykémie, která může vést až ke smrti jedince, ale také může být příčinou akutně vzniklé cévní mozkové příhody nebo akutní koronární příhody či dysrytmie.
K hypoglykémii dochází v kteroukoli denní dobu, záludné však mohou být především hypoglykémie ve spánku vedoucí i k úmrtí. Na 4 % náhlých úmrtí diabetiků se může podílet právě nepoznaná hypoglykémie [22]. Ačkoli příčinu nelze sekčně dokázat, patogeneze těchto náhlých úmrtí je vysvětlitelná. Jde vesměs o následky protrahované neuroglykopenie, která se uplatňuje více v korových vrstvách CNS než v hlubokých strukturách kmene. Současně nelze zapomínat ani na iontovou nerovnováhu, neboť hypoglykémie bývá provázena těžkou hypokalémií v důsledku posunu draslíku do nitra buněk s navazujícími elektrofyziologickými změnami prokazatelnými jednak elektroencefalografií, jednak při poruše převodního srdečního systému. U starších osob s ischemickou chorobou srdeční se pak může hypoglykémie podílet na fatální dysrytmii [23]. Hypoglykémie podmiňuje elektrofyziologické změny v myokardu, které se projevují na elektrokardiogramu prodloužením QT intervalu a jeho větší variabilitou. Přítomnost autonomní neuropatie zhoršuje elektrofyziologické vlastnosti myokardu a dále zvyšuje riziko náhlé smrti diabetiků.
Závěr
V diagnostice hypoglykémie má obecně zásadní význam klinická anamnéza. U farmakologicky léčeného diabetika je příčina jasná. Moderní způsob léčby usilující o co možná nejlepší kompenzaci může vést poměrně často k hypoglykémii. Jde však o nežádoucí stav a jeho prevence je zásadním úkolem při volbě léčebných opatření i edukace diabetika. U každého farmakologicky léčeného diabetika je tudíž zapotřebí hledat optimální intenzitu léčby, aby nebyl zvýšeně ohrožen následky hypoglykémie.
Seznam použité literatury
- [1] Škrha J. Hypoglykemický syndrom. 1. vydání. Praha, Grada 2001.
- [2] Gerich JE, Mokáň M, Veneman T, et al. Hypoglycemia unawareness. Endocr Rev 1991; 12: 356–371.
- [3] Cryer PE. Iatrogenic hypoglycemia as a cause of hypoglycemia-associated autonomic failure in IDDM. A vicious cycle. Diabetes 1992; 41: 255–260.
- [4] Davis SN, Shavers C, Mosqueda-Garcia R, et al. Effects of differing antecedent hypoglycemia on subsequent counterregulation in normal humans. Diabetes 1997; 46:1328–1335.
- [5] Bolli G, Defeo P, Compangnucci P, et al. Abnormal glucose counterregulation in insulin-dependent diabetes mellitus: interaction of anti-insulin antibodies and impaired glucagon and epinephrine secretion. Diabetes 1983; 32: 134–141.
- [6] Zhou HR, Zhang T, Oseid E, et al. Reversal of defective glucagon responses to hypoglycemia in insulin-dependent autoimmune diabetic BB rats. Endocrinology 2007; 148: 2863–2869.
- [7] Amiel SA, Sherwin RS, Simonson DC, et al. Effect of intensive insulin therapy on glycemic thresholds for counterregulatory hormone release. Diabetes 1988; 37: 901–907.
- [8] Service FJ. Classification of hypoglycemic disorders. Endocrinol Metab Clin North Am 1999; 28: 501–507.
- [9] Hepburn DA, Deary IJ, Frier BM, et al. Symptoms of acute insulin-induced hypoglycemia in humans with and without IDDM: factor-analysis approach. Diabetes Care 1991; 14: 949–957.
- [10] Veneman T, Mitrakou A, Mokaň M, et al. Induction of hypoglycemia unawareness by asymptomatic nocturnal hypoglycemia. Diabetes 1993; 42: 1233–1237.
- [11] Diabetes Control and Complication Trial Research Group. Epidemiology of severe hypoglyce mia in the Diabetes Control and Complications Trial. Am J Med 1991; 90: 450–459.
- [12] Spallino L, Stirling HF, O’Regan M, et al. Transient hypoglycemic hemiparesis in children with IDDM. Diabetes Care 1998; 21: 1567–1568.
- [13] Gale EAM, Bennett T, Green JH, MacDonald IA. Hypoglycemia, hypothermia and shivering in man. Clin Sci 1981; 61: 463–469.
- [14] UK Prospective Diabetes Study Group. UK Prospective Study 16: overview of 6 years therapy of type II diabetes: a progressive disease. Diabetes 1995; 44: 1249–1258.
- [15] Meneilly GS, Cheung E, Tuokko H. Counterregulatory hormone responses to hypoglycemia in the elderly patient with diabetes. Diabetes 1994; 43: 403–410.
- [16] Berman JD, Cook DM, Buchman M, et al. Diminished adrenocorticotropin response to insulin-induced hypoglycemia in nondepressed, actively drinking male alcoholics. J Clin Endocrinol Metab 1990; 71: 712–717.
- [17] Flanagan D, Wood P, Sherwin R, et al. Gin and tonic and reactive hypooglycemia: what is important – the gin, the tonic, or both? J Clin Endocrinol Metab 1998; 83: 796–800.
- [18] Glaser B, Leibowitz G. Hypoglycemia. In: Joslin’s Diabetes mellitus. Eds.: Kahn CR, et al., Lippincott Williams&Wilkins, Philadelphia 2005; 1147–1175.
- [19] Brunelle RL, Llewelyn J, Anderson JH, et al. Meta-analysis of the effect of insulin lispro on severe hypoglycemia in patients with Type 1 diabetes. Diabetes Care 1998; 21: 1726–1731.
- [20] Fonseca V, Bell DS, Berger S, et al. A comparison of bedtime insulin glargin with bedtime neutral protamin hagedorn insulin in patients with type 2 diabetes: subgroup analysis of patients taking once-daily insulin in a multicenter, randomized, parallel group study. Am J Med Sci 2004; 328: 274–280.
- [21] Škrha J. Inzulinová analoga. Remedia 2006; 16: 164–169.
- [22] Tattersall RB, Gill GV. Unexplained deaths of Type 1 diabetic patients. Diabetic Med 8; 1991: 49–58.
- [23] Sawicki PT, Kiwitt S, Bender R, Berger M. The value of QT interval dispersion for identification of total mortality risk in non-insulin-dependent diabetes mellitus. J Intern Med 1998; 243: 49–56.