Individualizovaná léčba u pacientů s nemalobuněčným karcinomem plic
Článek dokumentuje vývoj individualizované léčby nemalobuněčného karcinomu plic (NSCLC) od roku 2000. V přehledech jsou uvedeny výsledky klinických studií, které dokládají účinnost uvedených individualizovaných léčebných postupů u NSCLC. Individualizovaná chemoterapie dnes vychází z rozdílné citlivosti skvamózních a neskvamózních karcinomů plic k chemoterapii. U neskvamózních karcinomů je v 1. linii léčby volbou kombinace pemetrexed–cisplatina, ve 2. linii pak pemetrexed, nebyl-li podán dříve. U skvamózních karcinomů je naproti tomu vhodnější kombinace gemcitabin–cisplatina v 1. linii a docetaxel v linii druhé. U neskvamózních karcinomů přichází pak ještě v úvahu podání pemetrexedu v léčbě pokračovací. Cílená terapie inhibitory tyrozinkinázy genu EGFR (receptoru epidermálního růstového faktoru) s využitím erlotinibu a gefitinibu je jako účinná indikována především u nemocných s tzv. senzitivními mutacemi uvedeného genu, erlotinib je navíc indikován i ve 2. a 3. linii po selhání chemoterapie u všech typů NSCLC. U nemocných se stabilizací nádoru po chemoterapii přináší významný efekt pokračovací léčba erlotinibem. V terapii NSCLC se na základě publikovaných klinických studií očekává u skvamózních karcinomů se zvýšenou expresí proteinu EGFR i využití cetuximabu v kombinaci s chemoterapií. Z monoklonálních protilátek proti vaskulárnímu endoteliálnímu růstovému faktoru (vascular endothelial growth factor, VEGF) se pro neskvamózní karcinomy stává léčbou prvních linií bevacizumab v doporučené kombinaci cytostatik paklitaxel–karboplatina. Zatím posledním cíleným preparátem, který začíná být využíván v léčbě nemocných s NSCLC, je crizotinib. Tento preparát prokazuje významný léčebný efekt u nemocných s aktivními mutacemi genu anaplastické lymfomové kinázy (ALK).
Úvod
V roce 2000 bylo dle výsledků studie Schillerové a kol. konstatováno, že výsledky kombinovaných chemoterapií podávaných v první linii léčby pacientů s pokročilými stadii nemalobuněčného karcinomu plic (non-small cell lung cancer, NSCLC), které byly založeny na podávání platinových derivátů v kombinaci s cytostatiky III. generace, se statisticky neliší. Každé z hodnocených léčebných schémat mělo stanovenu frekvenci léčebných odpovědí. časy do progrese nádoru byly významně delší u nemocných léčených kombinací cisplatina–gemcitabin, ale celkové přežití nemocných bylo ve všech souborech stejné. Při relapsu či progresi onemocnění přicházela v úvahu chemoterapie druhé linie, kde jakožto jediný účinný preparát byl dle výsledku klinických studií doporučitelný docetaxel.
Období, které následovalo, bylo charakterizováno hledáním prognostických a prediktivních faktorů. Pátrání po těchto údajích důležitých pro volbu účinnější terapie se odehrávalo na morfologické i na genetické úrovni.
Jednonukleotidové polymorfismy genů souvisejících zejména s opravou DNA pro podání cytostatik pomáhají do jisté míry vyhledávat nemocné s pravděpodobnější remisí navozenou cytostatiky, nebo naopak definovat nemocné, u kterých lze očekávat závažné nežádoucí účinky léčby cytostatiky. Výhodou těchto vyšetření je snadná dostupnost vyšetřované tkáně. Jednonu-kleotidové polymorfismy je totiž možno vyšetřovat z nových tkání pacienta, např. z periferních leukocytů. Společné varianty těchto polymorfismů sdílejí jak původní tkáně nemocného, tak i tkáně nádorové. Nevýhodou těchto vyšetření je znalost prozatím jen relativně malého počtu genů prediku-jících účinnost chemoterapie nebo molekulárně cílené léčby, ale také chybění prospektivních studií v této oblasti [1, 2]. Perspektivní oblastí jsou i vyšetření genových expresí, jež mohou mít vztah k účinnosti jak chemoterapie, tak i biologicky cílené léčby [3].
Jaké jsou možnosti pro volbu individua-lizované terapie dnes?
Individualizovaná chemoterapie vychází z rozdílné citlivosti skvamózních a ne-skvamózních karcinomů k léčbě pemetrexedem a platinovým derivátem v první linii a pemetrexedem samotným v linii druhé a v léčbě udržovací.
Individualizovaná molekulárně cílená léčba vychází z průkazu tzv. EGFR TKI (epidermal growth factor receptor tyrosine kinase inhibitor) senzitivních mutací. Tyto mutace se častěji vyskytují u nemocných s adenokarcinomy, u nekuřáků či bývalých mírných kuřáků a v populaci orientálců [4, 5]. U těchto nemocných je indikováno podání gefitinibu či erlotinibu v první linii, ale i v li-niích dalších, jsou-li senzitivní mutace zjištěny až v průběhu systémové chemoterapie či při jejím selhání. Erlotinib podaný ve 2. nebo 3. linii představuje významný přínos také u nemocných, u kterých senzitivní mutace genu EGFR nebyly nalezeny.
Individualizovaná chemoterapie
Pemetrexed v 1. linii léčby NSCLC
Použití pemetrexedu v kombinaci s cisplatinou v 1. linii léčby pokročilého nebo metastazujícího NSCLC predominantně neskvamózních histologických forem bylo registrováno na základě výsledků nejrozsáhlejší dosud provedené registrační studie testující léčbu 1. linie u NSCLC (1725 pacientů) a výsledků její předem plánované subanalýzy zaměřené na hodnocení účinku léčby vzhledem k histologickému typu nádoru [6].
Pacienti byli randomizováni v poměru 1 : 1 k podávání pemetrexedu (500 mg/m2 i.v. v 1. den 21denního cyklu) a cisplatiny (75 mg/m2 i.v. v 1. den 21denního cyklu) nebo k podávání gemcitabinu (1250 mg/m2 i.v. 1. a 8. den 21denního cyklu), v obou případech do dávky maximálně 6 cyklů. V obou studijních ramenech byla podávána identická premedikace kortikosteroidy, kyselinou listovou a vitaminem B12. Primárním sledovaným parametrem bylo celkové přežití (overall survival, OS).
V populaci bez rozlišení histologického typu nádoru bylo dosaženo srovnatelné střední doby OS při léčbě kombinací pemetrexed–cisplatina ve srovnání s kombinací gemcitabin–cisplatina (10,3 měsíce v obou ramenech léčby, hazard ratio – HR 0,94; p < 0,001 pro test noninferiority); podávání kombinace pemetrexed–cisplatina však bylo spojeno s výrazně nižší hematologickou toxicitou a z toho vyplývající významně nižší frekvencí výskytu febrilní neutropenie a nutností podání krevních derivátů a růstových faktorů.
![Graf 1 Celkové přežívání u pacientů s adenokarcinomem; podle [6] – Scagliotti, et al., 2008.](https://www.remedia.cz/photo-a-28727---.jpg) Ve zpětné subanalýze vlivu histologické formy nádoru na výsledky léčby peme-trexedem pak byla potvrzena předpokládaná vyšší účinnost léčby pemetrexedem u pacientů s predominantně neskvamocelulárním histologickým typem nádoru ve srovnání s dlaždicobuněčným histologickým typem NSCLC. Zřetelný a statisticky významný příznivý rozdíl v efektu léčby pemetrexedem oproti gemcitabinu (v obou případech v kombinaci s cisplatinou) byl pozorován zvláště ve skupině pacientů s velkobuněčným
Ve zpětné subanalýze vlivu histologické formy nádoru na výsledky léčby peme-trexedem pak byla potvrzena předpokládaná vyšší účinnost léčby pemetrexedem u pacientů s predominantně neskvamocelulárním histologickým typem nádoru ve srovnání s dlaždicobuněčným histologickým typem NSCLC. Zřetelný a statisticky významný příznivý rozdíl v efektu léčby pemetrexedem oproti gemcitabinu (v obou případech v kombinaci s cisplatinou) byl pozorován zvláště ve skupině pacientů s velkobuněčným ![Graf 2 Celkové přežívání u pacientů s karcinomem z velkých buněk; podle [6] – Scagliotti, et al., 2008.](https://www.remedia.cz/photo-a-28728---.jpg) karcinomem (prodloužení střední doby přežití o 3,7 měsíce; HR 0,67) a u pacientů s adenokarcinomem (prodloužení střední doby přežití o 1,7 měsíce; HR 0,84), viz graf 1, 2. Naopak u pa-cientů s převážně dlaždicobuněčným histologickým typem nádoru se prokázala jako hraničně významně účinnější léčba kombinací gemcitabin–cisplatina (rozdíl ve střední délce přežití 1,4 měsíce; HR 1,23).
karcinomem (prodloužení střední doby přežití o 3,7 měsíce; HR 0,67) a u pacientů s adenokarcinomem (prodloužení střední doby přežití o 1,7 měsíce; HR 0,84), viz graf 1, 2. Naopak u pa-cientů s převážně dlaždicobuněčným histologickým typem nádoru se prokázala jako hraničně významně účinnější léčba kombinací gemcitabin–cisplatina (rozdíl ve střední délce přežití 1,4 měsíce; HR 1,23).
Pemetrexed ve 2. linii léčby NSCLC
Pemetrexed byl hodnocen ve 2. linii léčby v rámci multicentrické, randomizované, otevřené studie testující noninferioritu podávání monoterapie pemetrexedem (500 mg/m2 i.v. v 1. den 21denního cyklu s premedikací dexamethasonem a suplementací kyselinou listovou a vitaminem B12) oproti docetaxelu (75 mg/m2 i.v. v 1. den 21denního cyklu s premedikací dexame-thasonem) na souboru 571 pacientů v relativně dobrém stavu (ECOG performance status 0–2), s progredujícím lokálně pokročilým nebo metastazujícím NSCLC po jedné předchozí chemoterapii. Primárním sledovaným parametrem bylo OS. Léčba pemetrexedem prokázala v ITT (Intention to treat) populaci pacientů bez rozlišení histologického typu nádoru srovnatelnou účinnost s léčbou docetaxelem. Bylo dosaženo mediánu OS 8,3 měsíce při léčbě pe-metrexedem vs. 7,9 měsíce při léčbě doce-taxelem, celková odpověď na léčbu dosáhla 9,1 % vs. 8,8 %; medián přežití bez progrese (progression free survival, PFS) byl 2,9 měsíce v obou ramenech studie a stejný byl u obou typů léčby i podíl pacientů přežívajících 1 rok – 29,7 % [7].
Oba typy léčby se však významně lišily v toxicitě a snášenlivosti. Při podávání pemetrexedu byl ve srovnání s doceta-xelem pozorován především statisticky významně nižší výskyt závažných hematologických toxicit a z toho vyplývajících komplikací. Výsledky retrospektivně provedené analýzy účinnosti léčby (OS) dle histologického typu nádoru naznačily vyšší účinnost pemetrexedu u pacientů s ne-skvamózními histologickými typy NSCLC. U pacientů s NSCLC jiného histologického typu než predominantně z dlaždicových buněk byl medián OS při léčbě pemetrexedem 9,3 měsíce vs. 8,0 měsíců při léčbě docetaxelem (HR 0,78; p = 0,047). Na-opak docetaxel jevil vyšší účinnost ve srovnání s pemetrexedem při léčbě pa-cientů se skvamózním NSCLC (medián OS 6,2 měsíce při léčbě pemetrexedem vs. 7,4 měsíce při léčbě docetaxelem (HR 1,56; p = 0,018) [7].
Poznatky získané ze subanalýz vedly k etablování histologického typu nádoru jako uznávaného prediktivního faktoru pro účinnost léčby pemetrexedem a k následné úpravě znění indikací v SPC přípravku, jež definuje pacienty vhodné pro léčbu tímto přípravkem na základě histologického typu nádoru [8].
Pemetrexed v udržovací léčbě NSCLC
Jako perspektivní se jeví použití peme-trexedu také v tzv. udržovací léčbě u pokročilého a metastazujícího NSCLC neskvamózní histologie. V randomizované, dvojitě slepé, placebem kontrolované studii fáze III s léčbou pemetrexedem v režimu tzv. switch maintenance (udržovací léčba se změnou terapie) bylo podávání monoterapie pemetrexedem do progrese hodnoceno ve srovnání s podáváním placeba a nejlepší podpůrné léčby (best supportive care, BSC) u pacientů s NSCLC stadia IIIb/IV, kteří dosáhli kontroly onemocnění (objektivní odpovědi či stabilizace onemocnění) po podání 4 cyklů platinového dubletu (cisplatina nebo karboplatina v kombinaci s gemcitabinem, docetaxelem nebo pakli-taxelem). V této studii bylo dosaženo primárního cíle, tj. průkazu prodloužení PFS při udržovací léčbě pemetrexedem vs. ponechání na BSC v populaci bez rozlišení dle histologického typu nádoru (4,6 vs. 2,6 měsíce; HR 0,5; p < 0,0001), zároveň byl prokázán i z hlediska pacientů i plátců velmi důležitý přínos v podobě prodloužení celkového přežití (13,4 vs. 10,6 měsíce; HR 0,79; p = 0,012). V souladu s již dříve zjištěnou skutečností, že neskvamózní histologie je pozitivním prediktorem účinnosti pemetrexedu, byl přínos jak v parametru PFS, tak v parametru OS výraznější pro pacienty s neskvamózní histologií nádoru (PFS 4,4 vs. 1,8 měsíce; HR 0,47; p < 0,0001 a OS 15,5 vs. 10,3 měsíce; HR 0,7; p = 0,02). Podávání pemetrexedu v monoterapii bezprostředně po ukončení první linie léčby bylo pacienty dobře tolerováno a profil nežádoucích účinků se nelišil od zjištění jiných studií s pemetrexedem [9, 10]. Poslední publikovanou studií fáze III je studie PARAMOUNT, prezentovaná na kongresu ASCO 2011. V této dvojitě slepé, randomizované studii kontrolované pla-cebem byl pemetrexed hodnocen oproti placebu a BSC při podávání v monoterapii do progrese u pacientů s neskvamózním NSCLC stadia IIIb/IV, u nichž nedošlo k progresi po absolvování 4 cyklů léčby první linie dvojkombinací cisplatina–peme-trexed. Ve srovnání s placebem a BSC došlo k významnému prodloužení přežití bez progrese při pokračující udržovací léčbě pemetrexedem (4,1 vs. 2,8 měsíce; HR 0,62; log-rank p = 0,00006) při dobré snášenlivosti léčby a bez zhoršení kvality života při pokračující chemoterapii.
Bezpečnost a snášenlivost pemetrexedu
Relativně nízká toxicita a dobrá snášenlivost pemetrexedu je podmíněna správně a důsledně prováděnou premedikací a vitaminovou suplementační léčbou, kterou je třeba aplikovat po celou dobu trvání terapie. Ke snížení výskytu a závažnosti kožních reakcí se jako premedikace podává kortikosteroid den před podáním peme-trexedu, v den jeho podání a v den po jeho podání. Kortikosteroid by měl být ekvivalentní dávce 4 mg dexamethasonu podávané perorálně 2krát denně. Ke snížení toxicity musí dále pacienti denně perorálně užívat kyselinu listovou nebo multivitaminy s obsahem kyseliny listové (v denní dávce 350–1000 mg). Během sedmi dnů před první dávkou pemetrexedu se musí podat nejméně pět dávek kyseliny listové a její podávání musí pokračovat po celý průběh léčby a po dobu 21 dní po poslední dávce pemetrexedu. Pacientům musí být v týdnu před podáním první dávky pemetrexedu rovněž aplikována intramus-kulární injekce vitaminu B12 (1000 mg) a tato aplikace musí být následně opakována jednou za každé tři cykly. Další injekce vitaminu B12 se mohou podávat ve stejný den jako pemetrexed [8].
Cílená terapie
Cílená terapie přináší nemocným další reálné vyhlídky na zlepšení kvality života i na jeho prodloužení. Mechanismy jejího působení na nádorové buňky jsou odlišné od chemoterapie, rozdílné je i spektrum nežádoucích účinků. V současnosti jsou k dispozici inhibitory tyrozinkinázy (TK) EGFR gefitinib a erlotinib, a dále pak humanizovaná protilátka proti receptoru vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor, VEGF) bevacizumab.
Význam mutací genu EGFR ve vztahu k účinnosti cílené léčby byl poprvé odhalen v roce 2004 Lynchem a Paezem [4, 5]. Tyto mutace jsou zodpovědné za formování nádoru i za jeho perzistenci a v současné době jsou uznávanými prediktory účinnosti inhibitorů EGFR.
Průkaz těchto řídících mutací, které zároveň signalizují tzv. závislost na onkogenu, je indikací pro molekulárně cílenou terapii inhibitory TK (gefitinib nebo erlotinib), které účinky onkogenní stimulace blokují.
Patologická aktivace receptoru je odhalena na pozadí vzniku mnoha druhů nádorů. Nádorové buňky mohou produkovat příslušný růstový faktor a tím samy sebe stimulovat k růstu, může docházet k nadměrné syntéze receptoru a jeho přítomnosti na povrchu buňky (overexprese), která souvisí zpravidla se zmnožením příslušného genu pro daný receptor (amplifikace). V některých případech může být receptor aktivován i bez předchozího navázání ligandu – například při mutaci mimobuněčné části EGFR (EGFRvIII) nebo při odštěpení mimobuněčné části receptorů proteolytickými enzymy (HER2-p95), což rovněž vede k progresi nádoru.
Membránové receptory tedy hrají u zhoubných nádorů významnou roli, byla proto na ně upřena pozornost při hledání nových možností léčby. Receptory jsou nyní cílem řady nových, tzv. cílených (biologických) léků, jejichž úkolem je zabránit aktivaci receptorů a přenosu signálu na další členy signální kaskády.
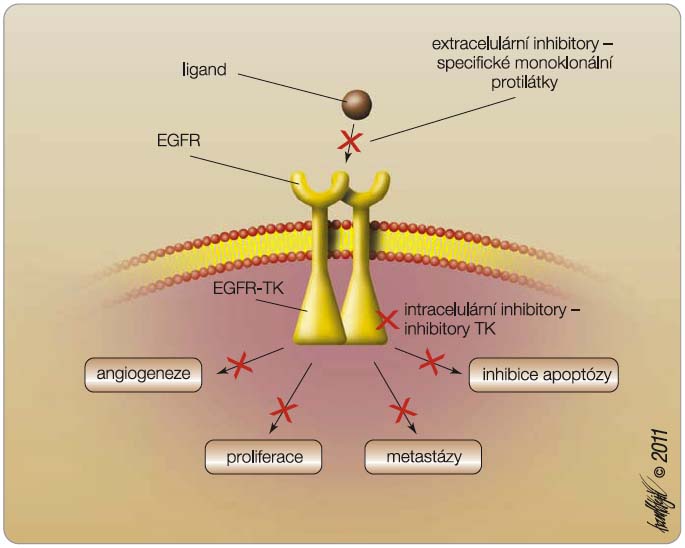 V současné době je možno daného cíle dosáhnout dvěma zásadně odlišnými způsoby (obr. 1). Prvním z nich je použití specifické monoklonální protilátky proti mimobuněčné části receptoru. Tím se zabrání aktivaci nitrobuněčné části receptoru. Protilátky navázané na povrch nádorové buňky kromě toho aktivují buněčnou imunitu, která je významnou součástí jejich protinádorové aktivity.
V současné době je možno daného cíle dosáhnout dvěma zásadně odlišnými způsoby (obr. 1). Prvním z nich je použití specifické monoklonální protilátky proti mimobuněčné části receptoru. Tím se zabrání aktivaci nitrobuněčné části receptoru. Protilátky navázané na povrch nádorové buňky kromě toho aktivují buněčnou imunitu, která je významnou součástí jejich protinádorové aktivity.
Druhou možností je zabránit fosforylaci tyrozinových zbytků v tyrozinkinázové doméně nitrobuněčné části receptoru. Toho dosahují inhibitory TK – relativně malé molekuly snadno pronikající do buňky a vážící se na TK receptoru. I když principiálně fungují všechny TK podobně, jejich stavba se v detailech liší. To umožňuje vytváření různých inhibitorů TK, jejichž vlastnosti se diametrálně odlišují – inhibitor se může specificky vázat na jediný či na více receptorů TK, reverzibilně či ireverzibilně. Všechny tyto vlastnosti ovlivňují nejen účinnost léku, ale i spektrum jeho nežádoucích účinků.
K léčbě NSCLC se používají dva reverzibilní inhibitory TK EGFR: erlotinib, který je registrován a k léčbě NSCLC běžně používán, a gefitinib.
Postavení gefitinibu v léčbě NSCLC
Klinické studie
Studie fáze III 0709 ISEL prokázala, že gefitinib významně prodloužil přežití nemocných nekuřáků a nemocných z asijských etnik a také nemocných, jejichž nádory exprimovaly zvýšený počet kopií genu EGFR. Frekvence léčebných odpovědí celého souboru byla 7,28 %, pro celý soubor nebylo dosaženo významného prodloužení OS nemocných.
Studie INTEREST prokázala, že při pozorování souborů nemocných s NSCLC léčených ve 2. linii gefitinibem nebo docetaxelem nebyly doby celkového přežití nemocných obou souborů významně rozdílné. Významně častěji byla však doložena lepší kvalita života nemocných léčených gefitinibem proti souboru nemocných léčených docetaxelem [11]. Tato studie neprokázala význam klinických faktorů ani biomarkerů specifických pro signální dráhu EGFR pro volbu mezi oběma léčivy s cílem dosáhnout delšího přežití. V dalších studiích, které rovněž porovnávaly účinnost gefiti-nibu a docetaxelu ve 2. linii léčby pokročilého NSCLC, rovněž nebyl prokázán rozdíl v přežití souborů nemocných, nicméně časy do progrese nemoci a frekvence léčebných odpovědí byly podobné nebo výhodnější při podávání gefitinibu. Podobně tomu bylo i při hodnocení zlepšení kvality života při léčbě oběma preparáty.
Studie fáze III IPASS, provedená v Asii u 1217 nemocných s NSCLC, kde byl histologicky prokázán adenokarcinom a nemocní byli bývalými mírnými kuřáky či nekuřáky a nedostávali dříve chemoterapii, zjistila, že gefitinib podávaný v dávce 250 mg denně perorálně byl prokazatelně účinnější než kombinace paklitaxel–karboplatina, pokud jde o časy do progrese nádoru, a dosahoval častěji významného zlepšení kvality života nemocných než uvedená chemoterapie. Celkové přežití a frekvence zlepšení symptomů nemoci však nebyly mezi oběma soubory nemocných rozdílné [12–14].
Zásadním zjištěním však je skutečnost, že účinnost léčby je závislá na přítomnosti mutací genu pro EGFR. Tyto mutace jsou silným prediktivním biomarkerem účinnosti gefitinibu ve srovnání s kombinací paklitaxel–karboplatina.
U nemocných s mutacemi EGFR byl při léčbě gefitinibem zaznamenán delší čas do progrese nádoru, vyšší frekvence léčebných odpovědí a významně více nemocných mělo zlepšenou kvalitu života než v případě léčby kombinací paklitaxel–karboplatina. Na druhé straně u pacientů, jejichž nádory byly z hlediska přítomnosti mutací EGFR negativní, byl čas do progrese nádoru významně delší u nemocných léčených chemoterapií a více pacientů léčených chemoterapií dosáhlo zlepšení kvality života při porovnání se souborem nemocných léčených gefitinibem. K podobným závěrům dospěla i studie WJTOG3405, která srovnávala gefitinib s kombinací cisplatina–docetaxel [14].
Bezpečnost a snášenlivost
Ze získaných dat vyplývá, že gefitinib je dobře tolerován, nebyly prokázány nežádoucí účinky provázející běžnou chemoterapii – tedy útlum krvetvorby, neurotoxicita či nefrotoxicita [15–17].
Většina nežádoucích účinků je mírného stupně. K nejčastějším patří rash (vyrážka), suchá kůže, pruritus, průjem, zvýšení hladin aminotransferáz a další poruchy funkce gastrointestinálního traktu.
Postavení erlotinibu v léčbě NSCLC
Erlotinib podávaný perorálně je vhodnou léčbou u nemocných s lokálně pokročilým či metastazujícím NSCLC zejména tam, kde byly v nádorové tkáni nalezeny mutace EGFR. Jeho použití přichází v úvahu i u pacientů ve vyšším věku [18, 19]. Existují důkazy o jeho dobré účinnosti u ne-kuřáků s adenokarcinomy či u bývalých mírných kuřáků [20, 21] v případě, že není možné stanovit mutační status EGFR. Velmi dobrá efektivita byla pozorována dokonce u nemocných s asymptomatickými metastázami do mozku. U nemocných s mutacemi EGFR je cílená terapie erlotinibem indikována v 1., 2. i 3. linii léčby NSCLC [22].
![Graf 3 Celkové přežívání v populaci; podle [18] – Shepherd, et al., 2005.](https://www.remedia.cz/photo-a-28730---.jpg) Erlotinib byl zařazen do standardní léčby NSCLC na základě výsledků studie BR.21 [18], která hodnotila účinnost a bezpečnost erlotinibu v monoterapii u pacientů s lokálně pokročilým nebo metastazujícím NSCLC po selhání jednoho nebo dvou předchozích režimů chemoterapie. Primárním cílem studie bylo prokázat prodloužení doby celkového přežívání při léčbě erlotinibem ve srovnání s placebem, viz graf 3. Primární cíl byl splněn, medián doby celkového přežívání byl u pacientů léčených erlotinibem 6,7 měsíce ve srovnání se 4,7 měsíce v rameni s placebem (HR 0,73; 95% CI: 0,60–0,87; p = 0,001).
Erlotinib byl zařazen do standardní léčby NSCLC na základě výsledků studie BR.21 [18], která hodnotila účinnost a bezpečnost erlotinibu v monoterapii u pacientů s lokálně pokročilým nebo metastazujícím NSCLC po selhání jednoho nebo dvou předchozích režimů chemoterapie. Primárním cílem studie bylo prokázat prodloužení doby celkového přežívání při léčbě erlotinibem ve srovnání s placebem, viz graf 3. Primární cíl byl splněn, medián doby celkového přežívání byl u pacientů léčených erlotinibem 6,7 měsíce ve srovnání se 4,7 měsíce v rameni s placebem (HR 0,73; 95% CI: 0,60–0,87; p = 0,001).
Retrospektivní analýza prokázala, že er-lotinib prodlužuje dobu přežití i u podskupi-ny nemocných, kteří jsou některými autory považováni za méně vhodné pro léčbu inhibitory TK. Jedná se o muže–kuřáky s dlaždicobuněčným karcinomem, u nichž bylo dosaženo mediánu doby přežívání 5,5 mě-síce při léčbě erlotinibem oproti 3,4 měsíce při podávání placeba (HR 0,66; CI: 0,47–0,92) [20].
Léčba erlotinibem prodlužuje rovněž dobu do zhoršení některých důležitých příznaků onemocnění: střední doba do zhoršení kašle činila 28,14 týdne při léčbě erlotinibem vs. 15,71 týdne při podávání placeba (p = 0,041), odpovídající hodnoty pro dušnost byly 20,4 týdne vs. 12,1 týdne (p = 0,010) a pro bolest 12,1 týdne vs. 8,1 týdne (p = 0,020). Celková kvalita života hodnocená dotazníkem EORTC QLQ-C30 byla při léčbě erlotinibem zlepšena u 35 % nemocných ve srovnání se 16 % v rameni s placebem.
![Graf 4 Přežití bez progrese (PFS) – všichni randomizovaní pacienti (ITT); podle [19] – Capuzzo, et al., 2009.](https://www.remedia.cz/photo-a-28731---.jpg) Součástí studií hodnotících biologickou léčbu je hledání markeru, který umožní výběr skupiny nemocných vhodných k léčbě. Ve studii SATURN [19, 23], která hodnotila erlotinib v udržovací léčbě oproti placebu u pacientů bez progrese po 1. linii léčby režimem s platinou, byly prospektivně centrálně vyšetřovány bioptické vzorky nádoru a hodnocen prognostický a prediktivní význam jednotlivých biomarkerů i klinických charakteristik.
Součástí studií hodnotících biologickou léčbu je hledání markeru, který umožní výběr skupiny nemocných vhodných k léčbě. Ve studii SATURN [19, 23], která hodnotila erlotinib v udržovací léčbě oproti placebu u pacientů bez progrese po 1. linii léčby režimem s platinou, byly prospektivně centrálně vyšetřovány bioptické vzorky nádoru a hodnocen prognostický a prediktivní význam jednotlivých biomarkerů i klinických charakteristik. ![Graf 5 Přežití bez progrese (PFS) – při mutaci EGFR; podle [19] – Capuzzo, et al., 2009.](https://www.remedia.cz/photo-a-28732---.jpg) Celkem 889 pa-cientů bez progrese po 4 cyklech chemoterapie obsahující platinový dublet bylo randomizováno v poměru 1 : 1 do skupin s erlotinibem nebo s placebem. Primárním cílem bylo přežití bez progrese (PFS) všech nemocných a nemocných s aktivační mutací EGFR (stanovenou IHC), viz graf 4 a 5.
Celkem 889 pa-cientů bez progrese po 4 cyklech chemoterapie obsahující platinový dublet bylo randomizováno v poměru 1 : 1 do skupin s erlotinibem nebo s placebem. Primárním cílem bylo přežití bez progrese (PFS) všech nemocných a nemocných s aktivační mutací EGFR (stanovenou IHC), viz graf 4 a 5.
Podobně jako v jiných studiích s erlotinibem byla prokázána vyšší účinnost léčby u některých podskupin nemocných (ženy vs. muži, nekuřáci vs. kuřáci, adenokarcinom vs. dlaždicobuněčný karcinom), nebyla však nalezena žádná podskupina, u které by léčba erlotinibem nevedla ke zlepšení přežití bez progrese a/nebo celkového přežití ve srovnání s placebem. Je tomu tak i u nemocných s mutací KRAS (HR pro přežití bez progrese 0,77) nebo s negativitou EGFR, ať již při hodnocení IHC (HR 0,77), nebo FISH (HR 0,81), nebo při „divokém“ typu genu EGFR (HR 0,78) [19].
Přímé srovnání erlotinibu s chemoterapií ve druhé linii léčby bylo cílem studie TITAN [24], v níž bylo 424 pacientů s progresí nemoci po 4 cyklech chemoterapie obsahující platinový dublet randomizováno v poměru 1 : 1 do skupin s erlotinibem vs. s docetaxelem nebo s paklitaxelem (podle rozhodnutí zkoušejícího). Primárním cílem bylo celkové přežití. Mezi rameny s erlotinibem a chemoterapií nebyl zaznamenán rozdíl v celkovém přežití: medián 5,3 měsíce při léčbě erlotinibem vs. 5,5 měsíce při podávání chemoterapie (HR 0,96; 95% CI: 0,78–1,19; p = 0,73); podobně u pacientů s PFS nedosáhl rozdíl statistické významnosti – představoval 6,3 týdne při léčbě erlotinibem vs. 8,6 týdne při chemoterapii (HR 1,19; p = 0,09). Závažné nežádoucí účinky související s léčbou se vyskytly při léčbě erlotinibem u 1 % pacientů, zatímco při chemoterapii u 6,6 % pa-cientů. Léčba erlotinibem má ve srovnání s chemoterapeutiky srovnatelnou účinnost, ale při nižším výskytu závažných nežádoucích účinků.
![Graf 6 Aktualizovaná analýza přežití bez progrese (PFS) – všichni randomizovaní pacienti (ITT); podle [21] – Zhou, et al., 2010.](https://www.remedia.cz/photo-a-28733---.jpg) Aktivační mutace genu EGFR, která se vyskytuje asi u 10–15 % kavkazské populace, se jeví jako výrazný prediktivní marker účinnosti inhibitorů TK. Ve studii OPTIMAL [21], která hodnotila erlotinib u asijských pacientů s aktivační mutací EGFR v 1. linii léčby NSCLC, prodloužil erlotinib čas do zhoršení příznaků (PFS) na více než jeden rok a téměř jej ztrojnásobil oproti pacientům léčeným standardní chemoterapií (mPFS 13,1 vs. 4,6 měsíce, HR 0,16; p < 0,0001), viz graf 6. Po jednom roce od zahájení terapie byla více než polovina pacientů (56 %) s NSCLC s aktivační mutací EGFR léčených erlotinibem bez příznaků onemocnění, zatímco u pacientů léčených chemoterapií bylo bez příznaků onemocnění jen 1,7 %. Navíc došlo u pacientů léčených erlotinibem ke zmenšení nádoru ve více než dvojnásobném počtu případů ve srovnání s ramenem s chemoterapií (83 % vs. 36 %, p < 0,00001). Výsledky studie OPTIMAL a studie EURTAC, která hodnotí erlotinib u evropských pacientů s aktivační mutací EGFR, budou jako další argument předloženy Evropské lékové agentuře (EMA), která v současné době rozhoduje o rozšíření indikace erlotinibu v monoterapii o 1. linii léčby pacientů s NSCLC s aktivační mutací EGFR.
Aktivační mutace genu EGFR, která se vyskytuje asi u 10–15 % kavkazské populace, se jeví jako výrazný prediktivní marker účinnosti inhibitorů TK. Ve studii OPTIMAL [21], která hodnotila erlotinib u asijských pacientů s aktivační mutací EGFR v 1. linii léčby NSCLC, prodloužil erlotinib čas do zhoršení příznaků (PFS) na více než jeden rok a téměř jej ztrojnásobil oproti pacientům léčeným standardní chemoterapií (mPFS 13,1 vs. 4,6 měsíce, HR 0,16; p < 0,0001), viz graf 6. Po jednom roce od zahájení terapie byla více než polovina pacientů (56 %) s NSCLC s aktivační mutací EGFR léčených erlotinibem bez příznaků onemocnění, zatímco u pacientů léčených chemoterapií bylo bez příznaků onemocnění jen 1,7 %. Navíc došlo u pacientů léčených erlotinibem ke zmenšení nádoru ve více než dvojnásobném počtu případů ve srovnání s ramenem s chemoterapií (83 % vs. 36 %, p < 0,00001). Výsledky studie OPTIMAL a studie EURTAC, která hodnotí erlotinib u evropských pacientů s aktivační mutací EGFR, budou jako další argument předloženy Evropské lékové agentuře (EMA), která v současné době rozhoduje o rozšíření indikace erlotinibu v monoterapii o 1. linii léčby pacientů s NSCLC s aktivační mutací EGFR.
Léčba inhibitory EGFR je obecně považována za velmi bezpečnou, tyto léky nemají hematologickou toxicitu. Nejčastějším nežádoucím účinkem erlotinibu je kožní toxicita (rash), kterou lze pozorovat u většiny nemocných. Zpravidla dosahuje jen mírného až středního stupně a ve většině případů se během krátké doby spontánně zmírňuje, při přetrvávání je možno dávku redukovat.
Molekulárně cílená léčba inhibitory TK v 1. linii NSCLC nesoucích aktivační mutace EGFR získala kromě dosavadních [25, 26] i další doporučení – po ASCO guidelines i doporučení konference ESMO-ECCO 2011 ve Stockholmu.
Postavení monoklonálních protilátek proti EGFR v léčbě NSCLC
Cetuximab je monoklonální protilátka proti EGFR, blokuje přímo extracelulární část receptoru pro epidermální růstový faktor. Inhibitory TK naopak interferují s intracelulární signální dráhou. Tato protilátka zabíjí buňky přímým působením na EGFR, ale také cestou imunologických mechanismů (protilátkou zprostředkovaná buněčná toxicita). Účinnost cetuximabu byla prokázána ve studii FLEX [27], kde byli nemocní léčeni kombinací této protilátky s chemoterapií ve složení vinorelbin–cisplatina. Byl zde doložen jak přínos v celkovém přežití proti samotné chemoterapii, tak i ve frekvenci léčebných odpovědí. Ve studii FLEX nebyly nalezeny biomarkery, které by mohly sloužit jako prediktor účinnosti cetuximabu. V současnosti není cetuximab v Evropské unii schválen pro léčbu NSCLC, ale v USA je součástí doporučení pro léčbu tohoto onemocnění. V Evropské unii probíhá nyní řízení o registraci u subpopulace nemocných s vysokou expresí proteinu EGFR, probíhají validace skórovacího testu založeného na imunohistochemickém vyšetření.
Postavení monoklonálních protilátek proti VEGF v léčbě NSCLC
Druhou nejčastěji používanou skupinou biologických léků podávaných pacientům s NSCLC jsou monoklonální protilátky proti VEGF. Vznik nových cév, které přivádějí živiny a kyslík k nádoru, je nezbytnou podmínkou růstu i metastazování nádoru. Protože VEGF je nádorem produkován trvale, je nutná i trvalá blokáda signální cesty VEGF–receptor VEGF, a to nejméně do progrese nádoru (i po ukončení souběžně podávané chemoterapie). Řada preklinických i klinických dat naznačuje, že antiangiogenní léčba by měla pokračovat i po progresi nemoci souběžně s jiným druhem léčby (další linie chemoterapie, jiná cílená léčba).
Zatím jediným přípravkem registrovaným pro antiangiogenní léčbu NSCLC je humanizovaná monoklonální protilátka proti VEGF bevacizumab – ten je indikován k první linii léčby nemocných s NSCLC jiného histologického typu než predominantně z dlaždicových buněk v kombinaci se standardním platinovým režimem chemoterapie, po jejímž ukončení je podáván dále až do progrese. Účinnost a bezpečnost bevacizumabu byla prokázána ve dvou studiích fáze III (E4599 a AVAiL) a v rozsáhlé studii fáze IV SAiL [28–32].
![Graf 7 Přežití u pacientů s adenokarcinomem; podle [28] – Sandler, et al., 2006.](https://www.remedia.cz/photo-a-28734---.jpg) V americké studii E4599 [28] byl bevacizumab (15 mg/kg každé 3 týdny) podáván společně s režimem karboplatina–paklitaxel. Oproti samotné chemoterapii měli pacienti v rameni s bevacizumabem vyšší četnost odpovědí (35 % vs. 15 %), delší přežití bez progrese (6,2 vs. 4,5 měsíce, HR 0,66; p < 0,001) i delší celkové přežití (12,3 vs. 10,3 měsíce, HR 0,79; p = 0,003). V podskupině nemocných s adenokarcinomem pak bylo dosaženo dosud nejdelšího pozorovaného přežití – 14,2 měsíce (HR 0,69), viz graf 7.
V americké studii E4599 [28] byl bevacizumab (15 mg/kg každé 3 týdny) podáván společně s režimem karboplatina–paklitaxel. Oproti samotné chemoterapii měli pacienti v rameni s bevacizumabem vyšší četnost odpovědí (35 % vs. 15 %), delší přežití bez progrese (6,2 vs. 4,5 měsíce, HR 0,66; p < 0,001) i delší celkové přežití (12,3 vs. 10,3 měsíce, HR 0,79; p = 0,003). V podskupině nemocných s adenokarcinomem pak bylo dosaženo dosud nejdelšího pozorovaného přežití – 14,2 měsíce (HR 0,69), viz graf 7.
Ve studii AVAiL [30] byl bevacizumab podáván ve dvou různých dávkách, a to 7,5 mg/kg nebo 15 mg/kg každé 3 týdny společně s chemoterapeutickým režimem, který je v Evropě běžnější: cisplatina–gemcitabin. Ve srovnávacím rameni bylo s chemoterapií podáváno placebo. Rovněž v této studii bylo dosaženo vyšší četnosti odpovědí v ramenech s bevacizumabem než v rameni s placebem (34 % vs. 20 %) a delšího přežití bez progrese (6,8 vs. 6,2 měsíce, HR 0,75; p = 0,0003), nebylo však dosaženo statisticky významného prodloužení celkového přežití (13,6 vs. 13,1 měsíce, HR 0,93; p = 0,42). Příčinou může být i skutečnost, že v rameni s placebem bylo dosaženo neobvykle dlouhého přežití, což může být důsledkem toho, že téměř dvě třetiny nemocných absolvovaly léčbu další linie, včetně léčby erlotinibem.
Do studie fáze IV SaiL [32], v níž byl bevacizumab přidán ke standardnímu režimu chemoterapie první linie, pak bylo zařazeno přes 2000 nemocných. V této studii, ve které byli nemocní léčeni „v podmínkách běžné klinické praxe“, bylo dosaženo četnosti odpovědí 50,8 %, střední doba do progrese činila 7,8 měsíce a doba středního celkového přežití 15,3 měsíce. Přidání bevacizumabu nevedlo k významnému zvýšení četnosti či závažnosti nežádoucích příhod, nejčastěji byla pozorována hypertenze, která byla ve většině případů zvládnutelná běžnou medikací. Vyloučením nemocných s dlaždicobuněčným karcinomem bylo redukováno riziko závažného krvácení, incidence hemoptýzy stupně 3/4 ve studii SAiL byla 0,4 %, což odpovídá incidenci u nemocných s plicními nádory léčenými jinak.
Dosud nebyl nalezen žádný prediktivní faktor pro výběr nemocných k léčbě bevacizumabem. Exprese VEGF u řady nádorů koreluje s prognózou nemoci, nebyl však zjištěn vztah mezi expresí VEGF a účinností léčby. Vzhledem k tomu, že antiangiogenní léčba je cílena na „normální“ endotelové buňky a nikoli na nádor, nelze předpokládat, že by se zde mohly uplatnit například mutace genu či různá exprese signálních molekul.
Další molekulárně cílená léčiva?
Dalším léčivem molekulárně cíleným – tentokrát na aktivační mutace genu ALK (anaplastic lymphoma kinase) – je crizotinib. Aktivační mutace genu ALK se nacházejí u anaplastických velkobuněčných lymfomů, NSCLC, neuroblastů a některých vzácných sarkomů – tyto nádory se souhrnně označují jako ALK-omy. Nicméně, jen asi 3–5 % nemocných s NSCLC má tuto mutaci v nádorové tkáni prokazatelnou. Na sympoziu společnosti Pfizer zazněly první zkušenosti s léčbou celkem 136 nemocných z 22 zemí ze 151 center. Frekvence léčebných odpovědí dosáhla v daném souboru 51 % (1 kompletní a 66 parciálních odpovědí nádorů na léčbu) [33]. K závažným nežádoucím účinkům ve 3.–4. skupině patřily jen u 1,5 % pacientů souboru slabost a u 7,3 % vzestup hladiny alaninaminotrans-ferázy. Doba do dosažení léčebné odpovědi byla 6,1 týdne (v rozmezí 51–24,3 tý-dne), 79,4 % odpovědí se prokázalo během prvních 8 týdnů terapie, čas do progrese nádoru činil 10 měsíců. Z nežádoucích účinků se při léčbě crizotinibem uvádí i zhoršené vidění, při vyhodnocení daného souboru nemocných však byly nežádoucí oční příznaky vyhodnoceny jako minimální [34].
Molekulárně cílená léčba je významným příslibem pro pacienty s tímto zatím nevyléčitelným onemocněním. Dokončené studie prokazují jasný přínos cílené léčby. S jejich pomocí prodlužujeme přežití nemocných daleko za hranici jednoho roku, což bylo při léčbě standardní chemoterapií nedosažitelné.
Závěr
Článek shrnuje současné možnosti cílené terapie pacientů s NSCLC. Histologie umožňuje indikovat účinnější léčbu peme-trexedem u adenokarcinomů a anaplastických velkobuněčných karcinomů. Cílená léčba gefitinibem a erlotinibem přináší významný prospěch u nemocných s adenokarcinomy nesoucími mutace genu EGFR.
V přehledu jsou uvedeny výsledky nejvýznamnějších klinických studií, které dokládají přínos kombinace chemoterapie a be-vacizumabu a kombinace chemoterapie a cetuximabu.
Novým a cíleným preparátem, jehož podávání přináší významný prospěch nemocným s fúzemi genu EML-ALK, je crizotinib. Tento preparát je v současnosti dostupný na základě výsledků genetického vyšetření v rámci tzv. programu časného přístupu.
Cílená terapie je další kapitolou terapie NSCLC, zejména u nemocných v pokročilých stadiích nádorových onemocnění.
Seznam použité literatury
- [1] Shiraishi K, Kohno T, Tanai C, et al. Association of DNA Repaire Gene Polymorphisms With Re-sponse to Platinum-Based Doublet Chemotherapy in Patients With Non-Small-Cell Lung Cancer. J Clin Oncol 2010; 28: 4945–4952.
- [2] Feng JF, Wu JZ, Hu SN, et al. Polymorphisms of the ribonucleotide reductase M1 gene and sensitivity to platin-based chemotherapy in non-small cell lung cancer. Lung Cancer 2009; 66: 344–349.
- [3] Adams VR, Harvey RD. Histological and genetic markers for non-small-cell lung cancer: Customizing treatment based on individual tumor biology. Am J Health Syst Pharm 2010; 67: S3–S9.
- [4] Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small cell lung cancer to gefitinib. N Engl J Med 2004; 350: 2129–2139.
- [5] Paez JG, Janne PA, Lee JC, et al. EGFR mutations in lung cancer: correlation with clinical re-sponse to gefitinib therapy. Science 2004; 304: 1497–1500.
- [6] Scagliotti GV, Parikh P, von Pawel J, et al. Phase III Study Comparing Cisplatin Plus Gemcitabi-ne With Cisplatin Plus Pemetrexed in Chemo-therapy-Naive Patients With Advanced-Stage Non-Small-Cell Lung Cancer. J Clin Oncol 2008; 26: 3543–3551.
- [7] Peterson P, Park K, Fossella F, et al. Is pemetrexed more effective in adenocarcinoma and large cell lung cancer then in squamous cell carcinoma? A retrospective analysis of phase III trial of peme-trexed versus docetaxel in previously treated pa-tients with advanced non-small cell lung cancer (NSCLC): P2 328. J Thorac Oncol 2007; 2: S851.
- [8] Souhrn údajů o přípravku Alimta 500 mg, EMEA EU/1/04/290/001, http: //www.ema.europa.eu/ docs/cs_CZ/document_library/EPAR_- Product_ Information/human/000564/WC500025611.pdf, citováno 10. ledna 2012.
- [9] Ciuleanu T, Brodowicz T, Zielinski Ch, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet 2009; 374: 1432–1440.
- [10] Belani CP, Brodowicz T, Ciuleanu T, et al. Maintenance pemetrexed plus best supportive care versus placebo plus BSC: A randomized phase III study in advanced non-small cell lung cancer. J Clin Oncol 2009; 27: abstract CRA8000.
- [11] Kim ES, Hirsh V, Mok TS, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet 2008; 372: 1809–1818.
- [12] Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or Carboplatin-Paclitaxel in Pulmonary Adenocarcinoma. N Engl J Med 2009; 361: 947–957.
- [13] Yang C-H, Fukuoka M, Mok TS. Final overall survival (OS) results from a phase III, randomised, open-label, first-line study of gefitinib (G) V carboplatin/paclitaxel (C/P) in clinically selected patients with advanced non-small cell lung cancer (NSCLC) in Asia (IPASS). Ann Oncol 2010; 21: viii1–viii12.
- [14] Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010; 11: 121–128.
- [15] Drug Substance IRESSATM (gefitinib, ZD1839), Project Code D7913000000, Editn Number 14, Investigator’s Brochure, 25 Feb 2009.
- [16] Sanford M, Scott LJ. Gefitinib – A Review of its Use in the Treatment of Locally Advanced/Meta-static Non-Small Cell Lung Cancer. Drugs 2009; 69: 2303–2328.
- [17] Uruga H, Kishi K, Fujii T, et al. Efficacy of Gefitinib for Elderly Patients with Advanced Non-Small Cell Lung Cancer Harboring Epidermal Growth Factor Receptor Gene Mutations: A Retrospective Analysis. Inter Med 2010; 49: 103–107.
- [18] Shepherd FA, Rodrigues PJ, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353: 123–132.
- [19] Cappuzzo F, Ciuleanu T, Stelmakh L, et al. SATURN: A double-blind, randomized, phase III study of maintenance erlotinib versus placebo following nonprogression with first-line platinum-based chemotherapy in patients with advanced NSCLC. J Clin Oncol 2009; 27: abstract 8001.
- [20] Clark GM, Zborowski DM, Santabarbara P, et al. Smoking history and epidermal growth factor receptor expression as predictors of survival benefit from erlotinib for patients with non-small-cell lung cancer in the National Cancer Institute of Canada Clinical Trials Group study BR.21. Clin Lung Cancer 2006; 7: 389–394.
- [21] Zhou C, Wu Y-L, Chen G, et al. Efficacy results from the randomized phase III OPTIMAL (CTONG 0802) study comparing first-line erlotinib versus carboplatin plus gemcitabine, in Chinese advanced nonsmall-cell lung cancer patients. Ann Oncol 2010; 21: abstract LBA13.
- [22] Rosell R, Viteri S, Molina MA, et al. Epidermal growth factor receptor tyrosine kinase inhibitors as first-line treatment in advanced non small-cell lung cancer. Cur Opin Oncol 2010; 22: 112–120.
- [23] Brugger W, et al. Molecular markers and clinical outcome with erlotinib: results from the phase III placebo-controlled SATURN study of maintenance therapy for advanced NSCLC. Abstracts 13th World Conference on Lung Cancer – B9.1.
- [24] Ciuleanu T, Stelmakh L, Cicenas S, et al. Erlotinib versus docetaxel or pemetrexed as second-line therapy in patients with advanced non-small-cell lung cancer (NSCLC) and poor prognosis: efficacy and safety results from the phase III TITAN study. Chicago Multidisciplinary Symposium in Thoracic Oncology 2010: Abstract LBOA5.
- [25] Dahabreh IJ, Linardou H, Siannis F, et al. Somatic EGFR Mutation and Gene Copy Gain as Predictive Biomarkers for Response to Tyrosine Kinase Inhibitors in Non-Small Cell Lung Cancer. Clin Cancer Res 2010; 16: 291–303.
- [26] Minegishi Y, Maemondo M, Okinaga S, et al. First-line gefitinib therapy for elder advanced non-small cell lung cancer patients with epidermal growth factor receptor mutations: Multicenter phase II trial (NEJ 003 study). J Clin Oncol 2010; 28: ASCO Meeting Abstract 7561.
- [27] Pirker R, Pereira JR, Szczesna A, et al. Cetuximab plus chemotherapy in patients with advanced non-small-cell lung cancer (FLEX): an open-label randomised phase III trial. Lancet 2009; 373: 1525–1531.
- [28] Sandler A, Gray R, Perry MC, et al. Paclitaxel-Carboplatin Alone or with Bevacizumab for Non-Small-Cell Lung Cancer. N Engl J Med 2006; 355: 2542–2450.
- [29] Sandler A, Kong G, Strickland D, et al. Treatment Outcomes by Tumor Histology in Eastern Cooperative Group (ECOG) Study E4599 of Bevacizumab (BV) with Paclitaxel/Carboplatin (PC) for Advanced Non-small Cell Lung Cancer (NSCLC) [abstract 133]. J Thor Oncol 2008; 3: S283.
- [30] Reck M, von Pawel J, Zatloukal P, et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol 2009; 27: 1227–1234.
- [31] Manegold C, von Pawel J, Zatloukal P, et al. BO17704 (AVAIL): a phase III randomised study of first-line bevacizumab combined with cisplatin/gemcitabine (cg) in patients (pts) with advanced or recurrent non-squamous, non-small cell lung cancer (NSCLC). ESMO 2008: Ann Oncol 2008; 19; Abstract LBA1.