Inzulinová analoga a jejich postavení v léčbě diabetu
Cílem léčby pacientů s diabetem je efektivně kompenzovat onemocnění a zabránit tak vzniku pozdních komplikací. Zahájení léčby inzulinem je vždy zásadním rozhodnutím. Dostupná škála inzulinů jednoznačně umožňuje přizpůsobit typ inzulinového režimu individuálním potřebám životního stylu pacienta. Inzulinová analoga jako biosynteticky připravené molekuly inzulinů mají předvídatelné nástupy a trvání účinku ve srovnání s klasickými humánními inzuliny. U diabetiků 1. typu jsou pro zabezpečení flexibility režimu lékem první volby. Glykemická kontrola pacientů s diabetem 2. typu se progresivně zhoršuje v závislosti na inzulinové rezistenci a snižování aktivity b-buněk, ale většina pacientů postupně k inzulinoterapii dospěje. Inzulinová analoga poskytují možnost cíleně zasáhnout v různé fázi progrese onemocnění a docílit požadovaných hodnot kompenzace.
Úvod
Prevalence diabetu ve světě rychle stoupá, do roku 2025 se předpokládá 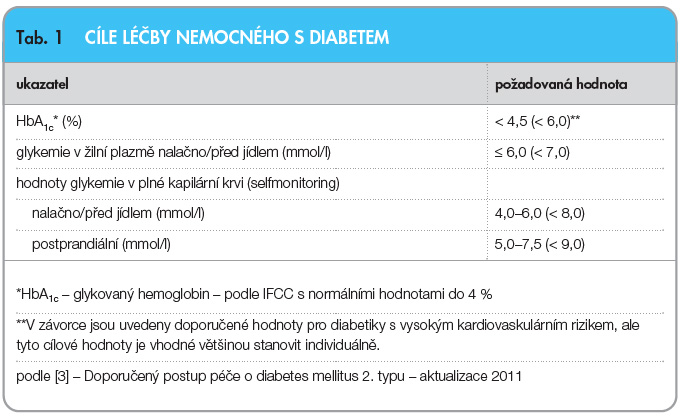 nárůst na 333 milionů pacientů – tedy zvýšení o 72 %. Nekontrolovaný diabetes vede ke vzniku závažných komplikací, jako jsou srdeční onemocnění, cévní mozkové příhody, hypertenze, slepota, selhání ledvin a postižení nervového systému. Studie DCCT [1] a UKPDS [2] prokázaly, že těsná kontrola glykemie může vést ke snížení mikrovaskulárních a některých makrovas-kulárních komplikací diabetu. Na základě studií byly definovány cíle kompenzace onemocnění – v České republice jsou stanoveny Českou diabetologickou společností, viz tab. 1. [3]
nárůst na 333 milionů pacientů – tedy zvýšení o 72 %. Nekontrolovaný diabetes vede ke vzniku závažných komplikací, jako jsou srdeční onemocnění, cévní mozkové příhody, hypertenze, slepota, selhání ledvin a postižení nervového systému. Studie DCCT [1] a UKPDS [2] prokázaly, že těsná kontrola glykemie může vést ke snížení mikrovaskulárních a některých makrovas-kulárních komplikací diabetu. Na základě studií byly definovány cíle kompenzace onemocnění – v České republice jsou stanoveny Českou diabetologickou společností, viz tab. 1. [3]
![Graf 1 Pravděpodobnost dosažení HbA1c < 6,5 % během 4–6 měsíců po zahájení inzulinoterapie; podle [4] – Tajima, et al., 2007.](https://www.remedia.cz/photo-a-28571---.jpg) Inzulin byl poprvé použit pro léčbu diabetu 1. typu, který je charakterizován rychlou ztrátou funkce b-buněk na základě imunitního procesu. Diabetem mellitem 1. typu trpí 5–10 % z celkového počtu diabetiků a prevalence tohoto onemocnění je stabilní. Naopak diabetes mellitus 2. typu vykazuje každoročně závažný vzestup. Přes-tože jsou tito pacienti od počátku léčeni dietou, změnou životního stylu, metforminem, kombinací dalších perorálních antidiabetik či inkretiny, řada z nich postupně přechází k léčbě inzulinem. V grafu 1 [4] je uvedeno, jaké procento pacientů na různých úrovních kompenzace svého onemocnění dosáhne hodnot HbA1c nižších než 6,5 % (DCCT), pokud je zahájena terapie inzulinem.
Inzulin byl poprvé použit pro léčbu diabetu 1. typu, který je charakterizován rychlou ztrátou funkce b-buněk na základě imunitního procesu. Diabetem mellitem 1. typu trpí 5–10 % z celkového počtu diabetiků a prevalence tohoto onemocnění je stabilní. Naopak diabetes mellitus 2. typu vykazuje každoročně závažný vzestup. Přes-tože jsou tito pacienti od počátku léčeni dietou, změnou životního stylu, metforminem, kombinací dalších perorálních antidiabetik či inkretiny, řada z nich postupně přechází k léčbě inzulinem. V grafu 1 [4] je uvedeno, jaké procento pacientů na různých úrovních kompenzace svého onemocnění dosáhne hodnot HbA1c nižších než 6,5 % (DCCT), pokud je zahájena terapie inzulinem.
Inzulinová analoga, biosynteticky připravené inzuliny
Inzulinová analoga jsou biosynteticky připravené inzuliny, které se od humánních inzulinů liší výměnou aminokyselin na určitých pozicích, čímž dosahují svých spe-cifických vlastností a účinků. V tab. 2 [5] jsou uvedeny dostupné druhy inzulinových analog: ultrakrátce působící (prandiální), dlouhodobá (bazální), stabilizované směsi ultrakrátce působícího a středně dlouho působícího inzulinu (premixované inzuliny, tzv. premixy). Tři ultrakrátce působící inzulinová analoga (glulisin, lispro, aspart) mají podobné účinky, které nastupují do 10–15 minut s maximem působení mezi 30.–45. minutou po aplikaci a ovlivňují postpran-diální glykemii. Dvě bazální dlouhodobá analoga (detemir a glargin) mají 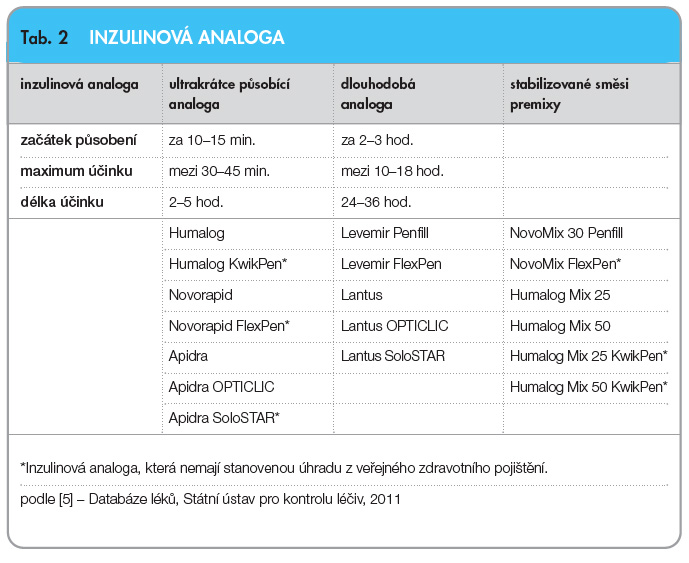 naopak velmi protrahovaný 24hodinový účinek bez vrcholu. Mají nízkou variabilitu, a tím zabezpečují menší kolísání glykemií, menší počet hypoglykemií (především nočních) a dobře ovlivňují glykemii nalačno. Tři stabilizované směsi inzulinů (premixy) představují neutrální suspenze protamin-zink inzulinu (aspart nebo lispro) v roztoku ultrakrátce působícího inzulinu (aspart nebo lispro) s různým poměrem obou složek (50/50, 75/25, 70/30). Inzulinová analoga jsou určena pro aplikaci pomocí inzulinových dávkovačů, nově jsou k dispozici již přímo předplněné jednorázové aplikátory. Ultrakrátce působící analoga v lahvičkách o objemu 10 ml se přetahují do zásobníků inzulinových pump.
naopak velmi protrahovaný 24hodinový účinek bez vrcholu. Mají nízkou variabilitu, a tím zabezpečují menší kolísání glykemií, menší počet hypoglykemií (především nočních) a dobře ovlivňují glykemii nalačno. Tři stabilizované směsi inzulinů (premixy) představují neutrální suspenze protamin-zink inzulinu (aspart nebo lispro) v roztoku ultrakrátce působícího inzulinu (aspart nebo lispro) s různým poměrem obou složek (50/50, 75/25, 70/30). Inzulinová analoga jsou určena pro aplikaci pomocí inzulinových dávkovačů, nově jsou k dispozici již přímo předplněné jednorázové aplikátory. Ultrakrátce působící analoga v lahvičkách o objemu 10 ml se přetahují do zásobníků inzulinových pump.
Diabetes mellitus 1. typu
Kombinace ultrakrátce působících a bazálních analog v režimu bazál/bolus představuje pro diabetiky 1. typu léčebný postup první volby. Heller a kol. [6] srovnávali inzulin aspart s krátkodobým humánním inzulinem u diabetiků 1. typu v režimu bazál/bolus a prokázali 70% redukci nočních hypoglykemií ve skupině pacientů léčených aspartem. Metaanalýza studií [7], která zahrnovala více než 2500 diabetiků 1. typu, prokázala při terapii inzulinem lispro 25% redukci těžkých hypoglykemií oproti terapii krátkodobým humánním inzulinem. Velmi příznivé výsledky v terapii diabetu 1. typu vykazují rovněž dlouhodobá bazální analoga. Ratner a kol. [8] porovnávali inzulin glargin s NPH inzulinem v režimu bazál/bolus u diabetiků 1. typu. Studie dokumentovala ve skupině s glarginem signifikantní redukci symptomatických hypoglykemií – 39,9 % oproti 49,2 % – a nočních hypoglykemií – 18,2 % oproti 27,1 %. Prospektivní studie ATLANTUS [9] prokázala u diabetiků 1. typu bezpečnost převodu z jiného intenzifikovaného inzulinového režimu na terapii inzulinem glarginem – došlo k významnému zlepšení metabolické kompenzace s nízkým výskytem hypoglykemií bez ohledu na způsob zvolené titrace. Mezi novou generaci inzulinových analog patří inzulin degludec s tzv. ultradlouhodobým účinkem (u diabetiků 2. typu může stačit aplikace jen 3krát týdně), nízkou variabilitou a minimalizovaným mitogenním potenciálem.
Diabetes mellitus 2. typu
Diabetes mellitus 2. typu je progresivní onemocnění, nejčasnějším defektem je deficit časné fáze inzulinové sekrece. V době diagnózy onemocnění může mít pacient ztrátu již kolem 50 % sekrece inzulinu. Terapie se tedy musí přizpůsobovat fázi vývoje onemocnění tak, aby byly vyrovnávány jak postprandiální, tak lačné hyperglykemie. Ve studii ACCORD [10] vedla maximální snaha dosáhnout normoglykemie u pacientů se zvýšeným kardiovaskulárním rizikem k výskytu častých hypoglykemií (4,6/100 pacientů/rok), a tím i k možnosti zvýšení kardiovaskulární mortality. Desetileté prodloužení (follow-up) studie UKPDS [11] prokázalo nezbytnost snahy o dobrou kompenzaci onemocnění již od počátku stanovení diagnózy. Dobrá glykemická kontrola se projeví v prevenci kardiovaskulárních komplikací s určitým prodlením (tzv. glykemická paměť), přísná kontrola diabetu je přínosná v prevenci aterosklerotických komplikací, jen pokud trvá dostatečně dlouho. Kritériem správnosti výběru terapie je výsledné zlepšení kompenzace především dle hodnoty glykovaného hemoglobinu a nepřítomnost nežádoucích účinků (zvláště hypoglykemií). V případě, že léčba nemá tyto požadované efekty, musíme se společně s pacientem rozhodnout, že ji ukončíme a změníme.
Kombinace perorálních antidiabetik s bazálním analogem
Podle doporučení ADA/EASD (American Diabetes Association/European Association for the Study of Diabetes) pro léčbu diabetu 2. typu (obr. 1) [12] můžeme využít kombinaci s bazálním inzulinem již ve druhém kroku, pokud nedosáhneme hodnoty glykovaného hemoglobinu nižší než 7 % (dle DCCT či 5,4 % dle IFCC) jen změnou životního stylu a terapií metfor-minem. Celá řada studií prokázala výhodnější profil účinku bazálních analog ve srovnání s NPH inzulinem. Philis-Tsimikas a kol. [13] srovnávali terapii bazálním analogem detemirem a ![Obr. 1 Doporučení ADA/EASD 2009 pro léčbu DM 2. typu; podle [12] – Nathan et al., 2009.](https://www.remedia.cz/photo-a-28573---.jpg) humánním střednědobým inzulinem NPH u špatně kompenzovaných diabetiků 2. typu léčených perorálními antidiabetiky. Počet nočních hypoglykemií ve skupině s detemirem byl oproti skupině s NPH redukován o 87 %, ve skupině s detemirem aplikovaným večer se prokázaly i nižší hmotnostní přírůstky, a to 0,7 kg vs. 1,6 kg s NPH (p = 0,005) při srovnatelné kompenzaci. Detemir měl v clampových studiích [14] větší účinek na periferní glukózovou utilizaci a menší účinek na supresi endogenní glukózové produkce než NPH. Jeho 98% vazba na albumin v cirkulaci vede k plnému přístupu k hepatocytům cestou hepatických sinusoid, a tím k fyziologičtějšímu účinku. Rovněž nízký obsah albuminu v cerebrospinální tekutině relativně zvyšuje přístup k receptorům CNS. Tím se vysvětlují pozitivní účinky detemiru na hmotnost u diabetiků 2. typu. Byly ověřeny i ve studii PREDICTIVE [15], kdy rozdíl hmotnosti skupiny léčené 26 týdnů detemirem byl oproti pacientům léčeným NPH -1,5 kg (p < 0,0001). Další studií, jež se zabývala efektem bazálního analoga na dosažení cílů kompenzace, byla studie TITRATE [16]. Do této 20týdenní studie bylo zařazeno 244 diabetiků 2. typu špatně kontrolovaných perorálními antidiabetiky, s hodnotami glykovaného hemo-globinu v rozmezí 7–9 % (DCCT). Studie ověřovala dva titrační postupy: jeden titroval inzulin detemir v bazále po 3 IU večer na hodnoty glykemie nalačno 3,9–5,0 mmol/l a druhý na 4,4–6,1 mmol/l. V celém souboru dosáhlo hodnoty HbA1c < 7 % (DCCT) 59,4 % pacientů. Přes výrazné zlepšení kompenzace onemocnění zaznamenala studie jen velmi nízký počet hypo-glykemií (< 8 příhod celkově, < 3 noční hypoglykemie na pacienta/rok v cílové skupině s rozmezím hodnot 3,9–5 mmol/l a jen jednu větší hypoglykemii v této titrační skupině). Hmotnostní přírůstky byly velmi nízké a mezi skupinami se signifikantně nelišily, dávky inzulinu IU/kg byly srovnatelné. Současné doporučení pro dávko-vání detemiru v bazále je 0,1–0,2 IU/kg nebo 10 IU v zahajovací dávce večer a dále titrace po 2 IU k dosažení glykemie nalačno v rozmezí hodnot 4,1–6,0 mmol/l.
humánním střednědobým inzulinem NPH u špatně kompenzovaných diabetiků 2. typu léčených perorálními antidiabetiky. Počet nočních hypoglykemií ve skupině s detemirem byl oproti skupině s NPH redukován o 87 %, ve skupině s detemirem aplikovaným večer se prokázaly i nižší hmotnostní přírůstky, a to 0,7 kg vs. 1,6 kg s NPH (p = 0,005) při srovnatelné kompenzaci. Detemir měl v clampových studiích [14] větší účinek na periferní glukózovou utilizaci a menší účinek na supresi endogenní glukózové produkce než NPH. Jeho 98% vazba na albumin v cirkulaci vede k plnému přístupu k hepatocytům cestou hepatických sinusoid, a tím k fyziologičtějšímu účinku. Rovněž nízký obsah albuminu v cerebrospinální tekutině relativně zvyšuje přístup k receptorům CNS. Tím se vysvětlují pozitivní účinky detemiru na hmotnost u diabetiků 2. typu. Byly ověřeny i ve studii PREDICTIVE [15], kdy rozdíl hmotnosti skupiny léčené 26 týdnů detemirem byl oproti pacientům léčeným NPH -1,5 kg (p < 0,0001). Další studií, jež se zabývala efektem bazálního analoga na dosažení cílů kompenzace, byla studie TITRATE [16]. Do této 20týdenní studie bylo zařazeno 244 diabetiků 2. typu špatně kontrolovaných perorálními antidiabetiky, s hodnotami glykovaného hemo-globinu v rozmezí 7–9 % (DCCT). Studie ověřovala dva titrační postupy: jeden titroval inzulin detemir v bazále po 3 IU večer na hodnoty glykemie nalačno 3,9–5,0 mmol/l a druhý na 4,4–6,1 mmol/l. V celém souboru dosáhlo hodnoty HbA1c < 7 % (DCCT) 59,4 % pacientů. Přes výrazné zlepšení kompenzace onemocnění zaznamenala studie jen velmi nízký počet hypo-glykemií (< 8 příhod celkově, < 3 noční hypoglykemie na pacienta/rok v cílové skupině s rozmezím hodnot 3,9–5 mmol/l a jen jednu větší hypoglykemii v této titrační skupině). Hmotnostní přírůstky byly velmi nízké a mezi skupinami se signifikantně nelišily, dávky inzulinu IU/kg byly srovnatelné. Současné doporučení pro dávko-vání detemiru v bazále je 0,1–0,2 IU/kg nebo 10 IU v zahajovací dávce večer a dále titrace po 2 IU k dosažení glykemie nalačno v rozmezí hodnot 4,1–6,0 mmol/l.
Studie TULIP [17] měla za cíl porovnat přínos včasného zahájení léčby bazálním analogem glarginem a intenzivní změny životního stylu u diabetiků 2. typu léčených perorálními antidiabetiky s neuspokojivou kompenzací a hodnotami HbA1c 7–8 % (DCCT). Ve studii dosáhlo 66 % pacientů léčených glarginem hodnot HbA1c < 7 % (dle DCCT či 5,4 % dle IFCC), výsledná hodnota HbA1c byla 6,8 %; byla též prokázána bezpečnost léčby – velmi nízký výskyt hypoglykemií, nízký přírůstek hmotnosti (0,9 kg/9 měsíců) a nízká spotřeba inzulinu (0,27 IU/kg). Ve skupině se změnou životního stylu se nepodařilo dosáhnout požadovaného poklesu hodnoty glykovaného hemoglobinu, naopak po určité fázi zlepšení začala tato hodnota opět stoupat, zřejmě při zhoršení compliance pacientů. Doporučené dávkování glarginu vychází z pokynů ADA/EASD, zahajovací dávka 0,2 IU/kg je po třech dnech dále titrována přidáváním 2 IU na hodnotu glykemie nalačno 5,5 mmol/l. Dávka metforminu či glitazonu se většinou ponechává stejná a dle aktuálních glykemií se upravuje jen dávka sulfonylurey.
Stabilizované směsi inzulinových analog – premixy
Alternativním postupem pro zahájení inzulinoterapie je použití stabilizovaných směsí inzulinových analog – tzv. premixů. Řada studií prokázala, že aplikace premixů ve dvou denních dávkách společně s terapií metforminem může pacientovi zabezpečit dobrou kompenzaci onemocnění. Studie s názvem 1-2-3 Study [18] Garbera a kol. u 100 diabetiků neuspokojivě léčených perorálními antidiabetiky s bazálním inzulinem a nebo bez bazálního inzulinu dokumentovala po přidání postupně 1–3 dávek premixovaného bifázického inzulinu aspart 70/30 k perorálním antidiabetikům dosažení požadovaných cílů kompenzace. Po přidání již jedné dávky premixu před večeří dosáhlo 21 % pacientů HbA1c < 6,5 % (DCCT) a 41 % pacientů mělo hodnotu HbA1c < 7 %, se dvěma dávkami premixu získalo tyto hodnoty 52 % a 70 % pacientů a se třemi postupně přidávanými dávkami mělo 60 % pacientů HbA1c < 6,5 % a 77 % pacientů mělo HbA1c < 7,0 %. I tento režim lze tedy postupně intenzifikovat. Studie Rosenstocka a kol. [19] se zabývala aplikací premixů ve srovnání s intenzifikovaným inzulinovým režimem bazál/bolus. Tzv. prandiální premixovaná terapie (PPT) vy-užívala inzulinového analogového premixu 50/50, dávka vycházela z původní spotřeby inzulinu za 24 hodin rozdělené do tří dávek podávaných k hlavním jídlům. Ve skupině s prandiální premixovanou terapií se vyskytl větší počet pacientů s HbA1c < 6 %, hmotnostní přírůstky a hypoglykemie nevykazovaly ve skupinách rozdíly.
Intenzifikovaná inzulinová terapie bazál/bolus
Intenzifikovaná inzulinová terapie bazál/ bolus je určena pro pacienty, kteří akceptují náročnější inzulinový režim s více dávkami inzulinu, jsou schopni selfmonitoringu a úprav jednotlivých dávek nebo potřebují těsnější postprandiální kontrolu glykemie. Kombinace ultrakrátce působícího analoga k hlavním jídlům s bazálním dlouhodobým analogem podávaným před spaním nejlépe napodobuje fyziologickou sekreci inzulinu zdravého člověka. Bazální analog má tvořit 60–70 % z celkové dávky inzulinu. Studie GINGER [20] se zabývala zlepšením kompenzace u diabetiků 2. typu dlouhodobě léčených premixovaným inzulinem (5 6 4 roky) podávaným ve dvou denních dávkách. Pacienti byli převedeni na režim bazál/bolus s bazálním analogem glarginem a ultrakrátce působícím glulisinem podávaným ve třech denních dávkách. Počet pacientů, kteří dosáhli HbA1c ≤ 7 %, byl signifikantně vyšší ve skupině glargin–glulisin než ve skupině s premixem, a to 47 % vs. 28 % (p = 0,0004). Rovněž průměrná denní glykemie (p = 0,0033) a postprandiální glykemie (p < 0,0001) byly nižší ve skupině bazál/bolus. Těsnější kompenzace nebyla spojena s vyšším počtem hypoglykemií (p = 0,2385). I pa-cientům dlouhodobě léčeným inzulinem poskytuje režim bazál/bolus s analogy lepší glykemickou kontrolu.
Kombinace agonistů receptorů GLP-1 s inzulinovými analogy
Terapie agonisty receptorů GLP-1 (gluca-gon-like peptide 1) zasahuje přímo do patofyziologie diabetu 2. typu. Podání GLP-1 vede ke zvýšení postprandiální sekrece inzulinu a snížení sekrece glukagonu, ke zpomalení vyprazdňování žaludku, ke snížení pocitu hladu, a tím k redukci příjmu potravy. Řada studií se již zabývala kombinací inzulinu a agonistů receptorů GLP-1. Studie R. M. Bergenstala [21] a kol. sledovala skupinu 259 diabetiků 2. typu, kteří měli průměrnou hmotnost 94,4 kg, hodnotu HbA1c 8,41 % a aplikovali glargin v dávce 48 IU. Byli randomizováni do 2 skupin, jedna přidávala k inzulinu exenatid v dávce 10 µg 2krát denně a druhá placebo. Během 30 týdnů poklesla hodnota HbA1c při terapii exenatidem o 1,71 % (na 6,7 %), ve skupině s placebem o 1,0 % (na 7,41 %; p < 0,001), hmotnost poklesla o 1,8 6 0,03 kg, (p < 0,001) a zvýšila se o 1,0 6 0,3 kg ve skupině s placebem. Počet hypoglykemií byl ve skupinách srovnatelný, vedlejší gastrointestinální účinky byly častější ve skupině s exenatidem.
Bezpečnost inzulinových analog
Diabetes mellitus převážně 2. typu je spojen se zvýšeným rizikem rozvoje některých typů onkologických onemocnění (játra, pankreas, endometrium, střevo a rektum, mamma, močový měchýř). Spojení mezi diabetem a nádorovým onemocněním může být dáno společnými rizikovými faktory, jako je věk, obezita, stravování a fyzická inaktivita. Mezi možné mechanismy rozvoje nádorového onemocnění se zařazují hyperinzulinemie, hyperglykemie a zánětlivé faktory. Konsenzus ADA (American Diabetes Association) [22] publikovaný v roce 2010 v Diabetes Care doporučil pacientům s diabetem a jejich ošetřujícím lékařům, aby se důsledně zaměřili na scree-ningové programy onkologických onemocnění. Metaanalýza 8693 diabetiků 1. a 2. typu, kterou uskutečnil Dejgaard a kol. [23], prokázala při léčbě detemirem nižší nebo podobný výskyt karcinomů jako ve skupině léčené inzulinem NPH nebo glarginem. Randomizovaná klinická data z 5leté studie Rosenstocka a kol. s inzulinem glarginem oproti NPH [24] neprokázala při terapii glarginem zvýšené známky výskytu karcinomů. Velká studie ORIGIN [25] (glargin oproti placebu u pacientů s poruchou glukózové tolerance nebo nově diagnostikovaným diabetem 2. typu) zahrne 12 000 pacientů a je rozvržena na 6–7 roků, sleduje kardiovaskulární onemocnění i výskyt karcinomů. Bezpečnost ultrakrátce působících analog lispro a aspart byla potvrzena i v graviditě.
Závěr
Inzulinová analoga, inzuliny nového tisíciletí, poskytují pacientům s různými typy i fázemi vývoje diabetu plnohodnotnou a flexibilní terapii, umožňují zlepšit kvalitu života a dosáhnout požadovaných cílů kompenzace jejich chronického onemocnění.
Seznam použité literatury
- [1] The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977–986.
- [2] UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonyl-ureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837–853.
- [3] Doporučený postup péče o diabetes mellitus 2. typu – aktualizace 2011, Česká diabetologická společnost, dostupné na www.diab.cz, citováno 30. června 2011.
- [4] Tajima N, Nakagami T, Tominaga M, et al. Combined Use of Fasting Plasma Glucose and Glycated Hemoglobin A1c in a Stepwise Fashion to Detect Undiagnosed Diabetes Mellitus. Tohoku J Exp Med 2007; 213: 25–32.
- [5] Databáze léků, Státní ústav pro kontrolu léčiv, dostupné na www.sukl.cz, citováno 5. červen-ce 2011.
- [6] Heller SR, Colagiuri S, Vaaler S, et al. Hypoglycaemia with insulin aspart: a double-blind, randomised, crossover trial in subjects with type 1 diabetes. Diabet Med 2004; 21: 769–775.
- [7] Brunelle BL, Llewelyn J, Anderson JH Jr, et al. Meta-analysis of the effect of insulin lispro on severe hypoglycaemia in patients with type 1 diabetes. Diabetes Care 1998; 21: 1726–1731.
- [8] Ratner RE, Hirsch IB, Wilson CA, et al. Less hypoglycemia with insulin glargine in intensive insulin therapy for type 1 diabetes. US Study Group of Insulin Glargine in Type 1 Diabetes. Diabetes Care 2000; 23: 639–643.
- [9] Gomis R, Storms F, Conget I, et al; on behalf of the AT.LANTUS Study Group. Improving metabolic control in sub-optimally controlled subjects with type 1 diabetes: Comparison of two treatment algorithms using insulin glargine. Diabetes Res Clin Pract 2007; 77: 84–91.
- [10] ACCORD (Action to Control Cardiovascular Risk in Diabetes) Gerstein HC, Miller ME, Byington RP, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- [11] UKPDS (The United Kingdom Prospective Diabetes Study). Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–1589.
- [12] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009; 32: 193–203.
- [13] Philis-Tsimikas A, Charpentier G, Clauson P, et al. Comparison of once-daily insulin detemir with NPH insulin added to a regimen of oral antidiabetic drugs in poorly controlled type 2 diabetes. Clinic Therap 2006; 28: 1569–1581.
- [14] Russell-Jones D, Khan R. Insulin-associated weight gain in diabetes-causes, effects and coping strategies. Diabetes Obes Metab 2007; 9: 799–812.
- [15] Meneghini L, Rosenberg KH, Koenen C, et al. Insulin detemir improves glycemic control with less hypoglycemia and no weight gain in patients with type 2 diabetes who were insulin naive treated with NPH or insulin glargine: clinical practice experience from a German subgroup of the PREDICTIVE study. Diabetes Obes Metab 2007; 9: 418–427.
- [16] Blonde L, Merilainen M, Karwe V, et al. Patient-directed titration for achieving glycaemic goals using a once-daily basal insulin analogue: an assesssment of two different fasting glucose targets-the TITRATE TM study. Diab Obes Metab 2009; 11: 623–631.
- [17] Blicklé JF, Hancu N, Piletic M, et al. Insulin glargin provides greater improvements in glycaemic control vs. intensifying lifestyle management for people with type 2 diabetes treated with OADs and 7–8 % A1c levels. The TULIP study. Diabetes Obes Metab 2009; 11: 379–386.
- [18] Garber AJ, Wahlen J, Wahl T, et al. Attainment of glycaemic goals in type 2 diabetes with once-, twice-, or thrice-daily dosing with biphasic insulin aspart 70/30 (The 1-2-3 Study). Diab Obes Metab 2006; 8: 58–66.
- [19] Rosenstock J, Ahmann AJ, Colon G, et al. Advancing insulin therapy in type 2 diabetes previously treated with glargine plus oral agents: prandial premixed (insulin lispro protamine suspension/lispro) versus basal/bolus (glargine/ lispro) therapy. Diab Care 2008; 31: 20–25.
- [20] Fritsche A, Larbig M, Owens D, et al. Comparison between a basal-bolus and a premixed insulin regimen in individuals with type 2 diabetes-results of the GINGER study. Diab Obes Metab 2010; 12: 115–123.
- [21] Bergenstal RM, Buse JB, Glass LC, et al. Exena-tide added to insulin glargine-treated patients with type 2 diabetes provided excedent fasting and postprandial control with weight loss and no increased risk of hypoglycaemia. The 46th EASD Annual Meeting, Stockholm, 20.–24. 9. 2010. Diabetologia 2010; 53, Suppl. 1: S37.
- [22] Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer. A consensus report. Diab Care 2010; 33: 1674–1685.
- [23] Dejgaard A, Lynggaard H, Rastam J, et al. No evidence of increased risk of malignanciesin patients with diabetes treated with insulin detemir: a meta-analysis. Diabetologia 2009; 52: 2507–2512.
- [24] Rosenstock J, Fonseca V, McGill JB, et al. Similar risk of malignancy with insulin glargine and neutral protamine Hagedorn (NPH) insulin in patients with type 2 diabetes: findings from a 5 year randomised, open-label study. Diabetologia 2009; 52: 1971–1973.
- [25] The ORIGIN Trial (Outcome Reduction With Initial Glargine Intervention) [registered clinical trial], 2009. Clinical trial reg. No. NCT00069784, clinicaltrials.gov. Accessed 5 April 2010.