Jak optimalizovat léčbu chronického srdečního selhání farmakologickou modulací srdeční frekvence
Klidová srdeční frekvence (SF) je u nemocných s chronickým srdečním selháním významným rizikovým faktorem kardiovaskulární mortality a morbidity. Farmakologické zpomalení SF u těchto nemocných významně zlepšuje jejich prognózu. K dispozici je několik léčiv k farmakologickému zpomalení SF, jejich místo v léčbě chronického srdečního selhání se sníženou ejekční frakcí definují současná guidelines.
Digoxin je určen především ke kontrole komorové frekvence u nemocných se srdečním selháním a tachyfibrilací síní, většinou v kombinaci s betablokátory, pokud nestačí monoterapie betablokátorem. Úloha digoxinu při srdečním selhání a sinusovém rytmu je velmi sporná. Betablokátory jsou dnes spolu s inhibitory angiotenzin konvertujícího enzymu (ACE) u chronického srdečního selhání léky první volby. Snižují významně mortalitu i morbiditu. Jejich příznivý účinek je podmíněn především zpomalením SF. U části nemocných zůstává SF i při léčbě betablokátorem vyšší než 70/min. U těchto nemocných lze využít nový bradykardizující lék ivabradin, buď v kombinaci s betablokátorem nebo při jeho kontraindikaci. Dodatečné zpomalení SF dále zlepšuje prognózu nemocného.
V nedávno publikovaných Doporučených postupech pro léčbu a diagnostiku chronického srdečního selhání České kardiologické společnosti (ČKS) se vůbec poprvé objevuje jako obecný léčebný mechanismus zpomalení srdeční frekvence (SF) [1]. Také v současných guidelines Evropské kardiologické společnosti pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2012 se vůbec poprvé objevuje lék, jehož jediným účinkem je zpomalení SF [2]. Jedná se o první klinicky použitelný blokátor kanálů If v buňkách sinoatriálního uzlu ivabradin.
Farmakologické zpomalení SF ale zdaleka není novým mechanismem účinku léčiv, která jsou v léčbě srdečního selhání používána. Již více než dvě stě let jsou v kardiologii používány digitalisové glykosidy, léky, které u selhávajícího srdce zpomalují zrychlenou srdeční frekvenci, přinejmenším v klidu. A v posledních dvaceti letech se jedněmi z léků první volby u chronického systolického srdečního selhání staly betablokátory, léky, jejichž bradykardizující účinek je velmi výrazný, ne-li dominující. Další skupina bradykardizujících léků – blokátory kalciových kanálů typu L nedihydropyridinového typu verapamil a diltiazem – se v léčbě srdečního selhání neuplatnila, naopak pro svůj negativně inotropní účinek jsou tyto léky kontraindikovány. A konečně, kdysi slibný blokátor kalciových kanálů typu T mibefradil byl pro své lékové interakce, které vedly v klinické studii MACH k nárůstu mortality, před několika lety stažen z trhu [3].
Digoxin
Extrakt z náprstníku byl používán k léčbě kardiálních otoků a srdečního selhání od publikace Williama Witheringa o jeho účincích v roce 1785. Postupně byly identifikovány a syntetizovány účinné digitalisové glykosidy, z nichž do současnosti u nás přečkal pouze digoxin. Jediná provedená klinická studie s digoxinem u chronického srdečního selhání ukázala, že digoxin příznivě ovlivnil morbiditu ve smyslu snížení počtu hospitalizací pro zhoršení srdečního selhání, ale neovlivnil mortalitu [4]. To byla celkem příznivá zpráva, protože do té doby panovaly obavy, že digoxin podobně jako všechny ostatní pozitivně inotropně působící látky může mortalitu nemocných se srdečním selháním zvyšovat.
V současnosti je hlavní místo digoxinu v léčbě chronického srdečního selhání u nemocných se současnou tachyfibrilací síní ke kontrole komorové frekvence. Ani v této indikaci však není lékem preferovaným, i v této situaci jsou lékem první volby betablokátory a digoxin je používán většinou až v kombinaci s nimi. Místo di goxinu v léčbě nemocných se srdečním selháním a sinusovým rytmem je dnes rozporuplné. Někteří ho stále doporučují vyzkoušet u nemocných, kteří zůstávají symptomatičtí i přes léčbu kombinací inhibitorů systému renin-angiotenzin-aldosteron (inhibitorů angiotenzin konvertujícího enzymu – ACE – a blokátorů mineralokortikoidních receptorů) a betablokátoru, zejména mají-li výrazně sníženou ejekční frakci (EF) a dilatovanou levou komoru. Pakliže se nemocný klinicky nezlepší, měla by být léčba digoxinem ukončena. Současná evropská doporučení, která převzala i ČKS [5], jsou však k podávání digoxinu nemocným se srdečním selháním a sinusovým rytmem velmi rezervovaná a spíše ho nedoporučují (klasifikace IIb), viz tab. 1.
goxinu v léčbě nemocných se srdečním selháním a sinusovým rytmem je dnes rozporuplné. Někteří ho stále doporučují vyzkoušet u nemocných, kteří zůstávají symptomatičtí i přes léčbu kombinací inhibitorů systému renin-angiotenzin-aldosteron (inhibitorů angiotenzin konvertujícího enzymu – ACE – a blokátorů mineralokortikoidních receptorů) a betablokátoru, zejména mají-li výrazně sníženou ejekční frakci (EF) a dilatovanou levou komoru. Pakliže se nemocný klinicky nezlepší, měla by být léčba digoxinem ukončena. Současná evropská doporučení, která převzala i ČKS [5], jsou však k podávání digoxinu nemocným se srdečním selháním a sinusovým rytmem velmi rezervovaná a spíše ho nedoporučují (klasifikace IIb), viz tab. 1.
V
![Graf 1 Vztah plazmatické koncentrace digoxinu a mortality ve studii DIG; podle [6] – Adams, et al., 2005. šedá čára – mortalita při podávání placeba; červená čára – mortalita při podávání digoxinu](https://www.remedia.cz/photo-a-29241---.jpg) ýrazně se také snížily doporučené léčebné plazmatické koncentrace digoxinu, a to na 0,55–0,90 ng/ml. Důvodem k tomuto kroku byla následná analýza vztahu plazmatických koncentrací digoxinu a mortality ze studie DIG, která jasně ukázala, že při vyšších koncentracích významně narůstá mortalita [6], viz graf 1.
ýrazně se také snížily doporučené léčebné plazmatické koncentrace digoxinu, a to na 0,55–0,90 ng/ml. Důvodem k tomuto kroku byla následná analýza vztahu plazmatických koncentrací digoxinu a mortality ze studie DIG, která jasně ukázala, že při vyšších koncentracích významně narůstá mortalita [6], viz graf 1.Betablokátory
V době, kdy byl uznáván hemodynamický výklad patofyziologie srdečního selhání, byly betablokátory pro svůj negativně inotropní účinek u nemocných se srdečním selháním přísně kontraindikovány. Poté, co převládla představa, že ve vzniku a progresi srdečního selhání hraje dominující úlohu patologická neurohumorální aktivace, se na základě přesvědčivých výsledků řady klinických studií v první polovině devadesátých let minulého století staly betablokátory spolu s inhibitory ACE při chronickém srdečním selhání léky první volby [2, 5]. Tři klíčové klinické studie s třemi různými betablokátory – bisoprololem, metoprololem ZOK (zero order kinetics – léková forma s modifikovaným uvolňováním) a karvedilolem – ukázaly roční pokles mortality o přibližně 34 % a také významný pokles morbidity. Zpočátku se předpokládalo, že za tento příznivý účinek betablokátorů je zodpovědné především snížení chronické patologické aktivace sympatoadrenálního systému. Čím dál více se ale ukazuje, že hlavním mechanismem je nejspíše zpomalení SF, která je při srdečním selhání zvýšena, nepochybně také jako kompenzační mechanismus v rámci patologické sympatoadrenální aktivace [7].
Byla publikována řada studií, které přinesly důkazy o tom, že klidová SF je nezávislým a významným prediktorem rizika. Např. v největší studii u nemocných s prokázanou ischemickou chorobou srdeční (ICHS) CASS (Coronary Artery Surgery Study) byla shromážděna data od 24 913 nemocných, kteří byli sledováni po dobu takřka 15 let. Ukázalo se, že vysoká vstupní klidová SF významně zvyšovala celkovou i kardiovaskulární mortalitu [8]. Výše zmíněné klinické studie s betablokátory prokázaly, že i u srdečního selhání je bazální klidová SF nezávislým prediktorem celkové i kardiovaskulární mortality a hospitalizací pro srdeční selhání [9]. Velmi přesvědčivý důkaz o tom, že klidová SF je u nemocných s chronickým srdečním selháním významným a nezávislým prediktorem kardiovaskulárního rizika, přinesla nedávno prospektivní analýza vztahu klidové SF a výskytu kardiovaskulárních příhod v placebové větvi klinické studie SHIFT (Systolic Heart failure treatment with If inhibitor ivabradine Trial) [10].
Betablokátory mají spolu s inhibitory ACE podle současných guidelines v léčbě chronického systolického srdečního selhání nejvyšší stupeň doporučení (třída I), který je podložen těmi nejspolehlivějšími důkazy (úroveň A) [2, 5]. Léčba začíná podáváním nízké denní dávky, která má být pozvolna zvyšována tak, aby byla klidová SF snížena na 60–70/min. Čím dál více se ukazuje, že pro prognózu nemocného je důležitější léčbou dosažená SF než denní dávka betablokátoru. Posílení představy o klíčovém významu SF u srdečního selhání přinesly také některé experimentální práce, stejně jako studie u nemocných se srdečním selháním. V nich bylo demonstrováno, že zlepšení systolické funkce a klinického stavu navozené zpomalením SF léčbou betablokátorem na 60/min bylo anulováno kardiostimulací o frekvenci 80/min [11].
Ivabradin
Ivabradin je lék, který inhibuje kanály If v sinusovém uzlu. Jeho jediným známým farmakologickým účinkem je zpomalení SF u nemocných se sinusovým rytmem. Ve studii SHIFT u nemocných se srdečním selháním, sinusovým rytmem a klidovou SF ≥ 70/min, EF ≤ 35 % a ve funkční třídě II–IV podle NYHA (New York Heart Association) vedlo podávání ivabradinu ke snížení výskytu primárního ukazatele složeného z kardiovaskulárních úmrtí a hospitalizací pro srdeční selhání o 18 % (p < 0,0001); snížení kardiovaskulární ani celkové mortality nebylo významné. Snížení počtu hospitalizací pro srdeční selhání představovalo 26 %. Ivabradin také zlepšil funkci levé komory a kvalitu života [12]. Dodatečné důkazy o bezpečnosti léčby ivabradinem (i v kombinaci s betablokátory) pocházejí ze studie BEAUTIFUL [13]. O výsledcích klinické studie SHIFT a jejich interpretaci bylo v tomto časopise podrobněji referováno před rokem [7]. Klidovou SF 70/min, která byla jedním ze vstupních kritérií pro nemocné ve studii SHIFT, převzali také autoři současných evropských doporučení jako podmínku pro použití ivabradinu v léčbě chronického srdečního selhání se sníženou EF [2, 5].
Za poslední rok bylo publikováno několik dodatečných analýz ze studie SHIFT, které více osvětlily vztah mezi farmakologickým ovlivněním klidové SF a prognózou nemocných s chronickým srdečním selháním. Také přinesly další informace o vzájemném vztahu mezi léčebným účinkem betablokátorů a ivabradinu [14, 15].
Detailní analýza SF u nemocných ve studii SHIFT ukázala, že počínaje SF 70/min znamenal každý další vzestup SF o 5/min progresivně zvýšení rizika kardiovaskulárního úmrtí nebo hospitalizace pro srdeční selhání o 16 % [10]. Zatímco riziko hospitalizací pro srdeční selhání (tvořící jednu komponentu složeného klinického primárního ukazatele) jasně stoupalo již od SF 70/min, byl práh SF pro progresivní vzestup rizika kardiovaskulárního úmrtí stanoven až od SF 75/min. Na základě tohoto pozorování registrovala Evropská léková agentura (European Medicine Agency, EMA) ivabradin pro léčbu nemocných se systolickým chronickým srdečním selháním, kteří jsou adekvátně léčeni podle guidelines včetně podávání betablokátorů nebo při jejich kontraindikaci, a přitom mají klidovou SF ≥ 75/min.
P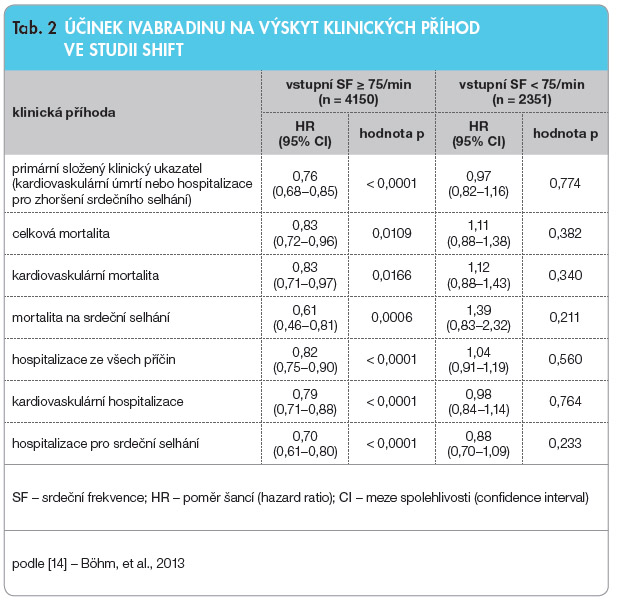 rotože ale pro tuto skupinu nemocných nebyly k dispozici žádné důkazy z klinických studií, rozhodli se autoři studie SHIFT provést dodatečnou detailní analýzu klinického účinku ivabradinu u nemocných se vstupní SF ≥ 75/min, a porovnat ho s těmi, jejichž vstupní SF byla nižší než 75/min. Při této analýze se ukázalo, že u nemocných se vstupní SF ≥ 75/min ivabradin významně snížil nejenom výskyt primárního kombinovaného klinického ukazatele (hazard ratio, HR = 0,76; 95% interval spolehlivosti, CI: 0,68–0,85; p < 0,0001) a počet hospitalizací pro srdeční selhání (HR = 0,70; CI: 0,61–0,80; p < 0,0001), ale také počet úmrtí na srdeční selhání (HR = 0,61; CI: 0,46–0,81; p < 0,0006), kardiovaskulární mortalitu (HR = 0,83; CI: 0,71–0,97; p = 0,0166), a dokonce i celkovou mortalitu (HR = 0,83; CI: 0,72–0,96; p = 0,0109), viz tab. 2 [14].
rotože ale pro tuto skupinu nemocných nebyly k dispozici žádné důkazy z klinických studií, rozhodli se autoři studie SHIFT provést dodatečnou detailní analýzu klinického účinku ivabradinu u nemocných se vstupní SF ≥ 75/min, a porovnat ho s těmi, jejichž vstupní SF byla nižší než 75/min. Při této analýze se ukázalo, že u nemocných se vstupní SF ≥ 75/min ivabradin významně snížil nejenom výskyt primárního kombinovaného klinického ukazatele (hazard ratio, HR = 0,76; 95% interval spolehlivosti, CI: 0,68–0,85; p < 0,0001) a počet hospitalizací pro srdeční selhání (HR = 0,70; CI: 0,61–0,80; p < 0,0001), ale také počet úmrtí na srdeční selhání (HR = 0,61; CI: 0,46–0,81; p < 0,0006), kardiovaskulární mortalitu (HR = 0,83; CI: 0,71–0,97; p = 0,0166), a dokonce i celkovou mortalitu (HR = 0,83; CI: 0,72–0,96; p = 0,0109), viz tab. 2 [14].
Výsledky této sekundární analýzy ze studie SHIFT dokládají, že u nemocných se systolickým chronickým srdečním selháním, sinusovým rytmem a SF ≥ 75/min, pro jejichž léčbu EMA nedávno ivabradin schválila, toto léčivo významně snižuje výskyt všech protokolem specifikovaných klinických ukazatelů včetně kardiovaskulární i celkové mortality. V podskupině nemocných se SF < 75/min nebyl pokles žádného klinického ukazatele statisticky významný. Vysvětlením může být nižší riziko nemocných s nižší SF – např. roční výskyt primárního ukazatele byl u nemocných se vstupní SF < 75/min 12 %, zatímco u nemocných se vstupní SF ≥ 75/min dosáhl 21 %. Jiným možným vysvětlením mohou být farmakologické vlastnosti ivabradinu. Lék totiž zpomaluje SF tím méně, čím je výchozí (vstupní) SF nižší. Tato vlastnost také brání vzniku extrémní symptomatické bradykardie.
Vztah mezi účinkem betablokátorů a ivabradinu
Záhy po publikaci výsledků prvních velkých morbiditních/mortalitních studií s ivabradinem – BEAUTIFUL [13] a zejména SHIFT [12] – se zákonitě rozhořela diskuse, zda denní dávka betablokátorů podávaná nemocným v těchto studiích byla dostatečná. Objevily se spekulace, že stejně příznivý účinek na morbiditu a mortalitu by mělo zvýšení dávky betablokátoru, respektive že příznivý účinek ivabradinu by nemusel být prokazatelný, pokud by nemocní užívali doporučené cílové dávky betablokátorů. Vznikla jasná potřeba odpovědět na otázku, zda dávka betablokátoru ovlivňuje klinickou odpověď na léčbu ivabradinem.
K zodpovězení této otázky byla provedena post hoc analýza dat ze studie SHIFT. Podle denní dávky užívaného betablokátoru při randomizaci byli nemocní rozděleni do 5 podskupin: 1) žádný betablokátor; 2) < 25 %; 3) 25–50 %; 4) 50 % až < 100 %; 5) 100 % dávky doporučené evropskými guidelines pro léčbu chronického srdečního selhání [2, 5]. Účinek ivabradinu na výskyt primárního kombinovaného klinického ukazatele byl testován v každé z těchto podskupin a byla také testována heterogenita účinku v jednotlivých podskupinách. Dodatečná analýza byla provedena také po adjustaci na interakci ivabradinu se vstupní SF [15].
Výskyt primárního ukazatele byl ivabradinem významně snížen ve všech podskupinách s dávkou betablokátoru nižší než 50 % cílové dávky včetně podskupiny nemocných, kteří betablokátor vůbec neužívali (p = 0,012). Přes zřetelný trend ke snižování léčebného účinku ivabradinu se zvyšující se dávkou betablokátoru neukázaly obecné interakční testy zaměřené na heterogenitu v léčebném účinku žádnou významnou interakci (p = 0,35). Mezi jednotlivými podskupinami podle užívané dávky betablokátoru byl léčebný účinek ivabradinu pro výskyt primárního ukazatele hraničně nevýznamný (p = 0,056) a významnosti dále ubylo po adjustaci na interakci mezi vstupní SF a účinkem ivabradinu (p = 0,14) [15].
![Graf 2 Snížení srdeční frekvence při léčbě ivabradinem v závislosti na dávce betablokátoru a vstupní srdeční frekvenci – dodatečné analýzy z klinické studie SHIFT; podle [15] – Swedberg, et al., 2012. BB – betablokátor; SF – srdeční frekvence](https://www.remedia.cz/photo-a-29243---.jpg) Logickým závěrem těchto post hoc analýz je, že míru léčebného účinku (měřeného výskytem klinických příhod) u nemocných s chronickým srdečním selháním určuje spíše mohutnost snížení SF navozená kombinací betablokátoru a ivabradinu nebo ivabradinem samotným při intoleranci či kontraindikacích léčby betablokátorem než denní dávka betablokátoru, viz graf 2. Jinými slovy, účinek ivabradinu na výskyt primárního ukazatele a jeho jednotlivých komponent ve studii SHIFT nebyl významně ovlivněn podávanou dávkou betablokátoru. Kritickým faktorem, který určoval prospěch z léčby, byl pokles SF dosažený léčbou.
Logickým závěrem těchto post hoc analýz je, že míru léčebného účinku (měřeného výskytem klinických příhod) u nemocných s chronickým srdečním selháním určuje spíše mohutnost snížení SF navozená kombinací betablokátoru a ivabradinu nebo ivabradinem samotným při intoleranci či kontraindikacích léčby betablokátorem než denní dávka betablokátoru, viz graf 2. Jinými slovy, účinek ivabradinu na výskyt primárního ukazatele a jeho jednotlivých komponent ve studii SHIFT nebyl významně ovlivněn podávanou dávkou betablokátoru. Kritickým faktorem, který určoval prospěch z léčby, byl pokles SF dosažený léčbou.
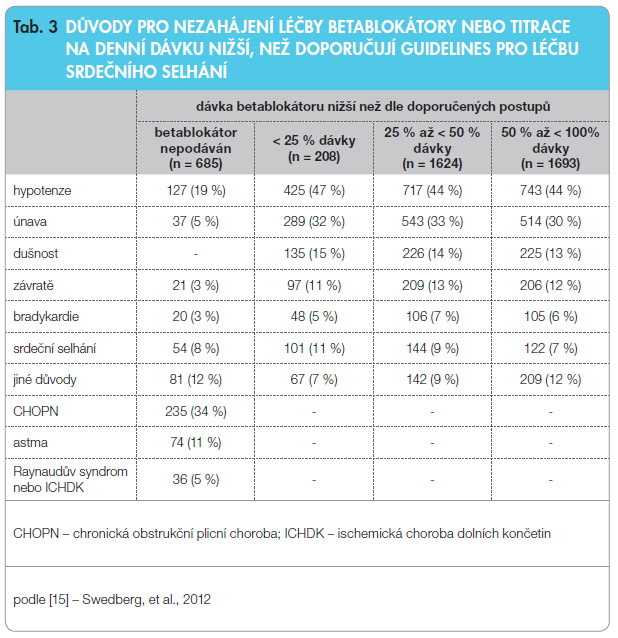 Zajímavá je také detailní analýza důvodů, které vedly výzkumníky ve studii SHIFT k tomu, že betablokátor buď vůbec nezačali podávat, nebo ho podávali v nižší denní dávce, než uvádějí doporučené postupy [1, 2, 5], viz tab. 3. Výzkumníci ve studii SHIFT byli podle protokolu nuceni zařazovat do sledování nemocné léčené maximální tolerovanou dávkou betablokátoru a museli podrobně zdůvodňovat, proč nemocný betablokátor buď vůbec nedostal, nebo ho dostal v denní dávce nižší, než doporučují guidelines. Bylo tak vyvinuto maximální úsilí, aby byly betablokátory ve studii používány optimálně. I přes toto úsilí dosáhla podávání doporučené denní dávky betablokátoru jen čtvrtina nemocných, zhruba polovina nemocných dostávala 50 % a více z doporučené denní dávky betablokátoru. To odpovídá situaci zjištěné v různých průzkumech a registrech v posledních letech. Průměrné denní dávky jednotlivých betablokátorů, jichž bylo dosaženo u nemocných ve studii SHIFT, jsou o něco nižší než průměrné dávky v klinických studiích s betablokátory u pacientů se srdečním selháním v období před 15–20 lety, které se staly základem dávek doporučovaných v současných guidelines. Na druhou stranu jsou ale dosažené průměrné dávky betablokátorů ve studii SHIFT v naprostém souladu s dávkami zjištěnými v nedávných mezinárodních průzkumech nebo podávanými v nedávných randomizovaných studiích. Na základě všech těchto zkušeností se zdá, že podíl nemocných s chronickým srdečním selháním v současné klinické praxi, u nichž může být denní dávka betablokátoru titrována do cílové hodnoty, se pohybuje v rozmezí 20–40 % [15].
Zajímavá je také detailní analýza důvodů, které vedly výzkumníky ve studii SHIFT k tomu, že betablokátor buď vůbec nezačali podávat, nebo ho podávali v nižší denní dávce, než uvádějí doporučené postupy [1, 2, 5], viz tab. 3. Výzkumníci ve studii SHIFT byli podle protokolu nuceni zařazovat do sledování nemocné léčené maximální tolerovanou dávkou betablokátoru a museli podrobně zdůvodňovat, proč nemocný betablokátor buď vůbec nedostal, nebo ho dostal v denní dávce nižší, než doporučují guidelines. Bylo tak vyvinuto maximální úsilí, aby byly betablokátory ve studii používány optimálně. I přes toto úsilí dosáhla podávání doporučené denní dávky betablokátoru jen čtvrtina nemocných, zhruba polovina nemocných dostávala 50 % a více z doporučené denní dávky betablokátoru. To odpovídá situaci zjištěné v různých průzkumech a registrech v posledních letech. Průměrné denní dávky jednotlivých betablokátorů, jichž bylo dosaženo u nemocných ve studii SHIFT, jsou o něco nižší než průměrné dávky v klinických studiích s betablokátory u pacientů se srdečním selháním v období před 15–20 lety, které se staly základem dávek doporučovaných v současných guidelines. Na druhou stranu jsou ale dosažené průměrné dávky betablokátorů ve studii SHIFT v naprostém souladu s dávkami zjištěnými v nedávných mezinárodních průzkumech nebo podávanými v nedávných randomizovaných studiích. Na základě všech těchto zkušeností se zdá, že podíl nemocných s chronickým srdečním selháním v současné klinické praxi, u nichž může být denní dávka betablokátoru titrována do cílové hodnoty, se pohybuje v rozmezí 20–40 % [15].Závěr
Zvýšená klidová SF je u chronického srdečního selhání nezávislým rizikovým faktorem. Její farmakologické snížení je spojeno se snížením výskytu kardiovaskulárních příhod. Výsledky klinických studií ukazují, že bradykardizující léčba je indikována při klidové SF vyšší než 70/min a cílovou SF, jíž by se mělo bradykardizující léčbou dosáhnout, je 60/min a méně. Ke zpomalení SF lze použít betablokátory, při sinusovém rytmu také ivabradin nebo jejich kombinaci, která je bezpečná. V souladu s tímto zjištěním je nová indikace ivabradinu, kterou nedávno zaregistrovala jak EMA, tak náš SÚKL a která uvádí, že ivabradin je indikován u chronického srdečního selhání na podkladě systolické dysfunkce, při funkční třídě II–IV podle NYHA, u nemocných se sinusovým rytmem a SF ≥ 75/min, kteří dostávají standardní léčbu včetně betablokátorů nebo u nichž jsou betablokátory kontraindikovány nebo nejsou tolerovány.
U nemocných s chronickým systolickým srdečním selháním je maximální dosažitelná denní dávka betablokátorů závislá na komorbiditách a jiných demografických charakteristikách. Přidání bradykardizujícího léku ivabradinu u nemocných, jejichž SF zůstává i přes léčbu betablokátorem 75/min a vyšší (stejně jako u těch, kteří betablokátor netolerují nebo mají kontraindikace), je prospěšné. Pro velikost tohoto prospěchu je rozhodující velikost poklesu SF navozeného ivabradinem daleko více než podávaná denní dávka betablokátoru.
Pr![Obr. 1 Léčebné možnosti pro nemocné s chronickým symptomatickým systolickým srdečním selháním (funkční třídy II–IV dle NYHA); podle [5] – Hradec, et al., 2013. ACE – angiotenzin konvertující enzym; ARB – blokátor receptorů pro angiotenzin II; CRT-D – kombinace srdeční resynchronizační léčby s defibrilátorem; CRT-P – kombinace srdeční resynchronizační léčby s kardiostimulátorem; H-ISDN – kombinace hydralazinu a isosorbid dinitrátu; HR – srdeční frekvence; ICD – implantabilní kardioverter-defibrilátor; LBBB – blokáda levého Tawarova raménka; LVAD – přístroj k levokomorové podpoře; LVEF – ejekční frakce levé komory; MR – mineralokortikoidní receptory; NYHA – New York Heart Association](https://www.remedia.cz/photo-a-29245---.jpg) o klinickou praxi vyplývají z těchto zjištění následující praktická doporučení. Jestliže u nemocného s chronickým systolickým srdečním selháním a sinusovým rytmem zůstává SF vyšší než 70/min, měla by být zrevidována farmakoterapie se zaměřením se zejména na betablokátor a jeho denní dávku. Může-li být denní dávka betablokátoru zvýšena a vede-li k poklesu SF pod hranici 70/min, je léčba samotným betablokátorem dostačující. Pakliže ale není tento cíl klinicky dosažitelný (např. pro intoleranci betablokátoru nebo jeho vyšší denní dávky), povede přidání ivabradinu ke stávající léčbě ke snížení rizika vzniku budoucích kardiovaskulárních příhod. Současné místo betablokátorů, ivabradinu i digoxinu v léčbě chronického srdečního selhání se sníženou EF ukazuje algoritmus léčby ze stávajících doporučení, viz obr. 1.
o klinickou praxi vyplývají z těchto zjištění následující praktická doporučení. Jestliže u nemocného s chronickým systolickým srdečním selháním a sinusovým rytmem zůstává SF vyšší než 70/min, měla by být zrevidována farmakoterapie se zaměřením se zejména na betablokátor a jeho denní dávku. Může-li být denní dávka betablokátoru zvýšena a vede-li k poklesu SF pod hranici 70/min, je léčba samotným betablokátorem dostačující. Pakliže ale není tento cíl klinicky dosažitelný (např. pro intoleranci betablokátoru nebo jeho vyšší denní dávky), povede přidání ivabradinu ke stávající léčbě ke snížení rizika vzniku budoucích kardiovaskulárních příhod. Současné místo betablokátorů, ivabradinu i digoxinu v léčbě chronického srdečního selhání se sníženou EF ukazuje algoritmus léčby ze stávajících doporučení, viz obr. 1.
Seznam použité literatury
- [1] Špinar J, Vítovec J, Hradec J, et al. Czech Society of Cardiology guidelines for the diagnosis and treatment of chronic heart failure. Cor Vasa 2012; 54: e113–e134.
- [2] McMurray JJ, Adamopoulos S, Anker SD, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33: 1787–1847.
- [3] Bradbury J. Posicor withdrawn voluntarily from market by Roche. Lancet 1998; 351: 1791.
- [4] The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525–533.
- [5] Hradec J, Vítovec J, Špinar J. Summary of the ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Prepared by the Czech Society of Cardiology. Cor Vasa 2013; 55: e25–e55, v online verzi Cor et Vasa: http://www.sciencedirect.com/science/article/pii/S0010865013000040
- [6] Adams KF, Patterson H, Gattis WA, et al. Relationship of serum digoxin concentration to mortality and morbidity in women in the Digitalis Investigation Group trial. J Am Coll Cardiol 2005; 46: 497–504.
- [7] Hradec J. Modulace srdeční frekvence – nový přístup v léčbě srdečního selhání. Remedia 2012; 22: 132–135.
- [8] Diaz A, Bourassa MG, Guertin MC, Tardiff JC. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 1999; (suppl H): H52–H57.
- [9] Lechat P, Hulot JS, Escolano S, et al., on behalf of the CIBIS II investigators. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II trial. Circulation 2001; 103: 1428–1433.
- [10] Böhm M, Swedberg K, Komajda M, et al., on behalf of the SHIFT Investigators. Heart rate as a risk factor in chronic heart failure (SHIFT): the association between heart rate and outcomes in a randomized placebo-controlled trial. Lancet 2010; 376: 886–894.
- [11] Thackraz SD, Ghosh JM, Wright GA, et al. The effect of altering heart rate on ventricular function in patients with heart failure treated with beta-blockers. Am Heart J 2006; 152: 713–717.
- [12] Swedberg K, Komajda M, Böhm M, et al., on behalf of the SHIFT investigators. Ivabradine outcomes in chronic heart failure (SHIFT): a randomized placebo-controlled study. Lancet 2010; 376: 875–885.
- [13] Fox K, Ford I, Steg G, et al., on behalf of the BEAUTIFUL investigators. Ivabradin for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomized, double-blind, placebo-controlled trial. Lancet 2008; 372: 807–816.
- [14] Böhm M, Borer J, Ford I, et al. Heart rate at baseline influences the effect of ivabradine on cardiovascular outcomes in chronic heart failure: analysis from the SHIFT study. Clin Res Cardiol 2013; 102: 11–22.
- [15] Swedberg K, Komajda M, Böhm M, et al. Effects on outcomes of heart rate reduction by ivabradine in patients with congestive heart failure: Is there an influence of beta-blocker dose? Findings from the SHIFT. J Am Coll Cardiol 2012; 59: 1938–1945.