Kardiovaskulární bezpečnost antidiabetik v roce 2018
Souhrn:
Článek přináší souhrn aktuálně dostupných informací o kardiovaskulární bezpečnosti antidiabetik počínaje klíčovými studiemi srovnávajícími těsnou a volnou kompenzaci diabetu z hlediska výskytu vaskulárních komplikací přes první studie zaměřené primárně na kardiovaskulární cíle až po studie uskutečněné v reakci na požadavek FDA (Food and Drug Administration) z roku 2008 týkající se všech nově vyvíjených antidiabetik. Hlavní část tohoto článku představuje komplexní přehled ukončených i probíhajících studií typu CVOT (CardioVascular Outcomes Trials) s moderními antidiabetiky ze skupiny inhibitorů dipeptidylpeptidázy 4 (DPP‑4), agonistů receptoru pro glukagonu podobný peptid 1 (GLP-1) a inhibitorů společného transportéru pro sodík a glukózu typu 2 (SGLT2). Na základě dosavadních dat lze považovat všechna moderní antidiabetika z hlediska kardiovaskulárního rizika za bezpečná, v některých případech dokonce za kardioprotektivní léky s potenciálním využitím v primární a sekundární kardiovaskulární prevenci.
Key words: diabetes mellitus , antidiabetics , cardiovascular events, CardioVascular Outcomes Trials, dipeptidyl peptidase‑4 (DPP‑4) inhibitors, gliptins , glucagon‑like peptide‑1 (GLP‑1) receptor agonists , inhibitors of common transporter for sodium and glucose (SGLT2), gliflozins.
Summary:
The article provides a summary of currently available information on cardiovascular safety of antidiabetics, starting with key studies comparing tight and loose compensation for diabetes in terms of vascular complications, through first studies focusing primarily on cardiovascular goals to studies conducted in response to the Food and Drug Administration guidelines for all newly developed antidiabetic agents published in 2008. The main part of this article is a comprehensive review of completed and ongoing CVOT (CardiVascular Outcomes Trials) studies with modern dipeptidyl peptidase‑4 (DPP‑4) inhibitors, glucagon‑like peptide‑1 (GLP‑1) agonists and inhibitors of common transporter for sodium and glucose (SGLT2). On the basis of available data, all modern antidiabetes can be considered safe from the cardiovascular risk perspective, in some cases even cardioprotective with a potential to be used in the primary and secondary cardiovascular prevention.
Summary:
The article provides a summary of currently available information on cardiovascular safety of antidiabetics, starting with key studies comparing tight and loose compensation for diabetes in terms of vascular complications, through first studies focusing primarily on cardiovascular goals to studies conducted in response to the Food and Drug Administration guidelines for all newly developed antidiabetic agents published in 2008. The main part of this article is a comprehensive review of completed and ongoing CVOT (CardiVascular Outcomes Trials) studies with modern dipeptidyl peptidase‑4 (DPP‑4) inhibitors, glucagon‑like peptide‑1 (GLP‑1) agonists and inhibitors of common transporter for sodium and glucose (SGLT2). On the basis of available data, all modern antidiabetes can be considered safe from the cardiovascular risk perspective, in some cases even cardioprotective with a potential to be used in the primary and secondary cardiovascular prevention.
Když v roce 2008 vydala americká organizace dohlížející nad bezpečností potravin a léků ve Spojených státech známá jako FDA (Food and Drug Administration) doporučení týkající se provádění klinických studií s antidiabetiky [1], byla v něm obsažena podmínka, že všechny nové antidiabetické léky musejí před svým vstupem na trh prokázat kardiovaskulární (KV) bezpečnost v randomizované studii třetí fáze, kde jsou kardiovaskulární parametry primárními cílovými ukazateli. Tato podmínka za 10 let razantně ovlivnila, ovlivňuje a jistě i ovlivní řadu aspektů léčby diabetu. Přestože si dovedu představit, eufemisticky řečeno, značně limitované nadšení farmaceutických společností respektovat toto nařízení FDA, je nutno poznamenat, že s přibývajícím časem lze z pohledu diabetologie považovat tuto skutečnost za velmi přínosnou z hlediska množství dat o účincích a bezpečnostních profilech moderních antidiabetik.
V současnosti tak již díky tomu máme k dispozici výsledky studií splňujících výše zmíněné zadání FDA se saxagliptinem (SAVOR TIMI 53) [2], alogliptinem (EXAMINE) [3], sitagliptinem (TECOS) [4], lixisenatidem (ELIXA) [5], empagliflozinem (EMPA REG OUTCOME) [6], kanagliflozinem (CANVAS) [7], liraglutidem (LEADER) [8] a s injekčním semaglutidem (SUSTAIN 6) [9]. Lze konstatovat, že všechny tyto molekuly prokázaly KV bezpečnost. Přesto lze při srovnání jednotlivých léků vypozorovat řadu odlišností plynoucích z farmakodynamiky a farmakokinetiky daného přípravku, v řadě případů dokonce zůstává podstata účinku konkrétního antidiabetika na jednotlivé KV parametry dosud neobjasněna. Výsledky posledních tří zmíněných studií navíc prokázaly nejen to, že dané antidiabetikum „neškodí“, ale právě naopak mimo jiné i přispívá ke snížení výskytu KV příhod (tzv. MACE – major adverse cardiovascular event, velká KV příhoda), což je zcela průlomové zjištění, které způsobilo značný povyk nejen mezi diabetology, ale i v kardiologické obci. Řada jiných studií sledujících KV příhody dále probíhá a jejich výsledky určitě přinesou spoustu dalších cenných informací o účincích a bezpečnosti moderních antidiabetik.
Antidiabetika a kardiovaskulární systém do roku 2008
Již před rokem 2008 bylo všeobecně
známým a akceptovaným faktem, že diabetes mellitus více než
zdvojnásobuje riziko výskytu KV příhod, a toto onemocnění
bylo považováno z hlediska rizikovosti za ekvivalent
ischemické choroby srdeční. Ačkoliv několik klinických studií
srovnávajících těsnou a méně striktní glykemickou
kontrolu nejprve neprokázalo, že intenzivní snížení glykemie
významně redukuje KV riziko, výsledky následné metaanalýzy
naznačily mírný pokles rizika nefatálního infarktu myokardu
(IM). Dlouhodobé neintervenční sledování DCCT (Diabetes Control
and Complications Trial) u diabetu 1. typu a studie
UKPDS (UK Prospective Diabetes Study) a VADT (Veterans
Affairs Diabetes Trial) u pacientů
s diabetem 2. typu poprvé naznačily „legacy effect“,
tedy paměťovou stopu, kterou zanechává přísnější kontrola
glykemie z hlediska dlouhodobého KV rizika, přestože
zdaleka ne v takové míře, jako je tomu ve vztahu
k mikrovaskulárním komplikacím (tab. 1). Na druhé straně vedla zvýšená úmrtnost
nemocných, kteří byli zařazeni do intenzivnější strategie
snižování plazmatické koncentrace glukózy ve studii ACCORD,
k podstatnému zmírnění „nadšení“ z těsné
kontroly glykemie, zejména u starších pacientů s vysokým
KV rizikem.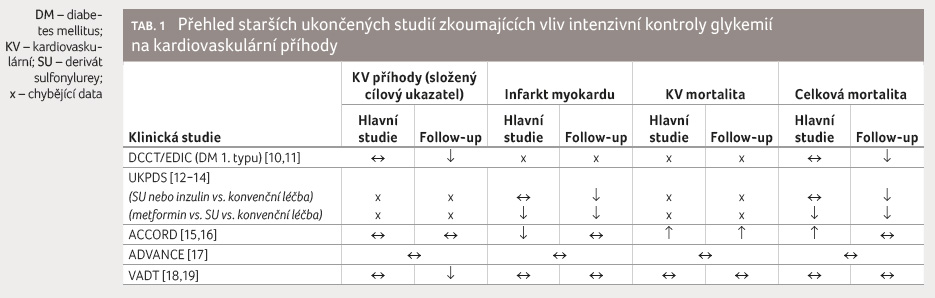
Předtím než FDA vydala v roce 2008 své pokyny pro data nezbytná ke schválení nových antidiabetik, bylo k registraci nových antidiabetik postačující prokázat krátkodobou glykemickou účinnost (tzn. především snížení hodnoty glykovaného hemoglobinu – HbA1c) spolu s bezpečnostními údaji z šesti až dvanáctiměsíčních randomizovaných, kontrolovaných klinických studií fáze II a III. Tyto studie obvykle zahrnovaly mladší pacienty s relativně krátkým trváním diabetu a s nízkým KV rizikem. Jedinci s manifestním KV onemocněním nebyli obvykle do těchto studií zařazeni. Tyto studie měly pochopitelně nízkou incidenci KV příhod a ty případy, které se vyskytly, nebyly předem určeny jako cílové ukazatele, a ani nebyly nezávisle a pod drobnohledem posuzovány. V důsledku toho byly znalosti o KV bezpečnosti těchto léčivých přípravků značně nekonzistentní a sporé [10−22].
Antidiabetika jako hrozba?
Obavy související s KV bezpečností antidiabetik se prudce zvýšily po zveřejnění dvou vysoce kontroverzních metaanalýz KV rizika spojeného s užíváním muraglitazaru (agonisty PPAR a a g), a především již registrovaného a široce používaného agonisty PPAR g thiazolidindionu rosiglitazonu [23,24]. Analýza podávání muraglitazaru prokázala více než dvojnásobný výskyt KV komplikací, včetně městnavého srdečního selhání a úmrtí, ve srovnání se standardní terapií. Nissenova metaanalýza léčby rosiglitazonem naznačila statisticky významné o 43 % zvýšené riziko pro vznik IM a statisticky nevýznamné o 64 % zvýšené riziko KV mortality ve srovnání s komparátory. V návaznosti na tyto publikace a na následnou mohutnou celosvětovou diskusi pak FDA v roce 2008 vydala své výše zmíněné bezpečnostní pokyny.
Po výsledcích studie RECORD [25,26], která byla primárně navržena pro testování KV bezpečnosti rosiglitazonu a nepotvrdila dřívější závěry metaanalýzy, FDA sice zrušila omezení pro podávání rosiglitazonu, jeho reálné užívání v klinické praxi však zůstalo zanedbatelné. Studie s dalším představitelem skupiny agonistů PPAR g pioglitazonem naopak poukázaly na KV přínos u vysoce rizikových pacientů s diabetem. Především studie PROactive (Prospective Pioglitazone Clinical Trial in Macrovascular Events) prokázala, že pioglitazon snížil ve srovnání s placebem o 16 % výskyt sekundárního cílového ukazatele zahrnujícího celkovou mortalitu, nefatální IM a cévní mozkovou příhodu (CMP) u rizikových pacientů s diabetem 2. typu [27]. Novější studie IRIS (Insulin Resistance Intervention After Stroke) zase prokázala, že u pacientů s inzulinovou rezistencí a s předchozí ischemickou CMP nebo s tranzitorní ischemickou atakou vedla léčba pioglitazonem k významnému snížení výskytu fatálních i nefatálních KV příhod [28,29].
Kardiovaskulární studie s moderními antidiabetiky
Důsledkem doporučení FDA bylo zahájení řady tzv. CVOT (CardioVascular Outcomes Trials) studií, které mají za úkol především potvrzení KV bezpečnosti nových antidiabetik. Tyto studie jsou určeny hlavně k vyloučení nepřijatelného KV rizika, řada z nich je navíc navržena s dostatečnou statistickou silou, aby po vyloučení non inferiority zkoumaného léku mohly prokázat i případnou superioritu ve vztahu ke KV riziku. Obvykle je do těchto studií zahrnuta populace diabetiků s delším trváním diabetu (kolem 10 let) a s pokročilým aterosklerotickým postižením nebo s již prodělanou KV příhodou tak, aby bylo reálné v přiměřeném časovém období zaznamenat dostatek KV příhod (MACE). Většina CVOT studií byla navržena jako klinické studie fáze IV vyžadující minimálně 600 primárních cílových ukazatelů (příhod), které jsou s to vyloučit zvýšené riziko (hazard ratio – HR, poměr rizik) s horním limi
tem intervalu spolehlivosti (confidence interval, CI) > 1,3 pro cíl složený ze tří MACE (3P MACE; KV úmrtí, nefatální IM a nefatální CMP). Ve třech studiích – TECOS, ELIXA a FREEDOM CVO – je primárním cílovým ukazatelem čtyřbodový MACE (4P MACE) rozšířený o hospitalizaci pro nestabilní anginu pectoris.
Všechny CVOT v diabetických populacích byly koncipovány tak, aby se minimalizoval vliv, který by bylo možné připsat rozdílu v glykemické kontrole mezi jednotlivými rameny studie. Proto je zde oproti jiným studiím zkoumajícím především antidiab
etickou účinnost léků patrná výraznější intenzifikace léčby prostřednictvím kombinace různých perorálních antidiabetik i inzulinu s cílem zachovat srovnatelnou kontrolu glykemie i ve větvi s placebem. Přesto byly na konci většiny studií pozorovány nepatrné rozdíly mezi skupinami v hodnotě HbA1c, přičemž vyšší hodnoty b
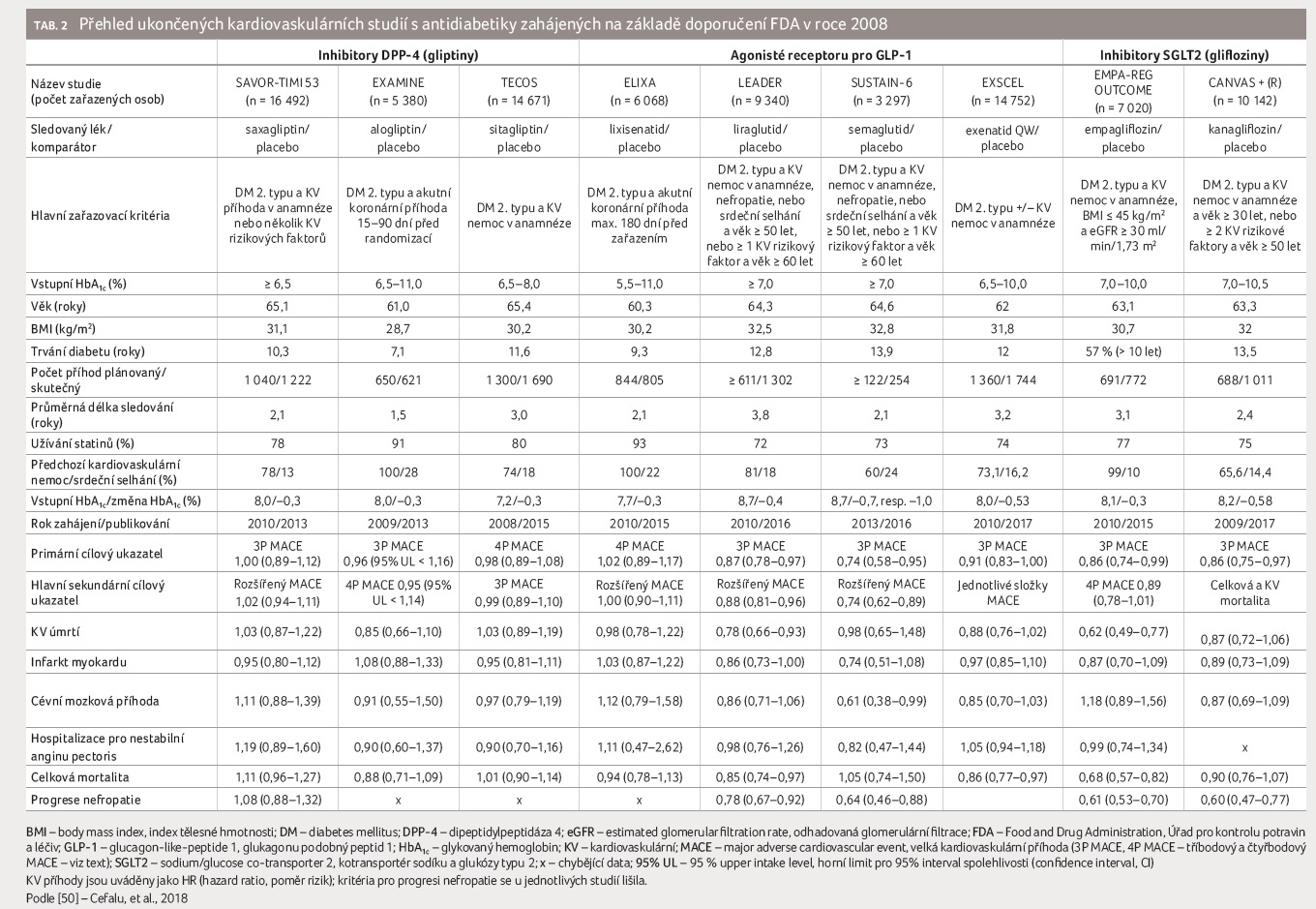
yly zaznamenány ve skupinách s placebem. Většina studovaných pacientů je již při vstupu do CVOT studií s antidiabetiky komplexně léčena z pohledu modifikovatelných rizikových KV faktorů, jak dokazuje vysoký podíl pacientů užívajících antihypertenzní, hypolipidemickou a antiagregační medikaci. Přehled ukončených a publikovaných CVOT s antidiabetiky zachycuje tabulka 2, zatímco tabulka 3 je souhrnem studií dosud probíhajících nebo dosud nepublikovaných.
Vliv moderních antidiabetik na kardiovaskulární příhody
Inhibitory DPP 4
K posouzení KV bezpečnosti
inhibitorů dipeptidylpeptidázy 4 (DPP 4) bylo prozatím
zařazeno celkem 49 618 pacientů do pěti klinických studií.
Tři studie (SAVOR TIMI 53, EXAMINE a TECOS) již byly
ukončeny a publikovány, dvě studie (CAROLINA [30] a CARMELINA
[31]) probíhají a další studie OMNEON (A Study to
Assess Cardiovascular Outcomes Following Treatment With
Omarigliptin [MK 3102]), která zkoumala jednou týdně podávaný
omarigliptin u 4 202 pacientů trpících diabetem
2. typu a KV onemocněním, byla ukončena na základě
obchodního rozhodnutí sponzora [32,33]. Přestože všechny tři
dokončené studie splnily primární cíl, jímž bylo vyloučení
horní hranice pro riziko 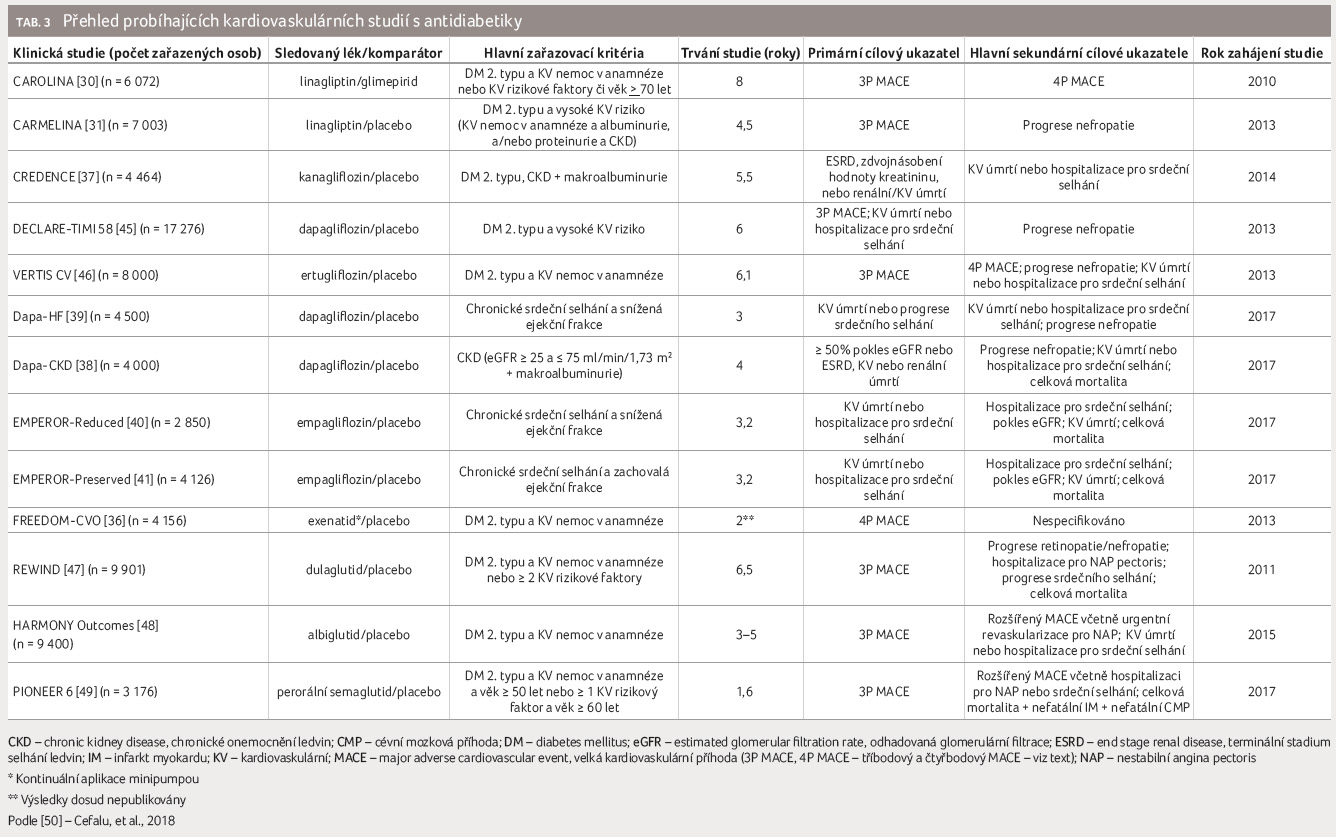 KV příhody (hazard ratio, HR) 1,3,
žádná z nich nenaznačila možnost příznivého vlivu
na snížení četnosti KV příhod u pacientů s diabetem
2. typu. Stejně tak ve studii OMNEON byla hodnota HR pro
primární 3P MACE po ukončení léčby o průměrné
délce sledování 96 týdnů (HR 1,00; 95% CI 0,77–1,29).
Ve výsledcích studie
SAVOR TIMI 53 (Saxagliptin Assessment of
Vascular Outcomes Recorded in Patients with Diabetes
Mellitus–Thrombolysis in Myocardial Infarction) se saxagliptinem
naopak rezonovalo zvýšené riziko pro vznik srdečního selhání
(HR 1,27; 95% CI 1,07–1,51, p = 0,007),
podobný trend byl zaznamenán i ve studii EXAMINE
(Examination of Cardiovascular Outcomes with Alogliptin versus
Standard of Care) s alogliptinem (HR 1,19; 95% CI 0,90–1,58,
p = 0,220)
[34]. Přímá souvislost mezi léčbou inhibitorem DPP 4
sitagliptinem a nutností hospitalizace pro progresi (vznik)
srdečního selhání naopak nebyla potvrzena ve studii TECOS
(Trial Evaluating Cardiovascular Outcomes with
Sitagliptin) (HR 1,00; 95% CI 0,83–1,20).
KV příhody (hazard ratio, HR) 1,3,
žádná z nich nenaznačila možnost příznivého vlivu
na snížení četnosti KV příhod u pacientů s diabetem
2. typu. Stejně tak ve studii OMNEON byla hodnota HR pro
primární 3P MACE po ukončení léčby o průměrné
délce sledování 96 týdnů (HR 1,00; 95% CI 0,77–1,29).
Ve výsledcích studie
SAVOR TIMI 53 (Saxagliptin Assessment of
Vascular Outcomes Recorded in Patients with Diabetes
Mellitus–Thrombolysis in Myocardial Infarction) se saxagliptinem
naopak rezonovalo zvýšené riziko pro vznik srdečního selhání
(HR 1,27; 95% CI 1,07–1,51, p = 0,007),
podobný trend byl zaznamenán i ve studii EXAMINE
(Examination of Cardiovascular Outcomes with Alogliptin versus
Standard of Care) s alogliptinem (HR 1,19; 95% CI 0,90–1,58,
p = 0,220)
[34]. Přímá souvislost mezi léčbou inhibitorem DPP 4
sitagliptinem a nutností hospitalizace pro progresi (vznik)
srdečního selhání naopak nebyla potvrzena ve studii TECOS
(Trial Evaluating Cardiovascular Outcomes with
Sitagliptin) (HR 1,00; 95% CI 0,83–1,20).
Probíhající studie CAROLINA (Cardiovascular Outcome Study of Linagliptin Versus Glimepiride in Patients With Type 2 Diabetes) byla na rozdíl od předchozích studií navržena s cílem potvrdit non inferioritu linagliptinu vůči aktivnímu komparátoru glimepiridu. Protože ale hloubková data o KV profilu glimepiridu nejsou k dispozici, souběžně je prováděna i placebem kontrolovaná studie CARMELINA (Cardiovascular and Renal Microvascular Outcome Study With Linagliptin in Patients With Type 2 Diabetes Mellitus), která je vedle KV bezpečnosti zaměřena i na potenciální renoprotektivní parametry linagliptinu. Tyto studie mohou pomoci kromě jiného odpovědět i na otázku KV bezpečnosti léčby antidiabetiky ze skupiny derivátů sulfonylurey, o nichž za desítky let jejich používání není zdaleka dostatek validních dat. Obecně lze říct, že inhibitory DPP 4 prokázaly v dosud publikovaných studiích svou KV bezpečnost a jejich používání není spojeno s rizikem ohrožení pacientů ve smyslu nárůstu výskytu KV příhod.
Agonisté receptorů pro GLP 1
Bezpečnost agonistů receptorů pro glukagonu podobný peptid 1 (glucagon like peptide 1, GLP 1) byla posuzována prozatím v osmi studiích typu CVOT, do nichž bylo zařazeno 60 090 pacientů. ELIXA, první z publikovaných studií, byla provedena u pacientů s anamnézou nedávného akutního koronárního syndromu (ACS) a z hlediska KV bezpečnosti prokázala neutrální výsledky a potvrdila non inferioritu lixisenatidu s ohledem na čtyřbodový MACE.
Druhá studie – LEADER – prokázala jednak non inferioritu, jednak navíc i statisticky významnou superioritu léčby liraglutidem vůči placebu s ohledem na výskyt KV příhod. Redukce tříbodového MACE (HR 0,87; 95% CI 0,78–0,97) ve větvi léčené liraglutidem byla ovlivněna především významným snížením KV mortality (HR 0,78; 95% CI 0,66–0,93) a dále již statisticky nevýznamnými rozdíly ve výskytu nefatálního IM a CMP ve prospěch liraglutidu. Na základě výsledků studie schválila FDA novou indikaci pro liraglutid „ke snížení rizika závažných nežádoucích kardiovaskulárních příhod u dospělých s diabetes mellitus 2. typu a s manifestním kardiovaskulárním onemocněním“.
Studie SUSTAIN 6 potvrdila non inferioritu jednou týdně podávaného injekčního semaglutidu (0,5 mg nebo 1 mg). Navíc bylo podobně jako ve studii LEADER dosaženo předem nedefinované statistické superiority (HR 0,74; 95% CI 0,58–0,95, p = 0,001). Příznivý účinek na tříbodový MACE byl spojen s významným poklesem výskytu nefatálních CMP (HR 0,61; 95% CI 0,38–0,99, p = 0,04) a s poklesem incidence nefatálního IM (HR 0,74; 95% CI 0,51–1,08, p = 0,12). Snížení rizika výskytu primárního cílového ukazatele bylo zaznamenáno navzdory zvýšení tepové frekvence, což je „class effect“ pozorovaný v řadě studií s agonisty receptorů pro GLP 1.
Čtvrtá publikovaná studie – EXSCEL – potvrdila pouze non inferioritu jednou týdně podávaného dlouhodobě působícího exenatidu v dávce 2 mg (HR 0,91; 95% CI 0,83–1,00, p = 0,06). Riziko úmrtí z jakékoliv příčiny bylo 6,9 % u skupiny léčené exenatidem a 7,9 % ve skupině léčené placebem (HR 0,86; 95% CI 0,77–0,97) [35]. Limitací studie byl poměrně výrazný podíl pacientů, u kterých došlo k vysazení studijního léku (až 43 %), patrně v důsledku pragmatického uspořádání studie (návštěvy u lékaře pouze jednou za šest měsíců). Přestože téměř třetina zařazených pacientů neměla manifestní KV onemocnění, došlo k 9% redukci výskytu 3P MACE, blížící se hranici statistické významnosti. Ačkoliv kompletní data ze studie FREEDOM CVO s exenatidem (ITCA 650) podávaným kontinuálně pomocí minipumpy nebyla dosud publikována, společnost Intarcia ohlásila úspěšné výsledky z hlediska KV bezpečnosti a plánuje další rozvoj a investice do této molekuly včetně žádosti o schválení u FDA [36].
Otázkou zůstává, jestli jsou různorodé výsledky jednotlivých studií s agonisty receptorů pro GLP 1 způsobeny odlišnostmi v uspořádání klinického hodnocení, ve studovaných populacích, nebo spíše rozdíly ve farmakokinetice a farmakodynamice jednotlivých molekul (délka působení, chemická struktura). Obecně lze říct, že tato skupina antidiabetik je dle současných poznatků bezpečná, dobře tolerovaná a zvláště účinná u pacientů s DM 2. typu v sekundární prevenci KV nemocí.
Inhibitory SGLT2
Kardiovaskulární a renální bezpečnost inhibitorů SGLT2 (sodium/glucose co transporter 2, kotransportér sodíku a glukózy typu 2) se hodnotí celkově v devíti studiích, v nichž bylo dohromady zařazeno 62 378 pacientů. K dnešnímu dni byly dokončeny studie EMPA REG OUTCOME s empagliflozinem a CANVAS s kanagliflozinem. Dalších sedm studií by mělo být dokončeno a publikováno v příštích dvou až třech letech. Ve čtyřech studiích s inhibitory SGLT2 je primární cílový ukazatel tvořen 3P MACE, ve dvou případech je zaměřen na zhoršení renálních parametrů a ve třech zbývajících studiích představuje primární cílový ukazatel kombinaci progrese srdečního selhání a KV mortality u osob s prokázaným srdečním selháním. Přestože jsou studie CANVAS R (jejíž data byla zahrnuta do celkových výsledků programu CANVAS) a pokračující CREDENCE (Evaluation of the Effects of Canagliflozin on Renal and Cardiovascular Outcomes in Participants With Diabetic Nephropathy) primárně renální, shromažďují rovněž data o KV příhodách v souladu s požadavkem FDA [37]. Podobně studie Dapa CKD (A Study to Evaluate the Effect of Dapagliflozin on Renal Outcomes and Cardiovascular Mortality in Patients With Chronic Kidney Disease) posuzuje kromě primárního složeného renálního cílového ukazatele i incidenci KV příhod a výskyt srdečního selhání [38].
Mnohem více dat o působení inhibitorů SGLT2 na chronické srdeční selhání pak přinesou studie navržené specificky pro tuto cílovou skupinu pacientů – Dapa HF (Study to Evaluate the Effect of Dapagliflozin on the Incidence of Worsening Heart Failure or Cardiovascular Death in Patients With Chronic Heart Failure), EMPEROR Reduced (Empagliflozin Outcome Trial in Patients With Chronic Heart Failure with Reduced Ejection Fraction) a EMPEROR Preserved (Empagliflozin Outcome Trial in Patients With Chronic Heart Failure With Preserved Ejection Fraction) [39−41].
Prvním inhibitorem SGLT2, který prokázal v randomizované studii fáze III příznivý účinek na redukci počtu KV příhod (KV úmrtí, nefatální IM a nefatální CMP), byl empagliflozin ve studii EMPA REG OUTCOME, publikované v roce 2015. Do studie bylo zahrnuto celkem 7 020 pacientů s manifestním KV onemocněním, kteří byli léčeni 10 mg, resp. 25 mg empagliflozinu nebo placebem. Průměrná doba sledování byla 3,1 roku. Riziko vzniku MACE bylo při léčbě empagliflozinem sníženo o 14 % ve srovnání s placebem (HR 0,86; 95% CI 0,74–0,99, p = 0,038). Když byly jednotlivé složky primárního kombinovaného cílového ukazatele posouzeny nezávisle, byl příznivý účinek empagliflozinu nejvýrazněji podmíněn statisticky významným snížením výskytu KV smrti o 38 % (HR 0,62; 95% CI 0,49–0,77, p = 0,001) bez významného vlivu na riziko nefatálního IM. Empagliflozin také významně snížil riziko hospitalizace pro srdeční selhání o 35 % (HR 0,65; 95% CI 0,50–0,85) a mortalitu ze všech příčin o 32 % (HR 0,68; 95% CI 0,57–0,82). Pozorovaný efekt na mortalitu a srdeční selhání byl obzvláště výrazný, přičemž pozitivní efekt se dostavil již během prvních týdnů od zahájení léčby s účinky konzistentními u rozdílných podskupin pacientů. Na základě tohoto příznivého výsledku schválila FDA novou indikaci pro empagliflozin – „snížení rizika kardiovaskulární smrti u dospělých pacientů s diabetes mellitus 2. typu a s kardiovaskulárním onemocněním“, která představuje zásadní průlom při léčbě pacientů s diabetem 2. typu.
Sdružená data o KV bezpečnosti kanagliflozinu pocházejí ze dvou samostatných studií CANVAS a CANVAS R. Ve srovnání s placebem vedlo podávání kanagliflozinu k redukci rizika primárního tříbodového MACE o 14 % (HR 0,86; 95% CI 0,75–0,97, p = 0,02), čímž bylo splněno kritérium pro non inferioritu. Výsledky však jsou ze striktně statistického pohledu pouze informativní, a nikoliv průkazné, protože většina cílových ukazatelů studie nebyla předem definována.
Inzulin
Přestože studie ORIGIN a její extenze ORIGINALE byla zahájena již pět let před zveřejněním požadavků FDA, lze ji považovat za plnohodnotnou CVOT studii, která poprvé po téměř 100 letech od objevu inzulinu prokázala KV bezpečnost tohoto nenahraditelného antidiabetika. Celkem 12 537 osob se zvýšeným KV rizikem a zvýšenou glykemií nalačno, s poruchou glukózové tolerance nebo s diabetem 2. typu bylo náhodně přiřazeno buď k léčbě pomocí inzulinu glarginu, nebo ke standardní (obvyklé) antidiabetické léčbě. Mezi hlavní sledované parametry studie patřil čas do výskytu nefatálního IM, CMP nebo úmrtí na KV příhodu společně s potřebou revaskularizace nebo hospitalizace pro srdeční selhání. Léčba glarginem měla neutrální efekt na incidenci KV příhod a prokázala bezpečnost časné léčby DM 2. typu tímto bazálním inzulinovým analogem [42,43]. V roce 2017 publikovaná studie DEVOTE (A Trial Comparing Cardiovascular Safety of Insulin Degludec Versus Insulin Glargine in Patients With Type 2 Diabetes at High Risk of Cardiovascular Events), zahrnující 7 637 pacientů s prokázaným KV onemocněním a s průměrnou délkou onemocnění diabetem 16 let, potvrdila KV bezpečnost dalšího dlouhodobě působícího inzulinového analoga degludeku ve srovnání s inzulinovým analogem glarginem (HR 0,91; 95% CI 0,78–1,06, p = 0,21) [44].
Vliv antidiabetik na kardiovaskulární rizikové faktory
Vliv inhibitorů DPP 4 na kardiometabolické faktory byl v dosud publikovaných studiích minimální, s výjimkou malého snížení hodnoty HbA1c o 0,3 % na konci studie. Ve studii EMPA REG OUTCOME byla obdobně zaznamenána na konci studie malá, ale statisticky signifikantní 0,3% redukce HbA1c, stejně tak jako redukce systolického (4–5 mm Hg) a diastolického (2 mm Hg) krevního tlaku, hmotnosti (2 kg) a minimální zvýšení koncentrace LDL a HDL cholesterolu bez vlivu empagliflozinu na srdeční frekvenci. V programu CANVAS bylo prokázáno statisticky významné snížení průměrných hodnot HbA1c (0,58 %), systolického (3,93 mm Hg) a diastolického (1,39 mm Hg) krevního tlaku, tělesné hmotnosti (1,6 kg) a zvýšení koncentrace LDL a HDL cholesterolu. Ve studii ELIXA s lixisenatidem bylo rovněž zaznamenáno statisticky významné snížení hodnoty HbA1c (0,3 %), systolického krevního tlaku (0,8 mm Hg) a hmotnosti (0,7 kg) s mírně zvýšenou srdeční frekvencí (0,4/min). Ve studii LEADER byla léčba liraglutidem spojena s malým, ale statisticky významným zvýšením srdeční frekvence (3/min), s redukcí hodnoty HbA1c (0,4 %), systolického krevního tlaku (1,2 mm Hg) a hmotnosti (2,3 kg) a s mírným zvýšením diastolického krevního tlaku (0,6 mm Hg). Podobné výsledky byly zjištěny ve studii SUSTAIN 6 se semaglutidem v dávkách 0,5 mg a 1,0 mg: pokles hodnot HbA1c (0,7 %, resp. 1,0 %), systolického krevního tlaku (1,3 mm Hg a 2,6 mm Hg) a tělesné hmotnosti (2,9 kg a 4,3 kg). Konečně ve studii EXSCEL s exenatidem podávaným jednou týdně byla průměrná hodnota HbA1c na konci studie nižší o 0,53 %, tělesná hmotnost o 1,3 kg a systolický krevní tlak o 1,6 mm Hg, zatímco srdeční frekvence stoupla o 2,5/min. Celkově lze dopad antidiabetik v CVOT studiích na kardiometabolické rizikové faktory označit za méně významný, a to ve značné míře v důsledku uspořádání studií (méně intenzivní strategie kontroly glykemie, riziková populace s vysokým podílem hypolipidemické, antihypertenzní a antiagregační medikace při vstupu do studie).
Závěr
Když se podíváme na ukončené a publikované KV studie s antidiabetiky, lze konstatovat, že inzuliny glargin a degludek, sitagliptin, alogliptin, saxagliptin, exenatid QW a lixisenatid mají neutrální účinky na četnost KV příhod (MACE) a podporují užívání těchto léků s cílem zlepšení kontroly glykemie a redukce výskytu mikrovaskulárních komplikací. Některé z ukončených studií nám navíc poskytly cenné informace nad rámec svého primárního zaměření. Důkazy o KV přínosu plynoucím z užívání empagliflozinu, kanagliflozinu, liraglutidu a injekčního semaglutidu vedly poměrně rychle k přehodnocení řady doporučených postupů a promítají se již do každodenní klinické praxe. Nečekaný výsledek podávání empagliflozinu ve studii EMPA REG OUTCOME na redukci počtu hospitalizací pro srdeční selhání podpořený výsledky studie CANVAS otevřel zcela nový prostor pro využití této lékové skupiny nejen k redukci hyperglykemií, ale i v kardiologii. Naopak vzhledem k mírně zvýšenému riziku srdečního selhání asociovanému se saxagliptinem a alogliptinem je potřeba aktivně získávat další data do patofyziologického pasu skupiny inhibitorů DPP 4, které patrně kromě primárního působení na GLP 1 modulují další procesy v organismu, jejichž dopad a význam je nutné zmapovat. Dalším podstatným zjištěním vyplývajícím z CVOT studií byl příznivý efekt na zpomalení progrese chronického onemocnění ledvin, který byl zaznamenán u empagliflozinu, kanagliflozinu, liraglutidu a semaglutidu.
CVOT studie mají samozřejmě rovněž řadu limitujících faktorů, mezi které patří především omezená délka trvání a specifická studijní populace. Rozdíly v uspořádání studií, heterogenita základních demografických a fenotypových charakteristik pacientů navíc způsobují, že je velmi obtížné srovnávat výsledky studií navzájem a nelze je zobecňovat pro tak různorodou populaci, jakou jsou pacienti s diabetem 2. typu. Ze zkušeností ze studií UKPDS a DCCT/EDIC víme, že teprve desetileté sledování odhalilo řadu skutečností souvisejících především s hyperglykemickým „paměťovým efektem“. Dále je potřebné zdůraznit, že díky datům z CVOT studií se kromě KV aspektů antidiabetické léčby vynořují a zanořují i další potenciální hrozby spojené s chronickým užíváním antidiabetik, jako např. diabetická ketoacidóza, pankreatitidy, medulární karcinomy štítné žlázy, močové a genitální infekce, karcinom močového měchýře, fraktury dlouhých kostí, amputace dolních končetin atd. Kdepak jsou ty časy, kdy nás trápila pouze laktátová acidóza u metforminu a hypoglykemie po glibenklamidu.
Problematika vztahu mezi antidiabetiky a KV systémem je natolik komplexní, že prozatím není možné vyvozovat konečné soudy, zejména co se týče podstaty jejich účinku (hemodynamické změny, alterace metabolismu myokardu atd.). Již dnes však můžeme s velkou pravděpodobností tvrdit, že zejména v případě agonistů receptorů pro GLP 1 a inhibitorů SGLT2 se jedná o moderní antidiabetika s všestranným působením přesahujícím pouze léčbu diabetu 2. typu. Dosavadní poznatky naznačují, že antidiabetika mohou být kromě primárního použití v léčbě diabetu i terapeutickým prostředkem v primární a sekundární prevenci KV příhod, srdečního selhání a diabetické nefropatie. Jelikož se v brzké době dočkáme řady dalších publikací a nových dat jak z klinických studií, tak z běžného používání, budeme se moci o vzájemném vztahu antidiabetik a KV systému naučit mnohem více a příští rok budeme zase o něco chytřejší.
Seznam použité literatury
- [1] U.S. Food and Drug Administration. Guidance from industry: diabetes mellitus evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes [Internet]. Available from www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/ Guidances/ucm071627.pdf. Accessed 31 October 2016.
- [2] Scirica BM, Bhatt DL, Braunwald E, et al.; SAVOR‑TIMI 53 Steering Committee and Investigators. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013; 369: 1317–1326.
- [3] White WB, Cannon CP, Heller SR, et al.; EXAMINE Investigators. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013; 369: 1327–1335.
- [4] Green JB, Bethel MA, Armstrong PW, et al.; TECOS Study Group. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015; 373: 232–242.
- [5] Pfeffer MA, Claggett B, Diaz R, et al.; ELIXA Investigators. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Engl J Med 2015; 373: 2247–2257.
- [6] Zinman B, Wanner C, Lachin JM, et al.; EMPA‑REG OUTCOME Investigators. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373: 2117–2128.
- [7] Neal B, Perkovic V, Mahaffey KW, et al.; CANVAS Program Collaborative Group. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377: 644–657.
- [8] Marso SP, Daniels GH, Brown‑Frandsen K, et al.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375: 311–322.
- [9] Marso SP, Bain SC, Consoli A, et al.; SUSTAIN‑ 6 Investigators. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375: 1834–1844.
- [10] Nathan DM, Genuth S, Lachin J, et al.; Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long‑term complications in insulin‑dependent diabetes mellitus. N Engl J Med 1993; 329: 977–986.
- [11] Nathan DM, Cleary PA, Backlund JY, et al.; Diabetes Control and Complications Trial/ Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353: 2643–2653.
- [12] UK Prospective Diabetes Study (UKPDS) Group. Intensive blood‑glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837–853.
- [13] UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood‑glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352: 854–865.
- [14] Holman RR, Paul SK, Bethel MA, et al. 10‑year follow‑up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–1589.
- [15] Gerstein HC, Miller ME, Byington RP, et al.; Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- [16] ACCORD Study Group. Nine‑year effects of 3.7 years of intensive glycemic control on cardiovascular outcomes. Diabetes Care 2016; 39: 701–708.
- [17] Patel A, MacMahon S, Chalmers J, et al.; ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358: 2560–2572.
- [18] Duckworth W, Abraira C, Moritz T, et al.; VADT Investigators. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360: 129–139.
- [19] Hayward RA, Reaven PD, Wiitala WL, et al.; VADT Investigators. Follow‑up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015; 372: 2197–2206.
- [20] Ray KK, Seshasai SR, Wijesuriya S, et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta‑analysis of randomised con‑ trolled trials. Lancet 2009; 373: 1765–1772.
- [21] Turnbull FM, Abraira C, Anderson RJ, et al.; Control Group. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabetologia 2009; 52: 2288–2298.
- [22] Holman RR, Sourij H, Califf RM. Cardiovascular outcome trials of glucose‑lowering drugs or strategies in type 2 diabetes. Lancet 2014; 383: 2008–2017.
- [23] Nissen SE, Wolski K, Topol EJ. Effect of muraglitazar on death and major adverse cardiovascular events in patients with type 2 diabetes mellitus. JAMA 2005; 294: 2581–2586.
- [24] Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007; 356: 2457–2471.
- [25] Home PD, Pocock SJ, Beck‑Nielsen H, et al.; RECORD Study Team. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open‑label trial. Lancet 2009; 373: 2125–2135.
- [26] Mahaffey KW, Hafley G, Dickerson S, et al. Results of a reevaluation of cardiovascular outcomes in the RECORD trial. Am Heart J 2013; 166: 240–249.e1.
- [27] Dormandy JA, Charbonnel B, Eckland DJ, et al.; PROactive Investigators. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366: 1279–1289.
- [28] Kernan WN, Viscoli CM, Furie KL, et al.; IRIS Trial Investigators. Pioglitazone after ischemic stroke or transient ischemic attack. N Engl J Med 2016; 374: 1321–1331.
- [29] Young LH, Viscoli CM, Curtis JP, et al. IRIS Investigators. Cardiac outcomes after ischemic stroke or TIA: effects of pioglitazone in patients with insulin resistance without diabetes. Circulation 2017; 135: 1882–1893.
- [30] Boehringer Ingelheim. CAROLINA: cardiovascular outcome study of linagliptin versus glimepiride in patients with type 2 diabetes. In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https:// clinicaltrials.gov/show/NCT01243424. NLM Identifier: NCT01243424. Accessed 6 April 2017.
- [31] Boehringer Ingelheim. Cardiovascular and renal microvascular outcome study with linagliptin in patients with type 2 diabetes mellitus (CARMELINA). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https://clinicaltrials.gov/show/NCT01897532. NLM Identifier: NCT01897532. Accessed 10 February 2017.
- [32] Gantz I, Chen M, Suryawanshi S, et al. A randomized, placebo‑controlled study of the cardiovascular safety of the once‑weekly DPP‑4 inhibitor omarigliptin in patients with type 2 diabetes mellitus. Cardiovasc Diabetol 2017; 16: 112.
- [33] Merck. Merck provides update on filing plans for omarigliptin, an investigational DPP‑4 inhibitor for type 2 diabetes [Internet]. Available from http://www.mrknewsroom.com/news/company‑statements/merck‑provides‑update‑filing‑plans‑omarigliptin‑investigational‑dpp‑4‑inhibi. Accessed 7 April 2017.
- [34] Zannad F, Cannon CP, Cushman WC, et al.; EXAMINE Investigators. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double‑blind trial. Lancet 2015; 385: 2067–2076.
- [35] Holman RR, Bethel MA, Mentz RJ, et al.; EXSCEL Study Group. Effects of once‑weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2017; 377: 1228–1239.
- [36] Intarcia Therapeutics. Intarcia announces successful cardiovascular safety results in phase 3 FREEDOM‑CVO trial for ITCA 650, an investigational therapy for type 2 diabetes: company also reports new $75 million financing for manufacturing scale‑up and inventory build for anticipated global launch of ITCA 650 [Internet]. Available from https://www.intarcia.com/media/press‑ releases/2016‑may‑6‑cardiovascular‑safety.html. Accessed 14 February 2017.
- [37] Janssen Research & Development. Evaluation of the effects of canagliflozin on renal and cardiovascular outcomes in participants with diabetic nephropathy (CREDENCE). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https://clinicaltrials.gov/show/NCT02065791. NLM Identifier: NCT02065791. Accessed 10 February 2017.
- [38] AstraZeneca. A study to evaluate the effect of dapagliflozin on renal outcomes and cardiovascular mortality in patients with chronic kidney disease (Dapa‑CKD). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https://clinicaltrials.gov/show/ NCT03036150. NLM Identifier: NCT03036150. Accessed 4 April 2017.
- [39] AstraZeneca. Study to evaluate the effect of dapagliflozin on the incidence of worsening heart failure or cardiovascular death in patients with chronic heart failure (Dapa‑HF). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https://clinicaltrials.gov/ show/NCT03036124. NLM Identifier: NCT03036124. Accessed 6 April 2017.
- [40] Boehringer Ingelheim. Empagliflozin outcome trial in patients with chronic heart failure with reduced ejection fraction (EMPEROR‑ Reduced). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https://clinicaltrials.gov/show/NCT03057977 NLM Identifier: NCT03057977. Accessed 6 April 2017.
- [41] Boehringer Ingelheim. Empagliflozin outcome trial in patients with chronic heart failure with preserved ejection fraction (EMPEROR‑Preserved). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https://clinicaltrials.gov/show/ NCT03057951. NLM Identifier: NCT03057951. Accessed 6 April 2017.
- [42] Gerstein HC, Bosch J, Dagenais GR, et al.; ORIGIN Trial Investigators. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367: 319–328.
- [43] ORIGIN Trial Investigators. Cardiovascular and other outcomes postintervention with insulin glargine and omega‑3 fatty acids (ORIGINALE). Diabetes Care 2016; 39: 709–716.
- [44] Marso SP, McGuire DK, Zinman B, et al.; DEVOTE Study Group. Efficacy and safety of degludec versus glargine in type 2 diabetes. N Engl J Med 2017; 377: 723–732.
- [45] AstraZeneca. Multicenter trial to evaluate the effect of dapagliflozin on the incidence of cardiovascular events (DECLARE‑TIMI 58). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available from https:// clinicaltrials.gov/show/NCT01730534. NLM Identifier: NCT01730534. Accessed 10 February 2017.
- [46] Merck Sharp & Dohme. Cardiovascular outcomes following ertugliflozin treatment in type 2 diabetes mellitus participants with vascular disease, the VERTIS CV study (MK‑8835‑004). In: ClinicalTrials.gov [Internet]. Bethesda, MD, National Library of Medicine. Available fromhttps://clinicaltrials.gov/show/ NCT01986881. NLM Identifier: NCT01986881. Accessed 14 February 2017.
- [47] Gerstein HC, Colhoun HM, Dagenais GR, et al.; REWIND Trial Investigators. Design and baseline characteristics of participants in the Researching cardiovascular Events with a Weekly INcretin in Diabetes (REWIND) trial on the cardiovascular effects of dulaglutide. Diabetes Obes Metab 14 July 2017 [Epub ahead of print]. https://doi.org/10.1111/dom.13028
- [48] GlaxoSmithKline. Effect of albiglutide, when added to standard blood glucose lowering therapies, on major cardiovascular events in subjects with type 2 diabetes mellitus. In: ClinicalTrials.gov [Internet]. Available from https:// clinicaltrials.gov/show/NCT02465515. NLM Identifier: NCT02465515. Accessed 14 February 2017.
- [49] Novo Nordisk A/S. A trial investigating the cardiovascular safety of oral semaglutide in subjects with type 2 diabetes (PIONEER 6). In: ClinicalTrials.gov [Internet]. Available from https://clinicaltrials.gov/show/NCT02692716. NLM Identifier: NCT02692716. Accessed 29 June 2017.
- [50] Cefalu WT, Kaul S, Gerstein HC, et al. Cardiovascular Outcomes Trials in Type 2 Diabetes: Where Do We Go From Here? Reflections From a Diabetes Care Editors' Expert Forum. Diabetes Care 2018; 41: 14−31.