Klinické využití inhibitorů DPP-4
Cílem terapie diabetu je dosažení normálních hodnot glykemie jako základu prevence závažných pozdních komplikací nemoci. Hlavním rizikem intenzivní terapie je zvýšené riziko hypoglykemie. Gliptiny jsou novou skupinou léků, které inhibicí enzymu DPP-4 zvyšují hodnotu endogenního GLP-1. Vykazují dobrou klinickou účinnost srovnatelnou s jinými perorálními antidiabetiky a vysokou bezpečnost, zejména velmi nízké riziko hypoglykemie. Velmi pravděpodobně mají i pozitivní vliv na kardiovaskulární riziko. V současnosti jsou v ČR registrovány sitagliptin, vildagliptin, saxagliptin a linagliptin.
Úvod
Diabetes mellitus 2. typu je chronická, doposud nevyléčitelná nemoc. Dosáhnout asymptomatického stavu, tedy situace, kdy pacient bez ohledu na aktuální hodnotu glykemie nemá žádné klinické symptomy, je v současnosti poměrně jedno-duché. Nicméně jakákoliv dlouhodobá glykemie vyšší než norma zvyšuje pravděpodobnost vzniku chronických komplikací, které prokazatelně zhoršují kvalitu života a také zvyšují mortalitu. Z tohoto důvodu se začátkem minulého desetiletí stalo cílem terapie diabetu dosažení normálních hodnot glykemie (hladin glykovaného hemo-globinu – HbA1c) jako úhelného kamene prevence závažných důsledků nemoci.
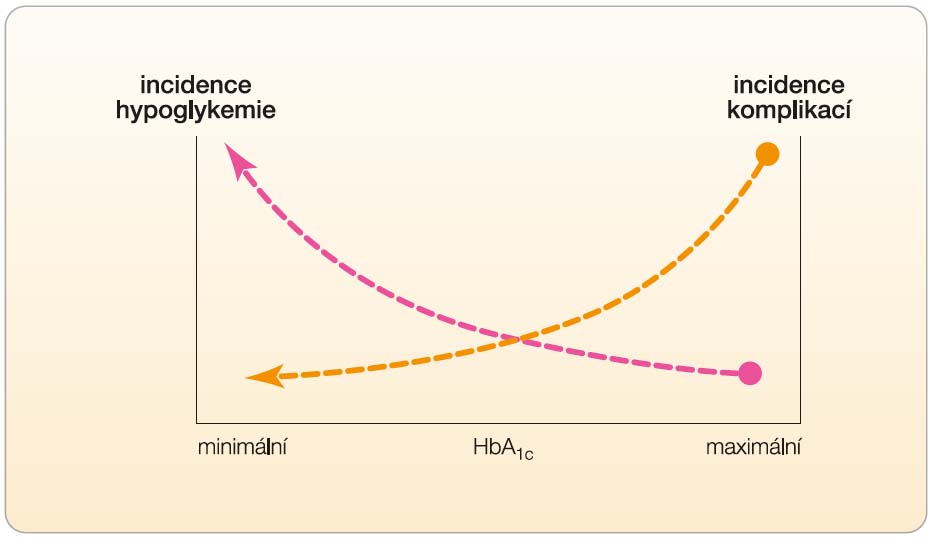 Výsledky velkých klinických studií, které byly uveřejněny koncem minulého desetiletí, však ukázaly, že dosažení tohoto cíle klasickou terapií není ani jednoduché, ani bez rizik. Hlavní překážkou se ukázalo být zvýšené riziko výskytu hypoglykemie jako důsledek intenzivní terapie (obr. 1). Při dalších analýzách bylo prokázáno, že právě zvýšení incidence hypoglykemie je provázeno závažnými negativními důsledky – dokonce relativním zvýšením mortality [1, 2, 3]. Vyvstal rozpor – normalizace glykemie klasickou intenzivní terapií sice sníží riziko pozdních komplikací, nicméně tento přínos je negován zvýšeným rizikem úmrtí v důsledku hypoglykemie. K řešení tohoto rozporu se nabízejí dvě základní cesty – revidovat cíle terapie pro nejrizikovější pacienty (nemocní s ischemickou chorobou srdeční, případně nemocní s delším průběhem diabetu), anebo využít terapii s minimálním rizikem vzniku hypoglykemie. K této terapii patří metformin (je standardně řazen na první místo volby), z derivátů sulfonylurey gliklazid v galenické formě s řízeným uvolňováním, glitazony (kvůli některým rizikům spojeným s léčbou však pouze u nemocných s významnou inzulinovou rezistencí), režim bazálního inzulinu s využitím predikovatelnosti účinku u inzulinových analog (inzulin glargin) [2].
Výsledky velkých klinických studií, které byly uveřejněny koncem minulého desetiletí, však ukázaly, že dosažení tohoto cíle klasickou terapií není ani jednoduché, ani bez rizik. Hlavní překážkou se ukázalo být zvýšené riziko výskytu hypoglykemie jako důsledek intenzivní terapie (obr. 1). Při dalších analýzách bylo prokázáno, že právě zvýšení incidence hypoglykemie je provázeno závažnými negativními důsledky – dokonce relativním zvýšením mortality [1, 2, 3]. Vyvstal rozpor – normalizace glykemie klasickou intenzivní terapií sice sníží riziko pozdních komplikací, nicméně tento přínos je negován zvýšeným rizikem úmrtí v důsledku hypoglykemie. K řešení tohoto rozporu se nabízejí dvě základní cesty – revidovat cíle terapie pro nejrizikovější pacienty (nemocní s ischemickou chorobou srdeční, případně nemocní s delším průběhem diabetu), anebo využít terapii s minimálním rizikem vzniku hypoglykemie. K této terapii patří metformin (je standardně řazen na první místo volby), z derivátů sulfonylurey gliklazid v galenické formě s řízeným uvolňováním, glitazony (kvůli některým rizikům spojeným s léčbou však pouze u nemocných s významnou inzulinovou rezistencí), režim bazálního inzulinu s využitím predikovatelnosti účinku u inzulinových analog (inzulin glargin) [2].
V době, kdy probíhaly diskuse o bezpečnosti terapie směřující k cílové normoglykemii, však byla zavedena do terapie farmaka, která ke svému účinku využívají vlastností inkretinového systému. Jejich zásadním přínosem je právě minimální riziko vzniku hypoglykemie, což tuto farmakologickou intervenci staví postupně do popředí zájmu kliniků z hlediska poměru terapeutického přínosu a rizika.
Gliptiny: inhibitory DPP-4
Gliptiny obecně inhibují aktivitu dipeptidylpeptidázy-4 (DPP-4), enzymu, který rozkládá hormon GLP-1 (glucagon-like peptide-1), jenž je produkován v L-buňkách tenkého střeva [4]. Z tohoto důvodu se také tato skupina antidiabetik nazývá inhibitory DPP-4. Při léčbě gliptiny se zvyšuje hladina endogenně produkovaného GLP-1 na 2–3násobek. Výsledkem je znovunastolení fyziologických poměrů v regulaci metabolismu u pacientů s diabetem 2. typu, u nichž byl prokázán defekt inkretinové osy [5].
GLP-1 zpomaluje vyprazdňování žaludku, zvyšuje citlivost b-buněk k sekrečním podnětům, upravuje kvalitu sekrece inzulinu (obnovuje první fázi inzulinové sekrece), snižuje sekreci glukagonu, a proto snižuje výdej glukózy hepatocyty. Byl prokázán příznivý efekt na proliferaci b-buněk, současně bylo prokázáno omezení jejich apoptózy. GLP-1 také snižuje chuť k jídlu. Při kontinuální infuzi GLP-1 se zlepšuje kompenzace diabetu, je významně ovlivněna postprandiální glykemie i glykemie nalačno [6, 7]. Účinek na sekreci inzulinu je tzv. glukózodependentní. To znamená, že se neprojevuje při normální nebo snížené glykemii, taktéž ustává při poklesu glykemie na normální hodnotu. Tato vlastnost vysvětluje minimální riziko hypoglykemie při léčbě gliptiny. Tím, že gliptiny zablokují aktivitu DPP-4, zpomalí výrazně jinak velmi rychlý katabolismus GLP-1 (poločas pouze několik minut) a jeho koncentrace se zvýší. Gliptiny tedy potencují účinky GLP-1, což v klinické praxi odpovídá bezpečnému zlepšení kompenzace diabetu.
V České republice byl registrován jako první sitagliptin, záhy poté i vildagliptin, saxagliptin a linagliptin.
Klinické účinky gliptinů
Gliptiny jako zástupci nové terapeutické skupiny farmak využívajících vlastností inkretinové osy byly v klinických studiích fáze II a III hodnoceny v prvé řadě z hlediska jejich účinku na kompenzaci diabetu [8]. Jsou to antidiabetika, proto je tento účinek nejdůležitější. Nicméně s ohledem na vlastnosti a účinky GLP-1 bylo v popředí zájmu i hodnocení ostatních pozitivních efektů, jako je vliv na tělesnou hmotnost, sekreci inzulinu a následně i na kardiovas-kulární rizikové parametry.
Vliv gliptinů na kompenzaci diabetu
Přes komplexní ovlivnění metabolismu je vlastní antidiabetický účinek GLP-1 vázán na přítomnost inzulinu, resp. na jeho dostatečnou sekreci. Z této skutečnosti vyplývají i vlastnosti gliptinů, které definují jejich optimální účinek [9–21].
![Graf 1 Vztah mezi výsledným poklesem hladiny glykovaného hemoglobinu vyjádřeným v absolutní hodnotě a míra kompenzace na začátku sledování platí pro gliptiny i pro ostatní terapeutické modality. Čím je hodnota glykovaného hemoglobinu vyšší na začátku léčby, tím vyšší je její absolutní pokles; volně podle [5] – Nauck, et al., 2007.](https://www.remedia.cz/photo-a-28797---.jpg) Gliptiny snižují glykemii nalačno i postprandiálně. Průměrné snížení hladiny glykovaného hemoglobinu se pohybuje okolo 0,8 % proti placebu, a to jak v monoterapii, tak i v kombinaci s ostatními antidiabetiky [10, 22–24]. Účinek je vyšší u pacientů s kratší dobou trvání diabetu (protože s prodlužujícím se průběhem nemoci klesá sekrece inzulinu, a to zejména postprandiálně). Zlepšení kompenzace vyjádřené v absolutní hodnotě poklesu glykovaného hemoglobinu je také významnější u hůře kompenzovaných pacientů, jinak vyjádřeno, pokles glykovaného hemoglobinu ko-reluje pozitivně s jeho vstupní hodnotou (graf 1), což je ale obecná vlastnost většiny antidiabetik [25].
Gliptiny snižují glykemii nalačno i postprandiálně. Průměrné snížení hladiny glykovaného hemoglobinu se pohybuje okolo 0,8 % proti placebu, a to jak v monoterapii, tak i v kombinaci s ostatními antidiabetiky [10, 22–24]. Účinek je vyšší u pacientů s kratší dobou trvání diabetu (protože s prodlužujícím se průběhem nemoci klesá sekrece inzulinu, a to zejména postprandiálně). Zlepšení kompenzace vyjádřené v absolutní hodnotě poklesu glykovaného hemoglobinu je také významnější u hůře kompenzovaných pacientů, jinak vyjádřeno, pokles glykovaného hemoglobinu ko-reluje pozitivně s jeho vstupní hodnotou (graf 1), což je ale obecná vlastnost většiny antidiabetik [25].
Speciální pozornost byla věnována kombinaci gliptinů s metforminem, protože se ukázalo, že tato kombinace zlepšuje kompenzaci diabetu více, než představuje součet očekávaných efektů j![Graf 2 Výsledný pokles hladiny glykovaného hemoglobinu po iniciální léčbě sitagliptinem samostatně (100 = 100 mg sitagliptinu denně), po léčbě sitagliptinem v kombinaci s metforminem (100/1 = kombinace 100 mg sitagliptinu a 1 g metforminu; 100/2 = kombinace 100 mg sitagliptinu a 2 g metforminu) a po léčbě metforminem samostatně (1 = 1 g metforminu denně, 2 = 2 g metforminu denně); volně podle [26] – Goldstein, et al., 2007.](https://www.remedia.cz/photo-a-28798---.jpg) ednotlivých farmak [26–28]. Přitom v předchozích dobách byl obvyklým nálezem efekt kombinace spíše nižší než součet účinnosti obou farmak v monoterapii. První studie, která na tuto skutečnost upozornila, byla provedena se sitagliptinem, největšího efektu bylo dosaženo v kombinaci 100 mg sitagliptinu a 2000 mg metforminu (graf 2). Následně bylo prokázáno, že metformin sám o sobě jako by nahrával tím, že také trochu zvyšuje sekreci GLP-1.
ednotlivých farmak [26–28]. Přitom v předchozích dobách byl obvyklým nálezem efekt kombinace spíše nižší než součet účinnosti obou farmak v monoterapii. První studie, která na tuto skutečnost upozornila, byla provedena se sitagliptinem, největšího efektu bylo dosaženo v kombinaci 100 mg sitagliptinu a 2000 mg metforminu (graf 2). Následně bylo prokázáno, že metformin sám o sobě jako by nahrával tím, že také trochu zvyšuje sekreci GLP-1.
Vliv gliptinů na sekreci inzulinu
GLP-1 zvyšuje sekreci inzulinu, totéž lze prokázat pro gliptiny [4, 29, 30]. Podmínkou je zachovalá sekreční kapacita
b-buněk. Pro setrvání účinku na kompenzaci je důležité, aby byla léčba gliptiny také schopna zpomalit přirozený úbytek sekrece inzulinu. Z dosavadních antidiabetik nejvíce urychluje úbytek sekrece inzulinu glibenklamid, glitazony mají potenciál zpomalení. S ohledem na další účinky GLP-1 bylo očekáváno, že gliptiny budou mít také příznivý dopad v této oblasti. Nejdelší studie, trvající 2 a 3 roky, ukazují, že kompenzace diabetu i po této době je udržena, což by svědčilo pro příznivé ovlivnění rychlosti poklesu sekrece inzulinu.
Nejvíce údajů je k dispozici pro sitagliptin, přehledně je jeho vliv na sekreci inzulinu zpracován v publikaci Dhillona [31]. Zlepšení funkce b-buněk bylo pozorováno během klinických studií trvajících do 54 týdnů při monoterapii sitagliptinem jako iniciální terapii a dále v léčbě kombinační (sitagliptin s pioglitazonem) nebo po přidání sitagliptinu k léčbě metforminem, inzulinem či k léčbě glitazony nebo sulfonylureou. Ve většině studií bylo popsáno zlepšení funkce b-buněk hodnocené indexem HOMA (HOmeostasis Model of Assessment) nebo poměrem proinzulin/inzulin či odpovědí b-buněk (Minimální model pro C-peptid) ve srovnání s placebem či s aktivním komparátorem. Bylo pozorováno i zlepšení dalších ukazatelů funkce b-buněk, jako je postprandiální inzulinemie, plochy pod křivkami koncentrací inzulinu a C-peptidu. Posléze byly publikovány podobné údaje i pro vildagliptin a linagliptin [32].
Vliv gliptinů na tělesnou hmotnost
Průvodním znakem zlepšení kompenzace diabetu je vzestup hmotnosti. U pa-cientů s vysokou glykemií se část glukózy ztrácí do moči (glykosurie). Pacienti tento úbytek energetického substrátu nahrazují vyšším příjmem energie potravou. Farmakologická intervence sníží glykemii, tím se sníží ztráty glukózy močí, tato je retinována v organismu a metabolizována na tuk. Pokud pacient nevyrovná retenci glukózy snížením příjmu potravy nebo větší fyzickou zátěží, přibývá na hmotnosti. Výsledkem je standardně tloustnutí na úroveň nově ustanovené rovnováhy mezi příjmem a výdejem (potřebou) energie.
![Graf 3 Změna hmotnosti pacientů v přímém porovnání terapie sitagliptinem a glipizidem proti vstupním hodnotám; volně podle [5] – Nauck, et al., 2007.](https://www.remedia.cz/photo-a-28799---.jpg) Gliptiny vedou ke snížení chuti k jídlu (GLP-1 je postprandiální hormon), což je příčinou tzv. hmotnostně neutrálního efektu. Ve většině klinických studií tedy terapie gliptiny, přestože vede ke zlepšení kompenzace a k poklesu glykemie, nevede ke zvýšení hmotnosti, naopak, v řadě případů pacienti o několik kilogramů svou tělesnou hmotnost sníží [5, 22]. Tato tendence je zřetelná zejména v přímém porovnání s účinkem sulfonylurey (graf 3).
Gliptiny vedou ke snížení chuti k jídlu (GLP-1 je postprandiální hormon), což je příčinou tzv. hmotnostně neutrálního efektu. Ve většině klinických studií tedy terapie gliptiny, přestože vede ke zlepšení kompenzace a k poklesu glykemie, nevede ke zvýšení hmotnosti, naopak, v řadě případů pacienti o několik kilogramů svou tělesnou hmotnost sníží [5, 22]. Tato tendence je zřetelná zejména v přímém porovnání s účinkem sulfonylurey (graf 3).
Vliv gliptinů na lipidy
Vliv terapie gliptiny na hladiny lipidů nalačno je neutrální v porovnání s placebem. Pokud jsou v jednotlivých studiích zaznamenány změny, jsou inkonzistentní, na hranici klinické významnosti a zejména, až na ojedinělou výjimku, popsané změ-ny nejsou adjustovány na změny v terapii hypolipidemiky. Zdá se však, že gliptiny by mohly pozitivně ovlivňovat hladiny lipidů postprandiálně. Tento účinek je jistě v souladu s představou GLP-1 jako postprandiálně secernovaného hormonu.
O možném vlivu gliptinů na postprandiální koncentraci lipidů svědčí dvě experimentální práce, které se zabývají vlivem inhibice DPP-4 (vildagliptinu) na postprandiální stav [33], a jedna randomizovaná, prospektivní, překřížená studie se sitagliptinem [34]. Podle nich je snížena postprandiální triacylglycerolemie patrně jako důsledek komplexního efektu inkretinů.
Vliv na krevní tlak
GLP-1 snižuje krevní tlak, agonisté receptoru pro GLP-1 snižují krevní tlak konstantně. Pro gliptiny není mnoho důkazů v klinických studiích fáze II a III, nicméně některé publikace z poslední doby pozitivní ovlivnění krevního tlaku dokládají u sitagliptinu a vildagliptinu [35].
Již v roce 2008 byla publikována první zpráva o vlivu sitagliptinu na krevní tlak, nyní byla uveřejněna druhá práce. Systolický krevní tlak poklesl při léčbě sitagliptinem o 9 mm Hg [36].
Gliptiny a riziko hypoglykemie
Jak bylo výše uvedeno, účinek GLP-1 na sekreci inzulinu je glukózodependentní. V praxi to znamená, že v okamžiku, kdy se glykemie přibližuje normálnímu rozmezí, se snižuje vliv GLP-1 na sekreci inzulinu a současně se zvyšuje sekrece glukagonu. Klinickým korelátem tohoto fenoménu je zjištění, že terapie gliptiny je zatížena rizikem hypoglykemie shodným s podáváním placeba [22, 26]. Výjimkou je kombinace s přímými sekretagogy, zejména se sulfonylureou.
Minimální riziko hypoglykemie při terapii gliptiny je z klinického pohledu významné až zásadní [22]. Hypoglykemie je limitujícím faktorem dosažení těsné kompenzace. Zvyšuje riziko akutní koronární příhody,
zvyšuje mortalitu. Z pohledu pacienta je velice nepříjemnou příhodou, která oslabuje jeho ochotu udržet těsnou kompenzaci, snižuje tedy compliance, taktéž vede ke kompenzačnímu dojídání se, a tedy přispívá ke zvýšení hmotnosti.
Vliv na kardiovaskulární riziko
Gliptiny mají velmi pravděpodobně reálný potenciál snížit kardiovaskulární riziko [37]. Hromadí se experimentální doklady o příznivém vlivu GLP-1 na myokard, které jsou stvrzovány pilotními klinickými studiemi [37, 38]. Terapie založená na inkretinech je nadějí pro další snížení kardiovaskulární mortality. Recentně byla uveřejněna analýza klinických studií s linagliptinem (analýza souboru 5239 účastníků), ve které byl nalezen statisticky významný pokles kardiovas-kulárního rizika (definovaného jako sdružený ukazatel zahrnující úmrtí z kardiovaskulárních příčin, hospitalizaci pro nestabilní anginu pectoris, cévní mozkovou příhodu) o 66 % (!) ve srovnání s ostatní terapií [39]. Velmi podobné výsledky byly získány pro saxagliptin a vildagliptin [24, 40].
Nově byla publikována práce hodnotící vliv sitagliptinu na mikroalbuminurii. U sledovaného souboru došlo po šestiměsíční terapii sitagliptinem k poklesu albuminurie, a to jak u pacientů se vstupním nálezem v normálním rozmezí, tak i u pacientů se vstupním nálezem odpovídajícím pozitivní mikroalbuminurii [41]. Vildagliptin zlepšuje endoteliální dysfunkci [42].
V současnosti probíhá několik velkých klinických morbiditně-mortalitních prospektivních studií s gliptiny, které mají vyhodnotit jejich vliv na kardiovaskulární riziko. První výsledky jsou očekávány v příštím roce. Taktéž probíhá studie SITAGRAMI [43], která hodnotí vliv sitagliptinu s další specifickou terapií u osob s akutním infarktem myokardu.
Nežádoucí účinky při léčbě gliptiny
Gliptiny, stejně jako jakákoliv jiná nová terapeutická skupina, jsou široce diskutovány v literatuře nejen z hlediska pozitivních přínosů, ale také z hlediska rizik spojených s jejich užitím. O hypoglykemii je pojednáno výše, nejvíce pozornosti bylo věnováno riziku vzniku nádorových onemocnění a pankreatitid.
V současnosti neexistuje jediný relevantní vědecký důkaz o zvýšeném riziku nádorových onemocnění při terapii gliptiny, stále se však objevují práce, jejichž výsledky jsou zkresleny spekulativní, nesprávnou aplikací statistických metod. Opatrnost je jistě vždy nezbytná, zatím však žádná seriózní analýza zvýšené riziko malignit neprokázala.
Kazuistické informace o vzniku akutní pankreatitidy jsou opakovaně publikovány. Pro tuto komplikaci však platí analýzy incidence akutních pankreatitid podle rizikového profilu pacientů. Obecně platí, že populace pacientů s diabetem 2. typu je zatížena vyšším rizikem vzniku onemocnění pankreatu ve srovnání s nediabetickou populací (u diabetiků jsou ve vyšší prevalenci zastoupeny klasické rizikové faktory – cholelitiáza, obezita a hypertriacylglycerolemie).
Porovnáme-li hlášené komplikace týkající se pankreatu z přísně sledovaných klinických studií s incidencí těchto onemocnění v populaci, je zřejmé, že gliptiny jsou z tohoto pohledu bezpečné. Souvislost byla jednoznačně vyvrácena podrobnou analýzou klinických studií [44] a také analýzou rizika vzniku pankreatitidy v populaci pacientů s diabetem – to je ve srovnání s nediabetiky zvýšeno [45].
Při léčbě gliptiny byly zaznamenány i jiné nežádoucí účinky než výše zmíněné, jejich incidence je však srovnatelná s incidencí při terapii ostatními antidiabetiky, vyjma mírného zvýšení výskytu počtu infekcí dýchacího traktu. Nejpodrobnější analýza byla uveřejněna v roce 2010 pro sitagliptin. Ve studii byla analyzována data ze souboru více než 10 000 osob léčených sitagliptinem v programu klinických studií [46]. Byla porovnána incidence všech gastrointestinálních příznaků při léčbě sitagliptinem a aktivním komparátorem (19,3 % vs. 18,1 %), předem specifikovaných příznaků, jako je průjem (5,0 % vs. 5,3 %), nevolnost (2,5 % vs. 2,6 %), zvracení (1,5 % vs. 1,2 %) či bolesti v oblasti břicha (1,1 % vs. 1,2 %). Incidence, jak uvedeno, je velmi podobná při léčbě sitagliptinem a ostatními antidiabetiky. Na základě analýzy autoři uzavírají, že léčba sitagliptinem nezvyšuje incidenci zažívacích potíží ve srovnání s běžnou léčbou diabetu 2. typu. Tato podrobná metaanalýza klinických studií hodnotila i bezpečnost terapie sitagliptinem, přitom nepřinesla žádné poznatky, které by mohly zpochybnit dlouhodobou bezpečnost terapie. Podobné výsledky byly získány i analýzou souboru více než 12 000 osob zařazených do klinických studií s vildagliptinem [40].
Celkové zhodnocení terapie gliptiny
Dosavadní výsledky prokazují účinnost gliptinů srovnatelnou s běžnou terapií metforminem, sulfonylureou, akarbózou, resp. voglibózou, a glitazony. Gliptiny nejsou účinnější, vynikají však několika přednostmi, jako je minimální riziko hypoglykemie, hmotnostně neutrální efekt, minimum nežádoucích účinků, celkově tedy velmi dobrá tolerance ze strany pacienta. Příslibem je pozitivní ovlivnění kardiovaskulárních rizikových faktorů. Snížení rizika kardiovas-kulárních příhod prokázané zatím meta-analýzami klinických studií je příslibem do budoucnosti [24, 39]. Souhrnně je možno říci, že terapie gliptiny je podle dosavadních poznatků účinná a velmi bezpečná [10, 47].
Gliptiny se liší strukturou a farmakokinetikou [48]. Klinický efekt je však shodný u shodných populací pacientů. Nemůže tomu být jinak, protože pokud je blízký stupeň inhibice DPP-4, pak musí být i vliv na kompenzaci prakticky stejný, neboť vlastním efektorem je zejména ovlivnění inzulinové sekrece. K dispozici je podrobná metaanalýza porovnávající sitagliptin a vildagliptin a pouze jedno přímé porovnání – non-inferiorní studie přímo porovnávající sitagliptin a saxagliptin [49]. Tato studie byla provedena u 801 pacientů s diabetem 2. typu léčených stabilní dávkou metforminu s hodnotou glykovaného hemoglobinu v rozmezí 6,5–10 % (podle metodiky DCCT, Diabetes Control and Complica-tions Trial). Populace byla randomizována v poměru 1 : 1 k podávání sitagliptinu (100 mg jednou denně) nebo k podávání saxagliptinu (5 mg jednou denně), tj. terapie metforminem byla v obou větvích zachována. Adjustovaný průměrný pokles glykovaného hemoglobinu představoval -0,65 % ve skupině léčené sitagliptinem a -0,52 % ve skupině léčené saxagliptinem. Terapie byla v obou větvích dobře tolerována, hypo-glykemické příhody byly zaznamenány u 3 % pacientů a pokles hmotnosti dosahoval v průměru -0,4 kg v každé větvi. Pod hranici 7% koncentrace glykovaného hemoglobinu se dostalo 39,1 % léčených sitagliptinem a 33,0 % léčených saxagliptinem. Klinická studie potvrdila dobrou toleranci obou látek a non-inferioritu saxagliptinu.
Linagliptin je metabolizován v játrech, proto je možné jej použít i u nemocných se závažnějším stupněm renální insuficience beze změny dávkování. Naopak u sitagliptinu je třeba dávku v tomto případě redukovat, nicméně bezpečnost a účinnost u pacientů s renální insuficiencí byla hodnocena i pro ostatní gliptiny.
Většina gliptinů vykazuje dostatečnou inhibici DPP-4 i po 24 hodinách [50], proto jsou podávány v jedné denní dávce. Výjimkou je vildagliptin, který je nutno podat ve dvou denních dávkách.
Místo gliptinů v terapii diabetu
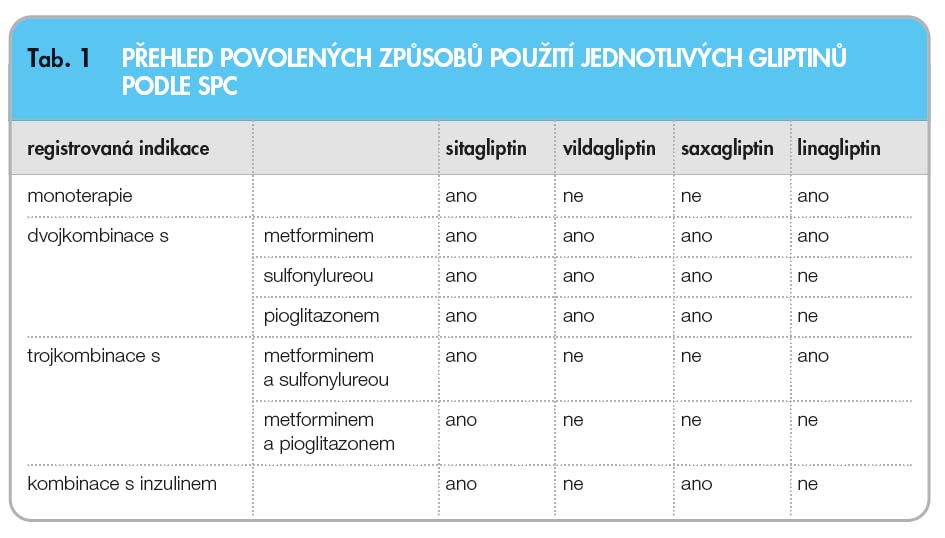 Gliptiny jsou účinné napříč celým spektrem všech pacientů s diabetem 2. typu. Nicméně zdá se, že jsou účinnější u osob s kratším trváním diabetu a u osob vyššího věku [51]. V současnosti jsou registrovány pro monoterapii i různé kombinace, přitom možnosti užití v klinické praxi u jednotlivých látek se liší podle registrace (tab. 1). Výhodou v kombinaci s metforminem je vzájemně komplementární účinek, výhodou v kombinaci s pioglitazonem je mírnější tendence ke vzestupu hmotnosti [52], což platí i pro kombinaci se sulfonylureou. U pacientů s vysokou glykemií nalačno je ideální kombinace s bazálním analogem inzulinu [17, 53].
Gliptiny jsou účinné napříč celým spektrem všech pacientů s diabetem 2. typu. Nicméně zdá se, že jsou účinnější u osob s kratším trváním diabetu a u osob vyššího věku [51]. V současnosti jsou registrovány pro monoterapii i různé kombinace, přitom možnosti užití v klinické praxi u jednotlivých látek se liší podle registrace (tab. 1). Výhodou v kombinaci s metforminem je vzájemně komplementární účinek, výhodou v kombinaci s pioglitazonem je mírnější tendence ke vzestupu hmotnosti [52], což platí i pro kombinaci se sulfonylureou. U pacientů s vysokou glykemií nalačno je ideální kombinace s bazálním analogem inzulinu [17, 53].
Gliptiny nebudou účinné u všech pacientů, omezený efekt lze očekávat u nemocných s již sníženou sekrecí inzulinu (i když byla zkoušena terapie gliptiny u pacientů s diabetem 1. typu), naopak, spekulativně můžeme předpokládat, že jejich efekt bude velmi dobrý u nemocných s defektem inkretinového systému, který však v praxi nelze běžně vyšetřit.
Závěr
Gliptiny, inhibitory DPP-4, představují velmi perspektivní antidiabetika, která mají dobrou účinnost a velmi dobrou bezpečnost. První údaje nasvědčují i tomu, že léčba gliptiny sníží rovněž kardiovaskulární riziko. Tyto vlastnosti posouvají gliptiny postupně na místo druhé volby po metforminu při léčbě diabetu 2. typu.
Seznam použité literatury
- [1] Hertzel, CG, et al. Glycemia Treatment Strate-gies in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) Trial. Am J Cardiol 2007; 99 (suppl): 34i–43i.
- [2] Kausik, KR, et al. Effect of intensive control of glukose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomized controlled trials. Lancet 2009; 373: 1765–1772.
- [3] Skyler, JS, et al. Intensive Glycemic Control and the Prevention of Cardiovascular Events: Implications of the ACCORD, ADVANCE, and VA Diabetes Trials. Diabetes Care 2009; 32: 187–192.
- [4] De Meester I, et al. Natural substrate of dipeptidyl petpidase IV. Adv Exp Med Biol 2000; 477: 67–87.
- [5] Nauck MA, et al. Efficacy and safety of the dipeptidylpeptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controlled on metformin alone a randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2007; 9: 194–205.
- [6] Ahrén B. Gut peptides and Type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3: 365–372.
- [7] D'Alessio, DA, Vahl TP. Glucagon-like peptid 1. Evolution of an incretin into a treatment for diabetes. Am J Physiol Endocrinol Metab 2004; 286: E882–E890.
- [8] Monami M, Cremasco F, Lamanna C. Predictors of response to dipeptidyl peptidase-4 inhibitors: evidence from randomized clinical trials. Diabetes Metab Res Rev 2011; 27: 362–372.
- [9] Esposito K, Cozzolino D, et al. Dipeptidyl peptidase-4 inhibitors and HbA1c target of < 7% in type 2 diabetes: meta-analysis of randomized controlled trials. Diabetes Obes Metab 2011; 13: 594–603.
- [10] Fakhoury WK, Lereun C, Wright D. A meta-analysis of placebo-controlled clinical trials assessing the efficacy and safety of incretin-based medications in patients with type 2 diabetes. Pharmacology 2010; 86: 44–57.
- [11] Keating GM. Vildagliptin: a review of its use in type 2 diabetes mellitus. Drugs 2010; 70: 2089–2112.
- [12] Kvapil M. Sitagliptin pro rok 2012. In Kvapil M. eds: Diabetologie 2012; Praha: Triton, 2012.
- [13] Kvapil, M. Sitagliptin – první inhibitor DPP 4. In Kvapil M. eds: Diabetologie 2011; Praha: Triton, 2011.
- [14] Neumiller JJ, Campbell RK. Saxagliptin: a dipeptidyl peptidase-4 inhibitor for the treatment of type 2 diabetes mellitus. Am J Health Syst Pharm 2010; 67: 1515–1525.
- [15] Schweizer A, et al. Comparison between vilda-gliptin and metformin to sustain reductions in HbA1c over 1 year in drug-naive patients with Type 2 diabetes. Diabet Med 2007; 955–961.
- [16] Subbarayan S, Kipnes M. Sitagliptin: a review. Expert Opin Pharmacother 2011; 12: 1613–1622.
- [17] Vilsbo/ll T, Rosenstock J, Yki-Järvinen H, et al. Efficacy and safety of sitagliptin when added to insulin therapy in patients with type 2 diabetes. Diabetes Obes Metab 2010; 12: 167–177.
- [18] SPC sitagliptin 2011.
- [19] SPC vildagliptin 2011.
- [20] SPC linagliptin 2011.
- [21] SPC saxagliptin 2011.
- [22] Amori RE, et al. Efficacy and Safety of Incretin Therapy in Type 2 Diabetes: Systematic Review and eta-analysis. JAMA 2007; 298: 194–206.
- [23] Deacon CF. Dipeptidyl peptidase-4 inhibitors
- [24] Frederich R, et al. A systematic assessment of cardiovascular outcomes in the saxagliptin drug development program for type 2 diabetes. Postgrad Med 2010; 122: 16–27.
- [25] Topp GP, et al. Differences in Reported Efficacy between Oral Anti-Hyperglycemic Agents Largely Reflect Differences in Baseline A1C. Diabetes 2008; 1 (suppl.1): A436–A437.
- [26] Goldstein BJ, et al. Effect of Initial Combination Therapy With Sitagliptin, a Dipeptidyl Peptida-se-4 Inhibitor, and Metformin on Glycemic Control in Patients With Type 2 Diabetes. Diabetes Care 2007; 30: 1979–1987.
- [27] Migoya EM, et al. Dipeptidyl peptidase-4 inhibitors administered in combination with metformin result in an additive increase in the plasma concentration of active GLP-1. Clin Pharmacol Ther 2010; 88: 801–808.
- [28] Olansky L, et al. A treatment strategy implementing combination therapy with sitagliptin and metformin results in superior glycaemic control versus metformin monotherapy due to a low rate of addition of antihyperglycaemic agents. Diabetes Obes Metab 2011; 13: 841–849.
- [29] Del Prato S, Barnett AH, Huisman H, et al. Effect of linagliptin monotherapy on glycaemic control and markers of beta-cell function in patients with inadequately controlled type 2 diabetes: a randomised controlled trial. Diabetes Obes Metab 2011; 13: 258–267.
- [30] Henry RR, et al. Effects of saxagliptin on beta-cell stimulation and insulin secretion in patients with type 2 diabetes. Diabetes Obes Metab 2011; 13: 850–858.
- [31] Dhillon S. Sitagliptin: a review of its use in the management of type 2 diabetes mellitus. Drugs 2010; 70: 489–512.
- [32] Foley JE, et al. Beta cell function following 1 year vildagliptin or placebo treatment and after 12 week washout in drug-naive patients with type 2 diabetes and mild hyperglycaemia: a rando-mised controlled trial. Diabetologia 2011; 54: 1985–1991.
- [33] Matikainen N, et al. Vildagliptin therapy reduces postprandial intestina triglyceride-rich lipopro-tein particles in patients with type 2 diabetes. Diabetologia 2006; 49: 2049 –2057.
- [34] DeFronzo RA. Effects of exenatide versus sita-gliptin on postprandial glucose, insulin and glucagon secretion, gastric emptying, and caloric intake: a randomized, cross-over study. Curr Med Res Opin 2008; 24: 2943–2952.
- [35] Mistry GC, et al. Effect of sitagliptin, a dipeptidyl peptidase-4 inhibitor, on blood pressure in non-diabetic patients with mild to moderate hypertension. J Clin Pharmacol 2008; 48: 592–598.
- [36] Ogawa S, et al. Sitagliptin, a dipeptidyl peptidase-4 inhibitor, decreases systolic blood pressure in Japanese hypertensive patients with type 2 diabetes. Tohoku J Exp Med 2011; 223: 133–135.
- [37] Anagnostis P, et al. Glucagon-like peptide-1-based therapies and cardiovascular disease: looking beyond glycaemic control. Diabetes Obes Metab 2011; 13: 302–312.
- [38] Read PA, Khan FZ, et al. DPP-4 inhibition by sitagliptin improves the myocardial response to dobutamine stress and mitigates stunning in a pilot study of patients with coronary artery disease. Circ Cardiovasc Imaging 2010; 3: 195–201.
- [39] Johansen OE, Neubacher D, von Eynatten M, et al. Cardiovascular safety with linagliptin in pa-tients with type 2 diabetes mellitus: A pre-specified, prospective, and adjudicated meta-analysis of a Phase 3 programme. Cardiovasc Diabetol 2012; 11: 3.
- [40] Schweizer A, et al. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab 2010; 12: 485–494.
- [41] Hattori S, et al. Sitagliptin reduces albuminuria in patients with type 2 diabetes. Endocr J 2011; 58: 69–73.
- [42] Van Poppel, PC, et al. Vildagliptin improves endo-thelium-dependent vasodilatation in type 2 diabetes. Diabetes Care 2011; 34: 2072–2077.
- [43] Theiss HD, et al. Safety and efficacy of SITAgliptin plus GRanulocyte-colony-stimulating factor in patients suffering from Acute Myocardial Infarction (SITAGRAMI-Trial)-rationale, design and firstinterim analysis. Int J Cardiol 2010; 145: 282–284.
- [44] Engel SS, et al. Sitagliptin: review of preclinical and clinical data regarding incidence of pancreatitis. Int J Clin Pract 2010; 64: 984–990.
- [45] Garg R, Chen W, Pendergrass M. Acute pancreatitis in type 2 diabetes treated with exenatide or sitagliptin: a retrospective observational pharmacy claims analysis. Diabetes Care 2010; 33: 2349–2354.
- [46] Williams-Herman D, Engel SS, Round E, et al. Safety and tolerability of sitagliptin in clinical studies: a pooled analysis of data from 10,246 pa-tients with type 2 diabetes. BMC Endocr Disord 2010; 10: 7.
- [47] Fadini GP, et al. The metabolic syndrome influen-ces the response to incretin-based therapies. Acta Diabetol 2011; 48: 219–225.
- [48] Baetta R, Corsini A. Pharmacology of dipeptidyl peptidase-4 inhibitors: similarities and differences. Drugs 2011; 71: 1441–1467.
- [49] Scheen AJ, et al. Efficacy and safety of saxagliptin in combination with metformin compared with sitagliptin in combination with metformin in adult patients with type 2 diabetes mellitus. Diabetes Metab Res Rev 2010; 26: 540–549.
- [50] Scheen AJ. Pharmacokinetics of dipeptidylpeptidase-4 inhibitors. Diabetes Obes Metab 2010; 12: 648–658.
- [51] Nauck MA, et al. Reduced incretin effect in Type 2 (non-insulin-dependent) diabetes. Diabetologia 1986; 29: 46–52.
- [52] Yki-Jarvinen H. Thiazolidinediones. N Engl J Med 2004; 351: 1106–1117.
- [53] Garg SK. The role of basal insulin and glucagon-like peptide-1 agonists in the therapeutic management of type 2 diabetes-a comprehensive review. Diabetes Technol Ther 2010; 12: 11–24.