Léčba sarkomů měkkých tkání z pohledu nových mezinárodních léčebných doporučení
Sarkomy měkkých tkání představují jako mezenchymální nádory vycházející z pojivové tkáně značně heterogenní skupinu nemocí. Patří mezi vzácné nádory, reprezentují asi 1 % všech maligních onemocněních dospělých. Často se na tuto diagnózu nepomýšlí a nemocní přicházejí v pokročilém stadiu onemocnění. European Society for Medical Oncology publikovala v loňském roce doporučení pro diagnostiku, léčbu a sledování nemocných se sarkomy měkkých tkání. Vzhledem k raritnosti těchto nádorů by jejich léčba měla být soustředěna do center, která jsou schopna vést léčbu nemocného v rámci multidisciplinárního týmu odborníků.
Sarkomy měkkých tkání patří mezi vzácná onemocnění, jejichž incidence se v Evropě pohybuje mezi 4–5/10 000 obyvatel. V České republice je ročně diagnostikováno kolem 400 nových případů maligních sarkomů. Jedná se o velmi heterogenní skupinu nádorů s různou prognózou. V současné době je patology popisováno více než 50 různých histologických podtypů. Každý podtyp představuje často specifickou chorobu lišící se svým biologickým chováním a citlivostí k chemoterapii a radioterapii. Primární lokalizace nádoru, histopatologický typ a velikost mohou zásadním způsobem ovlivnit přežívání nemocných. Retroperitoneální a intraabdominální lokalizace provází vyšší riziko lokální recidivy oproti končetinovým sarkomům.
Základem úspěšné léčby – počínaje diagnózou – je multidisciplinární přístup, na kterém by měli participovat patologové, radiodiagnostici, chirurgové, kliničtí a radiační onkologové, eventuálně pediatričtí onkologové. Vzhledem k raritnosti a heterogenitě histologických typů je nutné soustředit léčbu pacientů se sarkomy měkkých tkání do center, která mohou poskytnout tento mezioborový přístup. U nemocných léčených v takovýchto centrech byl prokázán nižší výskyt lokálních recidiv (19 % vs. 39 %) se zlepšením přežívání u některých pacientů [1]. Tato centra by měla sloužit jako referenční a měli by sem být posíláni všichni pacienti s podezřelou nádorovou masou lokalizovanou v hloubce měkkých tkání či s povrchovými lézemi většími než 5 cm a všichni pediatričtí pacienti [2, 3].
Vyšetřovací metody
Magnetická rezonance je základní vyšetřovací metodou pro tumory měkkých tkání. Prostý rtg snímek je vhodný k vyloučení přítomnosti primárních kostních tumorů, pro detekci kostní eroze s rizikem fraktury a identifikaci kalcifikací; počítačová tomografie (CT) nám pomůže v odlišení kalcifikací od osifikující myositidy a také u retroperitoneálních tumorů, kde i vyšetření pomocí nukleární magnetické rezonance (NMR) má identickou výpovědní hodnotu. U tumorů nejasné etiologie větších než 5 cm je indikována silnojehlová biopsie z několika míst tumoru, aby se minimalizovalo nebezpečí, že se nezachytí dostatečné množství materiálu pro patology k určení diagnózy. Je nutné použít jehlu o síle nejméně 16 G. U menších povrchových lézí (< 5 cm) je primární excize akceptovatelná jako konečné chirurgické řešení. Pokud je prováděna otevřená biopsie, je vhodné konzultovat peroperační vyšetření s patologem, aby byla zaručena dostatečná výtěžnost vzorku ke stanovení diagnózy. Tenkojehlová biopsie není doporučována pro běžnou klinickou praxi. Pokud radikální výkon následuje v druhé době, místo biopsie a jizva by měly být odstraněny během tohoto definitivního výkonu. Biopsie patří do rukou zkušeného chirurga či radiologa.
V letošním roce vydala Světová zdravotnická organizace novou klasifikaci sarkomů měkkých tkání. Vzhledem k vzácnosti některých histologických typů a obtížnosti stanovení diagnózy je nutné vždy zvážit druhé čtení, pokud první čtení bylo provedeno mimo centra zabývající se diagnostikou sarkomů. Patologická zpráva by měla obsahovat histologický grade založený na stupni diferenciace, přítomnosti nekróz a mitotické aktivitě. Nádorový grade není možno stanovit po neoadjuvantní terapii vzhledem ke změnám tkáně v důsledku léčby. Dále je nutná znalost velikosti a lokalizace tumoru ve vztahu k fasciím, tedy údaje představující základní prognostické faktory. V případě definitivního chirurgického výkonu očekává klinik též informaci o velikosti okrajů, o intaktnosti tumoru, přítomnosti kapsuly. Tyto informace může patolog poskytnout pouze za předpokladu, že je chirurgický výkon proveden lege artis. K hodnocení okrajů by měl patolog přistoupit společně s operatérem, po předoperační léčbě by měl poskytnout informaci o léčebné histologické odpovědi i s vědomím, že pro sarkomy měkkých tkání neexistuje validovaný systém percentuálního určení viability nádorových buněk. Základní staging (informace o rozsahu nádoru) musí obsahovat spirální CT hrudníku, jelikož plíce jsou nejčastějším místem výskytu vzdálených metastáz. Vzhledem k tomu, že metastázy do spádových lymfatických uzlin jsou vzácné, doporučuje se vyšetření těchto lokalit pomocí CT či NMR jen u sarkomů s metastatickou uzlinovou predilekcí, jako jsou epiteloidní a světlobuněčné sarkomy.
Vyšetření břicha pomocí CT by mělo být doplněno u končetinových myxoidních liposarkomů, CT mozku u alveolárních a světlobuněčných sarkomů a angiosarkomů s vyšším potenciálem mozkových metastáz.
Možnosti léčby
Základem léčby sarkomu je chirurgické řešení. Klinickým cílem je radikální extirpace s negativními dvoucentimetrovými okraji. Takovýto radikální přístup je někdy obtížně dosažitelný zvláště v blízkosti nervově-cévních svazků. V případě infiltrace těchto struktur je vždy nutné zvážit, zda onkologicky radikální výkon vedoucí k mutilaci vyváží přínos radikality. Příkladem extenzivních radikálních výkonů jsou amputace končetin, jejichž počet výrazně poklesl díky zavedení neoadjuvantní terapie a zlepšení operačních technik. V případě lokálních recidiv bez generalizace je vždy namístě zvážit extirpaci. Operaci by měl provádět chirurg s extenzivními zkušenostmi v této problematice. Často se stává, že se u povrchových lézí nepomýšlí na maligní etiologii, výkony jsou neradikální, někdy intralesionální. V těchto případech je doporučována reexcize s cílem uskutečnit radikální výkon. Pokud je primární výkon proveden mimo centrum, pak by k reexcizi mělo dojít vždy na pracovišti se zkušeností s léčbou těchto malignit.
Není-li možné provést radikální výkon či se předpokládá mutilující výkon, je nutno zvážit podání neoadjuvantní chemoterapie či ozařování. Takovýchto rozhodovacích procesů by se měl vždy účastnit nemocný. V případě končetinových lokalizací je možné zvážit hypertermickou perfuzi končetin s melfalanem a TNF-α (tumor nekrotizující faktor alfa), kterou v České republice některá centra provádějí. Hypertermie není v současné době v České republice dostupná. Experimentální zůstává také intraarteriální chemoterapie používaná některými centry především pro končetinové sarkomy a v kombinaci s radioterapií.
Chirurgie má své místo při řešení plicních metastáz jako lokality, kde se nejčastěji vyskytují vzdálené metastázy především končetinových sarkomů. V literatuře jsou leiomyosarkomy a synoviální sarkomy uvedeny jako nejčastější typy sarkomů metastazujících do plic. Plicní metastázy liposarkomu, tumorů pochev periferních nervů a věk nad 50 let jsou spojovány s horší prognózou. Za další negativní prognostické faktory je považována přítomnost více než tří plicních metastáz, metastáza větší než 2 cm a vysoký nádorový grade.
Léčba lokalizovaného onemocnění
Základem léčby lokalizovaného onemocnění je chirurgické radikální řešení – R0 resekce s dostatečnými okraji provedená zkušeným operatérem. Následná radioterapie je doporučována u tumorů s nádorovým gradem 2–3 a dále u povrchově lokalizovaných tumorů větších než 5 cm. Radioterapie se doporučuje rovněž u povrchových tumorů menších než 5 cm s vysokým gradem. Ve vybraných případech lze zvažovat pooperační ozáření též u povrchových nádorů větších než 5 cm a nízce maligních hlubokých tumorů. Při indikaci radioterapie v multidisciplinárním týmu je vždy nutno zvážit anatomické poměry ozařovaného pole a možné následky aktinoterapie ve smyslu přínosu aktinoterapie oproti možné agresivitě nádoru. Podle nejnovějších doporučení NCCN (The National Comprehensive Cancer Network) z letošního roku je třeba zvážit adjuvantní aktinoterapii i v případě tumorů menších než 5 cm s okraji menšími než 1 cm [4]. Nutno mít na paměti, že adjuvantní aktinoterapie neprodlouží celkové přežívání, ale může zlepšit pouze lokální kontrolu choroby. Doporučená dávka je 50–60 Gy. Na základě zkušeností center lze v jednotlivých případech indikovat i brachyterapii. U R1 a R2 resekcí je nutno zvážit možnost reoperace v centru s cílem dosažení dostatečně čistých okrajů. Předoperační léčba připadá v úvahu u nádorů, které by vedly k mutilujícím výkonům či k nedostatečným okrajům. Tam, kde R1 či R2 resekce představuje jediné možné řešení, následuje pooperační aktinoterapie. V případě vědomí neradikálního výkonu je nutné vyznačení resekčního lůžka kovovými klipy pro potřeby plánování následné aktinoterapie.
Přestože více než polovina nemocných po radikálním lokálním ošetření s tumory vysokého gradu vytvoří vzdálené metastázy, adjuvantní chemoterapie není standardem léčby pro sarkomy měkkých tkání dle doporučení ESMO (European Society of Medical Oncology) [5]. Podání adjuvantní chemoterapie můžeme zvažovat u nemocných s vysoce rizikovými tumory (větší než 5 cm, hluboce lokalizované, vysoký grade) vždy po diskusi s pacientem. Pokud se už rozhodneme pro adjuvantní chemoterapii, mělo by se jednat o kombinovanou léčbu nejúčinnějšími cytostatiky.
Pokročilé onemocnění
Nemocní s metachronními plicními metastázami jako jediným místem generalizovaného onemocnění by měli být indikováni k resekci plicních metastáz. Před takovouto operací musíme vyloučit generalizaci onemocnění a provést CT břicha, kostní scintigrafii nebo vyšetření PET/CT (pozitronová emisní tomografie/počítačová tomografie). V přítomnosti rizikových faktorů, jako je krátká doba od diagnózy či velký počet plicních ložisek, je možno po chirurgickém výkonu zvážit podání systémové chemoterapie. Je nutno mít ale na paměti absenci validních dat o přínosu tohoto postupu. Je doporučováno podat chemoterapii před operací ke zjištění nádorové odpovědi a možné modifikace následné léčebné strategie.
Extrapulmonální metastatická choroba by měla být řešena chemoterapií, i když v individuálních případech lze zvažovat i resekční výkon. Standardem první linie léčby zůstávají antracykliny v monoterapii. Léčba kombinací doxorubicinu s ifosfamidem nepřináší lepší terapeutické výsledky dle závěrů randomizované studie EORTC fáze III [6]. Podání této dvojkombinace lze ale zvažovat u pacientů s chemosenzitivními tumory s cílem rychlé léčebné odpovědi u nemocných v dobrém celkovém stavu.
![Graf 1 Dosažené prodloužení doby bez progrese při léčbě pazopanibem; podle [7] – van der Graaf, et al., 2012. CI – interval spolehlivosti (confidence interval); HR – poměr rizik (hazard ratio)](https://www.remedia.cz/photo-a-29422---.jpg) U angiosarkomů je alternativou podání taxanů, eventuálně v kombinaci s gemcitabinem. U leiomyosarkomů s nižší citlivostí k ifosfamidu lze v první linii podat kombinaci doxorubicinu s dakarbazinem. Imatinib je standardní léčbou při diagnóze dermatofibrosarcoma protuberans, která není vhodná k chirurgickému nemutilujícímu řešení. Pokud indikujeme nemocného k druhé linii paliativní chemoterapie po podávání doxorubicinu, máme několik možností. Ifosfamid ve standardním dávkování či vysok
U angiosarkomů je alternativou podání taxanů, eventuálně v kombinaci s gemcitabinem. U leiomyosarkomů s nižší citlivostí k ifosfamidu lze v první linii podat kombinaci doxorubicinu s dakarbazinem. Imatinib je standardní léčbou při diagnóze dermatofibrosarcoma protuberans, která není vhodná k chirurgickému nemutilujícímu řešení. Pokud indikujeme nemocného k druhé linii paliativní chemoterapie po podávání doxorubicinu, máme několik možností. Ifosfamid ve standardním dávkování či vysok![Graf 2 Analýza celkového přežití při léčbě pazopanibem; podle [7] – van der Graaf, et al., 2012. CI – interval spolehlivosti (confidence interval); HR – poměr rizik (hazard ratio)](https://www.remedia.cz/photo-a-29423---.jpg) odávkovaný (až 14 g/m2) lze podávat u nemocných, kteří jím již byli předléčeni. Trabektedin, který prokázal nejlepší protinádorový efekt u liposarkomů (především myxoidní formy) a u leiomyosarkomů, je též možností volby, a to jak pro druhou, tak eventuálně pro třetí linii paliativní chemoterapie. Toto nové cytostatikum bylo schváleno v Evropské unii pouze na základě výsledků studie fáze II.
odávkovaný (až 14 g/m2) lze podávat u nemocných, kteří jím již byli předléčeni. Trabektedin, který prokázal nejlepší protinádorový efekt u liposarkomů (především myxoidní formy) a u leiomyosarkomů, je též možností volby, a to jak pro druhou, tak eventuálně pro třetí linii paliativní chemoterapie. Toto nové cytostatikum bylo schváleno v Evropské unii pouze na základě výsledků studie fáze II.
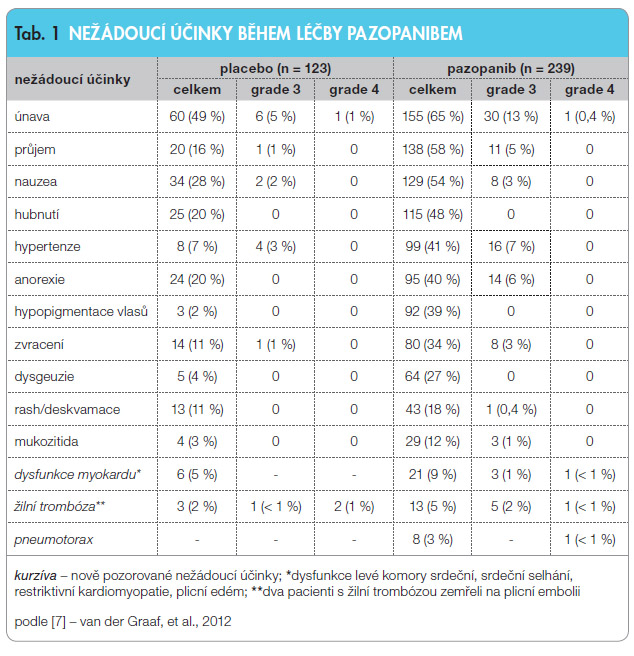 Nejnovějším léčivým přípravkem cílené terapie schváleným v Evropské unii pro nemocné předléčené systémovou chemoterapií je pazopanib. Jako jediný přípravek byl schválen na základě randomizované studie fáze III PALETTE, která srovnávala jeho účinnost s placebem. Tato studie prokázala prodloužení doby bez progrese onemocnění (graf 1), ale nebylo dosaženo statisticky významného rozdílu v přežívání nemocných (graf 2) [7]. Účinnost pazopanibu je prokázána jen u některých podtypů sarkomů s vyloučením liposarkomů. Profil nejčastějších nežádoucích účinků udává tab. 1.
Nejnovějším léčivým přípravkem cílené terapie schváleným v Evropské unii pro nemocné předléčené systémovou chemoterapií je pazopanib. Jako jediný přípravek byl schválen na základě randomizované studie fáze III PALETTE, která srovnávala jeho účinnost s placebem. Tato studie prokázala prodloužení doby bez progrese onemocnění (graf 1), ale nebylo dosaženo statisticky významného rozdílu v přežívání nemocných (graf 2) [7]. Účinnost pazopanibu je prokázána jen u některých podtypů sarkomů s vyloučením liposarkomů. Profil nejčastějších nežádoucích účinků udává tab. 1.
Léčebná doporučení ESMO zmiňují i možnost použití neregistrovaných léčivých přípravků pro vyšší linie paliativní léčby. Data o jejich účinnosti však zatím nejsou podložena dostatečnými důkazy. Jedna klinická studie fáze II prokázala vyšší efektivitu gemcitabinu v kombinaci s docetaxelem [8]. Gemcitabin v monoterapii má též protinádorový účinek u leiomyosarkomů. Dakarbazin má jistý antitumorózní efekt i v monoterapii, především u leiomyosarkomů. Španělská randomizovaná studie fáze II prokázala delší celkové přežití a dobu do p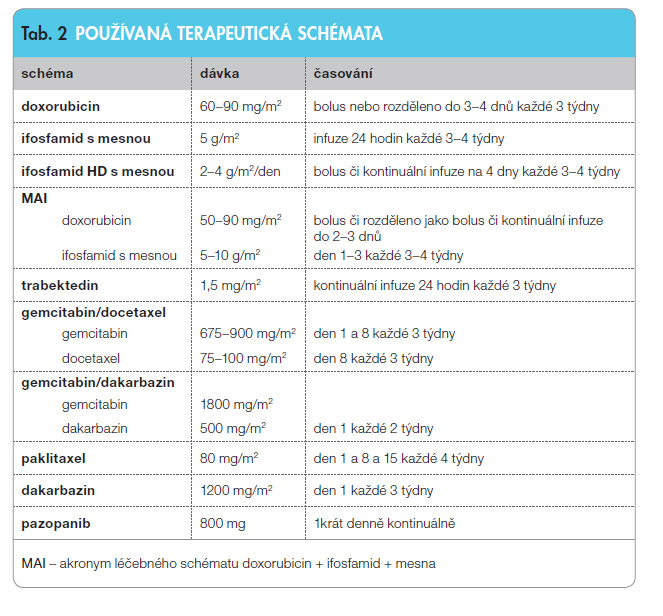 rogrese pro kombinaci dakarbazinu s gemcitabinem oproti monoterapii dakarbazinem u leimyosarkomů [9].Účinnost gemcitabinu a docetaxelu je založena na výsledcích studií fáze II, ani jeden z těchto přípravků není registrován regulačními agenturami pro diagnózu sarkomů měkkých tkání. Dávkování jednotlivých terapeutických schémat shrnuje tab. 2. Účinnost všech léčivých přípravků kromě doxorubicinu, ifosfamidu a pazopanibu je založena na evidenci stupně 2A či 2B. Proto by měly být podávány především v rámci klinických studií či po indikaci specialistů v centrech majících zkušenost s léčbou těchto nádorů. Pro další linie léčby by měli být nemocní zařazováni do klinických studií, alternativní možností je podpůrná terapie.
rogrese pro kombinaci dakarbazinu s gemcitabinem oproti monoterapii dakarbazinem u leimyosarkomů [9].Účinnost gemcitabinu a docetaxelu je založena na výsledcích studií fáze II, ani jeden z těchto přípravků není registrován regulačními agenturami pro diagnózu sarkomů měkkých tkání. Dávkování jednotlivých terapeutických schémat shrnuje tab. 2. Účinnost všech léčivých přípravků kromě doxorubicinu, ifosfamidu a pazopanibu je založena na evidenci stupně 2A či 2B. Proto by měly být podávány především v rámci klinických studií či po indikaci specialistů v centrech majících zkušenost s léčbou těchto nádorů. Pro další linie léčby by měli být nemocní zařazováni do klinických studií, alternativní možností je podpůrná terapie.
Především na základě preklinických dat lze zvažovat léčbu inhibitory mTOR u maligních perivaskulárních epiteloidních tumorů (PEComy), podávání krizotinibu u zánětlivých myofibroblastických tumorů s translokací genu ALK a terapii inhibitory tyrozinkinázy (jako je sunitinib) u alveolárních sarkomů. Vývoj těchto léčivých přípravků je ještě ve stadiu klinických studií a žádný z nich není registrován.
Sledování nemocných po léčbě
U vysoce rizikových pacientů dochází k relapsu nejčastěji během dvou až tří let, u pacientů s nízkým rizikem později. Re-lapsy jsou ale méně pravděpodobné. Nejčastějším místem relapsů jsou plíce. Včasná diagnóza lokálních recidiv či asymptomatických plicních metastáz vhodných k resekci může zásadně ovlivnit prognózu. Vzhledem k absenci publikovaných validních dat pro sledování nemocných je doporučováno u nemocných se středním a vysokým nádorovým gradem sledování každé tři až čtyři měsíce během prvních dvou až tří let, poté dvakrát ročně do pátého roku a následně jedenkrát ročně. Nemocní s nízce maligními sarkomy by měli být prvních tři až pět let sledováni jedenkrát za čtyři až šest měsíců pomocí rtg plic či CT v delších intervalech a posléze jedenkrát ročně. Přínosnost včetně nákladové efektivity pravidelného provádění magnetické rezonance k detekci lokální recidivy a CT plic k identifikaci plicních metastáz nebyla zatím prokázána pro nemocné s vysoce rizikovými tumory ve srovnání s klinickým vyšetřením a rtg plic.
Specifika jednotlivých typů sarkomů
Retroperitoneální tumory
Standardním diagnostickým přístupem je jehlová biopsie provedená přes peritoneum, standardním terapeutickým přístupem je resekce tumoru, a to i s okolními tkáněmi. Pro standardní doporučení jak předoperační, tak pooperační terapie (chemoterapie, radioterapie) neexistují v současné době dostatečná data.
Děložní sarkomy
V děloze se mohou vyskytovat leiomyosarkomy, endometriální stromální sarkomy, nediferencované endometriální sarkomy a heterogenní sarkomy. Karcinosarkomy (maligní Mülleriánské smíšené tumory) jsou charakterizovány přítomností epiteliální a mezenchymální složky a jejich léčba se řídí epiteliálními charakteristikami. Standardním přístupem je hysterektomie, význam adnexektomie není jednoznačně prokázán. U pacientek s endometriálními stromálními sarkomy se provádí oboustranná adnexektomie, především z důvodů jejich hormonální senzitivity. U nemocných s leiomyosarkomy a nediferencovanými sarkomy vysokého stupně malignity („high grade“) neprokázala oboustranná lymfadenektomie a adnexektomie žádný přínos. Prospěšná je pouze v přítomnosti makroskopické infiltrace daných struktur. Standardním přístupem není ani radioterapie, o té lze uvažovat v individuálních případech po diskusi s nemocnou. Účinek adjuvantní chemoterapie není (stejně jako u ostatních typů sarkomů) jednoznačně prokázán.
Pro generalizované stromální endometroidní sarkomy lze indikovat vzhledem k jejich hormonální závislosti léčbu progestiny, inhibitory aromatáz, analogy gonadoliberinu – GnRH (u premenopauzálních žen). Tamoxifen a hormonální substituce obsahující estrogeny je kontraindikována. Resekce plicních metastáz je metodou volby. Léčba ostatních typů sarkomů je identická s léčebnou strategií extrauterinních sarkomů.
Desmoidní typ fibromatózy
Vzhledem k nepředvídatelnému průběhu této choroby s možnou velmi pomalou progresí i spontánní regresí se doporučuje pouze sledování, vyjma lokalizací potenciálně ohrožujících život, jako je oblast hlavy a krku, intraabdominální mezenterická fibromatóza. U progredující choroby je indikováno chirurgické řešení (bez adjuvantní terapie) nebo radioterapie či sledování, eventuálně končetinová perfuze. Systémová terapie nabízí možnosti použití hormonálních přípravků (tamoxifen, toremifen, analoga GnRH), nesteroidní antirevmatika, nízké dávky chemoterapie (methotrexát + vinorelbin, methotrexát + vinkristin), nízké dávky interferonu, imatinib, sorafenib, eventuálně standardní dávky chemoterapeutik.
Sarkomy prsu
V prsu se můžeme setkat s primárními sarkomy či se sarkomy indukovanými radioterapií. Maligní fyloidní tumory prsu (více než 10 mitóz a přerůstání stromatu) mají 20–30% metastatický potenciál. U karcinosarkomů se léčba řídí dle jejich epiteliální složky. Vzhledem k vzácnosti těchto tumorů neexistují jednoznačná doporučení. Je možné provést pouze výkon zachovávající prs, bez nutnosti lymfadenektomie, a pokud nejsou postiženy spádové uzliny. U angiosarkomů se vzhledem k jejich agresivitě a vysokému riziku recidiv v prsu doporučuje mastek-
tomie včetně odstranění svalové fascie s pooperačním ozářením.
Sarkomy měkkých tkání dětského věku u adolescentů a dospělých
Léčba extraskeletálních Ewingových sarkomů, alveolárních a embryonálních sarkomů se řídí dětskými protokoly. Naproti tomu k pleomorfním sarkomům bychom měli přistupovat jako k vysoce maligním sarkomům dospělých.
Závěr
Ve stadiu lokalizovaného onemocnění je diagnostikována asi polovina nemocných, kteří mají díky možnosti radikálního chirurgického výkonu naději na dosažení dlouhodobé kompletní remise i na kurabilitu. Vliv adjuvantní chemoterapie na celkové přežití v neselektované skupině nemocných nebyl prokázán. Adjuvantní systémová léčba není standardem léčby sarkomů. Lze o ní uvažovat individuálně na základě přítomnosti rizikových faktorů. Indikaci neoadjuvantní chemoterapie zvažujeme především v případě lokálně pokročilých končetinových sarkomů s cílem umožnit končetinu šetřící chirurgický výkon.
Na základě randomizované studie EORTC, jejíž výsledky byly prezentovány na posledním zasedání ESMO 2012, zůstává standardem I. linie léčby metastatických sarkomů doxorubicin v monoterapii. Jeho kombinace s ifosfamidem neprokázala žádný přínos. Pro II. linii lze u nemocných v dobrém celkovém stavu zvažovat podání ifosfamidu či u leiomyosarkomů a liposarkomů léčbu trabektedinem, který je možno podat u vybraných nemocných i ve III. linii. V USA a EU byl schválen pro léčbu nemocných předléčených chemoterapií první inhibitor tyrozinkinázy pazopanib. S postupujícím výzkumem v oblasti molekulárněgenetické charakteristiky sarkomů lze v blízké budoucnosti očekávat personalizovaný terapeutický přístup i k této skupině nádorů s rozdělením na další terapeutické podjednotky, podobně jak jej známe z léčby solidních tumorů.
Sarkomy měkkých tkání představují značně heterogenní skupinu vzácných nádorů. Z této skutečnosti vyplývá jednoznačné doporučení ESMO pro soustředění péče o tyto pacienty do vybraných center, kde pracují mezioborové týmy specializované na tuto problematiku, mající možnost získat maximum zkušeností s léčbou těchto raritních entit. Proto by mělo i v České republice vzniknout několik málo center, která se budou léčbou sarkomů měkkých tkání zabývat. Jedině centralizace péče o nemocné s těmito vzácnými nádory může být předpokladem kvalitní a úspěšné péče.
Seznam použité literatury
- [1] Bhangu AA, Beard JAS, Grimer RJ. Should soft tissue sarcomas be treated at a specialist centre? Sarcoma 2004; 8: 1–6.
- [2] Bauer HCG, Trovik CS, Alvegard TA, et al. Monitoring referral and treatment in soft tissue sarcoma: a study based on 1 851 patients from the Scandinavian Sarcoma Group Register. Acta Orthop Scand 2001; 72: 150–159.
- [3] Rydholm A. Improving the management of soft tissue sarcoma (Editorial). BMJ 1998; 317: 93–94.
- [4] NCCN Guidelines, Soft Tissue Sarcoma, version I.20113, NCCN.org. Brennan MF, Antonescu CR, Maki RG. Management of Soft Tissue Sarcoma.Springer Science + Business Media, New York 2013.
- [5] ESMO/European Sarcomas Network Working Group. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (suppl 7):vii92–vii99.
- [6] van der Graaf WTA, Judson I, Verweij J, et al. Results of a randomized phase III trial (EORTC 62012) of single agent doxorubicin versus doxorubicin plus ifosfamide as first line chemotherapy for patients with advanced or metastatic soft tissue sarcoma: A survival study by the EORTC Soft Tissue and Bone Sarcoma Group. ESMO Congress 2012. Abstract LBA7.
- [7] van der Graaf WTA, Blay JY, Chabla SP, et al. Pazopanib for metastatic soft tissue sarcoma (PALETTE): a randomised, double blind, placebo-controlled phase 3 trial. Lancet 2012; 379: 1879–1886.
- [8] Maki RG, Wathen JK, Patel SR, et al. Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft tissue sarcomas: results of sarcoma alliance for research through collaboration study 002. J Clin Oncol 2007; 25: 2755–2763.
- [9] García-Del-Muro X, López-Pousa A, Maurel J, et al. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanisch Group for Research on Sarcomas study. J Clin Oncol 2011; 29: 2528–2533.